Слайд 1Экспрессия генов: транскрипция, трансляция и судьба белков.
Стрелкова А.Н.
рг ГЭВ/ОМГ
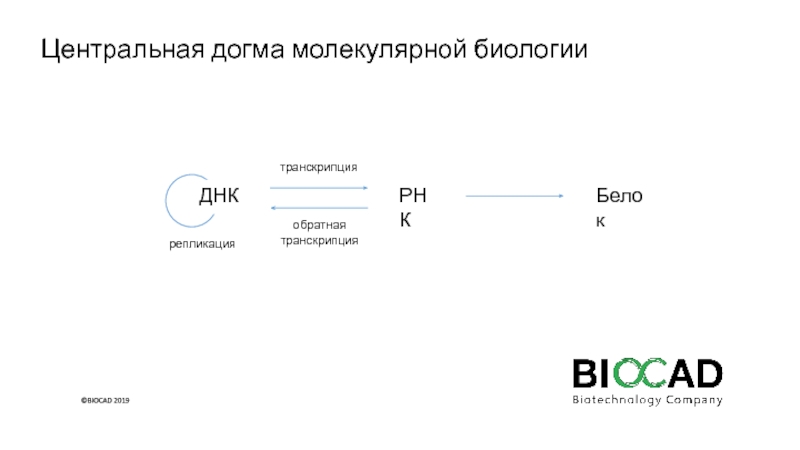
Слайд 2Центральная догма молекулярной биологии
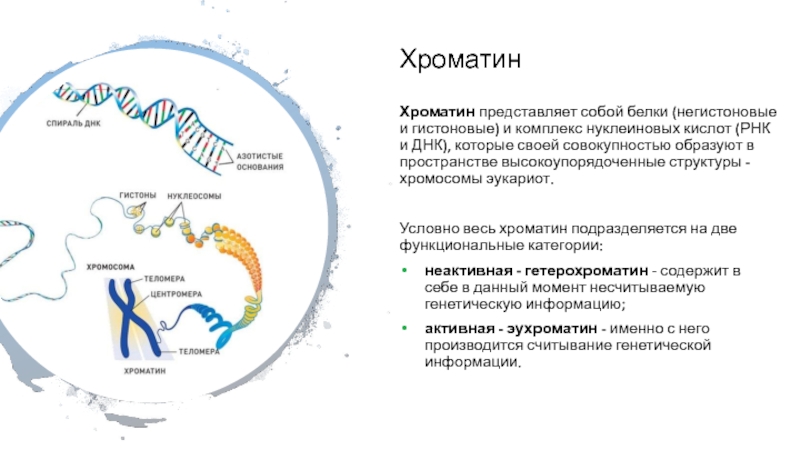
Слайд 3Хроматин
Хроматин представляет собой белки (негистоновые и гистоновые) и комплекс нуклеиновых кислот
(РНК и ДНК), которые своей совокупностью образуют в пространстве высокоупорядоченные
структуры - хромосомы эукариот.
Условно весь хроматин подразделяется на две функциональные категории:
неактивная - гетерохроматин - содержит в себе в данный момент несчитываемую генетическую информацию;
активная - эухроматин - именно с него производится считывание генетической информации.
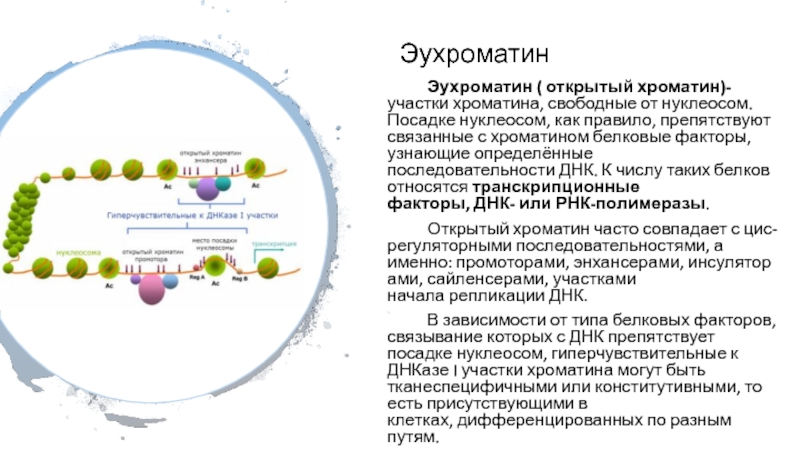
Слайд 4Эухроматин
Эухроматин ( открытый хроматин)- участки хроматина, свободные от нуклеосом. Посадке нуклеосом, как
правило, препятствуют связанные с хроматином белковые факторы, узнающие определённые последовательности ДНК. К
числу таких белков относятся транскрипционные факторы, ДНК- или РНК-полимеразы.
Открытый хроматин часто совпадает с цис-регуляторными последовательностями, а именно: промоторами, энхансерами, инсуляторами, сайленсерами, участками начала репликации ДНК.
В зависимости от типа белковых факторов, связывание которых с ДНК препятствует посадке нуклеосом, гиперчувствительные к ДНКазе I участки хроматина могут быть тканеспецифичными или конститутивными, то есть присутствующими в клетках, дифференцированных по разным путям.
Слайд 5Молекулярные механизмы транскрипции
Схема синтеза РНК одинакова для всех организмов и
включает 3 стадии:
Инициация – присоединение полимеразы к промотору, активация
процесса.
Элонгация – наращивание нуклеотидной цепи в направлении от 3´к 5´ концу с замыканием фосфодиэфирных связей между азотистыми основаниями, которые подбираются комплементарно мономерам ДНК.
Терминация – завершение процесса синтеза.
У прокариот все виды РНК транскрибируются одной РНК-полимеразой, состоящей из пяти протомеров (β, β′, ω и двух субъединиц α), которые в совокупности образуют кор-фермент, способный наращивать цепь рибонуклеотидов. Есть еще дополнительная единица σ, без которой невозможно присоединение полимеразы к промотору. Комплекс из кора и сигма-фактора называется холоферментом.
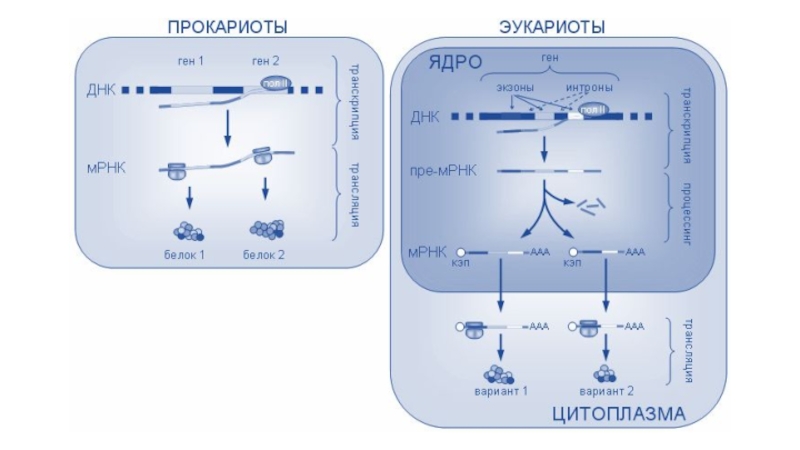
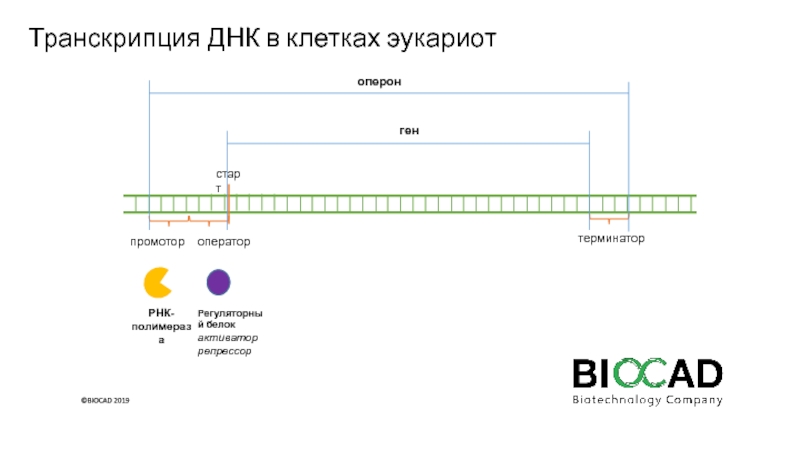
Слайд 7Транскрипция ДНК в клетках эукариот
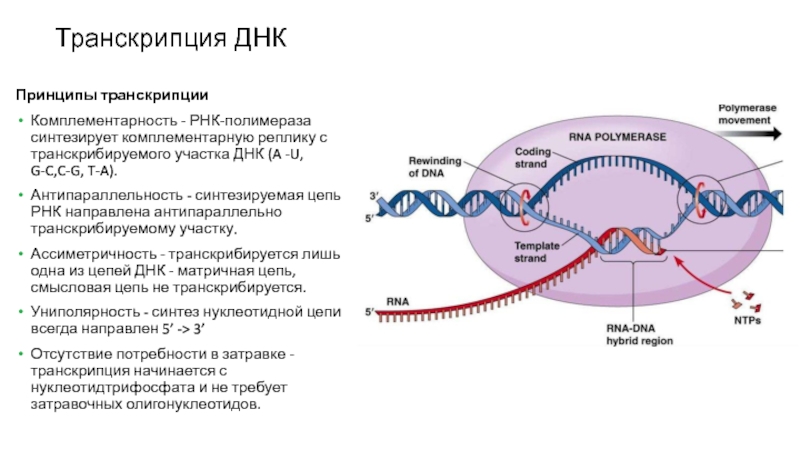
Слайд 8Транскрипция ДНК
Принципы транскрипции
Комплементарность - РНК-полимераза синтезирует комплементарную реплику с транскрибируемого
участка ДНК (A -U, G-C,C-G, T-A).
Антипараллельность - синтезируемая цепь РНК
направлена антипараллельно транскрибируемому участку.
Ассиметричность - транскрибируется лишь одна из цепей ДНК - матричная цепь, смысловая цепь не транскрибируется.
Униполярность - синтез нуклеотидной цепи всегда направлен 5’ -> 3’
Отсутствие потребности в затравке - транскрипция начинается с нуклеотидтрифосфата и не требует затравочных олигонуклеотидов.
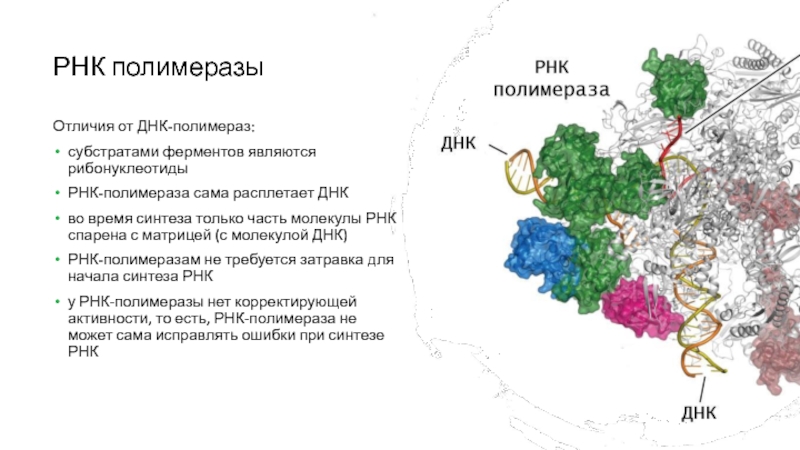
Слайд 9РНК полимеразы
У эукариот есть три различные РНК полимеразы - I,
II и III, представляющие собой мультибелковые комплексы и ответственные за
транскрипцию с соответствующих промоторов:
Класс I (гены, кодирующие рибосомальные РНК)
Класс II (гены, кодирующие матричные РНК и некоторые малые ядерные РНК)
Класс III (гены, кодирующие транспортные РНК и оставшиеся малые ядерные РНК).
У прокариот один и тот же фермент катализирует синтез трёх типов РНК: мРНК, рРНК и тРНК.
Слайд 10РНК полимеразы
Отличия от ДНК-полимераз:
субстратами ферментов являются рибонуклеотиды
РНК-полимераза сама расплетает ДНК
во
время синтеза только часть молекулы РНК спарена с матрицей (с
молекулой ДНК)
РНК-полимеразам не требуется затравка для начала синтеза РНК
у РНК-полимеразы нет корректирующей активности, то есть, РНК-полимераза не может сама исправлять ошибки при синтезе РНК
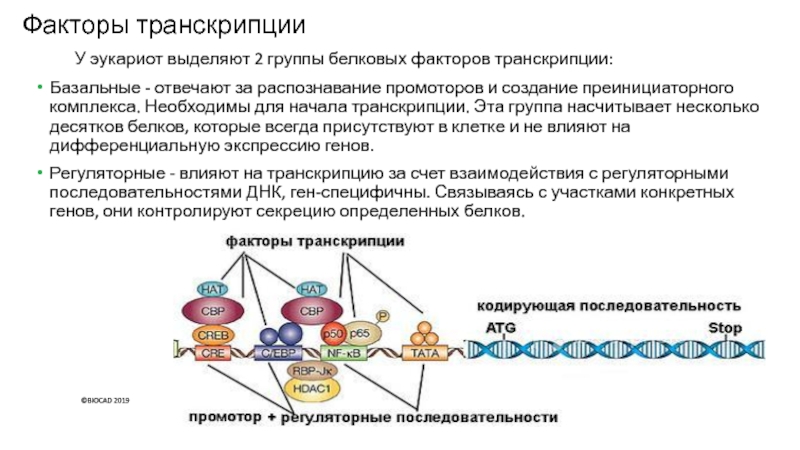
Слайд 11Факторы транскрипции
У эукариот выделяют 2 группы белковых факторов транскрипции:
Базальные
- отвечают за распознавание промоторов и создание преинициаторного комплекса. Необходимы
для начала транскрипции. Эта группа насчитывает несколько десятков белков, которые всегда присутствуют в клетке и не влияют на дифференциальную экспрессию генов.
Регуляторные - влияют на транскрипцию за счет взаимодействия с регуляторными последовательностями ДНК, ген-специфичны. Связываясь с участками конкретных генов, они контролируют секрецию определенных белков.
Слайд 12 Функционирование базальных факторов представляет собой каскадную сборку различных субъединиц с
образованием комплекса инициации и активацией транскрипции.
Специфические факторы могут регулировать
транскрипцию на двух этапах:
сборка комплекса инициации (перестройка хроматина, а также привлечение, ориентация и модификация медиатора, полимеразы и базальных факторов на промоторе, что приводит к активации транскрипции);
переход к продуктивной элонгации (осуществляется за счет взаимодействия фактора с белком P-Tef-b, который помогает РНК-полимеразе преодолеть ассоциированную с промотором паузу.)
Факторы транскрипции. Принцип действия
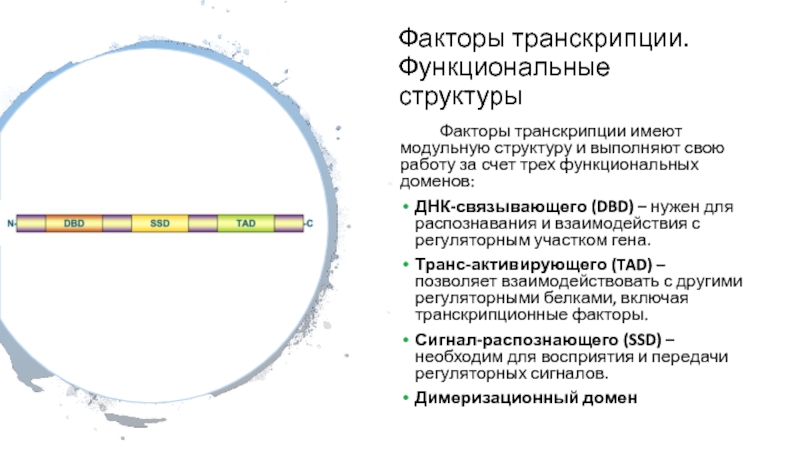
Слайд 13Факторы транскрипции. Функциональные структуры
Факторы транскрипции имеют модульную структуру и выполняют
свою работу за счет трех функциональных доменов:
ДНК-связывающего (DBD) –
нужен для распознавания и взаимодействия с регуляторным участком гена.
Транс-активирующего (TAD) – позволяет взаимодействовать с другими регуляторными белками, включая транскрипционные факторы.
Сигнал-распознающего (SSD) – необходим для восприятия и передачи регуляторных сигналов.
Димеризационный домен
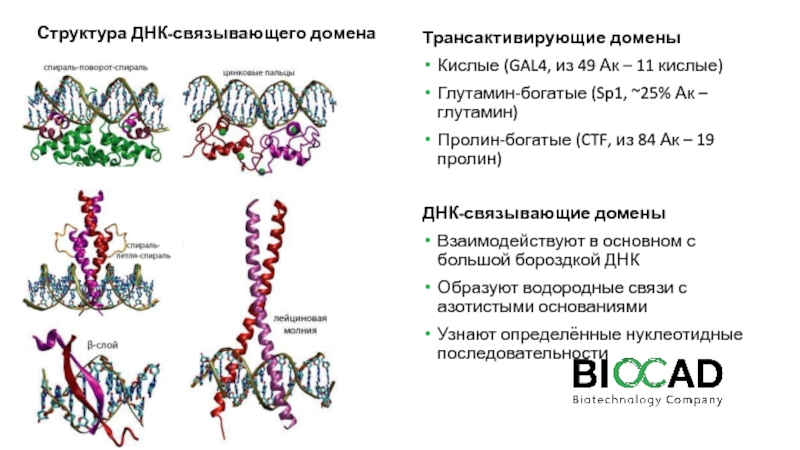
Слайд 14Структура ДНК-связывающего домена
Трансактивирующие домены
Кислые (GAL4, из 49 Ак – 11
кислые)
Глутамин-богатые (Sp1, ~25% Ак – глутамин)
Пролин-богатые (CTF, из
84 Ак – 19 пролин)
ДНК-связывающие домены
Взаимодействуют в основном с большой бороздкой ДНК
Образуют водородные связи с азотистыми основаниями
Узнают определённые нуклеотидные последовательности
Слайд 15Регуляция и синтез ТФ
Активация – изменение функциональности фактора по отношению
к ДНК за счет фосфорилирования, присоединения лиганда или взаимодействия с
другими регуляторными белками (в том числе ТФ)
Транслокация – транспортировка фактора из цитоплазмы в ядро
Доступность сайта связывания – зависит от степени конденсации хроматина (в состоянии гетерохроматина ДНК недоступна для ТФ)
Комплекс механизмов, характерных и для других белков (регуляция всех процессов от транскрипции до пострансляционной модификации и внутриклеточной локализации).
Некоторые ТФ способны регулировать свой синтез по типу классической обратной связи, когда ингибитором реакции становится ее собственный продукт. В таком случае определенная концентрация фактора останавливает транскрипцию кодирующего его гена.
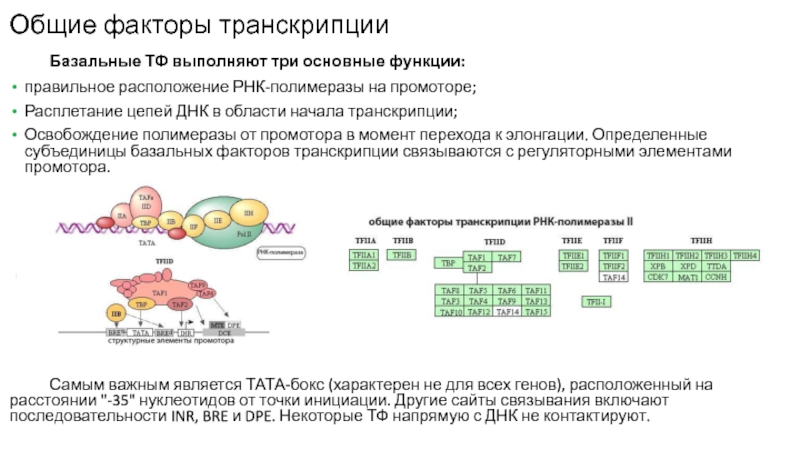
Слайд 16Общие факторы транскрипции
Базальные ТФ выполняют три основные функции:
правильное расположение
РНК-полимеразы на промоторе;
Расплетание цепей ДНК в области начала транскрипции;
Освобождение полимеразы
от промотора в момент перехода к элонгации. Определенные субъединицы базальных факторов транскрипции связываются с регуляторными элементами промотора.
Самым важным является ТАТА-бокс (характерен не для всех генов), расположенный на расстоянии "-35" нуклеотидов от точки инициации. Другие сайты связывания включают последовательности INR, BRE и DPE. Некоторые ТФ напрямую с ДНК не контактируют.
Слайд 17Базальные факторы транскрипции РНК-полимеразы ll
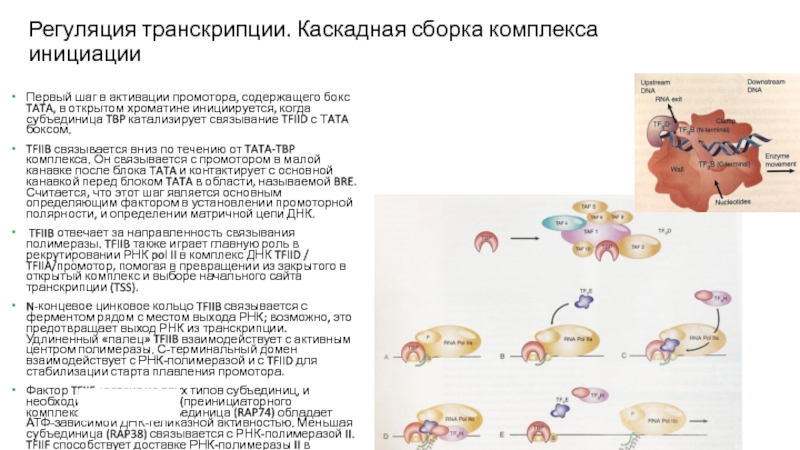
Слайд 18Регуляция транскрипции. Каскадная сборка комплекса инициации
Первый шаг в активации промотора,
содержащего бокс TATA, в открытом хроматине инициируется, когда субъединица TBP
катализирует связывание TFIID с ТATA боксом.
TFIIB связывается вниз по течению от TATA-TBP комплекса. Он связывается с промотором в малой канавке после блока TATA и контактирует с основной канавкой перед блоком TATA в области, называемой BRE. Считается, что этот шаг является основным определяющим фактором в установлении промоторной полярности, и определении матричной цепи ДНК.
TFIIB отвечает за направленность связывания полимеразы. TFIIB также играет главную роль в рекрутировании РНК pol II в комплекс ДНК TFIID / TFIIA/промотор, помогая в превращении из закрытого в открытый комплекс и выборе начального сайта транскрипции (TSS).
N-концевое цинковое кольцо TFIIB связывается с ферментом рядом с местом выхода РНК; возможно, это предотвращает выход РНК из транскрипции. Удлиненный «палец» TFIIB взаимодействует с активным центром полимеразы. С-терминальный домен взаимодействует с РНК-полимеразой и с TFIID для стабилизации старта плавления промотора.
Фактор TFIIF cостоит из двух типов субъединиц, и необходим для сборки PIC (преинициаторного комплекса). Большая субъединица (RAP74) обладает АТФ-зависимой ДНК-геликазной активностью. Меньшая субъединица (RAP38) связывается с РНК-полимеразой II. TFIIF способствует доставке РНК-полимеразы II в транскрипционный комплекс и вместе с TFIIB участвует в поиске сайта запуска транскрипции.
Слайд 19Специфические ТФ
Через контроль генетической экспресии эти факторы транскрипции регулируют биосинтетические
процессы как отдельных клеток, так и целого организма начиная от
эмбриогенеза заканчивая тонкой фенотипической адаптацией к изменяющимся условиям среды.
развитие (эмбрио- и онтогенез);
клеточный цикл;
ответ на внешние сигналы.
Самостоятельно найдите пример для специфических транскрипционных факторов
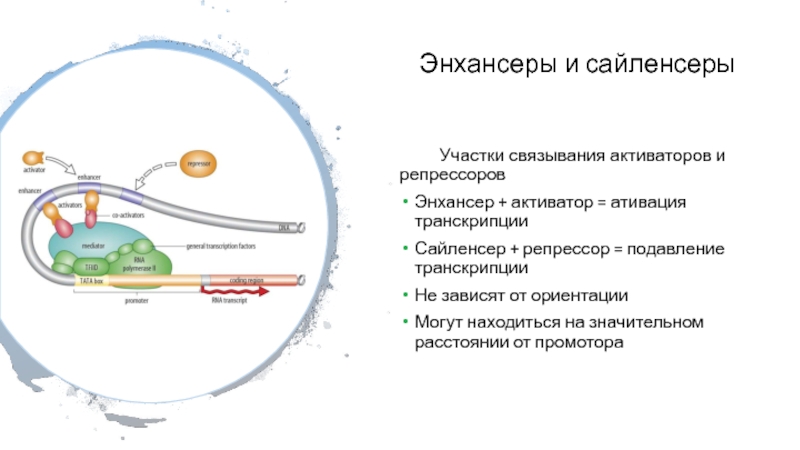
Слайд 20Энхансеры и сайленсеры
Участки связывания активаторов и репрессоров
Энхансер + активатор
= ативация транскрипции
Сайленсер + репрессор = подавление транскрипции
Не зависят
от ориентации
Могут находиться на значительном расстоянии от промотора
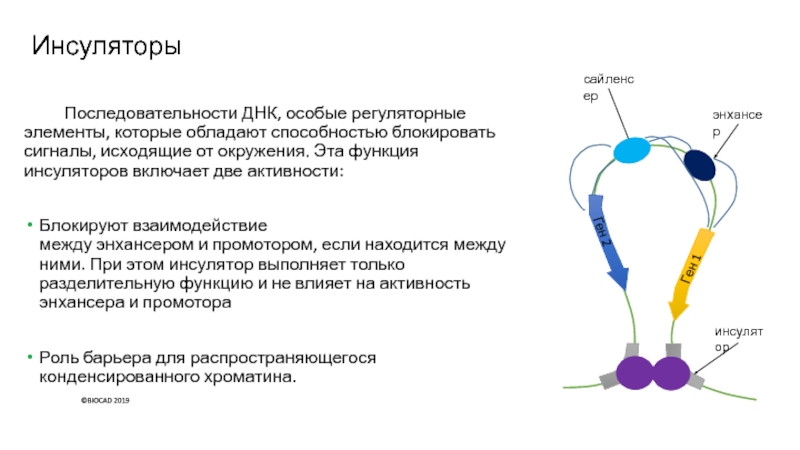
Слайд 21Инсуляторы
Последовательности ДНК, особые регуляторные элементы, которые обладают способностью блокировать сигналы,
исходящие от окружения. Эта функция инсуляторов включает две активности:
Блокируют взаимодействие
между энхансером и промотором, если находится между ними. При этом инсулятор выполняет только разделительную функцию и не влияет на активность энхансера и промотора
Роль барьера для распространяющегося конденсированного хроматина.
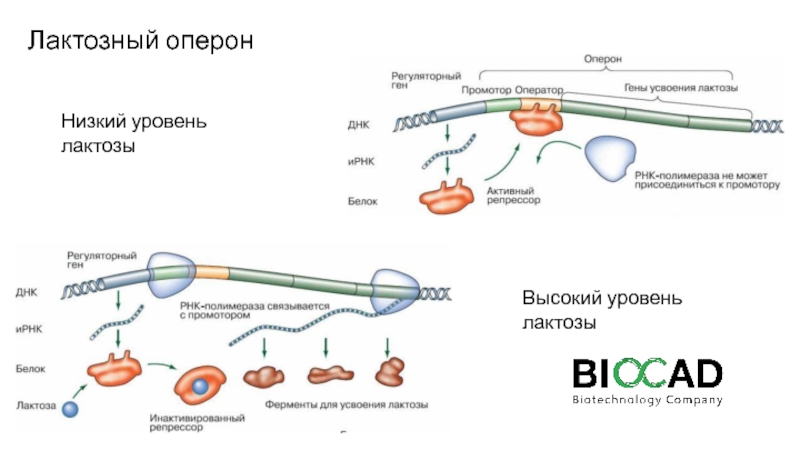
Слайд 23Лактозный оперон
Низкий уровень лактозы
Высокий уровень лактозы
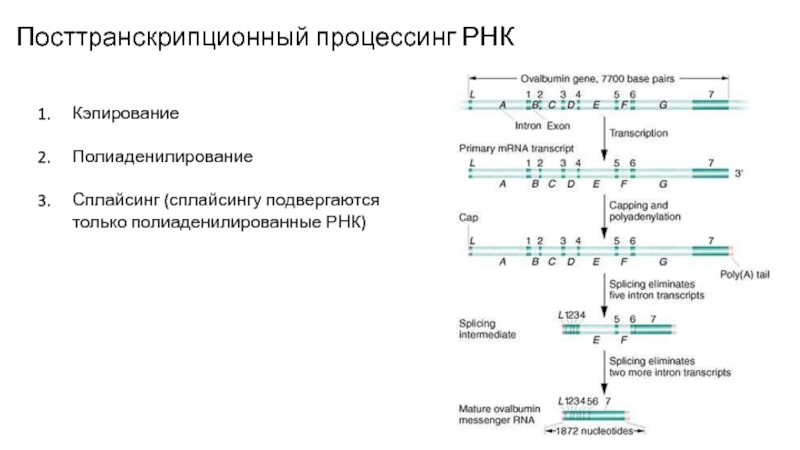
Слайд 24Посттранскрипционный процессинг РНК
Кэпирование
Полиаденилирование
Сплайсинг (сплайсингу подвергаются только полиаденилированные РНК)
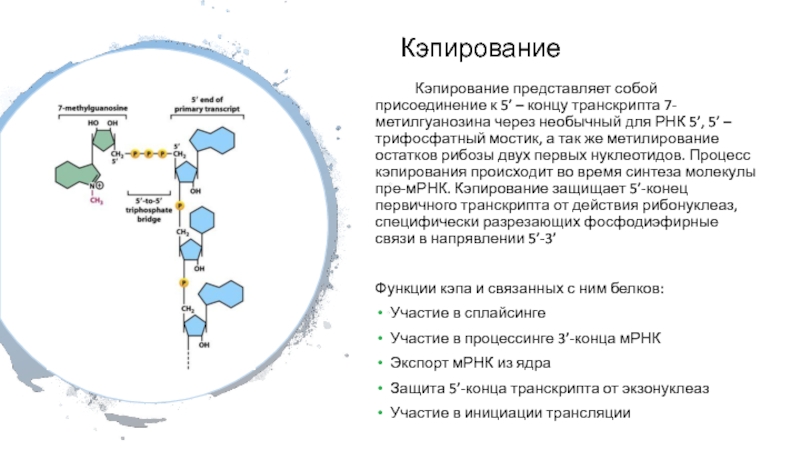
Слайд 25Кэпирование
Кэпирование представляет собой присоединение к 5’ – концу транскрипта 7-метилгуанозина
через необычный для РНК 5’, 5’ – трифосфатный мостик, а
так же метилирование остатков рибозы двух первых нуклеотидов. Процесс кэпирования происходит во время синтеза молекулы пре-мРНК. Кэпирование защищает 5’-конец первичного транскрипта от действия рибонуклеаз, специфически разрезающих фосфодиэфирные связи в напрявлении 5’-3’
Функции кэпа и связанных с ним белков:
Участие в сплайсинге
Участие в процессинге 3’-конца мРНК
Экспорт мРНК из ядра
Защита 5’-конца транскрипта от экзонуклеаз
Участие в инициации трансляции
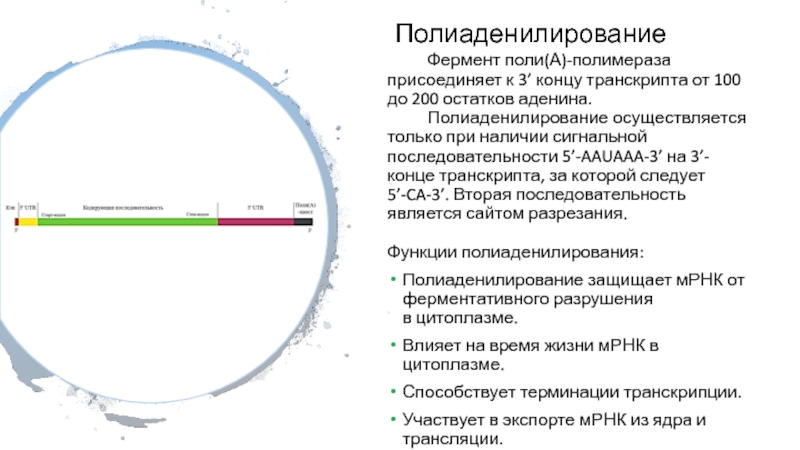
Слайд 26Полиаденилирование
Фермент поли(А)-полимераза присоединяет к 3’ концу транскрипта от 100 до
200 остатков аденина.
Полиаденилирование осуществляется только при наличии сигнальной последовательности
5’-AAUAAA-3’ на 3’-конце транскрипта, за которой следует 5’-CA-3’. Вторая последовательность является сайтом разрезания.
Функции полиаденилирования:
Полиаденилирование защищает мРНК от ферментативного разрушения в цитоплазме.
Влияет на время жизни мРНК в цитоплазме.
Способствует терминации транскрипции.
Участвует в экспорте мРНК из ядра и трансляции.
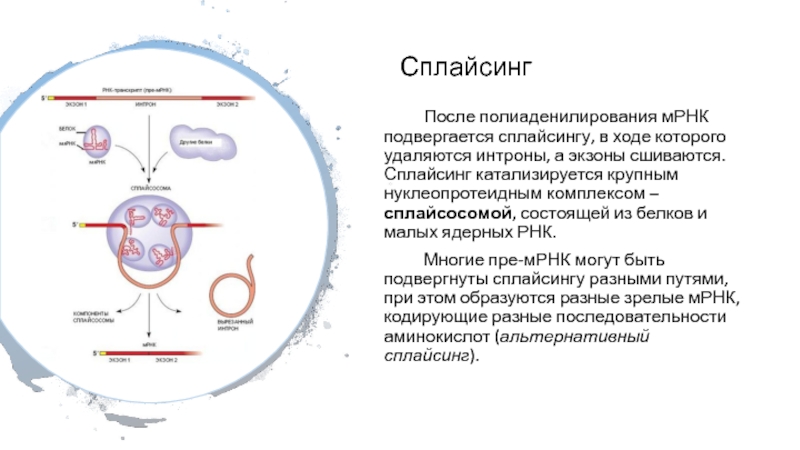
Слайд 27Сплайсинг
После полиаденилирования мРНК подвергается сплайсингу, в ходе которого удаляются интроны,
а экзоны сшиваются. Сплайсинг катализируется крупным нуклеопротеидным комплексом – сплайсосомой,
состоящей из белков и малых ядерных РНК.
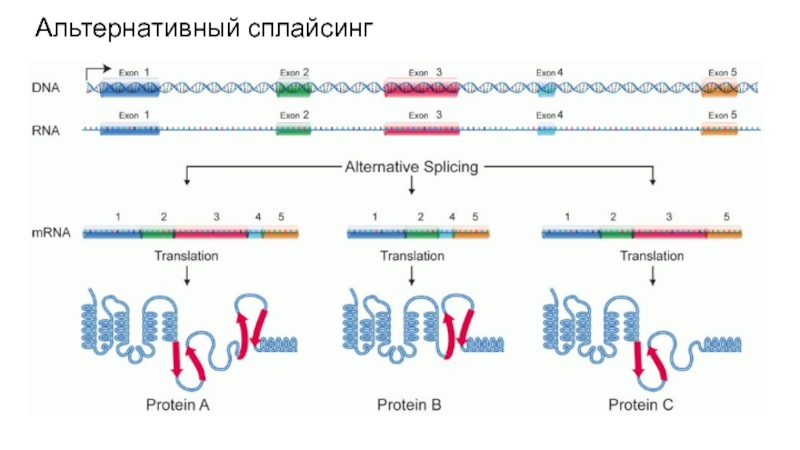
Многие пре-мРНК могут быть подвергнуты сплайсингу разными путями, при этом образуются разные зрелые мРНК, кодирующие разные последовательности аминокислот (альтернативный сплайсинг).
Слайд 29Строение мРНК эукариот
В эукариотических мРНК сразу за кэпом располагается 5'-нетранслирующая
область (5'-UTR), с которой связываются белки, играющие важнейшую роль в
регуляции инициации трансляции. К их числу относятся собственно белковые факторы инициации (elF), а также белки-репрессоры трансляции. В инициации трансляции принимают участие также З'-нетранслируемая область (3'-UTR) и поли(А)-хвосты мРНК. В З'-UTR имеются и особые последовательности: сигналы полиаденилирования и сигнал внутриклеточной локализации.
С З'-UTR способны связываться маскирующие белки (они делают мРНК недоступной для трансляции рибосомами) и дестабилизирующие белки, контролирующие доступность мРНК для атаки нуклеаз и таким образом определяющие время жизни мРНК в клетке.
В кодирующем участке (транслируемая область) с мРНК связываются факторы элонгации (eEF), АРСазы (аминоацил-тРНК-синтетазы), рибосомы, а также определенные ферменты, необходимые для процесса трансляции. В кодирующей области мРНК расположены также сигналы перекодирования (репрограммирования) трансляции, благодаря которым с одной и той же мРНК могут транслироваться разные белки.

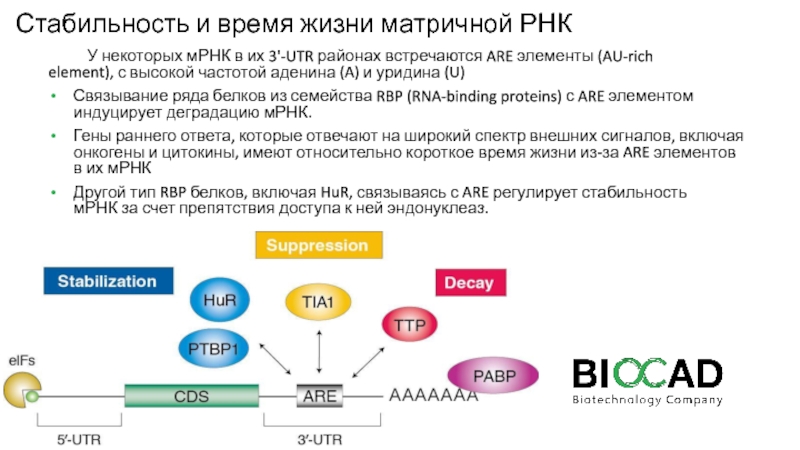
Слайд 30Стабильность и время жизни матричной РНК
У некоторых мРНК в их
3'-UTR районах встречаются ARE элементы (AU-rich element), с высокой частотой
аденина (A) и уридина (U)
Связывание ряда белков из семейства RBP (RNA-binding proteins) с ARE элементом индуцирует деградацию мРНК.
Гены раннего ответа, которые отвечают на широкий спектр внешних сигналов, включая онкогены и цитокины, имеют относительно короткое время жизни из-за ARE элементов в их мРНК
Другой тип RBP белков, включая HuR, связываясь с ARE регулирует стабильность мРНК за счет препятствия доступа к ней эндонуклеаз.
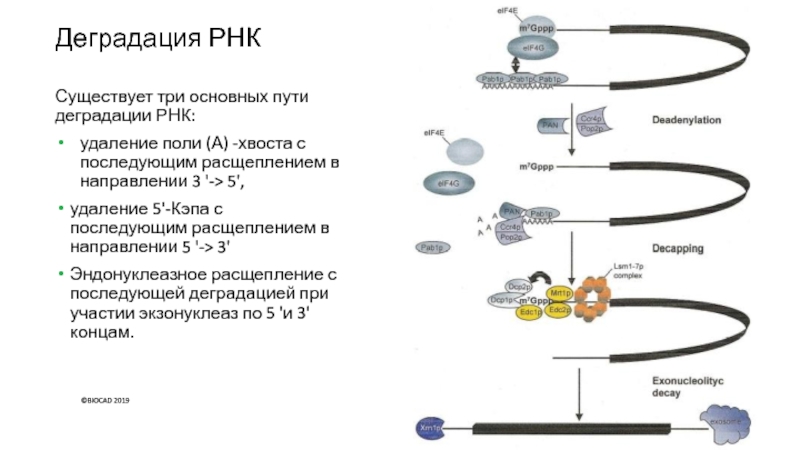
Слайд 31Деградация РНК
Существует три основных пути деградации РНК:
удаление поли (А) -хвоста
с последующим расщеплением в направлении 3 '-> 5',
удаление 5'-Кэпа с
последующим расщеплением в направлении 5 '-> 3'
Эндонуклеазное расщепление с последующей деградацией при участии экзонуклеаз по 5 'и 3' концам.
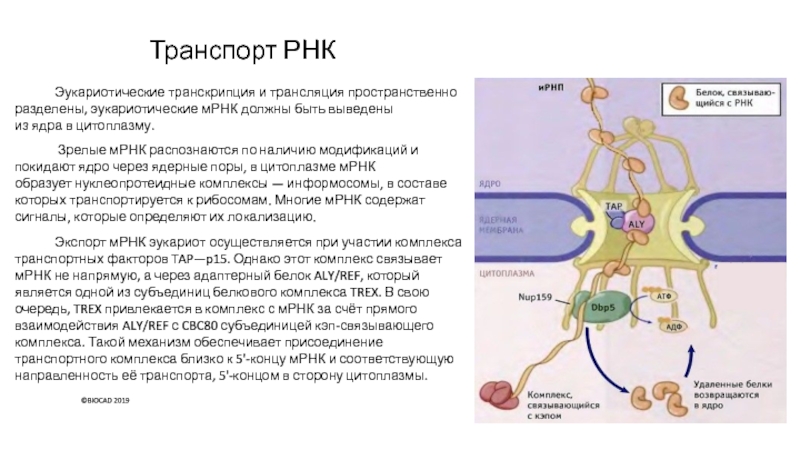
Слайд 32Транспорт РНК
Эукариотические транскрипция и трансляция пространственно разделены, эукариотические мРНК должны
быть выведены из ядра в цитоплазму.
Зрелые мРНК распознаются по наличию модификаций и
покидают ядро через ядерные поры, в цитоплазме мРНК образует нуклеопротеидные комплексы — информосомы, в составе которых транспортируется к рибосомам. Многие мРНК содержат сигналы, которые определяют их локализацию.
Экспорт мРНК эукариот осуществляется при участии комплекса транспортных факторов TAP—p15. Однако этот комплекс связывает мРНК не напрямую, а через адаптерный белок ALY/REF, который является одной из субъединиц белкового комплекса TREX. В свою очередь, TREX привлекается в комплекс с мРНК за счёт прямого взаимодействия ALY/REF с CBC80 субъединицей кэп-связывающего комплекса. Такой механизм обеспечивает присоединение транспортного комплекса близко к 5'-концу мРНК и соответствующую направленность её транспорта, 5'-концом в сторону цитоплазмы.
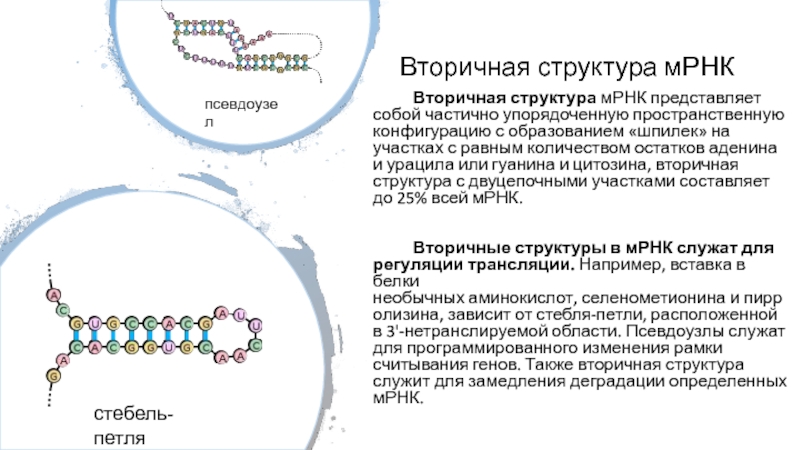
Слайд 33Вторичная структура мРНК
Вторичная структура мРНК представляет собой частично упорядоченную пространственную конфигурацию
с образованием «шпилек» на участках с равным количеством остатков аденина
и урацила или гуанина и цитозина, вторичная структура с двуцепочными участками составляет до 25% всей мРНК.
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3'-нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов. Также вторичная структура служит для замедления деградации определенных мРНК.
стебель-петля
псевдоузел
Слайд 34 Транспортные РНК
Две основные функции тРНК:
Акцепторная функция – способность ковалентно связываться
с аминоацильным остатком, превращаясь в аминоацил-тРНК;
Адапторная функция – способность узнавать триплет
генетического кода, соответствующий транспортируемой аминокислоте, и обеспечивать поступление аминокислоты на «законное» место в растущей цепи белка.
В антикодоновой петле РНК имеется антикодон, комплементарный кодовому триплету определенной аминокислоты.
Акцепторный участок на 3'-конце способен с помощью фермента аминоацил-тРНК-синтетазы присоединять именно эту аминокислоту (с затратой АТФ) к участку ССА.
Слайд 35Активация и акцептирование аминокислот.
Аминоацилирование тРНК – процесс активации аминокислот. Он происходит
на первом этапе биосинтеза белка – двадцать различных аминокислот присоединяются
эфирной связью к соответствующим тРНК под действием двадцати различных специфичных активирующих ферментов, называемыми аминоацил-тРНК-синтетазами.
Аминоацилирование состоит из двух стадий:
Образование аминоациладенилата в результате взаимодействия АТР и аминокислоты.
Перенос аминоацильного остатка с аминоациладенилата, связанного с ферментом, на соответствующую специфическую тРНК
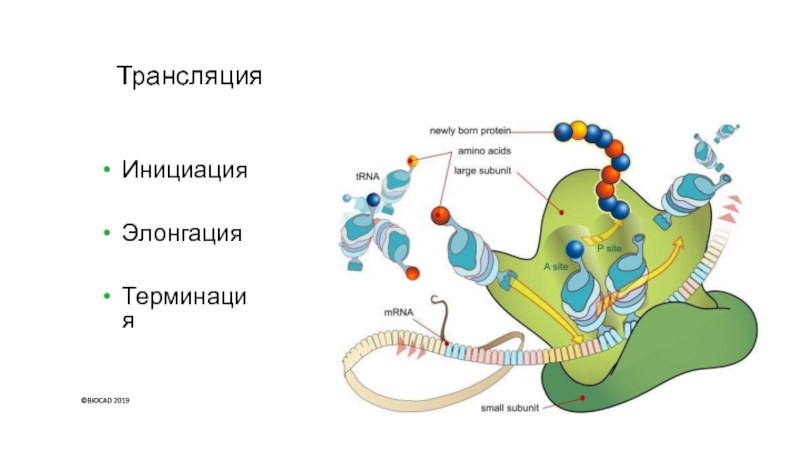
Слайд 36Трансляция
Инициация
Элонгация
Терминация
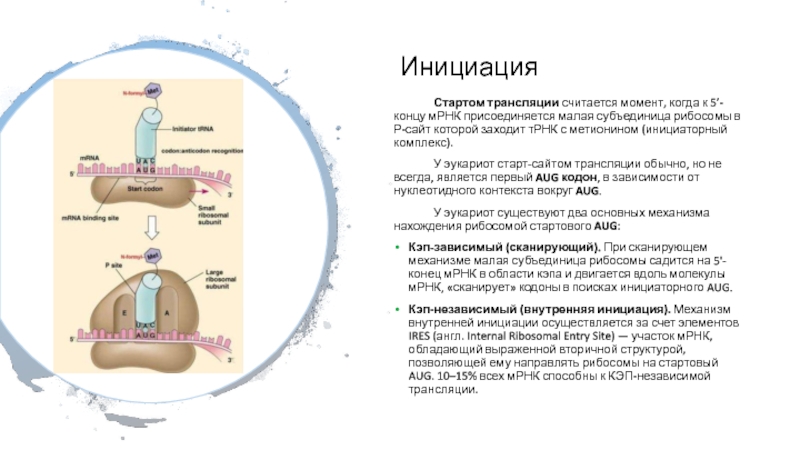
Слайд 37Инициация
Стартом трансляции считается момент, когда к 5’- концу мРНК присоединяется
малая субъединица рибосомы в Р-сайт которой заходит тРНК с метионином
(инициаторный комплекс).
У эукариот старт-сайтом трансляции обычно, но не всегда, является первый AUG кодон, в зависимости от нуклеотидного контекста вокруг AUG.
У эукариот существуют два основных механизма нахождения рибосомой стартового AUG:
Кэп-зависимый (сканирующий). При сканирующем механизме малая субъединица рибосомы садится на 5'-конец мРНК в области кэпа и двигается вдоль молекулы мРНК, «сканирует» кодоны в поисках инициаторного AUG.
Кэп-независимый (внутренняя инициация). Механизм внутренней инициации осуществляется за счет элементов IRES (англ. Internal Ribosomal Entry Site) — участок мРНК, обладающий выраженной вторичной структурой, позволяющей ему направлять рибосомы на стартовый AUG. 10–15% всех мРНК способны к КЭП-независимой трансляции.
Слайд 38Элонгация
Образование пептидной связи происходит за счет энергии ГТФ между карбоксильной
группой метионина и аминогрупой второй аминокислоты
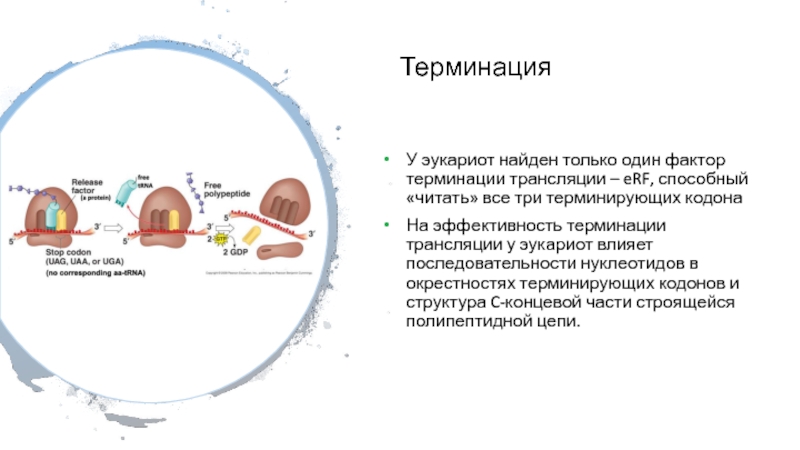
Слайд 39Терминация
У эукариот найден только один фактор терминации трансляции – eRF,
способный «читать» все три терминирующих кодона
На эффективность терминации трансляции у
эукариот влияет последовательности нуклеотидов в окрестностях терминирующих кодонов и структура C-концевой части строящейся полипептидной цепи.
Слайд 40Рибосома
Субъединицы эукариотических рибосом формируются в ядре из рРНК, ассоциированных с
рибосомными белками, которые транспортируются в ядро после синтеза в цитоплазме.
Молекулы рРНК определяют структуру, физические и химические свойства, функции рибосом, а также расположение рибосомных белков в субчастицах рибосом.
Обычно одна молекула мРНК читается сразу несколькими рибосомами, двигающимися вдоль мРНК друг за другом и, таким образом, независимо синтезирующими идентичные молекулы белка, но с соответствующим отставанием. Такой динамический комплекс одной мРНК с несколькими рибосомами называется полирибосомой.
Молекула тРНК крепится к А- и Р-сайтам только если её антикодон образует пары оснований с комплементарным кодоном молекулы мРНК. А- и Р-сайты расположены близко друг к другу чтобы две их тРНК молекулы формировали пары нуклеотидов с примыкающим кодоном молекулы мРНК.
Рибосомы разных клеток различаются по размерам, которые определяются по скорости осаждения при центрифугировании. Скорость осаждения измеряется в единицах Сведберга (S). Сведберг – это отношение скорости седиментации к центробежному ускорению, 1S = 10-13 секунд. Коэффициенты седиментации разных рибосом варьируют от 5S до 80S.
У прокариот рибосомы имеют коэффициент 70S, а рибосомы цитоплазмы эукариот — 80S.
А-сайт (aminoacyl-tRNA — аминоацил-тРНК)
Р-сайт (peptidyl-tRNA — пептидил-тРНК)
Е-сайт (exit — выход)
мРНК-связывающий участок

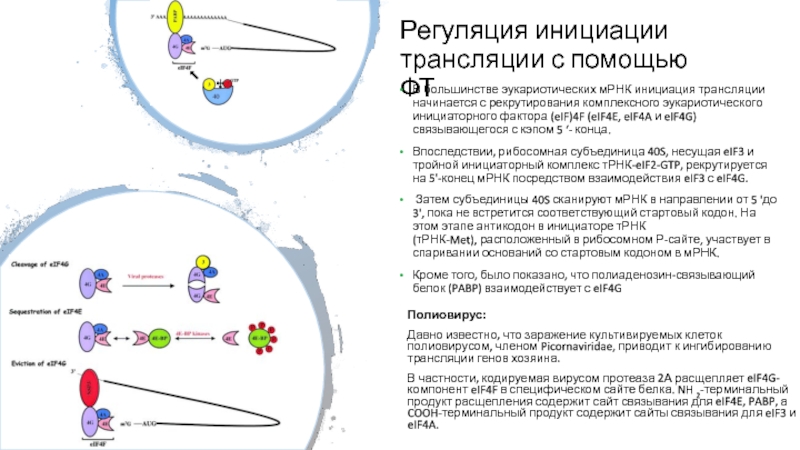
Слайд 42Регуляция инициации трансляции с помощью ФТ
В большинстве эукариотических мРНК инициация
трансляции начинается с рекрутирования комплексного эукариотического инициаторного фактора (eIF)4F (eIF4E,
eIF4A и eIF4G) связывающегося с кэпом 5 ‘- конца.
Впоследствии, рибосомная субъединица 40S, несущая eIF3 и тройной инициаторный комплекс тРНК-eIF2-GTP, рекрутируется на 5'-конец мРНК посредством взаимодействия eIF3 с eIF4G.
Затем субъединицы 40S сканируют мРНК в направлении от 5 'до 3', пока не встретится соответствующий стартовый кодон. На этом этапе антикодон в инициаторе тРНК (тРНК-Met), расположенный в рибосомном Р-сайте, участвует в спаривании оснований со стартовым кодоном в мРНК.
Кроме того, было показано, что полиаденозин-связывающий белок (PABP) взаимодействует с eIF4G
Полиовирус:
Давно известно, что заражение культивируемых клеток полиовирусом, членом Picornaviridae, приводит к ингибированию трансляции генов хозяина.
В частности, кодируемая вирусом протеаза 2А расщепляет eIF4G-компонент eIF4F в специфическом сайте белка. NH 2-терминальный продукт расщепления содержит сайт связывания для eIF4E, PABP, а COOH-терминальный продукт содержит сайты связывания для eIF3 и eIF4A.
Слайд 43Посттрансляционные
модификации белка
Новый пептид должен подвергнутся процессингу: свернутся в трехмерную
нативную конформацию, присоединить какие-либо молекулы, необходимые для его активности, модифицироваться
под действием протеинкиназ и других энзимов и правильно соединиться с другими частями белка, с которыми он функционирует.
Когда протеин сворачивается в компактную структуру, гидрофобные звенья обращаются внутрь глобулы. Формируется большая часть нековалентных взаимодействий между различными участками молекул. Итогом всех этих энергетически выгодных взаимодействий является конформация с самой низкой энергией.
Для некоторых белков сворачивание начинается с N-конца сразу после выхода полипептида из рибосомы. В этом случае, как только протеин покидает рибосому, через несколько секунд он формирует компактное строение, содержащее окончательную вторичную структуру (спирали и β-листы).
Большинство белков не сворачиваются во время синтеза. Вместо этого они "встречаются" у рибосомы с отдельным классом белков, называемых шаперонами. Связывание с шаперонами обеспечивает правильное сворачивание белка в нативную конформацию.
Известно более 100 вариантов посттрансляционных модификаций белков:
Фолдинг, сплайсинг (отщепление сигнальной последовательности), убиквитинилирование, метилирование, глутатионирование, фосфорилирование, гидроксилирование, гликозилирование и тд.