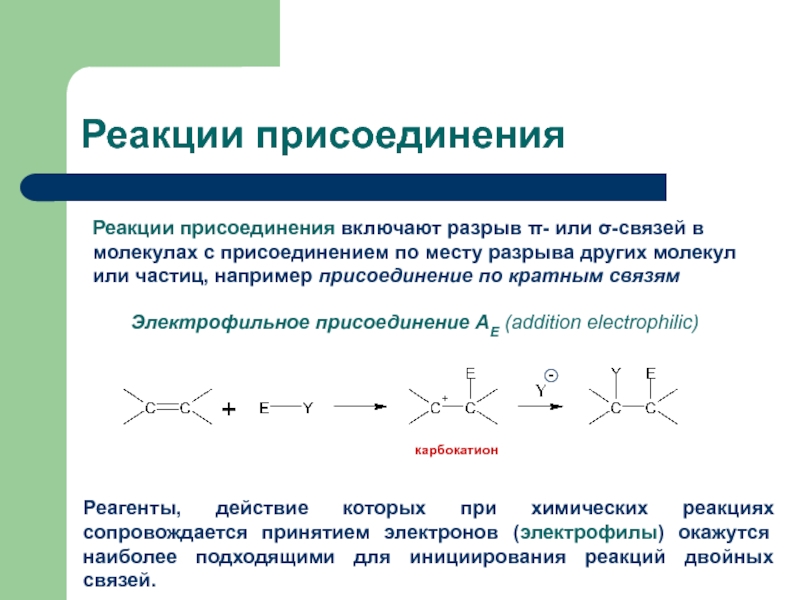
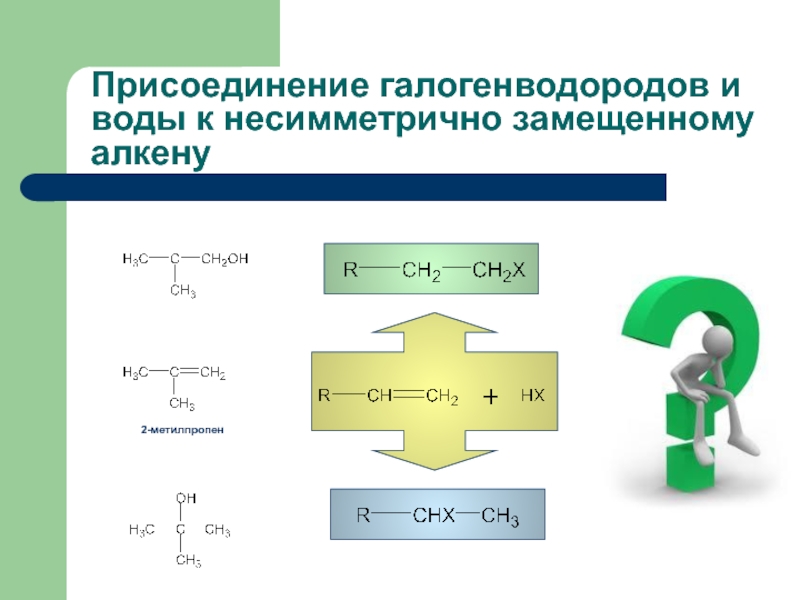
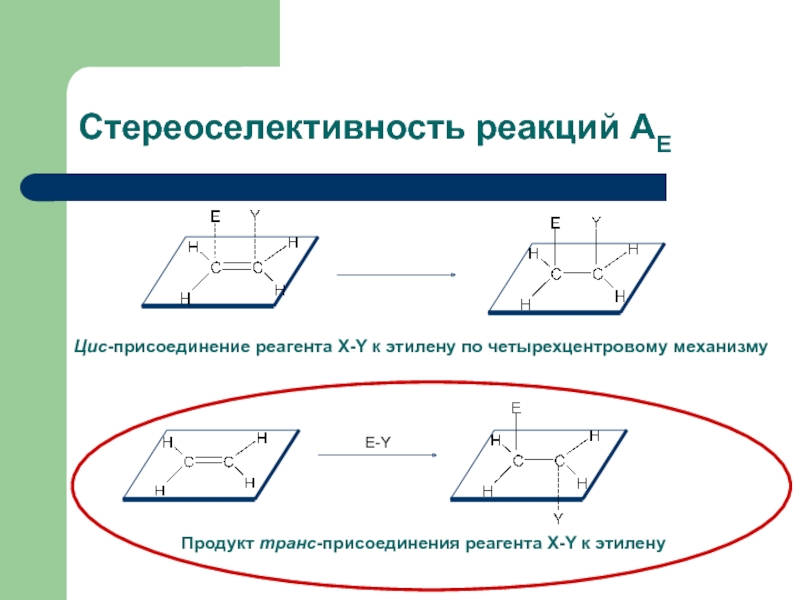
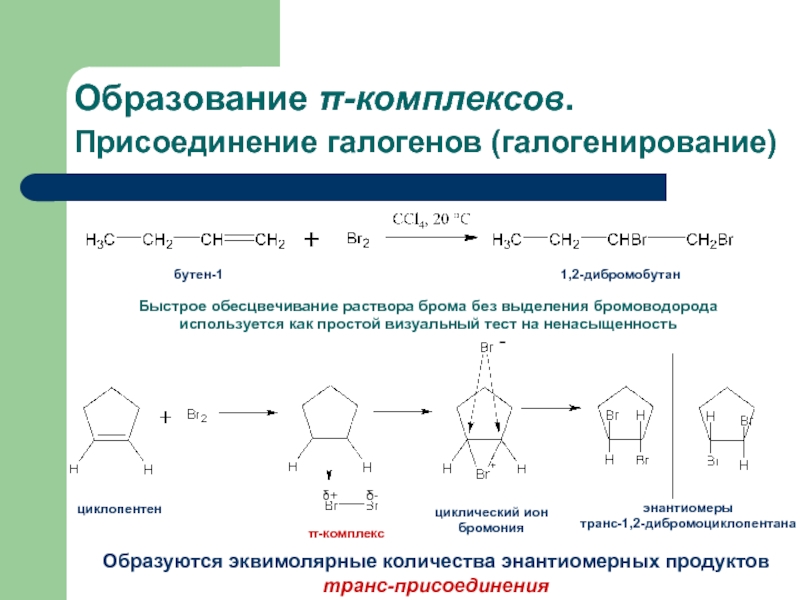
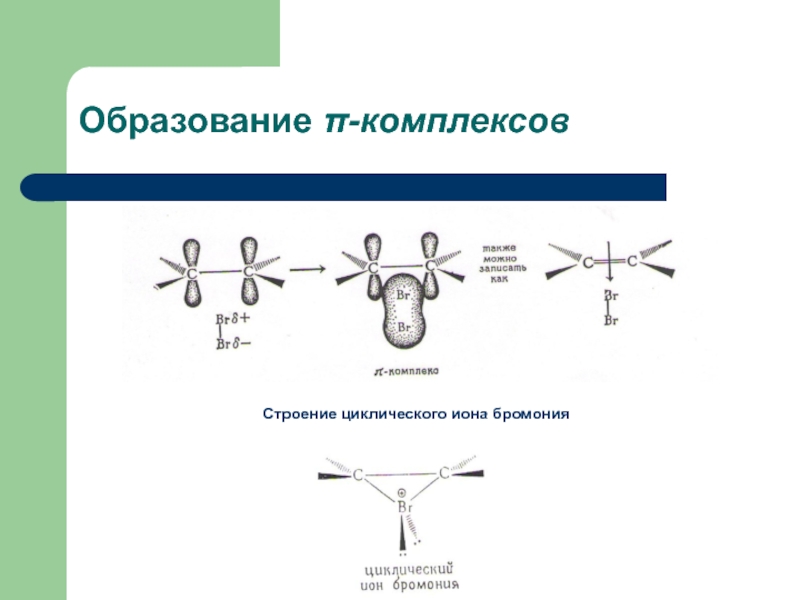
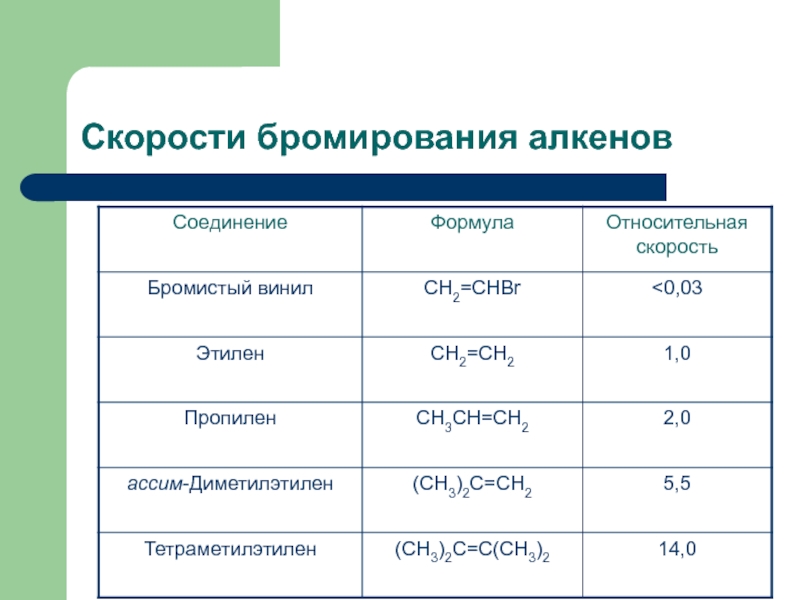
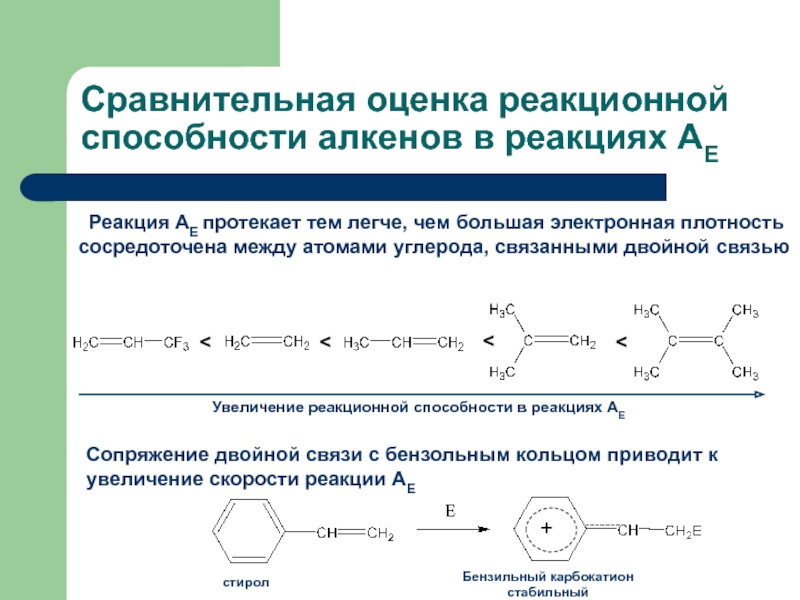
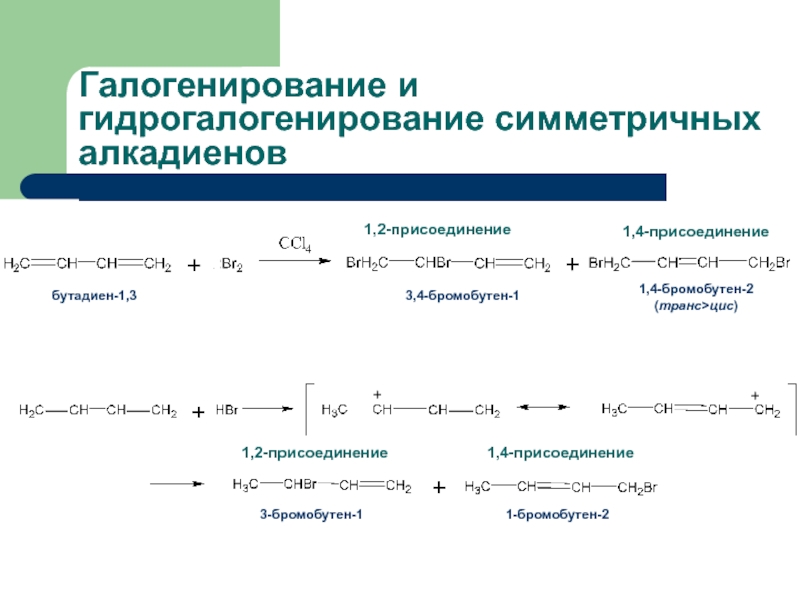
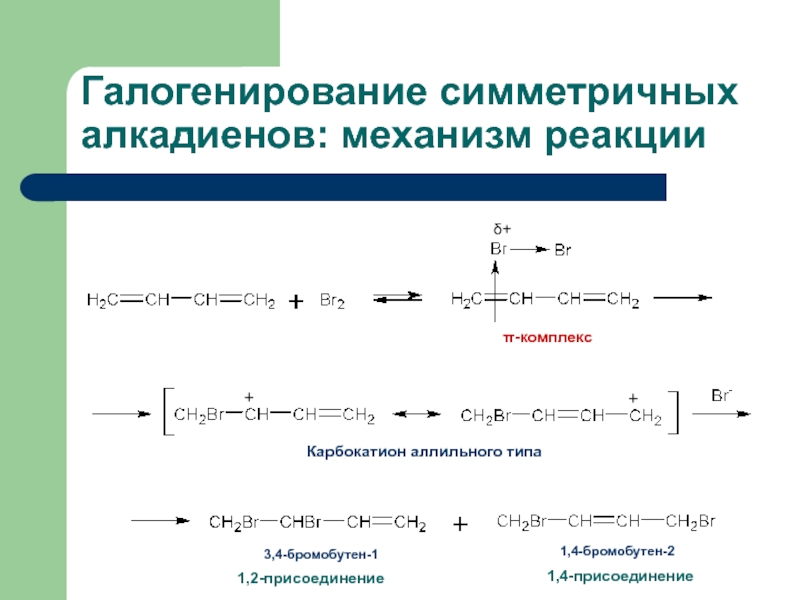
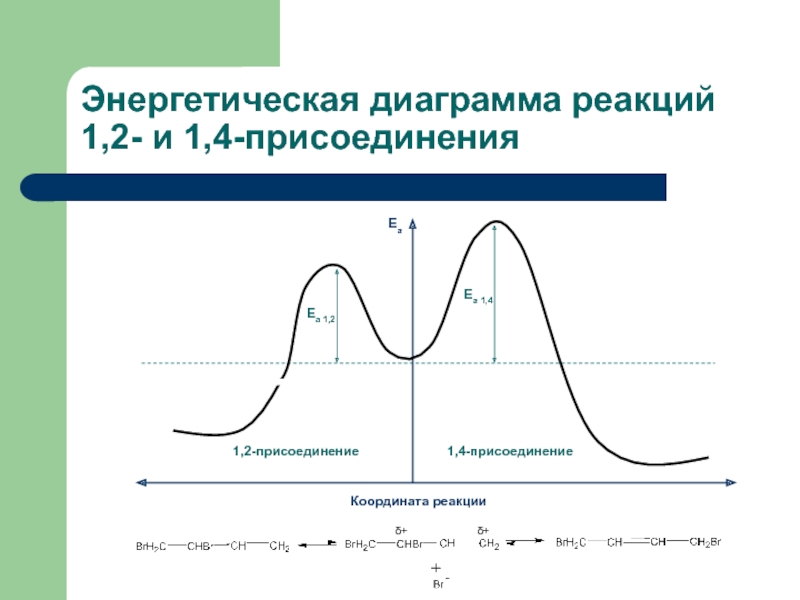
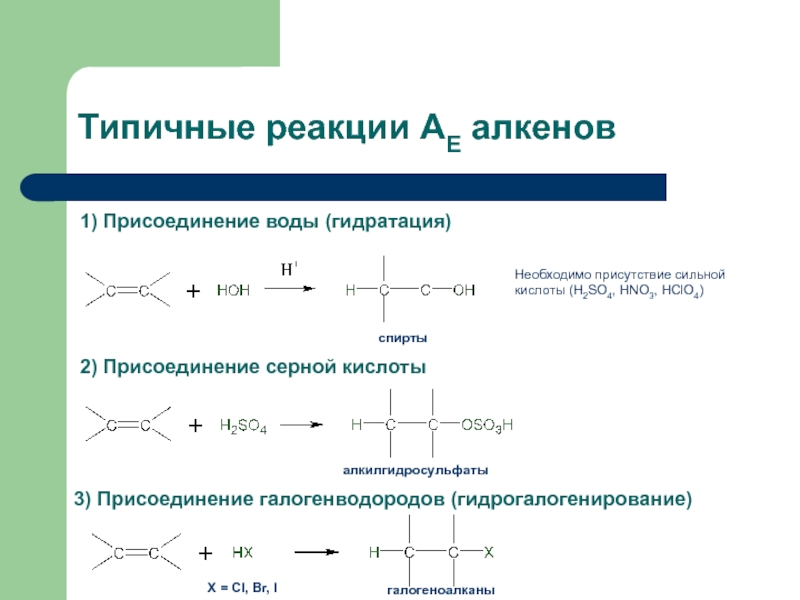
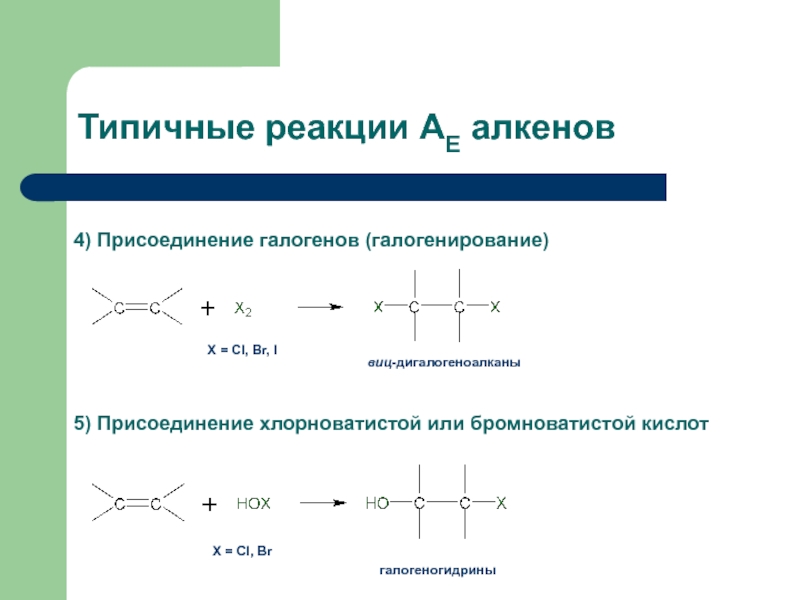
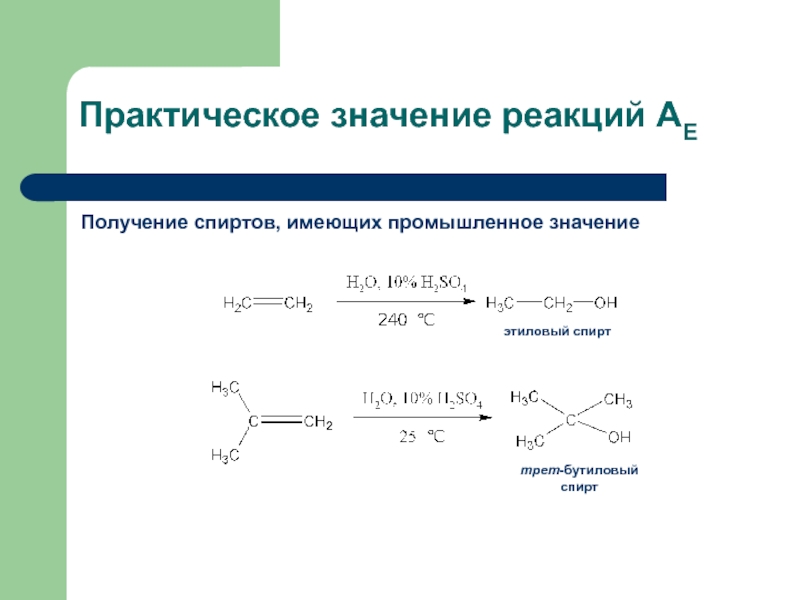
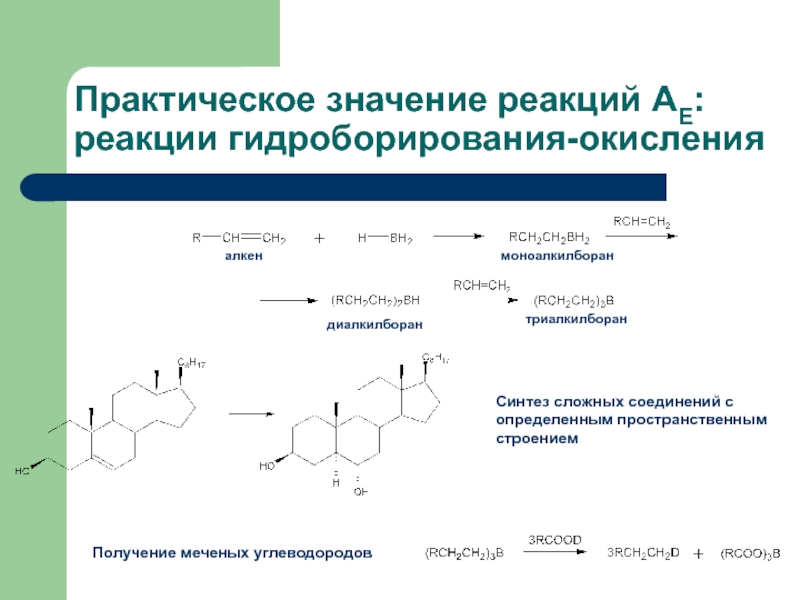
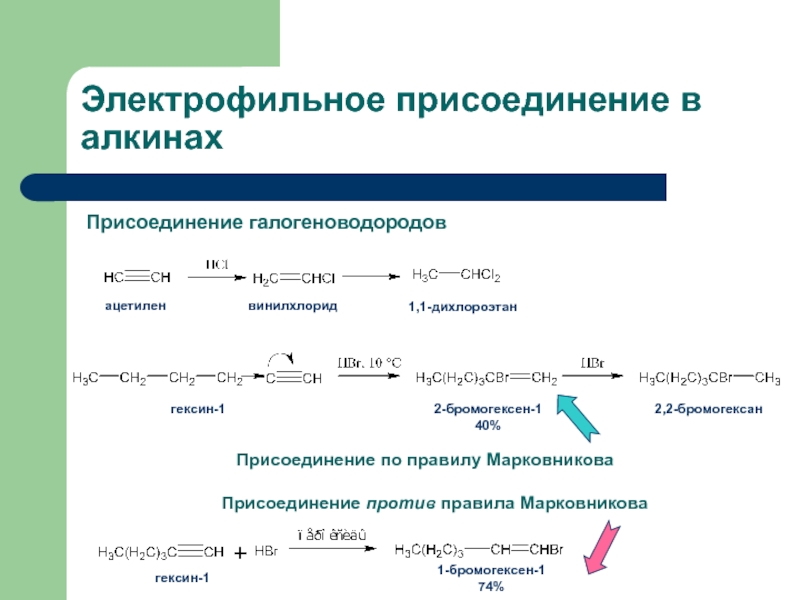
с присоединением по месту разрыва других молекул или частиц, например
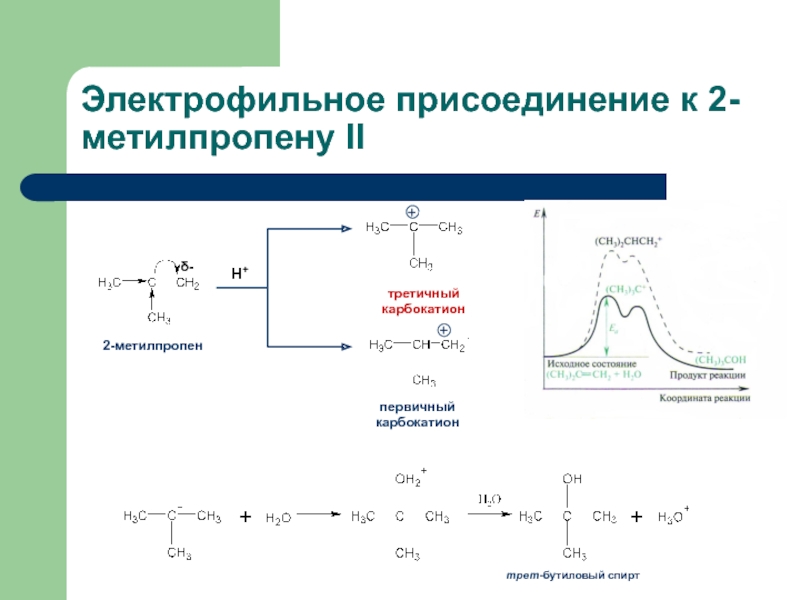
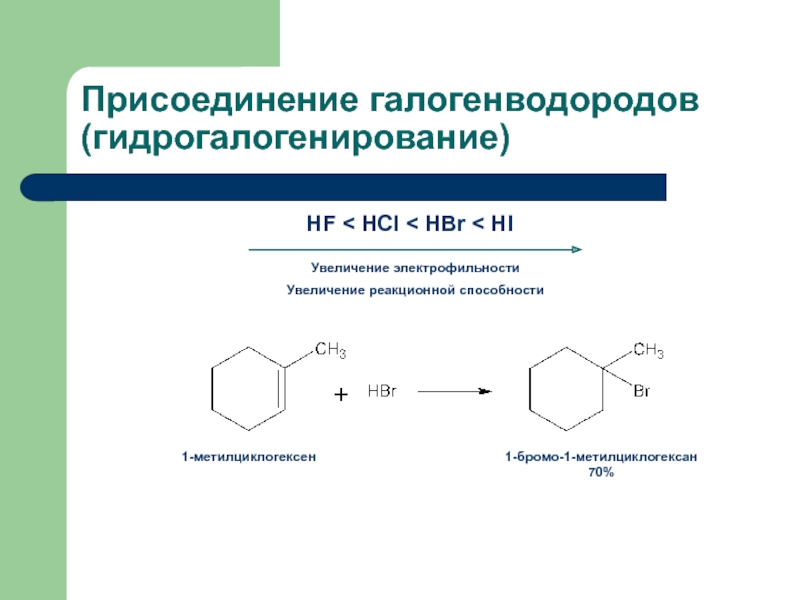
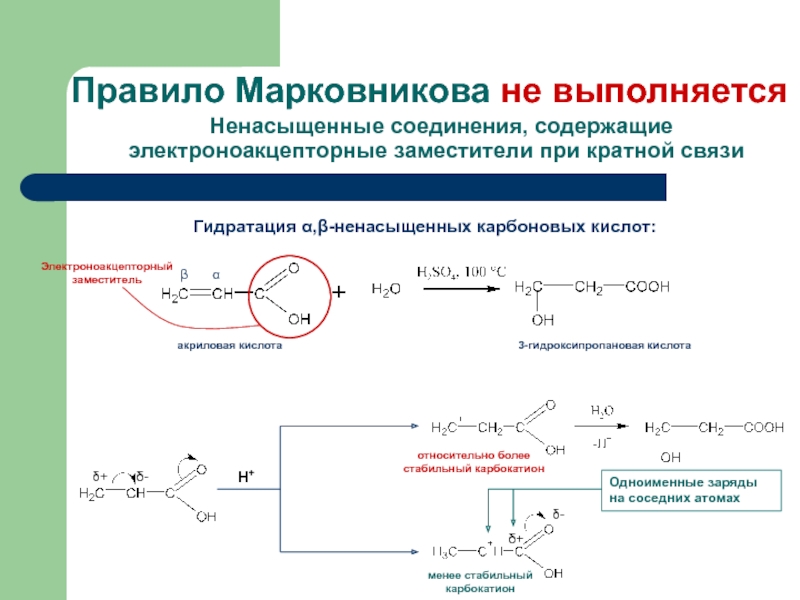
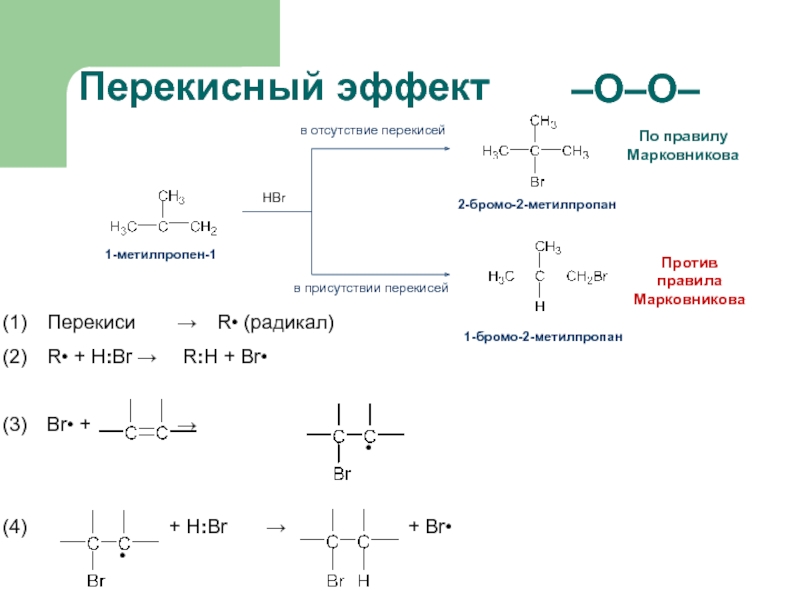
присоединение по кратным связямЭлектрофильное присоединение AE (addition electrophilic)
Реагенты, действие которых при химических реакциях сопровождается принятием электронов (электрофилы) окажутся наиболее подходящими для инициирования реакций двойных связей.
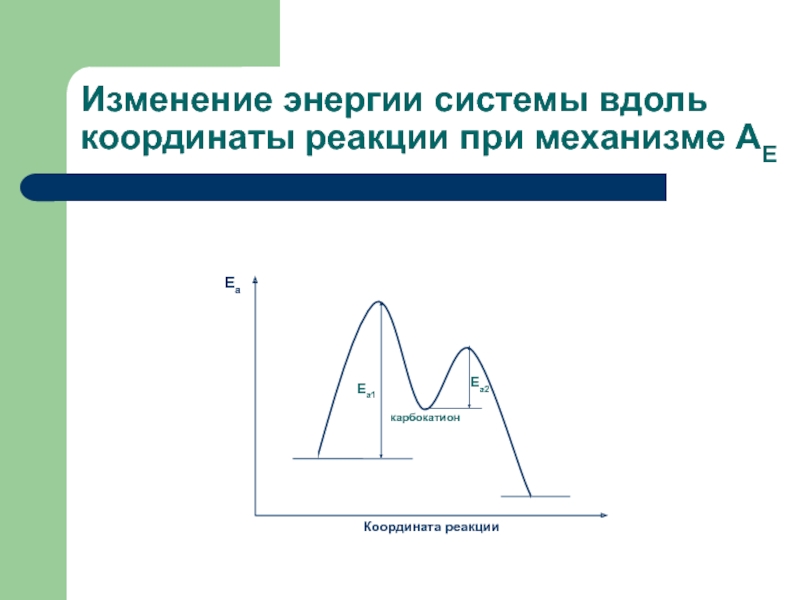
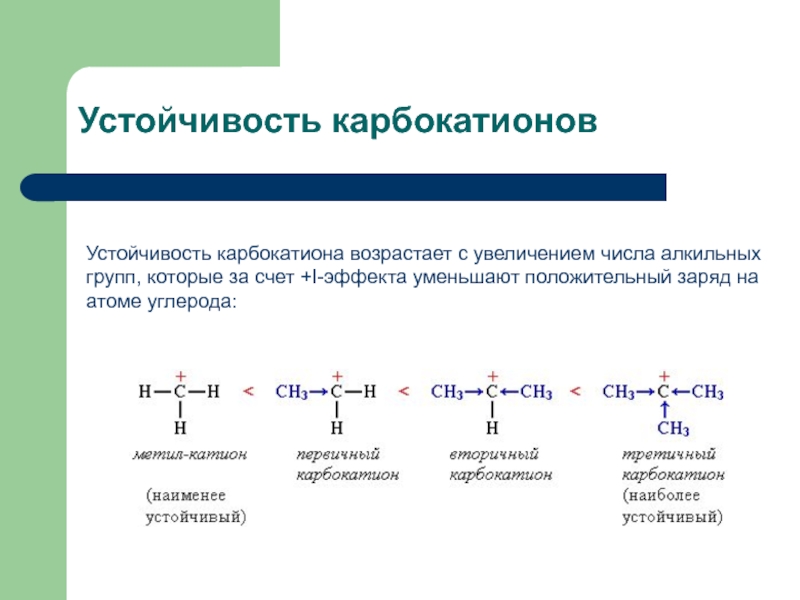
карбокатион