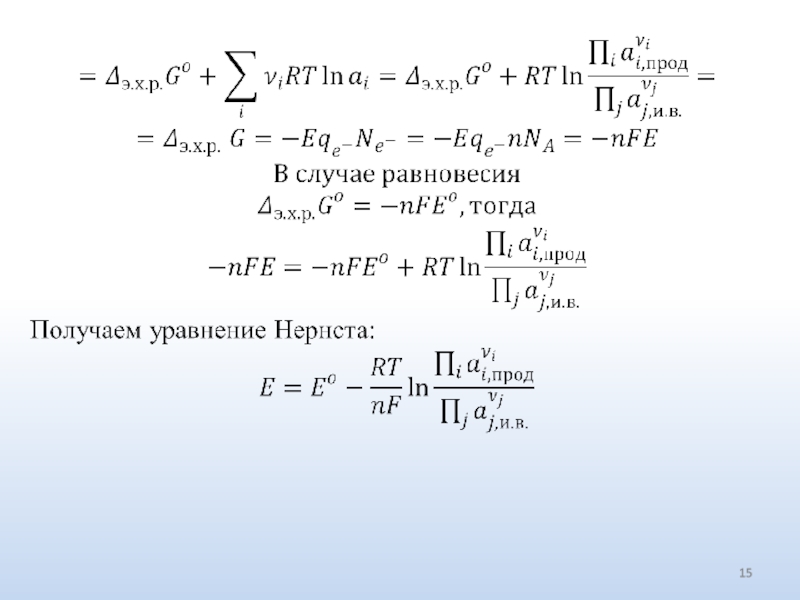Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
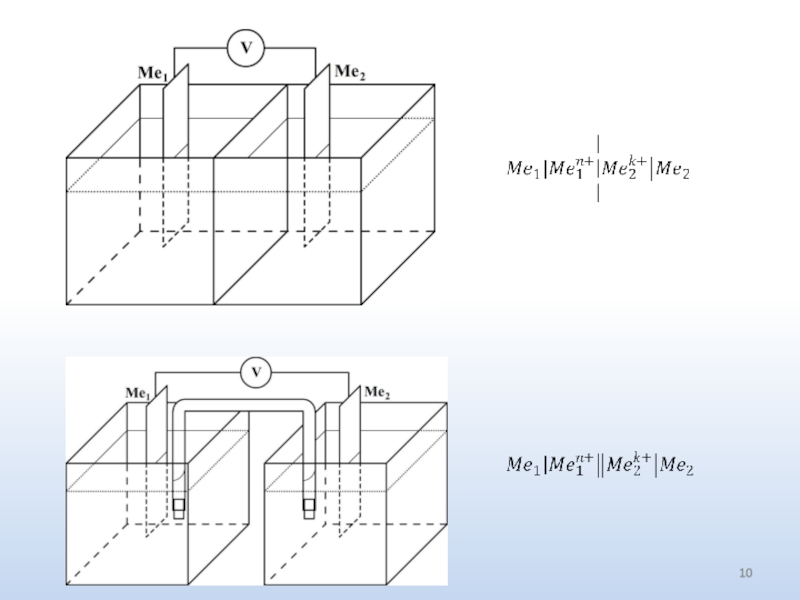
Электрохимические системы 1 Полный дифференциал энергии Гиббса dG = – SdT + Vdp
Содержание
- 1. Электрохимические системы 1 Полный дифференциал энергии Гиббса dG = – SdT + Vdp
- 2. Одна из самых простых таких систем –
- 3. Возникновение скачка потенциала на границе проводников I
- 4. Тонкий слой, образующийся на границе двух фаз
- 5. Потенциал электрохимический - термодинамическая функция, характеризующая состояние
- 6. В электрохимии – система, состоящая из двух
- 7. Потенциал электродный – разность электрохимических потенциалов на
- 8. Электрод необратимый - гальванический электрод, в котором
- 9. Гальванические элементы - химические источники тока, состоящие
- 10. Слайд 10
- 11. Электродвижущая сила (ЭДС) - предельное значение разности
- 12. Водородная шкала электродных потенциалов - используемая в
- 13. Положительным электродом называют электрод с более высоким
- 14. Слайд 14
- 15. Слайд 15
- 16. Уравнение Нернста можно получить несколько проще:
- 17. Fe3+ +3e- → FeCu2+ + 2e- → Cu3Cu2+ + 2Fe → 3Cu + 2Fe3+
- 18. Слайд 18
- 19. Скачать презентанцию
Слайды и текст этой презентации
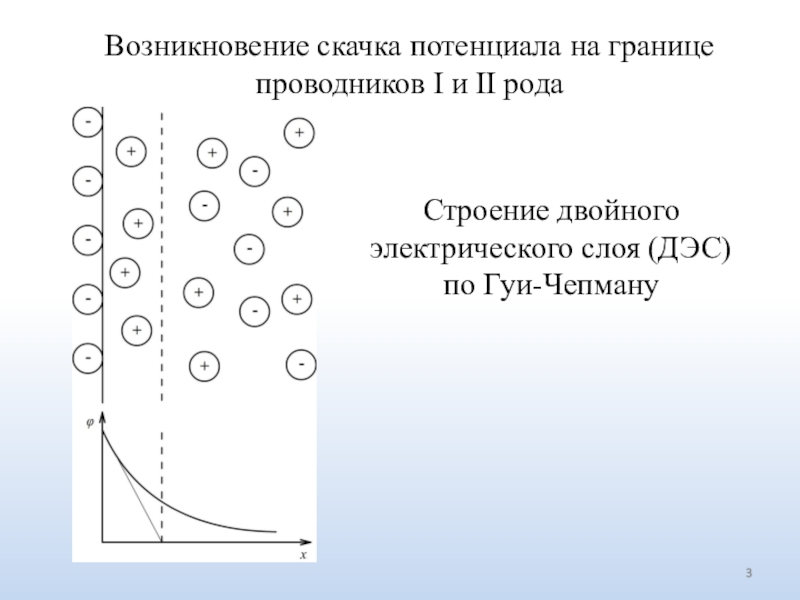
Слайд 3Возникновение скачка потенциала на границе проводников I и II рода
Строение двойного электрического слоя (ДЭС) по Гуи-Чепману
Слайд 4Тонкий слой, образующийся на границе двух фаз из пространственно разделенных
электрических зарядов противоположного знака. Пространственное разделение зарядов всегда сопровождается возникновением
электрической разности потенциалов. На границе «металл-раствор электролита», где строение ДЭС изучено наиболее детально, возникает ДЭС, образованный зарядами электрода и адсорбированными на нем ионами и молекулами органических веществ. Строение ДЭС зависит от экспериментальных условий и теоретически может быть описано с помощью моделей различной степени сложности. В простейшем случае положительный заряд ДЭС равномерно распределен по плоской поверхности и удален на расстояние, сравнимое с размерами ионов и молекул, от другой аналогичной плоскости, где равномерно распределен отрицательный заряд. Такой ДЭС подобен плоскому конденсатору и называется слоем Гельмгольца. В силу теплового движения ионов заряды одной из «обкладок» ДЭС, находящейся в жидкой фазе, «размазаны» и распределены в приповерхностном слое электролита подобно распределению ионов в ионной атмосфере. Такая модель, описывающая ДЭС с учетом теплового движения ионов, называется диффузным слоем или слоем Гуи-Чепмена. Наиболее совершенная модель ДЭС (модель Штерна) дополнительно учитывает хемосорбцию ионов. Согласно этой модели, ДЭС содержит плотную часть (слой Гельмгольца), состоящую из двух плоских «обкладок», и размытую часть в растворе (диффузный слой), подобную ионной атмосфере.Двойной электрический слой
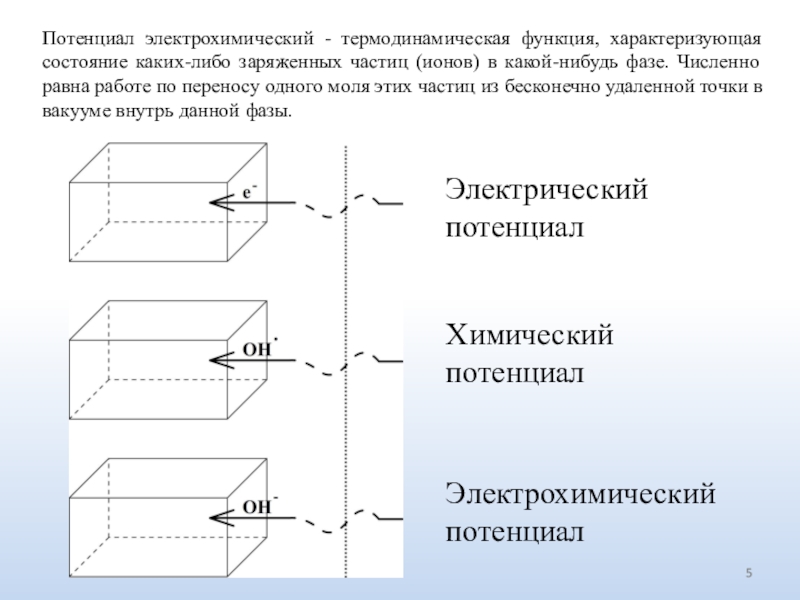
Слайд 5Потенциал электрохимический - термодинамическая функция, характеризующая состояние каких-либо заряженных частиц
(ионов) в какой-нибудь фазе. Численно равна работе по переносу одного
моля этих частиц из бесконечно удаленной точки в вакууме внутрь данной фазы.Электрический потенциал
Химический потенциал
Электрохимический потенциал
Слайд 6В электрохимии – система, состоящая из двух находящихся в контакте
проводников, один из которых – электронный проводник (проводник I рода),
а второй – ионный проводник (раствор или расплав электролита, проводник II рода).Электрод
Электрод – основная единица в электрохимических системах
*Исходя из определения электрода, для того чтобы дать определение электроду необходимо описать проводник I рода и проводник II рода
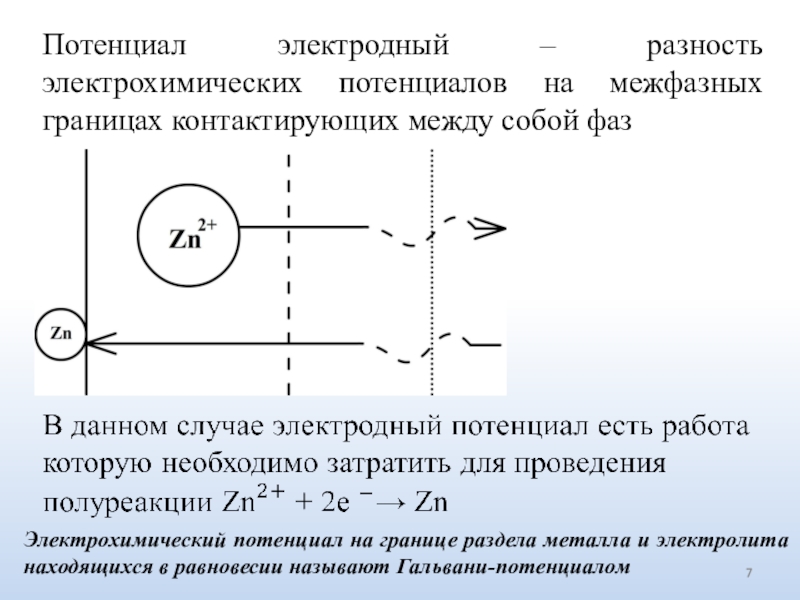
Слайд 7Потенциал электродный – разность электрохимических потенциалов на межфазных границах контактирующих
между собой фаз
Электрохимический потенциал на границе раздела металла и электролита
находящихся в равновесии называют Гальвани-потенциаломСлайд 8Электрод необратимый - гальванический электрод, в котором не устанавливается электрохимическое
равновесие при контакте с электролитом, а потенциал которого нельзя рассчитать
по уравнению Нернста.Электрод обратимый - электрод, в котором устанавливается электрохимическое равновесие между металлом и электролитом, характеризующееся равенством электрических токов от раствора к металлу и от металла к раствору. Если такой электрод работает в составе гальванического элемента, то при смене направления электрического тока во внешней цепи в данном электроде пртоекает одна и та же полуреакция, но в противоположных направлениях. У обратимых электродов потенциалы зависят от активностей компонентов электродных реакций в соответствии с уравнением Нернста.
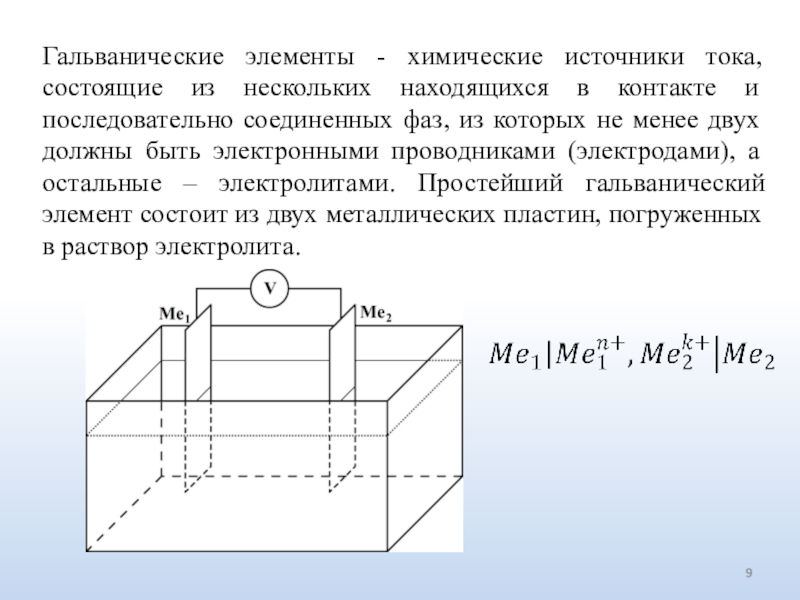
Слайд 9Гальванические элементы - химические источники тока, состоящие из нескольких находящихся
в контакте и последовательно соединенных фаз, из которых не менее
двух должны быть электронными проводниками (электродами), а остальные – электролитами. Простейший гальванический элемент состоит из двух металлических пластин, погруженных в раствор электролита.Слайд 11Электродвижущая сила (ЭДС) - предельное значение разности электрических потенциалов между
контактами гальванического элемента, которое наблюдается в условиях равенства нулю тока
во внешней цепи и установления всех химических и локальных равновесий в фазах и на границах раздела фаз данного элемента. Величину ЭДС обычно определяют для правильно разомкнутого гальванического элемента, контакты которого образованы одним и тем же металлом.Слайд 12Водородная шкала электродных потенциалов - используемая в настоящее время условная
шкала электродных потенциалов, согласно которой потенциал какого-либо электрода рассматривается равным
(по абсолютной величине) электродвижущей силе гальванического элемента, состоящего из данного электрода и из стандартного водородного электрода в растворе кислоты. Знак электродного потенциала соответствует знаку полюса данного электрода в названном гальваническом элементе. Стандартный потенциал водородного электрода в растворе кислоты (с активностью ионов H+, равной единице, и с давлением водорода 1 атм) условно принимается равным нулю.Условный потенциал стандартного водородного электрода принят за 0 В при любой температуре
Слайд 13Положительным электродом называют электрод с более высоким значением условного электродного
потенциала. Такой электрод, в ходе самопроизвольного протекания электрохимической реакции принимает
электрон. В записи гальванического элемента принято располагать положительный электрод справа.Исключением из этого правила является стандартный водородный электрод, который всегда располагается слева. При такой записи ЭДС всегда будет численно равен условному электродному потенциалу правого электрода.
ЭДС принято рассчитывать как разницу между условными электродными потенциалами положительного и отрицательного электрода (или разницу правого и левого электрода).