Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
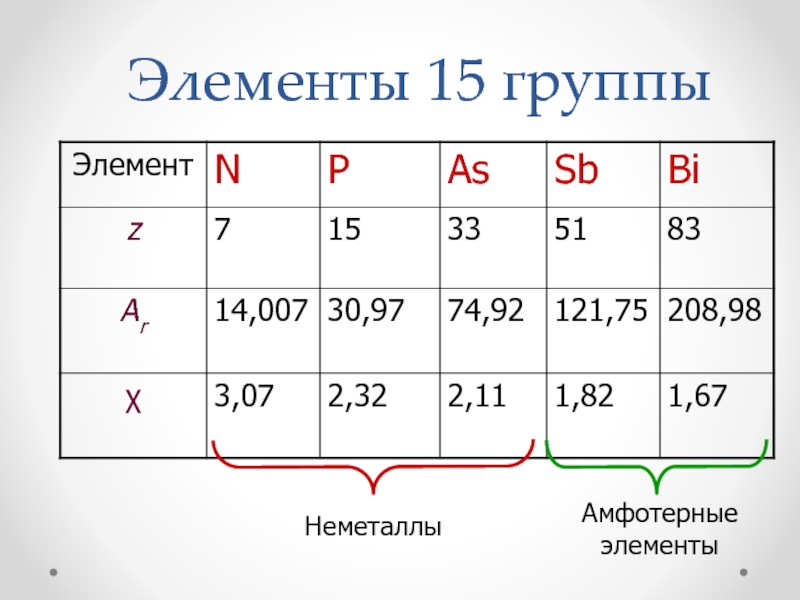
Элементы 15 группы ( пниктогены )
Содержание
- 1. Элементы 15 группы ( пниктогены )
- 2. Элементы 15 группы
- 3. Общая электронная формула:[…] ns 2 (n–1)d
- 4. История открытия элементовАзот: 1772 г., Д. Резерфорд,
- 5. Распространение в природе12. P – 0,09
- 6. Азот, фосфорНитратин (чилийская селитра) NaNO3Нитрокалит (индийская селитра) KNO3 Нашатырь NH4Cl Апатит 3Ca3(PO4)2·Ca(Cl,OH,F)2 Фосфорит Ca3(PO4)2 Фторапатит 3Ca3(PO4)2·CaF2
- 7. Мышьяк, сурьма, висмутРеальгар As4S4Аурипигмент As2S3Арсенопирит FeAsSТетраэдрит Cul2As4S13Антимонит
- 8. АЗОТ В 1772 году азот, (под названием «испорченного воздуха»)
- 9. Свойства азотаN2 – бесцветный газ, без запаха
- 10. Молекулярный азот1. Молекулярное строение в паре, жидкости
- 11. Получение и применение азота1. Азот составляет 78%
- 12. Фракционирование воздуха
- 13. Азот. Шкала степеней окисленияN2O5, NO3, HNO3, NaNO3,
- 14. Реакции молекулярного азота1. С металлами при нагревании3Mg
- 15. Получение аммиакаВ промышленности N2 + 3H2
- 16. Синтез аммиака в промышленности
- 17. Аммиак - газ с резким запахом, при
- 18. Для аммиака характерны реакции присоединения, окислительно-восстановительные и
- 19. Модель тетрааминодиаквамеди(II) [Cu(NH3)4(H2O)2]2+
- 20. Окислительно-восстановительные реакции В аммиаке у азота
- 21. Реакции замещения. Они идут за
- 22. Важным продуктом частичного окисления аммиака является гидразин
- 23. Слайд 23
- 24. Виды ракетного топлива, образованного гидразином с окислителями
- 25. Слайд 25
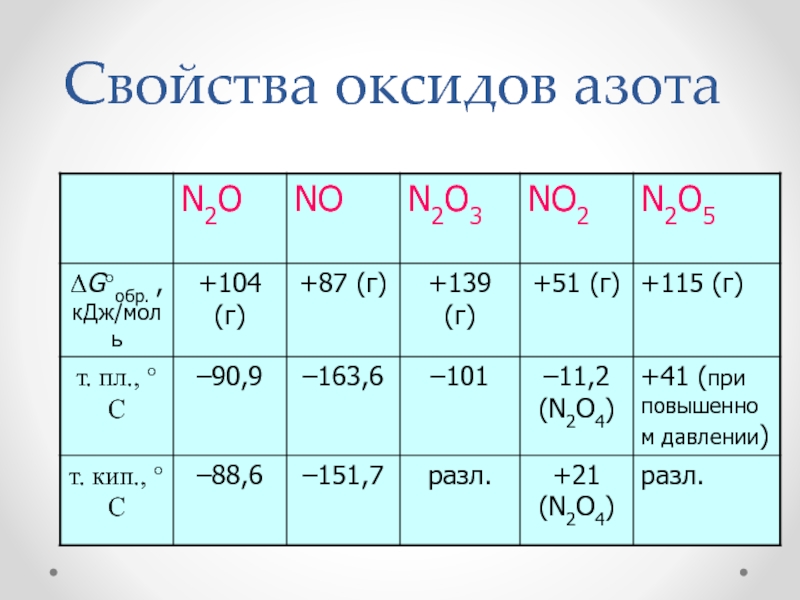
- 26. Свойства оксидов азота
- 27. Оксид диазота N2O N2O – бесцв.
- 28. Монооксид азота - NO NO – бесцв.
- 29. Триоксид диазота N2O3 N2O3 – термически неуст.,
- 30. Азотистая кислота HNO2 Протолиз в водном р-ре:HNO2
- 31. Окислительно-восстановительные свойства Окислительные свойстварН > 7: NO2–+
- 32. Диоксид азота ·NO2 2NO2 N2O4
- 33. Получение В промышленности 2NO +
- 34. Пентаоксид диазота N2O5 N2O5 – бесцв. крист.,
- 35. Азотная кислота HNO3 HNO3 – бесцветная жидкость,
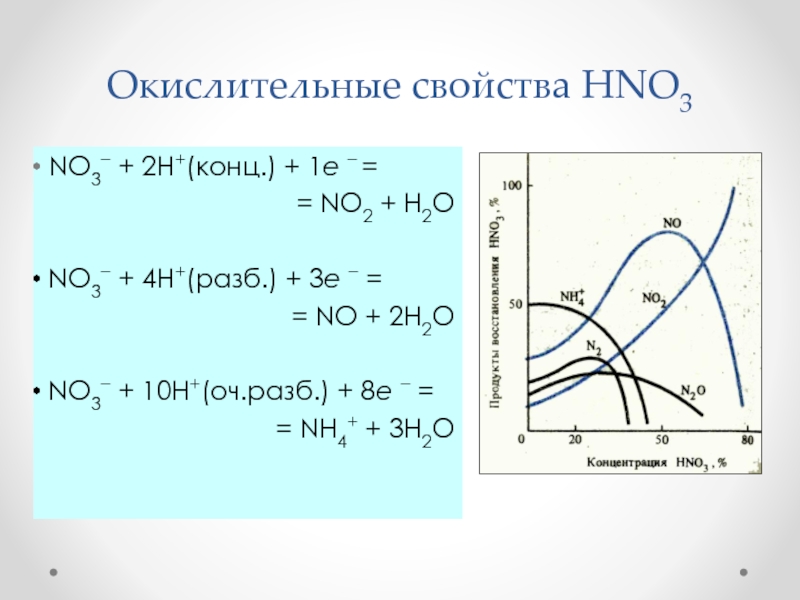
- 36. Окислительные свойства HNO3 NO3 + 2H+(конц.) +
- 37. «Царская водка»: HNO3(к) + HCl(к) (1:3
- 38. Азотная кислотаВ промышленности азотную кислоту получают окислением
- 39. фосфор
- 40. Шкала степеней окисления фосфора P4O10, (HPO3)x, H3PO4,
- 41. ПолиморфизмP(ж)P(г)P4P4P4P4 , P2Белый фосфор P4Красный фосфор PхЧерный
- 42. Дисмутация фосфора в щелочной средена холоду: 4P
- 43. ФосфидыЭх РyСолеобразныеЭ – MIA,MIIA,Cu,ZnCa3P2 + 6H2O =
- 44. Фосфин PH3 PH3 (монофосфан) – ядовитый газ
- 45. Строение оксидов: sp 3-гибридизацияP4P4O6P4O10Метафосфорная к-та (HPO3)x – тетраэдры, связанные углами
- 46. 1. С кислородом. При горении
- 47. 2. С галогенами. С элементами, обладающими большей, чем
- 48. 3. С серой при нагревании. 4P + 6S
- 49. 5. Красный фосфор окисляется водой при температуре
- 50. Оксид фосфора (V) Оксид фосфора(V) P2O5 (или
- 51. или при нагревании ортофосфорную кислоту Н3РО4. P2O5 +
- 52. Кислородные кислоты Фосфорноватистая (фосфоновая) к-та, одноосновная
- 53. Строение кислородных кислот: sp 3H(P+IH2O2) фосфорноватистая к-таH2(P+IIIHO3) фосфористая к-таH3P+VO4 ортофосфорная к-таГипофосфит (фосфинат)-ионОртофосфат-ионФосфит(фосфонат)-ион
- 54. Ортофосфорная кислотаВ промышленности фосфорную кислоту получают действием сернойкислоты на фосфорит:Ca3(PO4)2 + 3H2SO4 3CaSO4 + 2H3PO4
- 55. Химические свойства фосфорной кислоты1.С металлами, стоящими в
- 56. 4.С солями слабых кислот:2H3PO4 + 3Na2CO3 →
- 57. 6.При действии раствора нитрата серебра появляется желтый
- 58. Соли фосфорной кислоты Различают средние соли - фосфаты
- 59. МЫШЬЯК, СУРЬМА, ВИСМУТ
- 60. Cодержание элементов в земной коре сравнительно невелико
- 61. Химические свойстваМышьяк и сурьма имеют две модификации:
- 62. С разбавленными кислотами не взаимодействуют, концентрированные кислоты
- 63. Оксиды в низшей степени окисления As2O3, Sb2O3,
- 64. В ряду As(OH)3 →Sb(OH)3 →Bi(OH)3 основные свойства
- 65. В высшей степени окисления оксид мышьяка растворим
- 66. Арсенаты по свойствам похожи на фосфаты, а
- 67. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4История открытия элементов
Азот: 1772 г., Д. Резерфорд, Г.Кавендиш, 1769-1771 гг.,
К.Шееле, А.Л. Лавуазье
Фосфор: 1669 г., Хённиг Бранд
Мышьяк: XIII в.,
Альберт Великий, XVI в., Парацельс, 1735 г., Г. БрандтСурьма: 3000 лет до н.э.; XVI в., Парацельс, Василий Валентин, 1735 г., Г. Брандт
Висмут: XV-XVI вв., Агрикола, Василий Валентин, 1739 г., И.Потт
Слайд 5Распространение в природе
12. P – 0,09 масс.%
16.
N – 0,03 масс.%
47. As – 5·10–4 масс.%
62. Sb – 5·10–5 масс.%
66. Bi – 1·10–5 масс.%
Азот атмосферы N2 (самородный)
Слайд 6Азот, фосфор
Нитратин (чилийская селитра) NaNO3
Нитрокалит (индийская селитра) KNO3
Нашатырь NH4Cl
Апатит 3Ca3(PO4)2·Ca(Cl,OH,F)2
Фосфорит Ca3(PO4)2
Фторапатит 3Ca3(PO4)2·CaF2
Слайд 7Мышьяк, сурьма, висмут
Реальгар As4S4
Аурипигмент As2S3
Арсенопирит FeAsS
Тетраэдрит Cul2As4S13
Антимонит (сурьмяный блеск) Sb2S3
Висмутин
(висмутовый блеск) Bi2S3
Редкие минералы
Анимикит (Ag, Sb)
Арсенопалладинит Pd3As
Геверсит
PtSb2Стибиопалладинит Pd3Sb
Слайд 8АЗОТ
В 1772 году азот, (под названием «испорченного воздуха») как простое вещество,
описал Даниэль Резерфорд.
Азо́т (от греч. ázōos — безжизненный, лат. nitrogenium)предложил
в 1787 году Антуан Лавуазье.Слайд 9Свойства азота
N2 – бесцветный газ, без запаха и вкуса, т.пл.
–210,0 С, т.кип. –195,8 С
малорастворим в воде и орг.
р-рителях энергия связи в молекуле N2 равна 945 кДж/моль, длина связи 110 пм.
N2 + F2
N2 + 6Li = 2 Li3N нитрид лития (катализатор – вода)
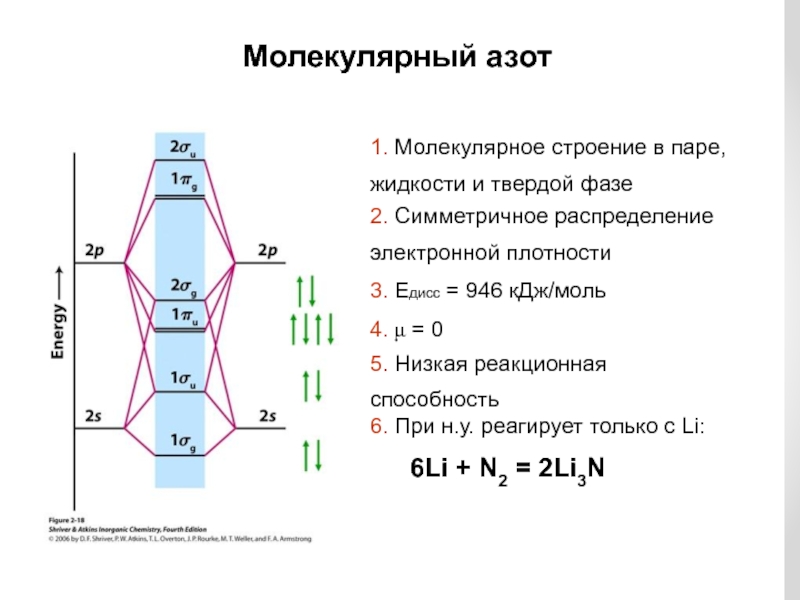
Слайд 10Молекулярный азот
1. Молекулярное строение в паре,
жидкости и твердой фазе
2. Симметричное
распределение
электронной плотности
3. Едисс = 946 кДж/моль
4. μ = 0
5. Низкая
реакционная
способность6. При н.у. реагирует только с Li:
6Li + N2 = 2Li3N
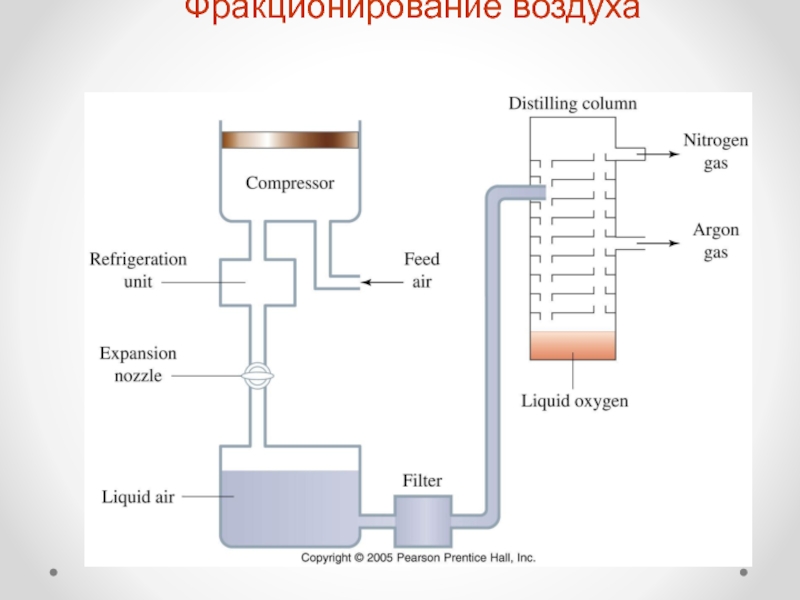
Слайд 11Получение и применение азота
1. Азот составляет 78% воздуха (по объему)
или 76% (по массе)
2. Промышленное получение азота:
фракционирование воздуха
или
разделение воздуха на
мембранах3. Получение азота в лаборатории:
2NaN3 = 2Na + 3N2
(to)
NH4NO2 = N2 + 2H2O
(to)
4. Основное применение:
- создание инертной атмосферы
- синтез аммиака
- охлаждение
Слайд 13Азот. Шкала степеней окисления
N2O5, NO3, HNO3, NaNO3, AgNO3
NO2, N2O4
N2O3, NO2, HNO2, NaNO2, NF3
NO, N2O2
H2N2O2
N2
NH2OH,
NH3OH+ N2H4, N2H5+, N2H62+
NH3, NH4+, NH3·H2O, NH4Cl, Li3N, Cl3N
Слайд 14Реакции молекулярного азота
1. С металлами при нагревании
3Mg +N2 = Mg3N2
2Ti
+ N2 = 2TiN
2Al + N2 = 2AlN
2. С Н2
на катализаторе
N2 + 3H2 = 2NH3450 oC
800 oC
900 oC
(процесс Боша-Габера)
3. С О2 в электрическом разряде
N2 + O2 = 2NO
4. С комплексами переходных металлов
[Ru(NH3)5]Cl3 + N2 + Zn/Hg =
[Ru(NH3)5(N2)]Cl2 + ZnCl2 + Hg + H2O
Слайд 15Получение аммиака
В промышленности
N2 + 3H2 2NH3 + Q
(300-500
С, 300 атм, катализатор: Fe, Pt)
В лаборатории (при нагревании)
NH4Cl +
NaOH = = NaCl + H2O + NH3
NH3·H2O = H2O + NH3
Слайд 17
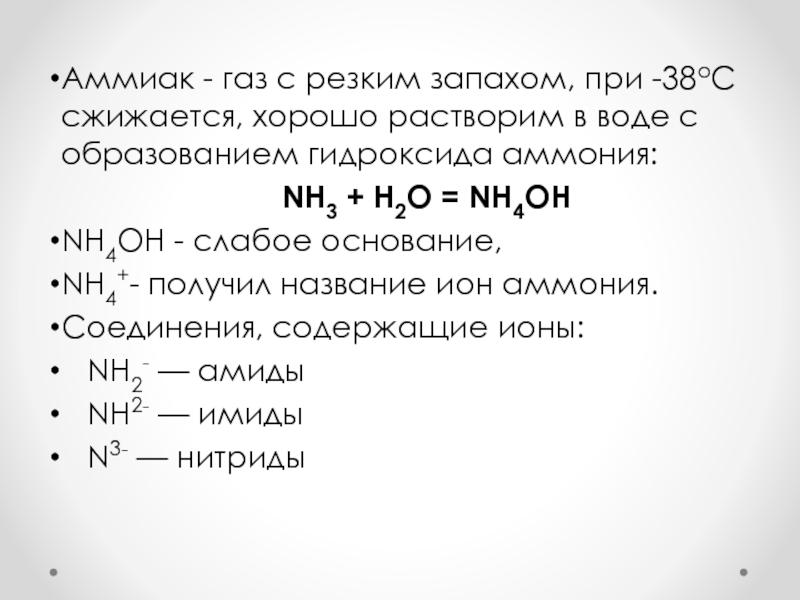
Аммиак - газ с резким запахом, при -38оС сжижается, хорошо
растворим в воде с образованием гидроксида аммония:
NH3 + H2O =
NH4OHNH4OH - слабое основание,
NH4+- получил название ион аммония.
Соединения, содержащие ионы:
NH2- — амиды
NH2- — имиды
N3- — нитриды
Слайд 18Для аммиака характерны реакции присоединения, окислительно-восстановительные и замещения.
Реакции
присоединения:
NH3 + HCl = NH4Cl
NH3 + CuSO4 = [Cu(NH3)4]SO4
эти
реакции основаны на том, что в аммиаке азот имеет неподеленную пару электронов и может выступать в качестве донора, образуя донорно-акцепторную связь в комплексных соединениях.Слайд 20Окислительно-восстановительные реакции
В аммиаке у азота низшая степень окисления
-3 и он может выступать лишь в качестве восстановителя:
3CuO +
2NH3 = 3Cu + N2 + 3H2O2NH3 + 2KMnO4 = 2MnO2 + N2 + 2KOH + 2H2O
Во всех реакциях без катализатора аммиак окисляется до свободного азота, в присутствии катализатора до NO.
Слайд 21
Реакции замещения.
Они идут за счет замещения водорода
аммиака металлом или неметаллом:
2NH3 + 2Na = 2NH2Na + H2
NH3
+ 2Na = NHNa2 + H22NH3 + 6Na = 2NNa3 + 3H2
Слайд 22Важным продуктом частичного окисления аммиака является гидразин (N2H4):
2NH3 + NaOCl
= N2H4 + NaCl + H2O
Это бесцветная жидкость, дымящая
на воздухе и смешивающаяся с водой в любых соотношениях. Слайд 27Оксид диазота N2O
N2O – бесцв. газ со слабым
приятным запахом и слабонаркотическим действием, т.пл. –91 °С, т.кип. –89
°С.N2O – несолеобр. оксид, сильный окислитель.
Разложение:
2N2O = 2N2 + O2
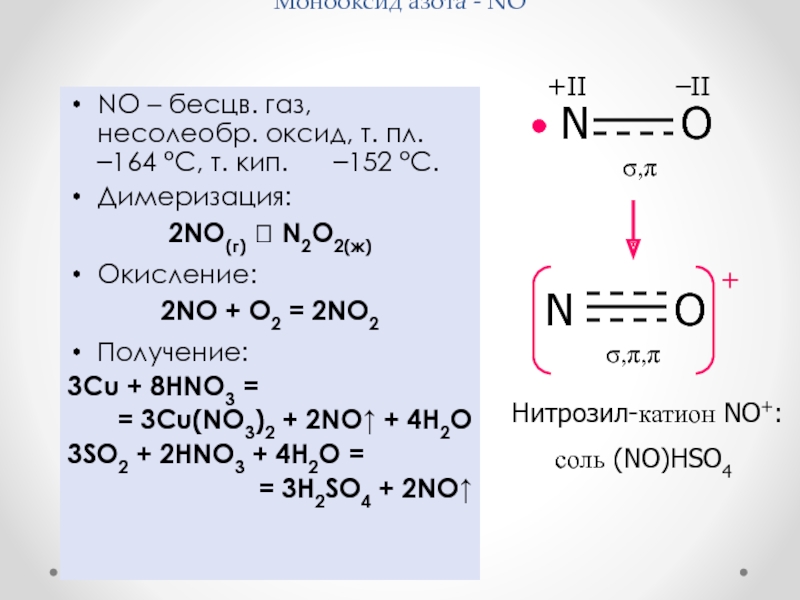
Слайд 28Монооксид азота - NO
NO – бесцв. газ, несолеобр. оксид,
т. пл. –164 °С, т. кип. –152 °С.
Димеризация:
2NO(г) N2O2(ж)
Окисление:
2NO + O2 = 2NO2
Получение:
3Cu + 8HNO3 =
= 3Cu(NO3)2 + 2NO + 4H2O
3SO2 + 2HNO3 + 4H2O =
= 3H2SO4 + 2NO
Нитрозил-катион NO+:
соль (NO)HSO4
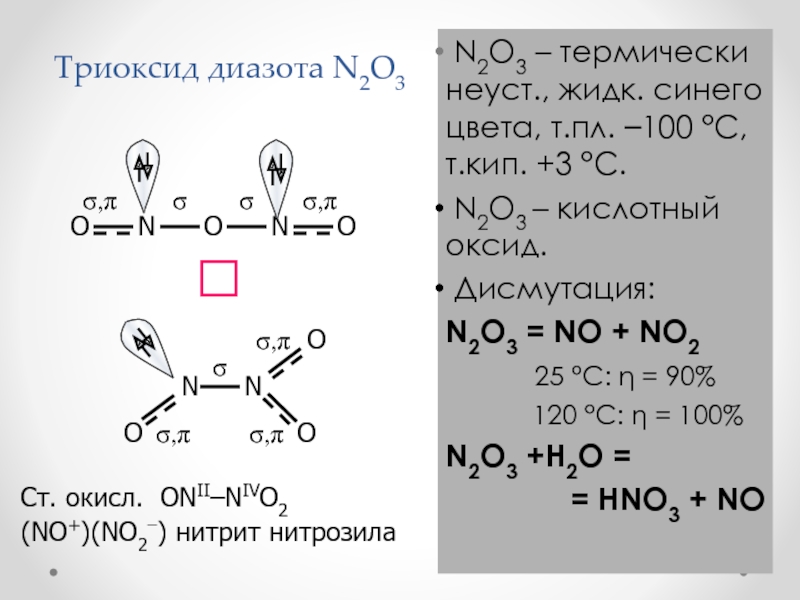
Слайд 29Триоксид диазота N2O3
N2O3 – термически неуст., жидк. синего
цвета, т.пл. –100 °С, т.кип. +3 °С.
N2O3 –
кислотный оксид. Дисмутация:
N2O3 = NO + NO2
25 °С: = 90%
120 °С: = 100%
N2O3 +H2O =
= HNO3 + NO
Ст. окисл. ONII–NIVO2
(NO+)(NO2) нитрит нитрозила
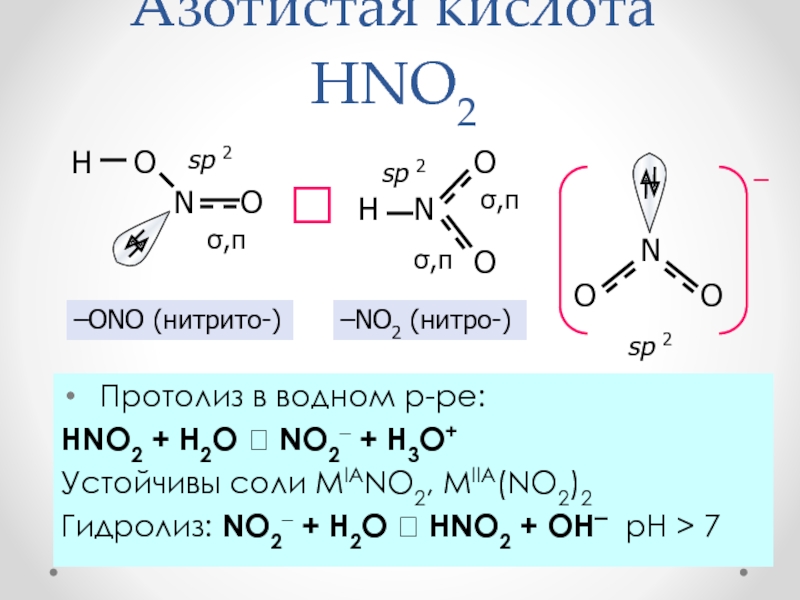
Слайд 30Азотистая кислота HNO2
Протолиз в водном р-ре:
HNO2 + H2O
NO2– + H3O+
Устойчивы соли MIANO2, MIIA(NO2)2
Гидролиз: NO2– + H2O
HNO2 + OH– рН > 7
–ONO (нитрито-)
–NO2 (нитро-)
sp 2
Слайд 31Окислительно-восстановительные свойства
Окислительные свойства
рН > 7: NO2–+ H2O + 2e
= NO + 2OH
рН < 7: HNO2 + H+
+ 2e = NO + H2OВосстановительные свойства
рН > 7: NO2– + 2OH – 2e = NO3– + H2O
рН < 7: HNO2 + H2O – 2e = NO3– +3H+
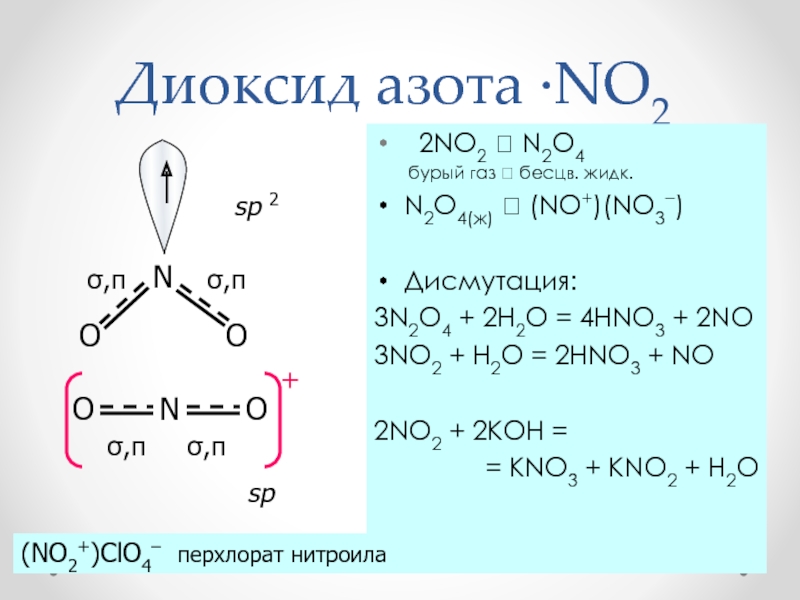
Слайд 32Диоксид азота ·NO2
2NO2 N2O4
бурый газ бесцв. жидк.
N2O4(ж) (NO+)(NO3)
Дисмутация:
3N2O4 + 2H2O
= 4HNO3 + 2NO3NO2 + H2O = 2HNO3 + NO
2NO2 + 2KOH =
= KNO3 + KNO2 + H2O
sp 2
sp
(NO2+)ClO4– перхлорат нитроила
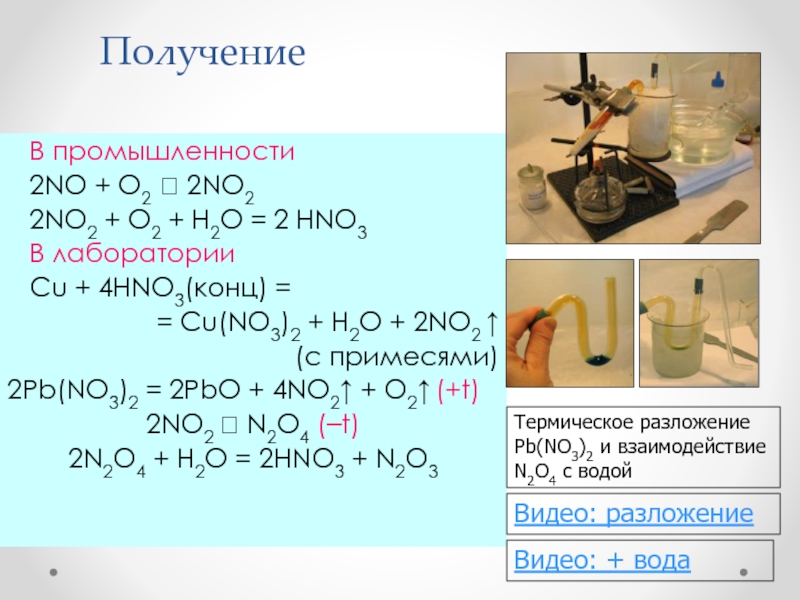
Слайд 33Получение
В промышленности
2NO + O2 2NO2
2NO2 + O2 + H2O = 2 HNO3
В лабораторииCu + 4HNO3(конц) =
= Cu(NO3)2 + H2O + 2NO2
(c примесями)
2Pb(NO3)2 = 2PbO + 4NO2 + O2 (+t)
2NO2 N2O4 (–t)
2N2O4 + H2O = 2HNO3 + N2O3
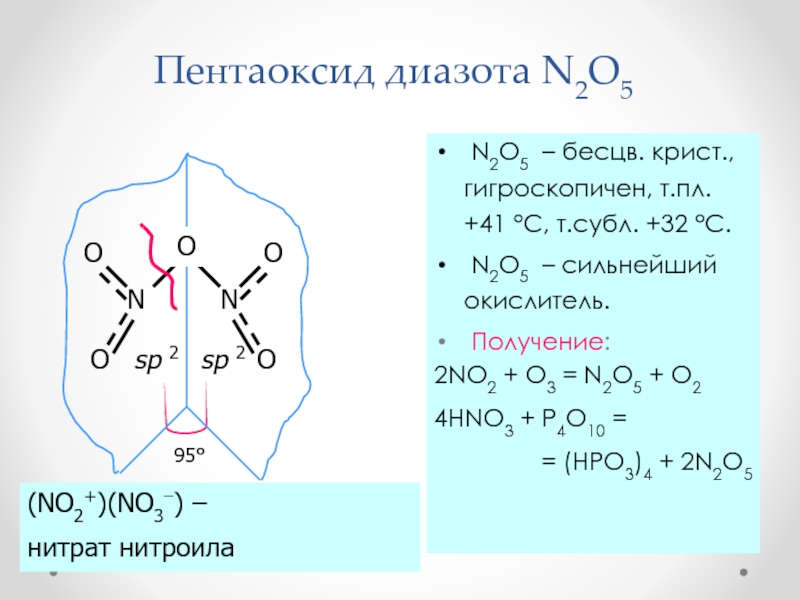
Слайд 34Пентаоксид диазота N2O5
N2O5 – бесцв. крист., гигроскопичен, т.пл.
+41 °С, т.субл. +32 °С.
N2O5 – сильнейший окислитель.
Получение:2NO2 + O3 = N2O5 + O2
4HNO3 + P4O10 =
= (HPO3)4 + 2N2O5
sp 2
sp 2
O
(NO2+)(NO3) –
нитрат нитроила
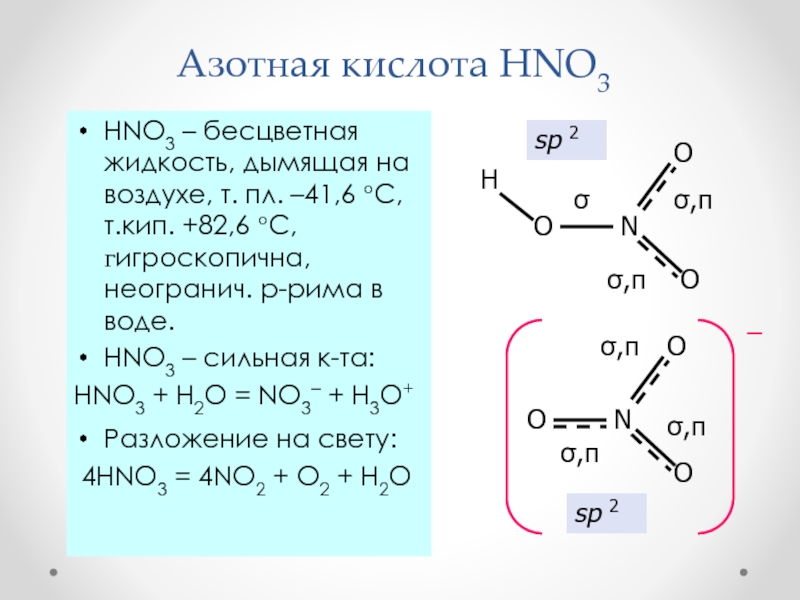
Слайд 35Азотная кислота HNO3
HNO3 – бесцветная жидкость, дымящая на воздухе,
т. пл. –41,6 С, т.кип. +82,6 С, гигроскопична, неогранич. р-рима
в воде.HNO3 – сильная к-та:
HNO3 + H2O = NO3– + H3O+
Разложение на свету:
4HNO3 = 4NO2 + O2 + H2O
sp 2
Слайд 36Окислительные свойства HNO3
NO3 + 2H+(конц.) + 1e =
= NO2 + H2O
NO3 + 4H+(разб.) + 3e
== NO + 2H2O
NO3 + 10H+(оч.разб.) + 8e =
= NH4+ + 3H2O
Слайд 37«Царская водка»:
HNO3(к) + HCl(к) (1:3 по объему)
3HCl +
HNO3 NOCl + 2[Cl0] + H2O
Au + 4HCl
+ HNO3 = H[AuCl4] + NO + 2H2O3Pt + 18HCl + 4HNO3 = 3H2[PtCl6] + 4NO + 8H2O
Термическое разложение нитратов
MNO3
MNO2 + O2 (до Mg)
MO + NO2 + O2 (Mg-Cu)
M + NO2 + O2 (Ag, Au, Hg…)
Слайд 38Азотная кислота
В промышленности азотную кислоту получают окислением аммиака в присутствии
катализатора:
4NH3 + 5O2 = 4NO + 6H2O
2NO + O2 =
2NO24NO2 + O2 + 2H2O = 4HNO3
Слайд 40Шкала степеней окисления фосфора
P4O10, (HPO3)x, H3PO4, PO43, H4P2O7
P4O6,
H2(PHO3), PHO32–, PF3
H(PH2O2), PH2O2–
P (P4, Px), P2
PH3,
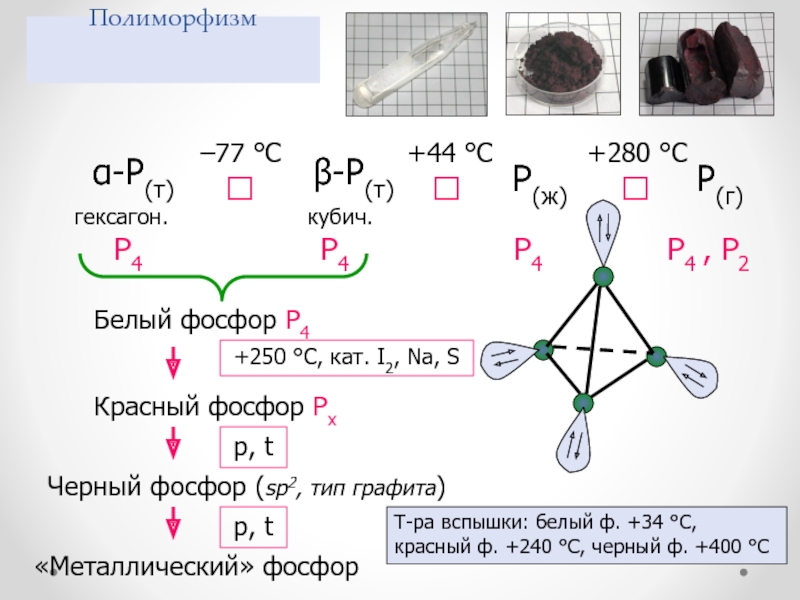
PH4+, Na3P, Mg3P2, AlP Слайд 41Полиморфизм
P(ж)
P(г)
P4
P4
P4
P4 , P2
Белый фосфор P4
Красный фосфор Pх
Черный фосфор (sp2, тип
графита)
«Металлический» фосфор
Т-ра вспышки: белый ф. +34 °С, красный ф. +240
°С, черный ф. +400 °ССлайд 42Дисмутация фосфора в щелочной среде
на холоду:
4P + 3NaOH(разб)
+ 3H2O = 3Na(P+IH2O2) + P–IIIH3
P + 3H2O +
3e = PH3 + 3OH–P + 2OH– – 1e = (PH2O2)– (гипофосфит-ион)
при нагревании:
2P + 2NaOH(конц) + H2O = Na2(P+IIIHO3) + P–IIIH3
P + 3H2O + 3e = PH3 + 3OH–
P + 5OH– – 3e = (PHO3)3– + 3H2O (фосфит-ион)
Получение
прокаливание фосфорита с углем и песком
2Ca3(PO4)2 + 10C + 6SiO2 = 2P2 + 10CO + 6CaSiO3
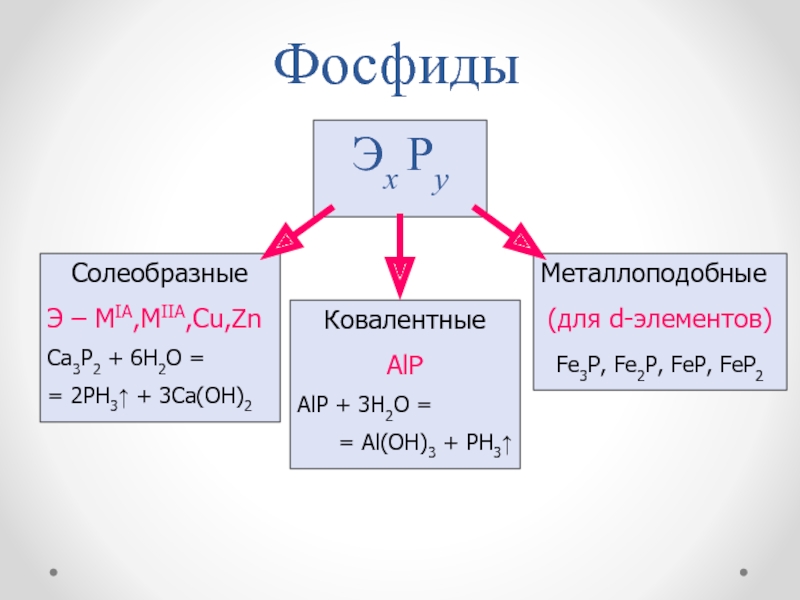
Слайд 43Фосфиды
Эх Рy
Солеобразные
Э – MIA,MIIA,Cu,Zn
Ca3P2 + 6H2O =
= 2PH3 +
3Ca(OH)2
Ковалентные
AlP
AlP + 3H2O =
= Al(OH)3 + PH3
Металлоподобные
(для d-элементов)
Fe3P, Fe2P,
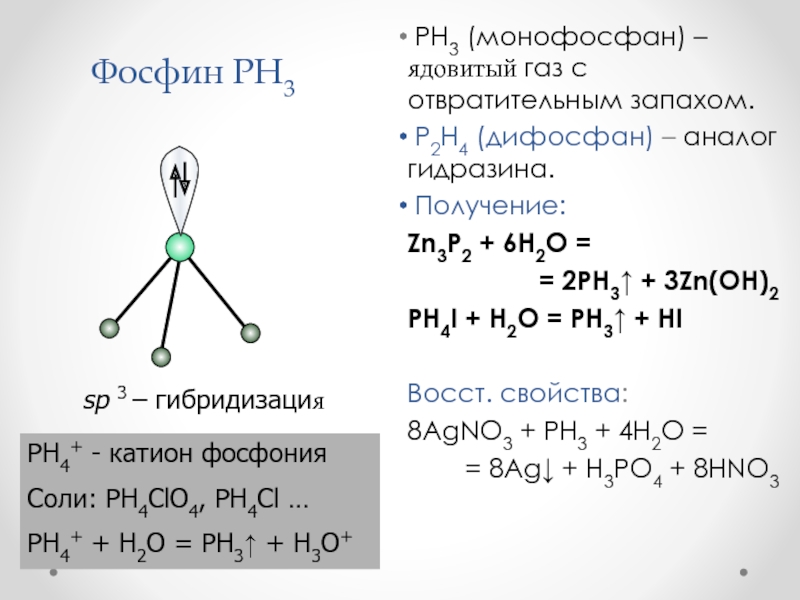
FeP, FeP2 Слайд 44Фосфин PH3
PH3 (монофосфан) – ядовитый газ с отвратительным
запахом.
P2H4 (дифосфан) – аналог гидразина.
Получение:
Zn3P2 + 6H2O =
= 2PH3 + 3Zn(OH)2
PH4I + H2O = PH3 + HI
Восст. свойства:
8AgNO3 + PH3 + 4H2O =
= 8Ag + H3PO4 + 8HNO3
sp 3 – гибридизация
PH4+ - катион фосфония
Соли: PH4ClO4, PH4Cl …
PH4+ + H2O = PH3 + H3O+
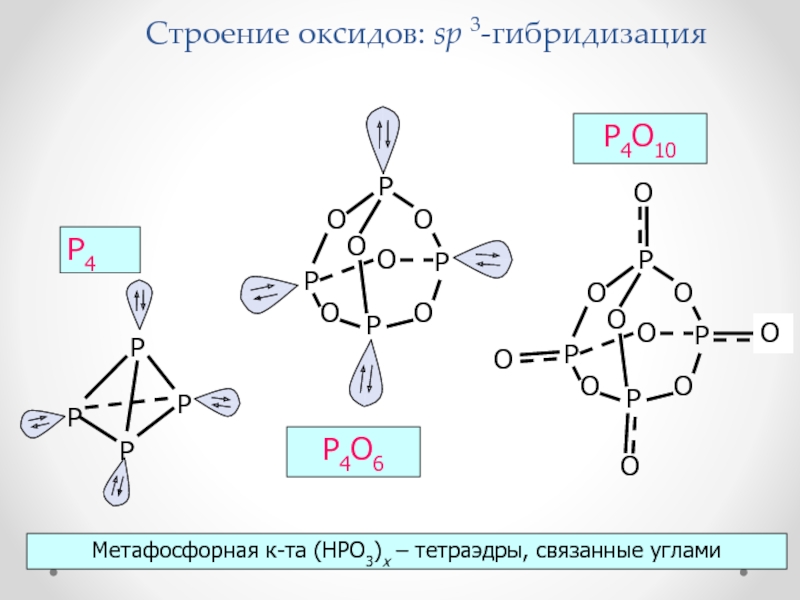
Слайд 45Строение оксидов: sp 3-гибридизация
P4
P4O6
P4O10
Метафосфорная к-та (HPO3)x – тетраэдры, связанные углами
Слайд 46 1. С кислородом.
При горении фосфора образуется белый
густой дым. Белый фосфор самовоспламеняется на воздухе, а красный горит
при поджигании.Фосфор сгорает в кислороде ослепительно
ярким пламенем.
4P + 3O2(недостат) → 2P2O3 (P4O6)
4P + 5O2(избыток) → 2P2O5 (P4O10)
Слайд 472. С галогенами.
С элементами, обладающими большей, чем у фосфора, электроотрицательностью,
фосфор реагирует очень энергично.
Если в сосуд с хлором внести красный
фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получается хлорид фосфора (III).4P + 6Cl2(недостат) → 4PCl3
4P + 10Cl2(избыток) → 4PCl5
Слайд 48 3. С серой при нагревании.
4P + 6S → 2P2S3
4P + 10S → 2P2S5
4. Фосфор окисляет
при нагревании почти все металлы, образуя фосфиды:
2P + 3Ca → Ca3P2
Фосфиды металлов легко гидролизуются
водой.
Ca3P2 + 6H2O → 2PH3 ↑+ 3Ca(OH)2
Слайд 495. Красный фосфор окисляется водой при
температуре около 800ºС в
присутствии
катализатора – порошка меди:
2P + 8H2O → 2H3PO4 +
5H2↑6. Концентрированная серная кислота
окисляет при нагревании фосфор:
t
2P + 5H2SO4(к) → 5SO2↑ + 2H3PO4 + 2H2O
7. Азотная кислота при нагревании окисляет
фосфор
t
P + 5HNO3(к) → 5NO2↑ + H3PO4 + H2O
3P + 5HNO3(разб) + 2H2O → 5NO↑ + 3H3PO4
Слайд 50Оксид фосфора (V)
Оксид фосфора(V) P2O5 (или P4O10)
образуется при горении фосфора
на воздухе.
4Р + 5О2 2Р2О5
Твердое кристаллическое вещество Р2О5
гигроскопично и
используется как водоотнимающее средство.
1. При взаимодействии с водой оксид
фосфора(V) образует на холоду
метафосфорную кислоту НРО3,
имеющую полимерное строение:
P2O5 + H2O 2HPO3
Слайд 51или при нагревании ортофосфорную
кислоту Н3РО4.
P2O5 + 3H2O 2H3PO4
2.
Как кислотный оксид, вступает в реакции с
основными оксидами:
P2O5 +
3CaO → Ca3(PO4)2 3. С щелочами:
P2O5 +3Ca(OH)2 → Ca3(PO4)2 + 3H2O
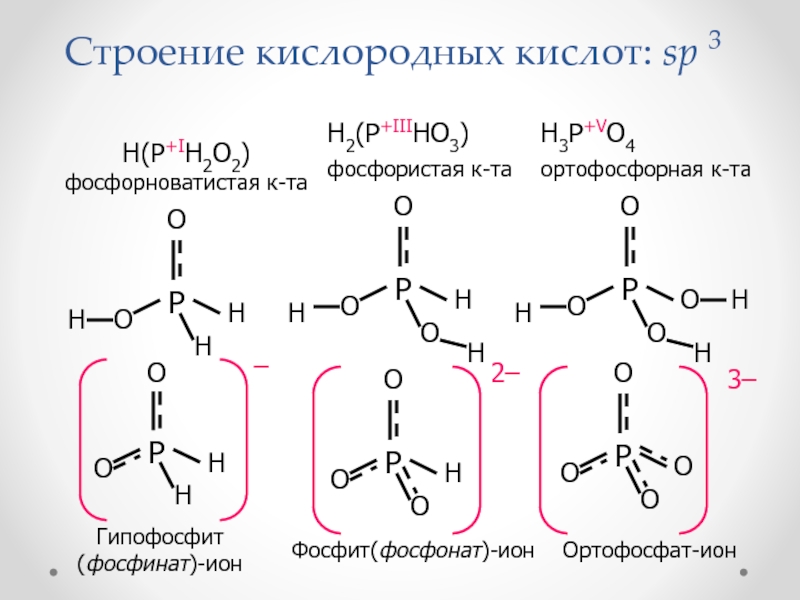
Слайд 52Кислородные кислоты
Фосфорноватистая (фосфоновая) к-та, одноосновная
H(PH2O2) + H2O (PH2O2) + H3O+
Фосфористая (фосфиновая)
к-та, двухосновнаяH2(PHO3) + H2O H(PHO3) + H3O+
H(PHO3)– + H2O (PHO3)2 + H3O+
Ортофосфорная к-та, трехосновная
H3PO4 + H2O H2PO4 + H3O+
H2PO4 + H2O HPO42 + H3O+
HPO42 + H2O PO43 + H3O+
Дифосфорная к-та - H4P2O7
Полиметафосфорная к-та - HPO3)x
Слайд 53Строение кислородных кислот: sp 3
H(P+IH2O2) фосфорноватистая к-та
H2(P+IIIHO3) фосфористая к-та
H3P+VO4 ортофосфорная
к-та
Гипофосфит (фосфинат)-ион
Ортофосфат-ион
Фосфит(фосфонат)-ион
Слайд 54Ортофосфорная кислота
В промышленности фосфорную
кислоту получают действием серной
кислоты на фосфорит:
Ca3(PO4)2
+ 3H2SO4 3CaSO4 + 2H3PO4
Слайд 55Химические свойства фосфорной кислоты
1.С металлами, стоящими в ряду напряжения
металлов
до водорода:
3Mg + 2H3PO4 Mg3(PO4)2 + 3H2↑
2.С основными оксидами:
3CaO + 2H3PO4 Сa3(PO4)2 + 3H2O3.С основаниями и аммиаком:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + NH3 → (NH4)2HPO4
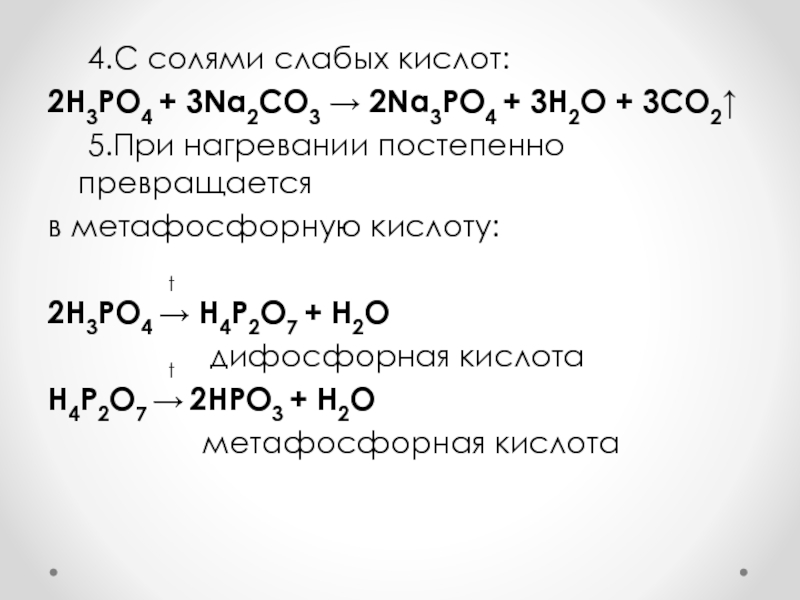
Слайд 56 4.С солями слабых кислот:
2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3H2O
+ 3CO2↑
5.При нагревании постепенно превращается
в метафосфорную кислоту:
t2H3PO4 → H4P2O7 + H2O
t дифосфорная кислота
H4P2O7 → 2HPO3 + H2O
метафосфорная кислота
Слайд 576.При действии раствора нитрата серебра
появляется желтый осадок:
H3PO4 +
3AgNO3 → Ag3PO4 ↓ + 3HNO3
желтый осадокЭто качественная реакция на фосфорную
кислоты и её соли – фосфаты.
Слайд 58Соли фосфорной кислоты
Различают средние соли - фосфаты (Na3PO4)
и кислые
соли - гидрофосфаты (Na2HPO4) и
дигидрофосфаты (NaH2PO4).
Растворимы в воде
фосфаты и гидрофосфаты щелочных металлов и аммония.
Все дигидрофосфаты растворимы в воде.
Фосфорная кислота вытесняется более
сильными кислотами из её солей:
Сa3(PO4)2 + 3H2SO4 3CaSO4 + 2H3PO4
конц.
Слайд 60Cодержание элементов в земной коре сравнительно невелико 1.10-4% - As,
5.10-6% - Sb, 2.10-6% - Bi. Получают эти элементы прокаливанием
на воздухе сульфидных руд, сернистые соединения переходят в оксиды, которые восстанавливают углем:2Sb2S3 + 9O2 = 2Sb2O3 + 6SO2
Sb2O3 + 3C = 2Sb + 3CO
В свободном состоянии элементы имеют металлический блеск, довольно хорошо проводят электрический ток и тепло, очень хрупкие.
Слайд 61Химические свойства
Мышьяк и сурьма имеют две модификации: желтый, серый и
серый, черный соответственно. Молекула мышьяка состоит из четырех атомов. Характерные
степени окисления в соединениях +5, +3, -3. В ряду As →Sb →Bi наиболее устойчивая степень окисления +5 у мышьяка, +3 у висмута.Все три элемента хорошо реагируют с кислородом, серой, галогенами, металлами:
4As + 3O2 = As2O3
2Sb + 3Cl2 = 2SbCl3
2Bi + 3S = Bi2S3
2As + 3Mg = Mg3As2
Слайд 62С разбавленными кислотами не взаимодействуют, концентрированные кислоты - окислители растворяют
мышьяк и сурьму:
Sb + 5HNO3 = H3SbO4 + 5NO2 +
H2O (As)Висмут концентрированной азотной кислотой пассивируется, в разбавленной растворяется:
Bi + 4HNO3 = Bi(NO3)3 + NO + 2H2O
В щелочах висмут не растворим, мышьяк и сурьма:
2As + 2NaOH + 5KNO3 = 5KNO2 + 2NaAsO3 + H2O (Sb)
Слайд 63Оксиды в низшей степени окисления As2O3, Sb2O3, Bi2O3 - порошки,
плохо растворимые в воде, получаются при сгорании в кислороде. Оксиды
мышьяка и сурьмы проявляют амфотерные свойства:As2O3 + 6NaOH = 2Na3AsO3 + 3H2O (Sb)
Sb2O3 + 3H2SO4 = Sb2(SO4)3 + 3H2O (As)
Оксид висмута - основного характера:
Bi2O3 + 3H2SO4 = Bi2(SO4)3 + 3H2O
Гидроксид мышьяка амфотерен, в свободном состоянии H3AsO3 не получена, существует только в растворах.
Слайд 64В ряду As(OH)3 →Sb(OH)3 →Bi(OH)3 основные свойства усиливаются, возрастает и
устойчивость солей (арсенитов, стибитов, висмутитов), но даже висмутиты сильно гидролизуются,
сразу по II cтупени:Bi(NO3)3 + H2O = Bi(OH)2NO3 + HNO3
полученное соединение нестойко и разлагается:
Bi(OH)2NO3 = BiONO3 + H2O
радикал BiO+ - носит название висмутил, то же самое справедливо для сурьмы, радикал SbO+ - носит название стибил.
Слайд 65В высшей степени окисления оксид мышьяка растворим в воде, оксиды
сурьмы и висмута - нерастворимые стеклообразные вещества. Обладают кислотными свойствами.
В рядуH3AsO4 →H3SbO4 →[HBiO3] кислотные
свойства убывают.
Висмутовая кислота не получена. Соли (висмутаты) легко получаются при взаимодействии оксидов со щелочами:
Bi2O5 + 6NaOH = 2Na3BiO4 + 3H2O
Bi2O5 + 2NaOH = 2NaBiO3 + H2O
Слайд 66Арсенаты по свойствам похожи на фосфаты, а мышьяковая кислота даже
сильнее фосфорной, которую можно получить взаимодействием оксида с водой, а
также окислением мышьяка в водной среде:2As + 5Cl2 + 8H2O = 2H3AsO4 + 10HCl
Сурмяную кислоту можно получить из стибатов:
NaSbO3 + H2O = NaOH + HSbO3
Все кислоты твердые вещества, хорошо растворимые в воде.

![Элементы 15 группы ( пниктогены ) Общая электронная формула:[…] ns 2 (n–1)d 10np 3 Степени окисления: Общая электронная формула:[…] ns 2 (n–1)d 10np 3 Степени окисления: –3, 0, +1, +2, +3, +4,](/img/thumbs/c974933d2fdaf350e57189973fce9e0b-800x.jpg)












![Элементы 15 группы ( пниктогены ) Модель тетрааминодиаквамеди(II) [Cu(NH3)4(H2O)2]2+ Модель тетрааминодиаквамеди(II) [Cu(NH3)4(H2O)2]2+](/img/thumbs/f26af39889eee31e1c62413834bb2ae3-800x.jpg)






![Элементы 15 группы ( пниктогены ) «Царская водка»: HNO3(к) + HCl(к) (1:3 по объему) 3HCl + HNO3 «Царская водка»: HNO3(к) + HCl(к) (1:3 по объему) 3HCl + HNO3 NOCl + 2[Cl0] +](/img/thumbs/0d3862471ea7449e320342c44bc96966-800x.jpg)