Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энзимология Строение и свойства ферментов (ферменты - 1)
Содержание
- 1. Энзимология Строение и свойства ферментов (ферменты - 1)
- 2. Ферменты – биологические катализаторы белковой природыВ природе
- 3. История энзимологии В древности использовали ферментативные
- 4. История энзимологии (прод)1871 г. М.М. Манассеина, а
- 5. Простые и сложные ферментыПростые ферменты состоят только
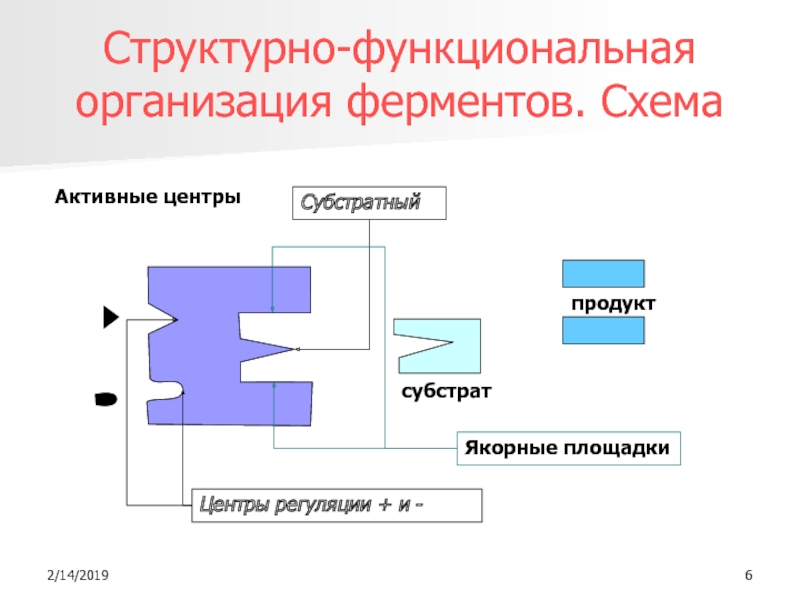
- 6. Структурно-функциональная организация ферментов. СхемаАктивные центрыЯкорные площадкиСубстратныйсубстратпродуктЦентры регуляции + и -
- 7. Сходство Е и неферметативных катализаторовКатализируют энергетически возможные
- 8. Отличия Е и неферметативных катализаторовКаталитическая эффективность -
- 9. Доказательства белковой природы ЕИдентичные свойства ВМСЧувствительность к
- 10. Свойства ферментов Белковая природа определяет многие свойства
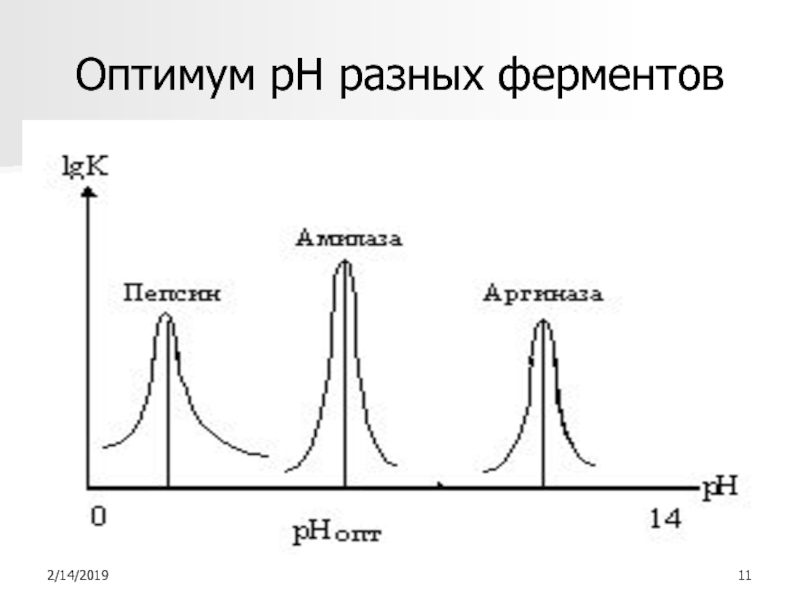
- 11. Оптимум рН разных ферментов
- 12. Механизмы рН зависимостиионизация и изменение зарядаповерхностных групп
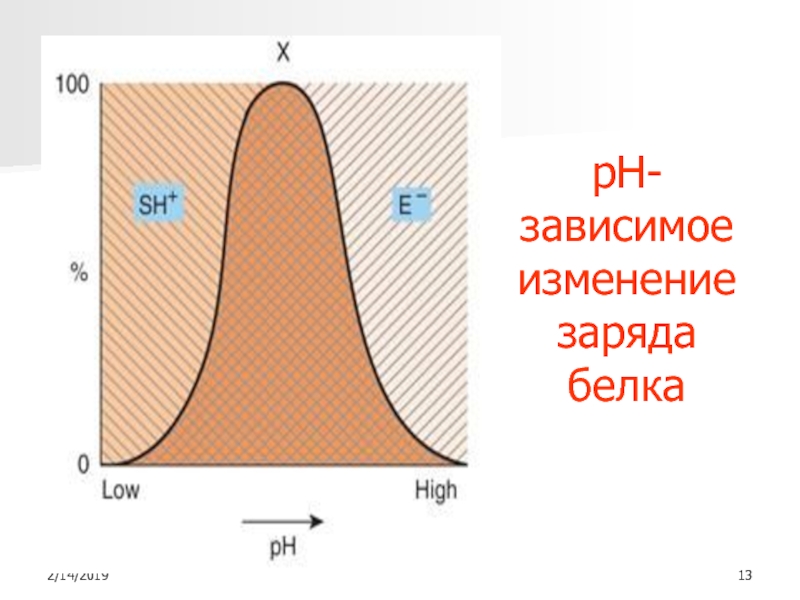
- 13. рН-зависимое изменение заряда белка
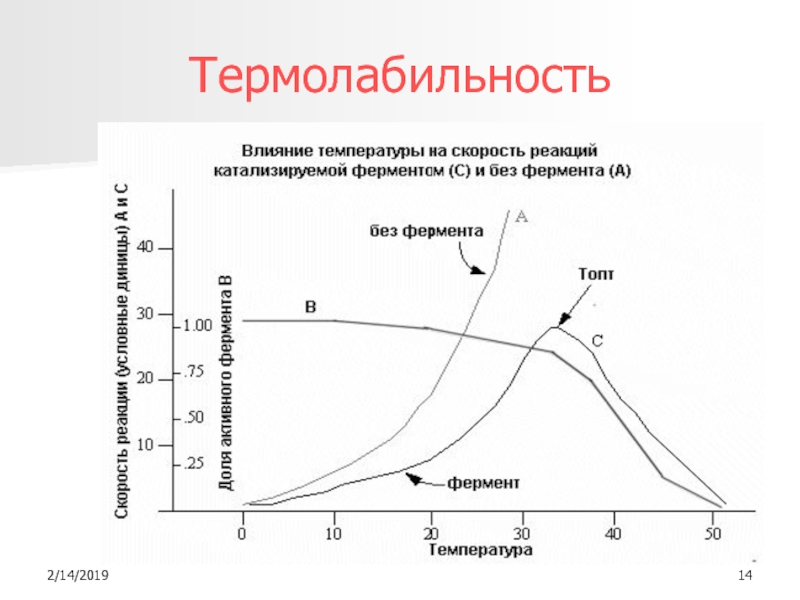
- 14. Термолабильность
- 15. Специфичность ЕВиды специфичности:Субстратная специфичностьАбсолютная - аргиназаОтносительная (групповая)
- 16. Специфичность химотрипсина
- 17. Этапы взаимодействия Е и SСближение и ориентация
- 18. Механизм взаимодействия Е и SТеория Э Фишера
- 19. Динамика белковой молекулы
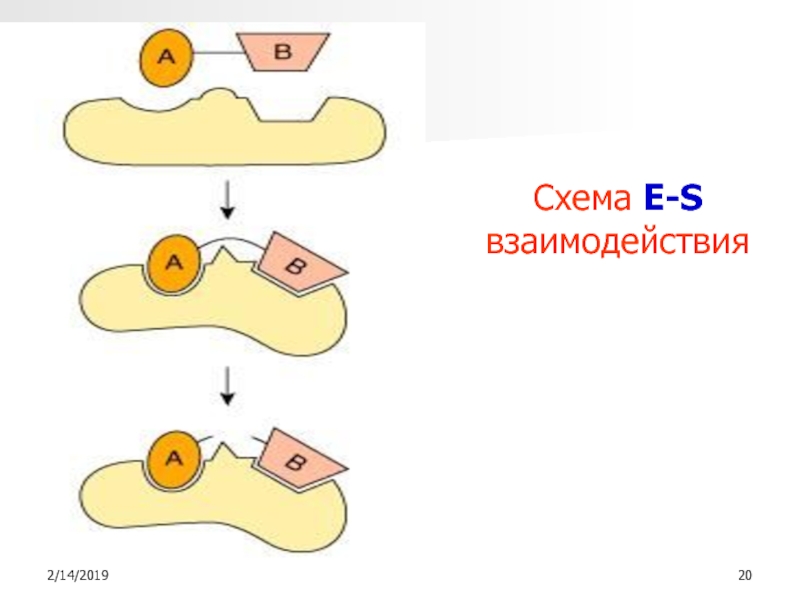
- 20. Схема Е-S взаимодействия
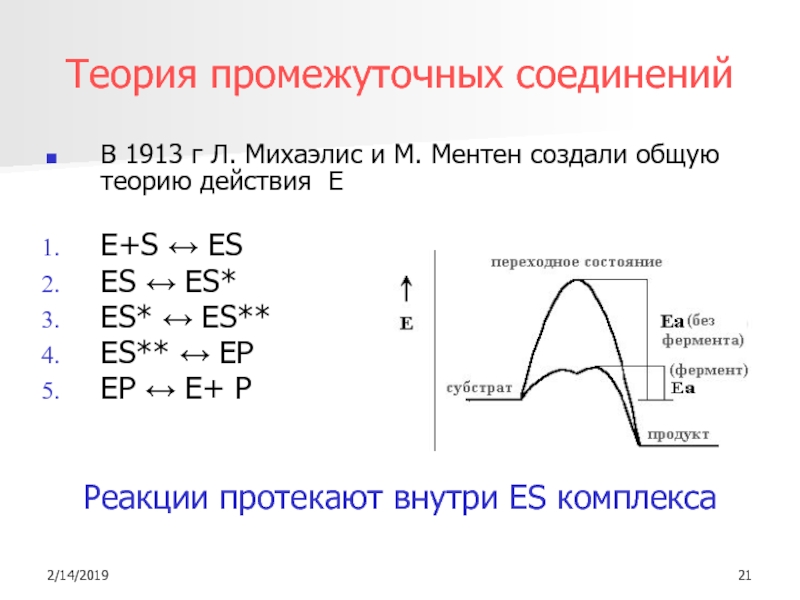
- 21. Теория промежуточных соединенийВ 1913 г Л. Михаэлис
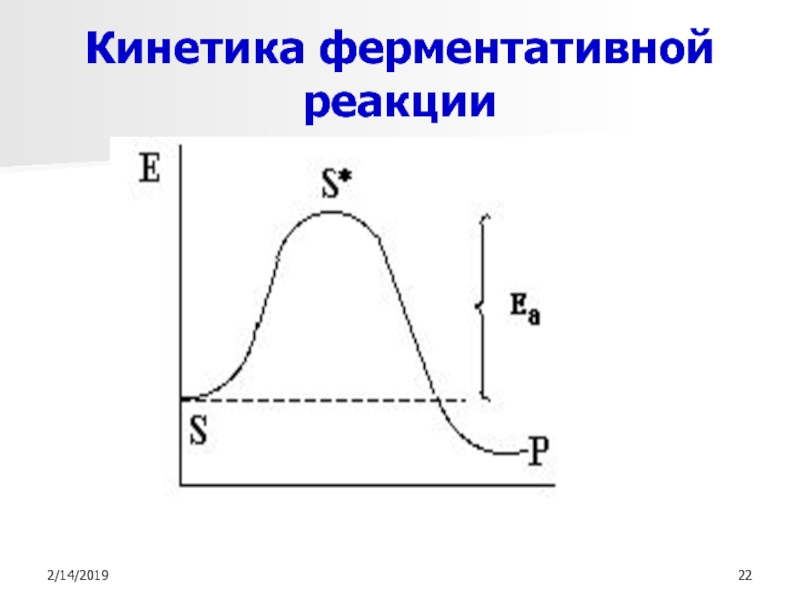
- 22. Кинетика ферментативной реакции
- 23. Зависимость активности Е от [S]
- 24. Активность фермента зависит от [S]
- 25. График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график Лайнуивера-Берка)
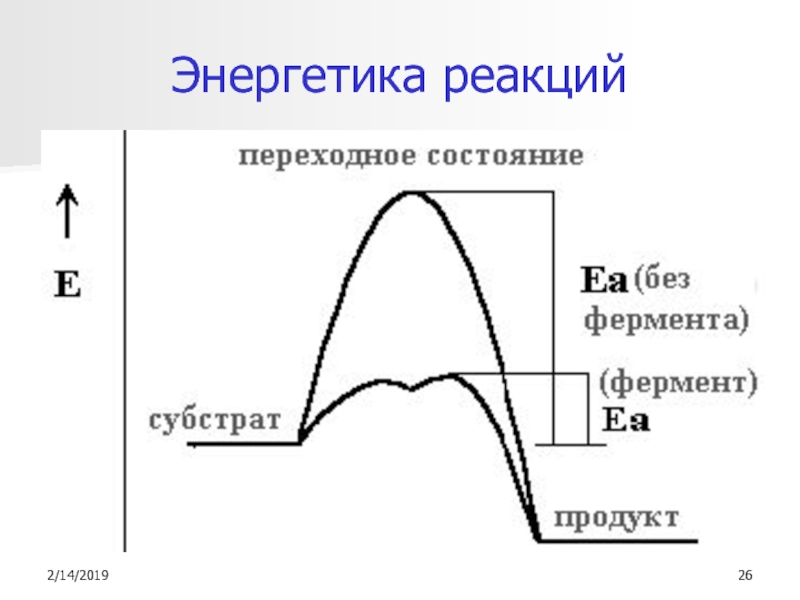
- 26. Энергетика реакций
- 27. Зависимость скорости реакции от [E]
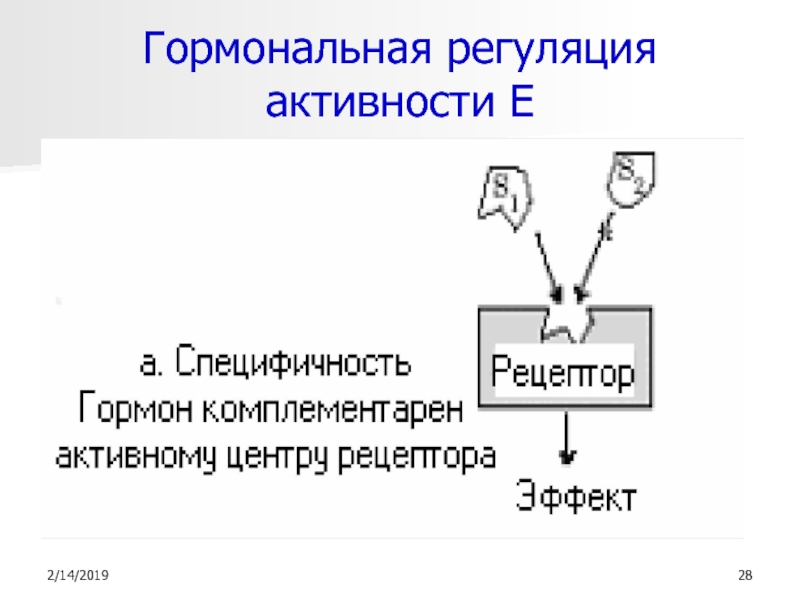
- 28. Гормональная регуляция активности Е
- 29. Структура АЦ комплекса
- 30. Каскадный принцип работы АЦ комплекса
- 31. Регуляция активности Е путем химической модификацииОграниченный протеолиз (Пепсиноген→пепсин)ФосфорилированиеМетилированиеАцетилированиеАденилированиеи др.
- 32. Виды ингибированияОбратимое - Обратимые изменения активности фермента
- 33. Регуляция активности ЕРегуляция условиями среды t°, pH,
- 34. Ретроингибирование
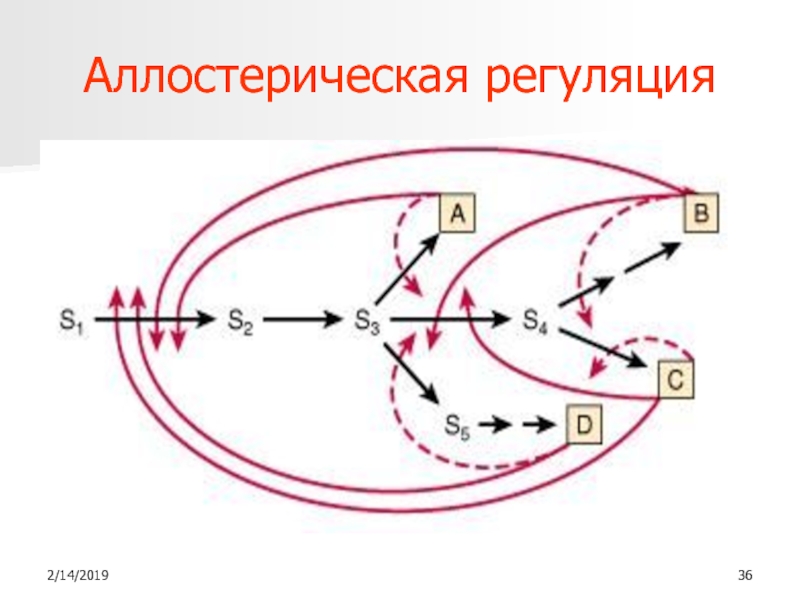
- 35. Свойства аллостерических ферментовРасположены в узловых пунктах метаболизма
- 36. Аллостерическая регуляция
- 37. Благодарю за внимание
- 38. Скачать презентанцию
Ферменты – биологические катализаторы белковой природыВ природе существует 3 вида биологических катализаторов :Ферменты (энзимы) – белковой природыРибозимы – РНК с каталитической активностьюАбзимы – антитела с каталитической активностью
Слайды и текст этой презентации
Слайд 2Ферменты – биологические катализаторы белковой природы
В природе существует 3 вида
биологических катализаторов :
Ферменты (энзимы) – белковой природы
Рибозимы – РНК с
каталитической активностьюАбзимы – антитела с каталитической активностью
Слайд 3
История энзимологии
В древности использовали ферментативные технологии (хлебопечение, виноделие, обработка шкур
и др)
XVIII в Р.Реомюр, Л. Спалланцани описание пищеварения у птиц
1814
г. К.Кирхгоф показал каталитический хар-р гидролиза крахмала при прорастании зернаСередина XIX в спор Ю. Либиха и Л. Пастера «организованные» и «неорганизованные» ферменты
1878 г. Ф. Кюне ввел термин «энзим»
Слайд 4История энзимологии (прод)
1871 г. М.М. Манассеина, а затем Э. Бюхнер
показали, что экстракт клеток способен к катализу
1894 г. Э. Фишер
создал модель «ключ-замок»1913 г. Л. Михаэлис и М. Ментен создали теорию ферм катализа
1929 г. Дж Самнер доказал белковую природу ферментов
1963 г. изучена первичная структура РНК-азы
1968 г. М. Меррифилд синтез искусственной РНК-азы
Слайд 5Простые и сложные ферменты
Простые ферменты состоят только из молекулы белка
(большинство ферментов ЖКТ)
Сложные ферменты простой фермент (апофермент) + небелкое соединение
(кофермент, кофактор) - коферменты алифатические (GSH)
- коферменты циклические (КоQ)
- коферменты- нуклеотиды (NAD, FAD, FMN)
- коферменты ионы Ме (K, Na, Ca, Mg, Mn, Fe …) ~ 25%
- коферменты-производные водорастворимых витаминов B1- ТПФ, В6 –Фосфопиридоксаль и др)
Слайд 6Структурно-функциональная организация ферментов. Схема
Активные центры
Якорные площадки
Субстратный
субстрат
продукт
Центры регуляции + и -
Слайд 7Сходство Е и неферметативных катализаторов
Катализируют энергетически возможные реакции
Энергия химической системы
остается постоянной
В ходе катализа направление реакции не меняется
Не расходуются в
процессе реакции Слайд 8Отличия Е и неферметативных катализаторов
Каталитическая эффективность - скорость Е реакций
выше –в 108 – 1014 раз, чем некатализируемые реакции
Высокая специфичность
Реакции
протекают в «мягких» условиях при t = 37° C, рН~7.0, постоянном атм давленииСкорость реакции регулируется
Слайд 9Доказательства белковой природы Е
Идентичные свойства ВМС
Чувствительность к рН, t, факторам
денатурации и др.
При парентеральном введении образуют АТ
Гидролиз Е дает свободные
протеиногенные АКИскусственный синтез Е
Слайд 10Свойства ферментов
Белковая природа определяет многие свойства ферментов
Высокая чувствительность
к pH, у каждого фермента существует свой pH-оптимум
Термолабильность
- высокая чувствительность к действию температурыСпецифичность
Многоуровневая разнообразная регуляция
Слайд 12Механизмы рН зависимости
ионизация и изменение заряда
поверхностных групп молекулы Е, в
т.ч. и его активного центра,
субстратов, т.к. большинство S являются
кислотамиСлайд 15Специфичность Е
Виды специфичности:
Субстратная специфичность
Абсолютная - аргиназа
Относительная (групповая) - ферм ЖКТ
Стереоспецифичность
D- и L-изомеры
2. Каталитическая 4 пути катализа Г6Ф (фосфоглюкомутаза, Г6Ф-аза,
фосфоглюкоизомераза, Г6Ф ДГ)Слайд 17Этапы взаимодействия Е и S
Сближение и ориентация S по отношению
к каталитической группе Е
Напряжение и деформация чувствительной к действию Е
связи, из-за индуцированного соответствия S и Е (образование ЕS компл)Общий кислотно-основной катализ
Ковалентный катализ
Слайд 18Механизм взаимодействия Е и S
Теория Э Фишера (1894) жесткого стерического
соответствия (ключ-замок)
Теория Д.Кошланда (1957) индуцированного взаимодействия Е и S (рука-перчатка)
Современные
представления – синтез обеих теорийСлайд 21Теория промежуточных соединений
В 1913 г Л. Михаэлис и М. Ментен
создали общую теорию действия Е
E+S ↔ ES
ES ↔ ES*
ES* ↔ ES**
ES** ↔ EP
EP ↔ E+ P
Реакции протекают внутри ES комплекса
Слайд 25График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график
Лайнуивера-Берка)
Слайд 31Регуляция активности Е путем химической модификации
Ограниченный протеолиз (Пепсиноген→пепсин)
Фосфорилирование
Метилирование
Ацетилирование
Аденилирование
и др.
Слайд 32Виды ингибирования
Обратимое - Обратимые изменения активности фермента путем ковалентной модификации
1. конкурентное (структурное сходство I с S) IE
- путем связывания активного центра - путем изменения конформации фермента
Принципы конкурентного торможения находят применение в медицине в химиотерапии и при лечении отравлений
2. неконкурентное ISE Неконкурентные ингибиторы не могут связаться со свободным ферментом , а только с ES комплексом
3. бесконкурентное
Необратимое обычно необратимое повреждение Е
Слайд 33Регуляция активности Е
Регуляция условиями среды t°, pH, ионной силы и
др.
Изостерическая с помощью S или P
- субстратная активация и
ингибирование- ретроингибирование (ингибирование продуктом)
Аллостерическая с помощью др веществ не являющихся ни S или P данной реакции
Слайд 35Свойства аллостерических ферментов
Расположены в узловых пунктах метаболизма
Субъединичная структура
Имеется ось
симметрии
Изменения конформации в пределах R и T
Сигмоидная форма кривой зависимости
скорости реакции от концентрация субстрата (в отличие от гиперболической для не аллостерических)Наличие эффекторов + и –
Двухфазный ответ на конкурентные ингибиторы (увеличение акт при малых [I] и торможение при больших)
Потеря аллостерических свойств при денатурации















![Энзимология Строение и свойства ферментов (ферменты - 1) Зависимость активности Е от [S] Зависимость активности Е от [S]](/img/thumbs/6ab9104c384bd0f6f7d9fd20bcd748d3-800x.jpg)
![Энзимология Строение и свойства ферментов (ферменты - 1) Активность фермента зависит от [S] Активность фермента зависит от [S]](/img/thumbs/e1f3028096169d358b718afec0f8d3f1-800x.jpg)
![Энзимология Строение и свойства ферментов (ферменты - 1) График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график Лайнуивера-Берка) График зависимости скорости реакции от[S] Метод «двойных обратных величин» (график Лайнуивера-Берка)](/img/thumbs/bcb6b2e52d72f8691bb395c708f2def7-800x.jpg)
![Энзимология Строение и свойства ферментов (ферменты - 1) Зависимость скорости реакции от [E] Зависимость скорости реакции от [E]](/img/thumbs/9d3086409e7c7746691067617343993c-800x.jpg)