Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФЕРМЕНТИ
Содержание
- 1. ФЕРМЕНТИ
- 2. Відмінність біологічних каталізаторів (ферментів) від мінеральнихНадзвичайно висока
- 3. Будова ферментів 1) прості білки (однокомпонентні) 2) складні білки
- 4. Молекулярна масаРИБОНУКЛЕАЗА ……………....………………..……………………..13700ТРИПСИН ………………………………………………………………23800ГЕКСОКІНАЗА ……………………...………………….……………..45000АЛЬДОЛАЗА ………………………………………………...………..142000УРЕАЗА ………………………………………………………………..480000ПІРУВАТДЕГІДРОГЕНАЗА ………..……….………………...……4500000
- 5. Коферменти1. Водорозчинні вітаміни – у вигляді фосфорних
- 6. Слайд 6
- 7. Центри ферментів це особливі ділянки ферментів, які
- 8. В структурі ферментів розрізняють наступні центри: 1. Активний
- 9. 2. Регуляторний (алостеричний) центр – це ділянка
- 10. 1 – активний центр:1а – субстратний центр
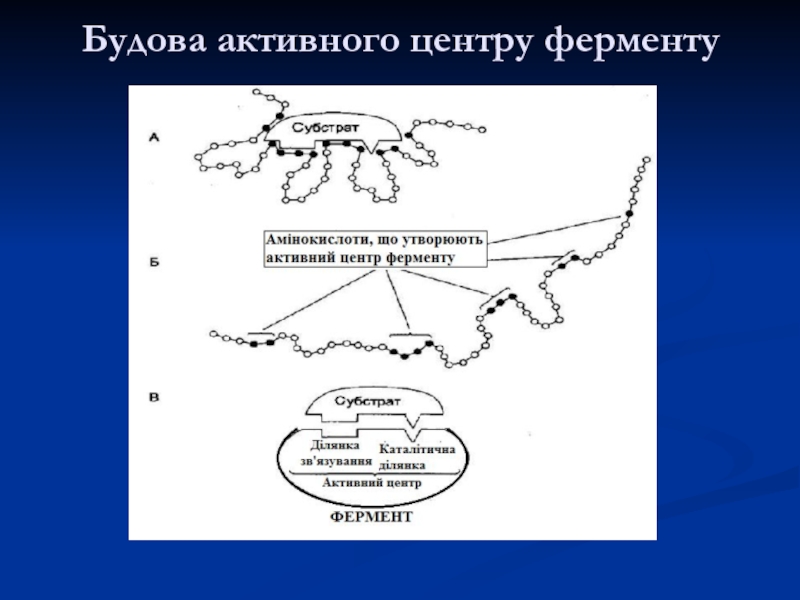
- 11. Будова активного центру ферменту
- 12. Амінокислоти, що найчастіше входять до структури центрівСерин
- 13. Загальні властивості ферментів1. Термолабільність – це зміна
- 14. Залежність швидкості ферментативної реакції (V) від температури
- 15. 2. Чутливість до рН середовища Більшість ферментів організму
- 16. Залежність швидкості ферментативної реакції (V) від рН середовища
- 17. 3. Специфічність дії – це вибірковість дії
- 18. 4. Зберігають активність в ізольованому вигляді, тому
- 19. Механізм дії ферментів. Енергетичні зміни ПРИ
- 20. Фермент зменшує енергію активації Еа, тобто знижує
- 21. Зниження енергетичного бар'єру відбувається за рахунок:1. Підвищення
- 22. Механізм ферментативного каталізу (теорія нестійких фермент-субстратних комплексів) В
- 23. S +
- 24. Ефект деформації Активний центр ферменту також сприяє дестабілізації
- 25. Етапи ферментативного каталізу I - етап зближення
- 26. Конкурентна і неконкурентна дія інгібіторів Конкурентна дія
- 27. Схема конкурентного інгібування активності ферменту
- 28. За неконкурентного інгібування інгібітор приєднується до
- 29. Схема неконкурентного інгібування активності ферменту
- 30. Ферментні ансамблі або мультиферменти – комплекс ферментів, які каталізують послідовні реакції при перетворенні однієї речовини.
- 31. ІЗОФЕРМЕНТИЦе множинні молекулярні форми, що мають єдину
- 32. Множинні ізоформи ЛДГА – будова різних ізоформ
- 33. Слайд 33
- 34. Для оцінки кількості молекул ферменту серед інших
- 35. Каталітична ефективність Кількість молекул субстрату, які перетворюються в
- 36. Номенклатура ферментівТривіальна (пепсин, трипсин, хімотрипсин);Назва субстрату (латинська
- 37. Наукова назва: за допомогою цифр: - перша
- 38. КЛАСИФІКАЦІЯ ФЕРМЕНТІВВсі ферменти за механізмом дії розділені на 6 основних класів:Оксидоредуктази 4. ЛіазиТрансферази 5. ІзомеразиГідролази 6. Лігази
- 39. ОксидоредуктазиФерменти цього класу каталізують окисно-відновні реакції, які
- 40. Дегідрогенази: а) піридинзалежні (анаеробні), б) флавінзалежні (аеробні).Цитохроми:
- 41. Піридинзалежні дегідрогенази (двохкомпонентні)Специфічний білок (апофермент) + кофермент НАД або НАДФ.Механізм дії:
- 42. Слайд 42
- 43. Слайд 43
- 44. Флавінзалежні дегідрогенази (двохкомпонентні)Специфічний білок (апофермент) + кофермент ФМН або ФАД.Механізм дії:
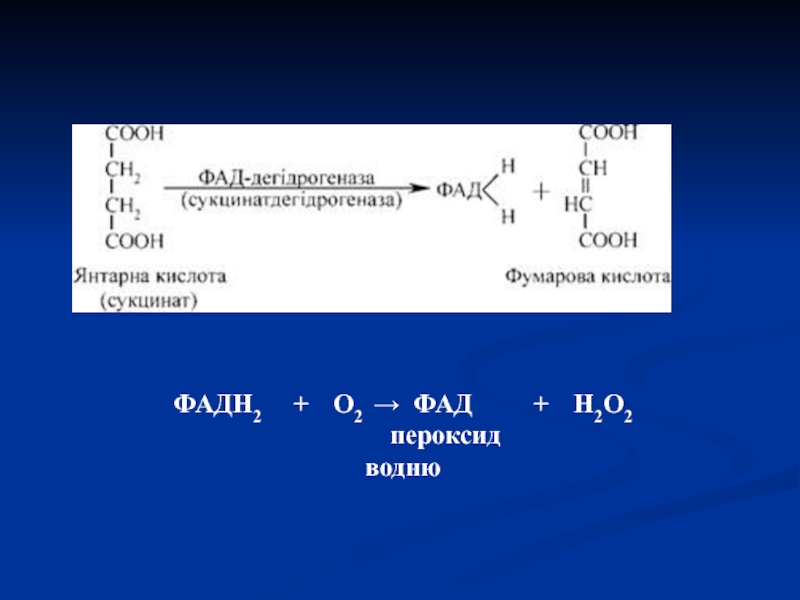
- 45. ФАДН2 + О2 → ФАД + Н2О2 пероксид водню
- 46. Слайд 46
- 47. Цитохроми За хімічною природою відносяться до хромопротеїнів
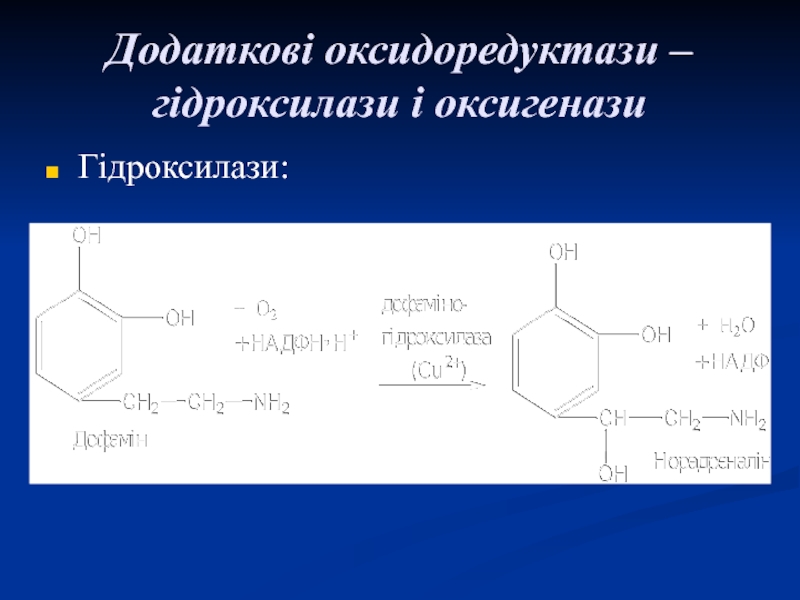
- 48. Додаткові оксидоредуктази – гідроксилази і оксигенази Гідроксилази:
- 49. Оксигенази: Гомогентизинова кислота
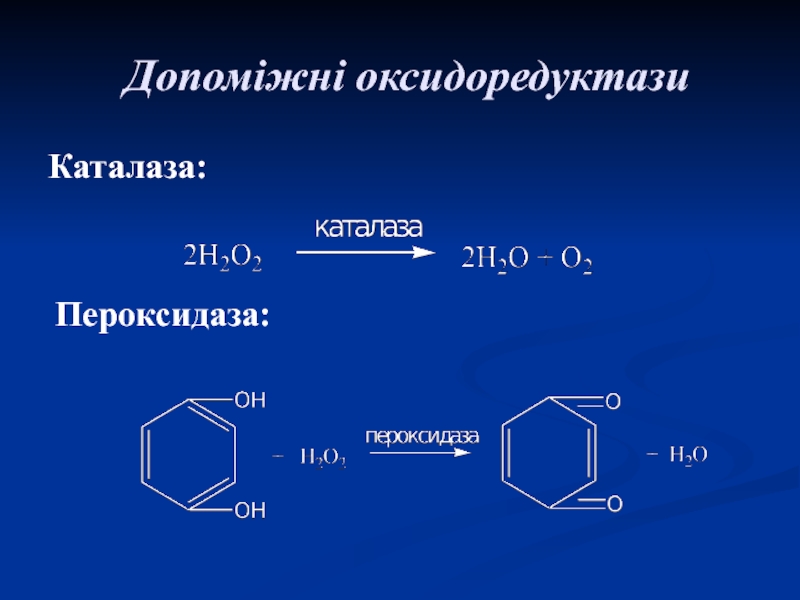
- 50. Допоміжні оксидоредуктази Каталаза:Пероксидаза:
- 51. ТрансферазиАмінотрансферази (апофермент + ФП), Ацилтрансферази (апофермент +
- 52. Амінотрансферази (двохкомпонентні) Склад: специфічний білок + фосфопіридоксаль (ФП), тобто фосфорильований вітамін В6.α
- 53. Ацилтрансферази (двохкомпонентні)Склад: специфічний білок (апофермент) + НS-коензимА (містить вітамін В3)
- 54. Метилтрансферази (двохкомпонентні)Склад: специфічний білок (апофермент) + вітамін В12 та Вс
- 55. Фосфотрансферази (двохкомпонентні)Склад: специфічний білок (апофермент) + АТФ
- 56. Гідролази (однокомпонентні)Каталізують розрив хімічних зв'язків в молекулах
- 57. Підкласипептидази, глікозидази, естерази, тіолази, амідази та ін.
- 58. ПептидазиПрискорюють гідроліз пептидних зв'язків в молекулах білків і поліпептидів:
- 59. ЕндопептидазиЕндопептидази гідролізують пептидні зв'язки в середині поліпептидного
- 60. ЕкзопептидазиПри дії цих ферментів від поліпептидного ланцюга
- 61. Слайд 61
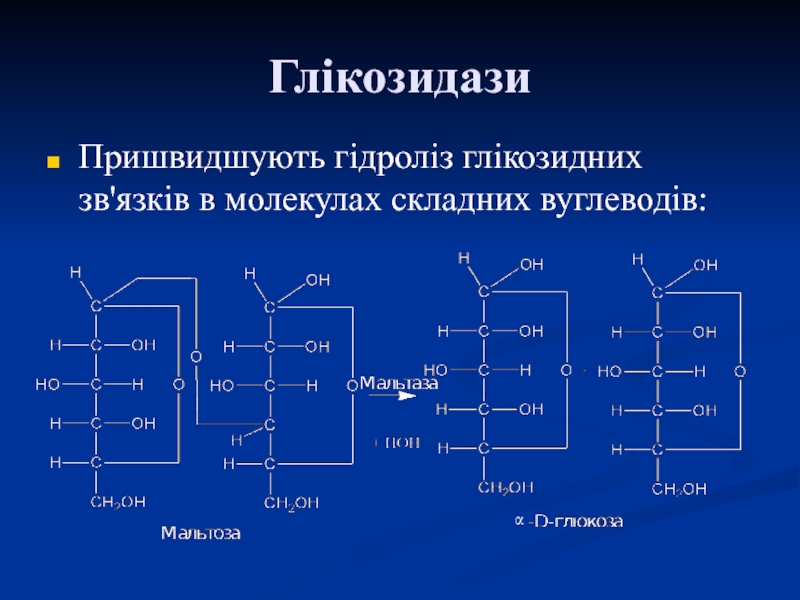
- 62. Глікозидази Пришвидшують гідроліз глікозидних зв'язків в молекулах складних вуглеводів:α
- 63. Слайд 63
- 64. Естерази Прискорюють гідроліз різних складних ефірів. Залежно
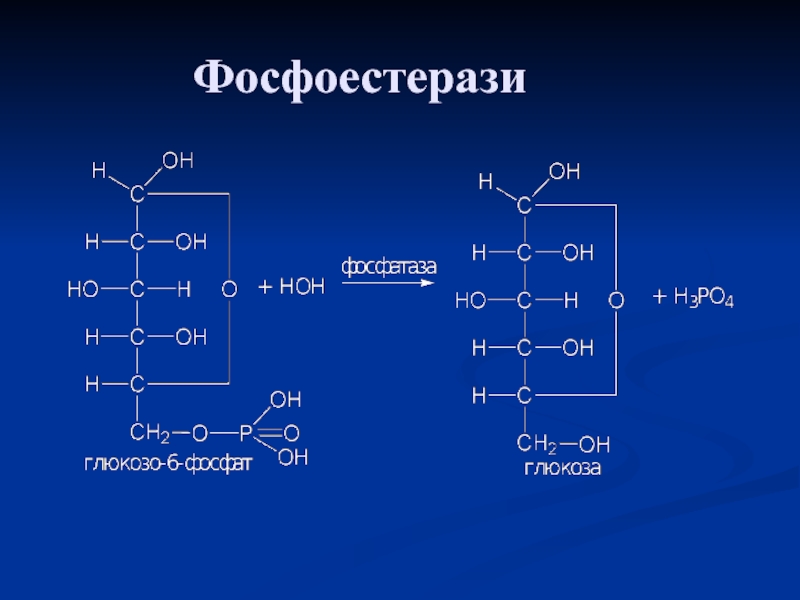
- 65. Фосфоестерази
- 66. ЛіазиЦе ферменти, які можуть обернено приєднувати або
- 67. Слайд 67
- 68. Слайд 68
- 69. ІзомеразиФерменти цього класу каталізують реакції ізомерних перебудов
- 70. Слайд 70
- 71. Лігази (синтетази)Каталізують синтез органічних речовин з двох
- 72. Слайд 72
- 73. Скачать презентанцию
Відмінність біологічних каталізаторів (ферментів) від мінеральнихНадзвичайно висока ефективність дії (в дуже малих кількостях підсилюють швидкості біохімічних реакцій в сотні тисяч разів).Висока специфічність дії (як по відношенню до типу хімічної реакції, так
Слайды и текст этой презентации
Слайд 1ФЕРМЕНТИ
Це специфічні білки, що виконують в організмі функцію біологічних каталізаторів
(Fermentum – закваска; enzyme – в дріжджах).
ферменти та ферментативні процеси, називається ензимологією.Слайд 2Відмінність біологічних каталізаторів (ферментів) від мінеральних
Надзвичайно висока ефективність дії (в
дуже малих кількостях підсилюють швидкості біохімічних реакцій в сотні тисяч
разів).Висока специфічність дії (як по відношенню до типу хімічної реакції, так і по відношенню до субстрату).
Проявляють свою дію в «м'яких» умовах (температура 36-42оС, нормальний тиск, рН=7,0)
Активність ферментів регулюється різними системами.
Слайд 3Будова ферментів
1) прості білки (однокомпонентні)
2) складні білки (двокомпонентні):
простий білок +
простетична група
(апофермент) (кофермент)
Слайд 4Молекулярна маса
РИБОНУКЛЕАЗА ……………....………………..……………………..13700
ТРИПСИН ………………………………………………………………23800
ГЕКСОКІНАЗА ……………………...………………….……………..45000
АЛЬДОЛАЗА ………………………………………………...………..142000
УРЕАЗА ………………………………………………………………..480000
ПІРУВАТДЕГІДРОГЕНАЗА ………..……….………………...……4500000
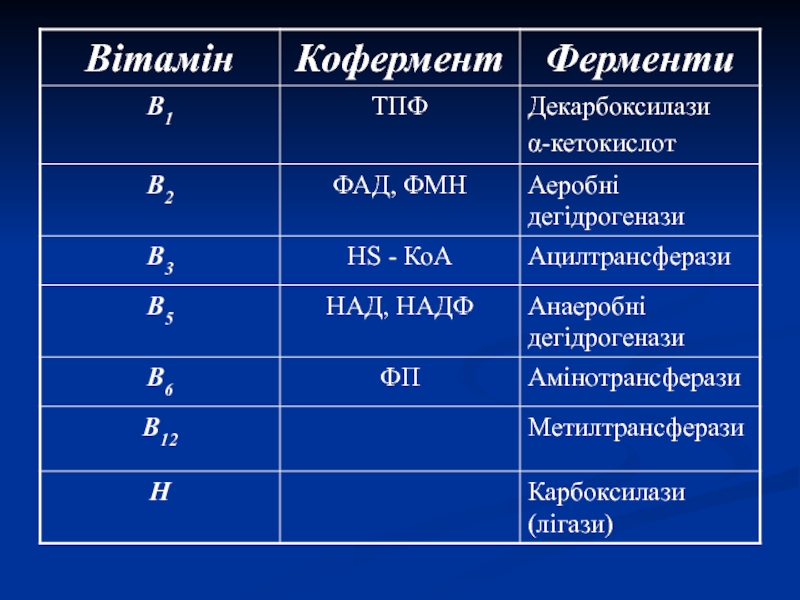
Слайд 5Коферменти
1. Водорозчинні вітаміни – у вигляді фосфорних ефірів (ТДФ та
ФП) або в складі нуклеотидів (ФМН, ФАД, НАД, НАДФ, НS-КоА)
2.
Нуклеозид три- і дифосфати (АТФ, ТТФ, УТФ, ГТФ).3. Метали (Zn2+, Cu2+, Fe2+, Mo2+).
4. Пептидні коферменти (глутатіон).
Слайд 7Центри ферментів
це особливі ділянки ферментів, які формуються на рівні
третинної і четвертинної структури та забезпечують каталітичну функцію ферментів
Слайд 8В структурі ферментів розрізняють наступні центри:
1. Активний центр, в ньому
виділяють 2 ділянки, які теж іноді називають центрами:
а). Субстратний центр
– це ділянка ферменту, за рахунок якого утворюється зв'язок між субстратом та ферментом і відбувається утворення нестійкого фермент-субстратного комплексу;б). Каталітичний центр – це ділянка ферменту, яка відповідає за безпосереднє проведення реакції (часто співпадає з коферментом).
Слайд 9 2. Регуляторний (алостеричний) центр – це ділянка ферменту, приєднання до
якого різних речовин (модифікаторів) призводить до змін просторової структури активного
центру, в результаті чого фермент змінює свою активність.Модифікатори, що збільшують активність ферментів, називаються активаторами, а ті, що зменшують – інгібіторами.
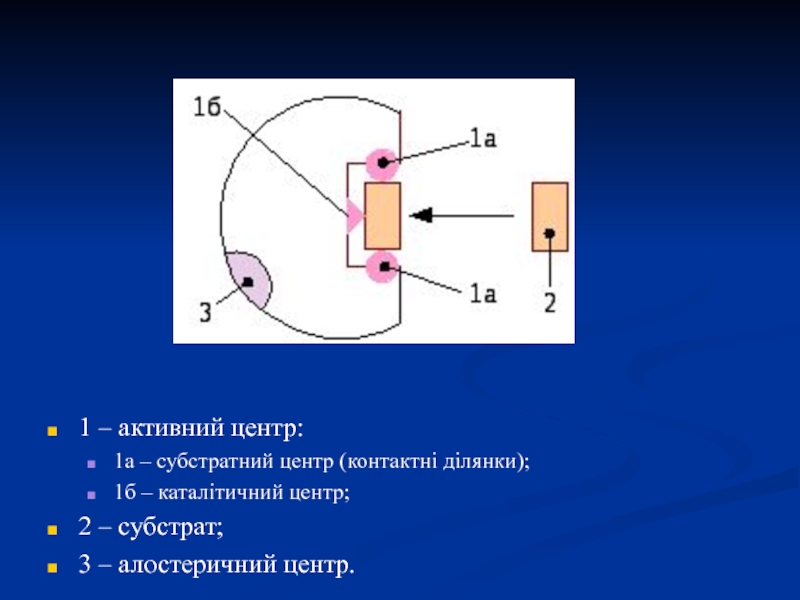
Слайд 101 – активний центр:
1а – субстратний центр (контактні ділянки);
1б –
каталітичний центр;
2 – субстрат;
3 – алостеричний центр.
Слайд 12Амінокислоти, що найчастіше входять до структури центрів
Серин – ОН
Треонін –
ОН
Тирозин – ОН
Цистеїн – SH
Лізин – NH2
Аргінін – HN –
C – NH2||
NH
Гістидин - імідазол
Слайд 13Загальні властивості ферментів
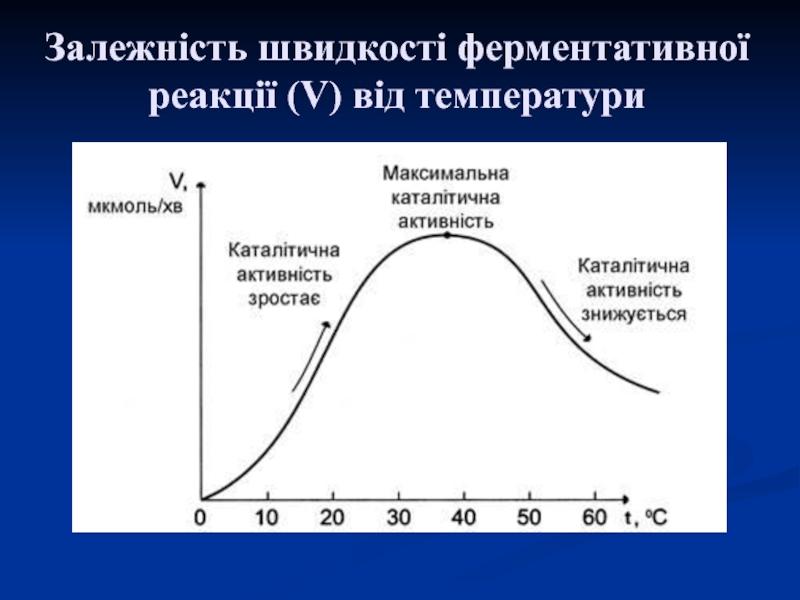
1. Термолабільність – це зміна активності ферментів при
різних температурах: оптимальну активність вони проявляють при температурі тіла тварин.
При підвищенні температури їх активність збільшується, але на певний час, бо з подальшим підвищенням температури (80-100оС) вони припиняють свою дію необоротно (відбувається денатурація білкової частини).
При зниженні температури активність ферментів зменшується, а при 0оС і нижче (заморожування) їх активність рівна нулю, але ця дія обернена.
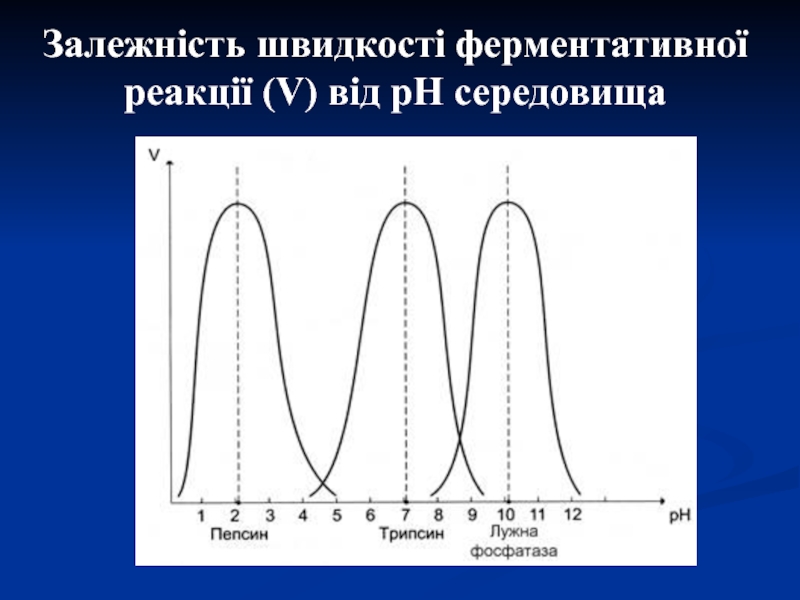
Слайд 152. Чутливість до рН середовища
Більшість ферментів організму мають оптимум рН,
наближений до нейтрального, хоча для кожного ферменту для прояву максимальної
його активності існує певне значення рН, так як при даних значеннях формується оптимальна конформація білка-фермента з максимальною активністю його центрів.Слайд 17 3. Специфічність дії – це вибірковість дії ферментів як по
відношенню до субстрату реакції, так і по відношенню до типу
хімічної реакції.Розрізняють наступні рівні специфічності:
Абсолютна (індивідуальна) – коли фермент діє тільки на один конкретний субстрат (наприклад, уреаза, яка каталізує гідроліз сечовини).
Відносна (групова) – фермент діє на групу речовин, близьких за хімічною будовою (наприклад, пепсин діє на різні білки).
Оптична (стереоспецифічність) – коли фермент діє не просто на одну речовину, а тільки на певний його оптичний ізомер (наприклад, ферменти амінокислот організму специфічні тільки по відношенню до L-ізомерів).
Слайд 184. Зберігають активність в ізольованому вигляді, тому багато ферментів використовують
як лікарські препарати.
5. Чутливість до наявності в середовищі модифікаторів
(активаторів та інгібіторів).За рахунок їх дії регулюється активність ферменту, кооперативність, взаємозв'язок і запрограмованість їх дії.
Слайд 19Механізм дії ферментів.
Енергетичні зміни
ПРИ ХІМІЧНИХ РЕАКЦІЯХ.
Будь-які хімічні реакції
перебігають згідно двох основних законів термодинаміки: закону збереження енергії та
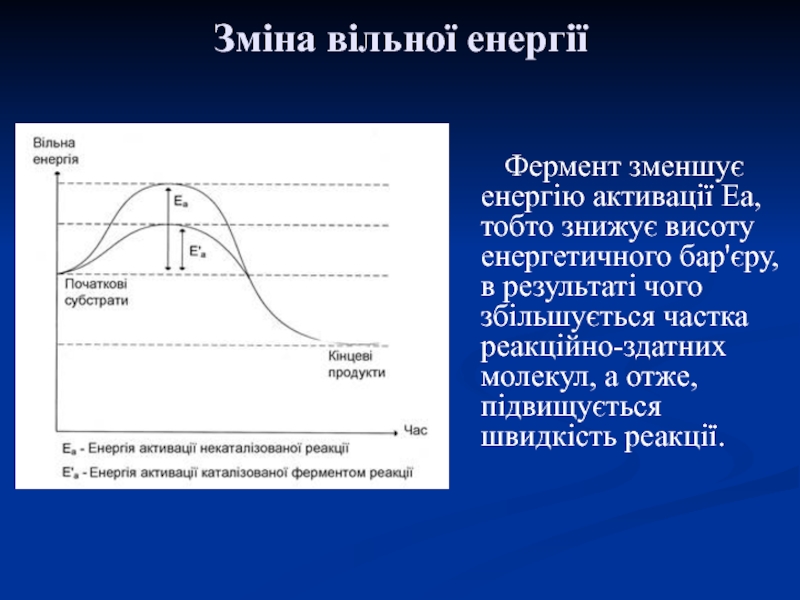
закону ентропії. Відповідно до цих законів, загальна енергія хімічної системи та її оточення залишається постійною, при цьому хімічна система прагне до зменшення впорядкованості (збільшення ентропії).Слайд 20 Фермент зменшує енергію активації Еа, тобто знижує висоту енергетичного бар'єру,
в результаті чого збільшується частка реакційно-здатних молекул, а отже, підвищується
швидкість реакції.Зміна вільної енергії
Слайд 21Зниження енергетичного бар'єру відбувається за рахунок:
1. Підвищення ймовірності зіткнення субстратів.
2.
Чіткої орієнтації взаємодій молекул в активному центрі.
3. Максимального зближення субстратів.
4.
Дії на певні атоми субстрату атомами активного центру.5. Зміщення електронів і протонів, що підвищує реакційноздатність атомів.
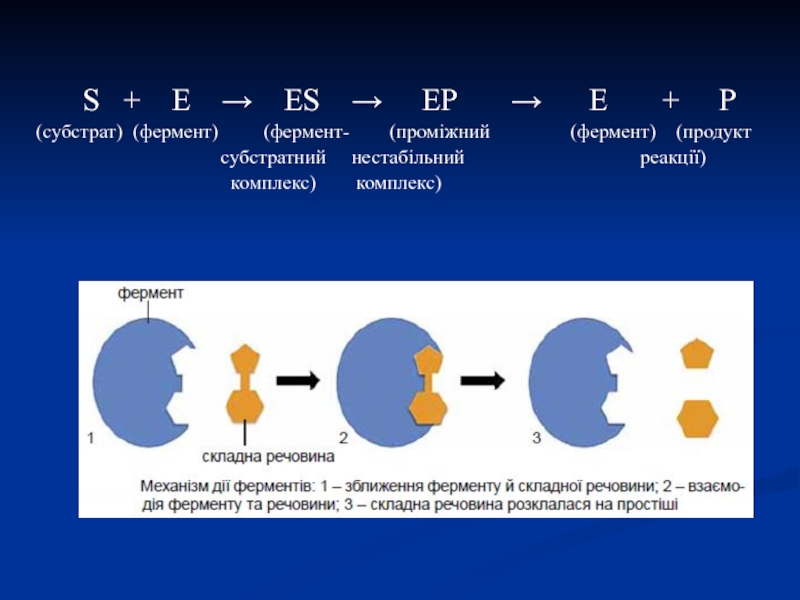
Слайд 22Механізм ферментативного каталізу (теорія нестійких фермент-субстратних комплексів)
В механізмі ферментативного каталізу
вирішальне значення має утворення нестійких проміжних сполук – фермент-субстратних комплексів
– ES, що перетворюються в нестабільний перехідний комплекс – ЕР, який майже миттєво розпадається на вільний фермент і продукт реакції.Слайд 23 S + E →
ES → EP
→ E + P(cубстрат) (фермент) (фермент- (проміжний (фермент) (продукт
субстратний нестабільний реакції)
комплекс) комплекс)
Слайд 24Ефект деформації
Активний центр ферменту також сприяє дестабілізації міжатомних зв'язків в
молекулі субстрату, що полегшує перебіг хімічної реакції та утворення продуктів.
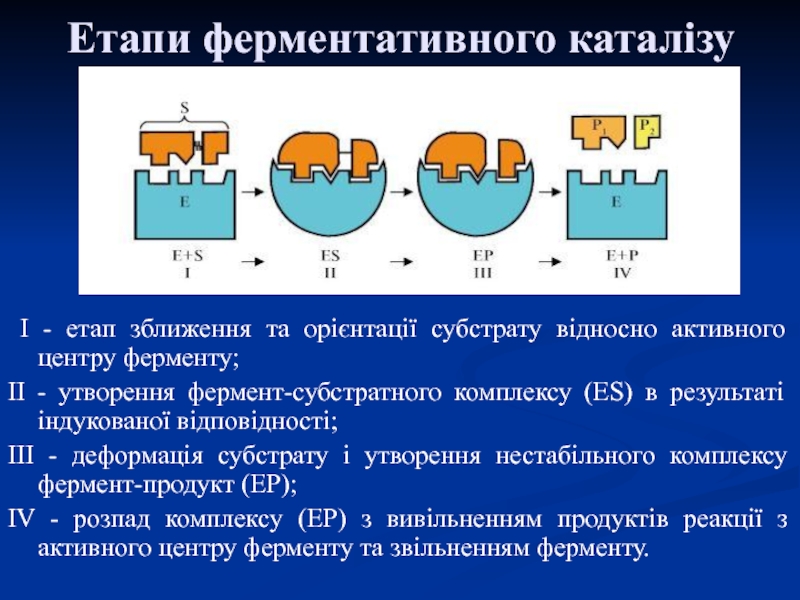
Ця властивість активного центру називається ефектом деформації субстрату.Слайд 25Етапи ферментативного каталізу
I - етап зближення та орієнтації
субстрату відносно активного центру ферменту;
II - утворення фермент-субстратного комплексу
(ES) в результаті індукованої відповідності; III - деформація субстрату і утворення нестабільного комплексу фермент-продукт (ЕР);
IV - розпад комплексу (ЕР) з вивільненням продуктів реакції з активного центру ферменту та звільненням ферменту.
Слайд 26Конкурентна і неконкурентна дія інгібіторів
Конкурентна дія інгібітора буває в
тому випадку, коли його хімічна будова подібна до будови субстрату
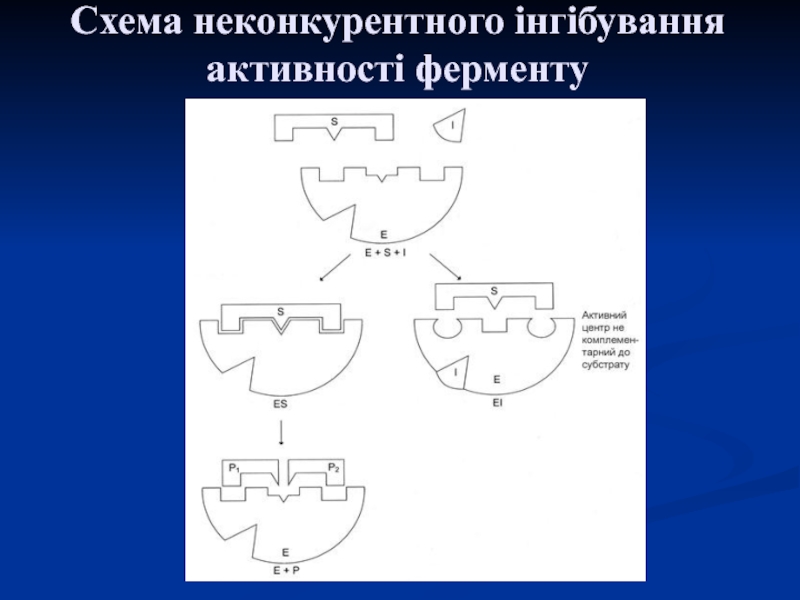
і тому він здатний приєднатися до субстратного центру, конкуруючи з субстратом, що пригнічує активність ферменту.Слайд 28 За неконкурентного інгібування інгібітор приєднується до алостеричного центру, в
результаті чого змінюється конформація активного центру та його здатність з'єднуватися
з субстратом. Ферментативна реакція при цьому пригнічується.Слайд 30Ферментні ансамблі або мультиферменти – комплекс ферментів, які каталізують послідовні
реакції при перетворенні однієї речовини.
Слайд 31ІЗОФЕРМЕНТИ
Це множинні молекулярні форми, що мають єдину субстратну специфічність (фактично
це один і той самий фермент), але відрізняються за фізико-хімічними
та імунологічними властивостями.Слайд 32Множинні ізоформи ЛДГ
А – будова різних ізоформ ЛДГ (субодиниці типу
Н і типу М);
Б – електрофореграма множинних форм ЛДГ;
В – вміст ізоформ ЛДГ в плазмі крові в нормі та при патології (електрофореграми – ліворуч та фотометричне сканування – праворуч).
Слайд 33
Активність ферментів визначають
опосередковано:
за кількістю продукту, що утворився (Р),
за кількістю спожитого субстрату
(S).Міжнародна одиниця активності ферменту Е – це така кількість ферменту, яка каталізує перетворення 1 мікромоля субстрату (S) на продукт реакції (Р) за 1 хв. у стандартних (оптимальних) умовах з розрахунку на 1 г тканини.
Слайд 34 Для оцінки кількості молекул ферменту серед інших білків досліджуваної тканини
визначають питому активність (пит. ак.) ферменту, яка чисельно рівна кількості
одиниць активності ферменту в зразку тканини, розділену на масу (мг) білка в цій тканині:Слайд 35
Каталітична ефективність
Кількість молекул субстрату, які перетворюються в продукт однією молекулою
ферменту за 1 с, називають числом обертів ферменту, або молярною
активністю.Слайд 36Номенклатура ферментів
Тривіальна (пепсин, трипсин, хімотрипсин);
Назва субстрату (латинська або інша) +
закінчення –аза: амілаза (amilum – крохмаль);
Тип реакції + закінчення –аза:
гідролази, оксидоредуктази, дегідрогенази.Слайд 37Наукова назва: за допомогою цифр:
- перша цифра – це
номер класу;
- друга цифра – це номер підкласу;
- третя цифра
– це номер підпідкласу;- четверта цифра – це номер ферменту за каталогом.
Аланінамінотрансфераза (АлАТ – 2.6.1.2.)
Слайд 38КЛАСИФІКАЦІЯ ФЕРМЕНТІВ
Всі ферменти за механізмом дії розділені на 6 основних
класів:
Оксидоредуктази 4. Ліази
Трансферази 5. Ізомерази
Гідролази 6. Лігази
Слайд 39Оксидоредуктази
Ферменти цього класу каталізують окисно-відновні реакції, які лежать в основі
забезпечення тканин необхідною енергією.
Оксидоредуктази ділять на основні чотири підкласи:
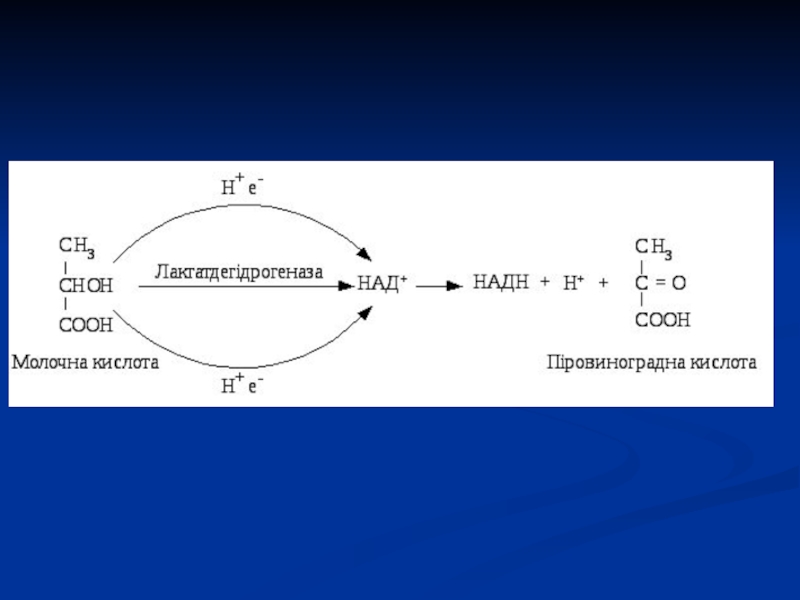
Слайд 40Дегідрогенази:
а) піридинзалежні (анаеробні),
б) флавінзалежні (аеробні).
Цитохроми:
а) сімейство а
(а1, а2, a3,…);
б) сімейство в (в1, в2, в3,…);
в)
сімейство с (с1, с2, с3,…).Допоміжні оксидоредуктази.
Додаткові оксидоредуктази.
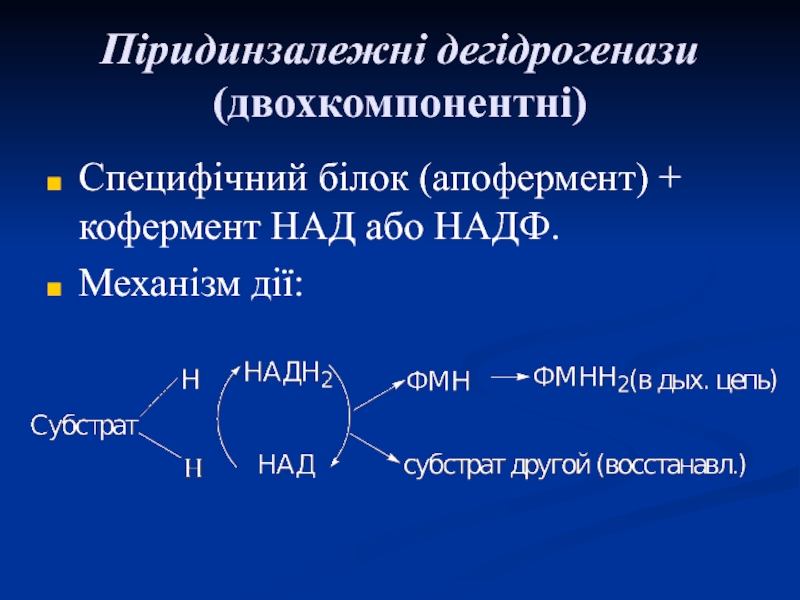
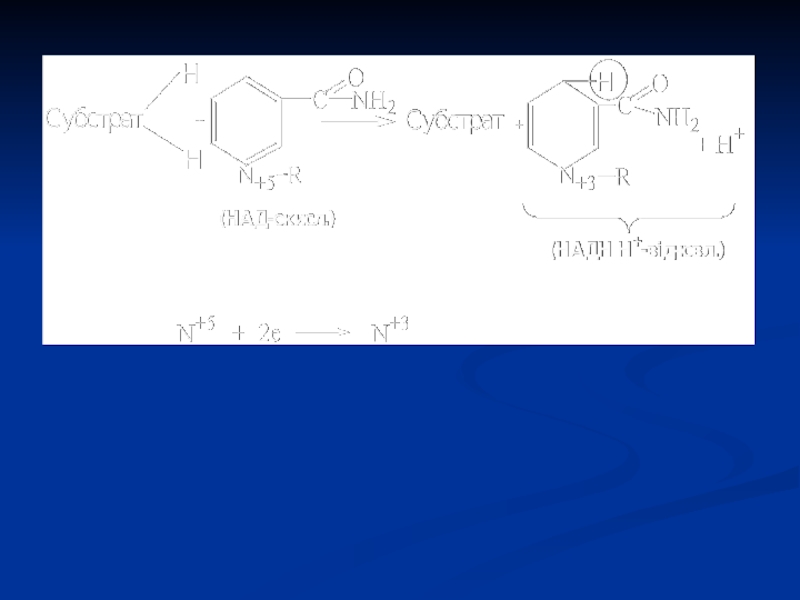
Слайд 41Піридинзалежні дегідрогенази (двохкомпонентні)
Специфічний білок (апофермент) + кофермент НАД або НАДФ.
Механізм
дії:
Слайд 44Флавінзалежні дегідрогенази (двохкомпонентні)
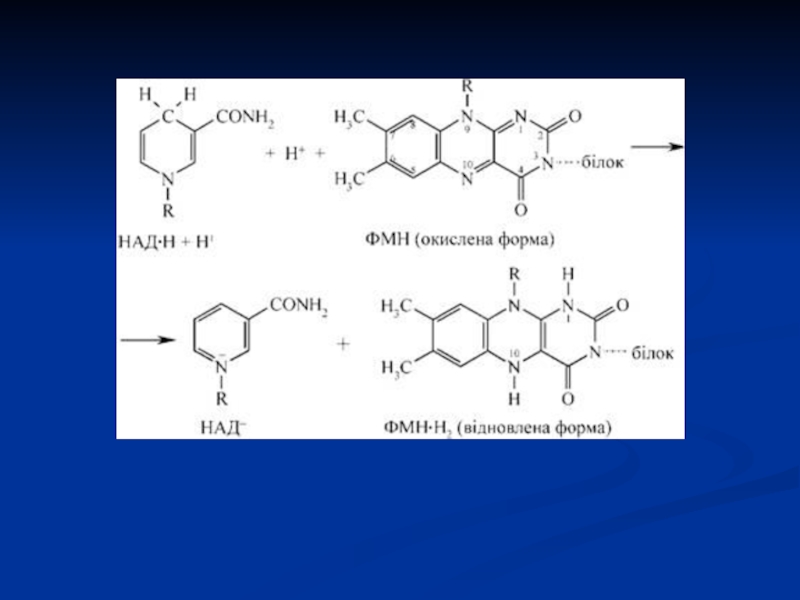
Специфічний білок (апофермент) + кофермент ФМН або ФАД.
Механізм
дії:
Слайд 47Цитохроми
За хімічною природою відносяться до хромопротеїнів (гемовмісних). Їх простетичною
групою (коферментом) є гем, атом заліза якого здатний легко приєднувати
(відновлюватися) і також легко віддавати (окиснюватися) електрони. В природі існує чотири сімейства цитохромів в, с, а, які відрізняються між собою величиною електричного потенціалу, що збільшується в напрямку в – с – а – а3. В такому порядку електрони в ланцюзі цитохромів послідовно передаються від в до а3. Тому, цитохроми ще називають проміжними переносниками електронів (між дегідрогеназами і Оксигеном).Слайд 51Трансферази
Амінотрансферази (апофермент + ФП),
Ацилтрансферази (апофермент + НS-КоА),
Метилтрансферази (апофермент +
В12),
Формілтрансферази (апофермент + Вс),
Фосфотрансферази (апофермент + АТФ).
Слайд 52Амінотрансферази
(двохкомпонентні)
Склад: специфічний білок + фосфопіридоксаль (ФП), тобто фосфорильований
вітамін В6.
α
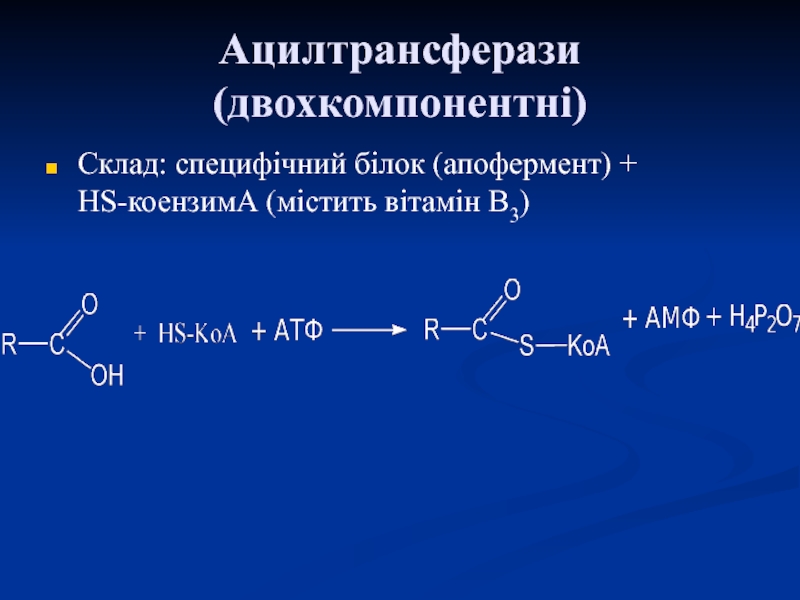
Слайд 53Ацилтрансферази (двохкомпонентні)
Склад: специфічний білок (апофермент) + НS-коензимА (містить вітамін В3)
Слайд 56Гідролази (однокомпонентні)
Каталізують розрив хімічних зв'язків в молекулах складних речовин шляхом
приєднання води. Найбільш часто гідролази зустрічаються в травних соках, а
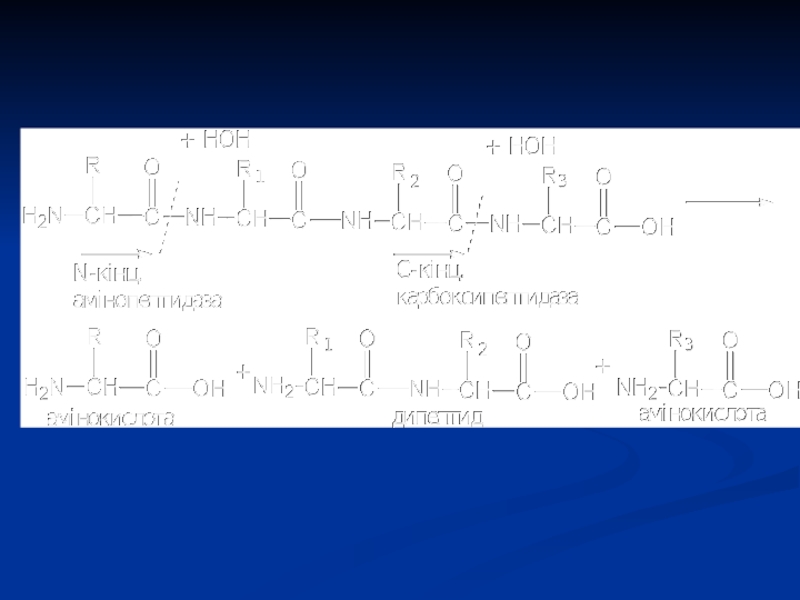
в клітинах вони сконцентровані в лізосомах.Слайд 59Ендопептидази
Ендопептидази гідролізують пептидні зв'язки в середині поліпептидного ланцюга та розщеплюють
її на декілька більш коротких ланцюгів. Прикладом таких пептидаз можуть
бути пепсин, трипсин, хімотрипсин, які гідролізують молекули білків до поліпептидів та олігопептидів різної величини.Слайд 60Екзопептидази
При дії цих ферментів від поліпептидного ланцюга відщеплюються окремі амінокислоти,
тобто екзопептидази гідролізують кінцеві пептидні зв'язки зі сторони вільної аміногрупи
– амінопептидази, або зі сторони вільної карбоксильної групи – карбоксипептидази.Слайд 64Естерази
Прискорюють гідроліз різних складних ефірів. Залежно від кислоти, що
бере участь в утворенні складно-ефірного зв'язку, естерази ділять на підкласи:
карбоестерази (ліпази), фосфоестерази (фосфатази), сульфоестерази та ін.Карбоестерази: