Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ХИМИЯ БИОГЕННЫХ ЭЛЕМЕНТОВ ПЛАН ЛЕКЦИИ (ч.1) 1. Биосфера, круговорот биогенных
Содержание
- 1. ХИМИЯ БИОГЕННЫХ ЭЛЕМЕНТОВ ПЛАН ЛЕКЦИИ (ч.1) 1. Биосфера, круговорот биогенных
- 2. Биосфера. Круговорот биогенных элементовРаздел геохимии, изучающий химические
- 3. Согласно В.И. Вернадскому, живые организмы принимают активное
- 4. Осадочные горные породы
- 5. Меловые отложения
- 6. железо отлагается с помощью железобактерий и образует залежи лимонита
- 7. В живых организмах, в том числе и
- 8. Среднее содержание элементов в живых организмах,
- 9. Увеличение содержания элемента в организме по сравнению с окружающей средой называют биологическим концентрированием
- 10. Биогенными элементами называют элементы, необходимые для построения и жизнедеятельности различных клеток организма.
- 11. Из 92 встречающихся в природе элементов 81
- 12. Классификация биогенных элементов Биотики-элементы экзогенного происхождения, имеющие способность:-
- 13. Классификация биогенных элементов по их функциональной ролиОрганогеныЭлементы электролитного фонаМикроэлементыКсенобиотики
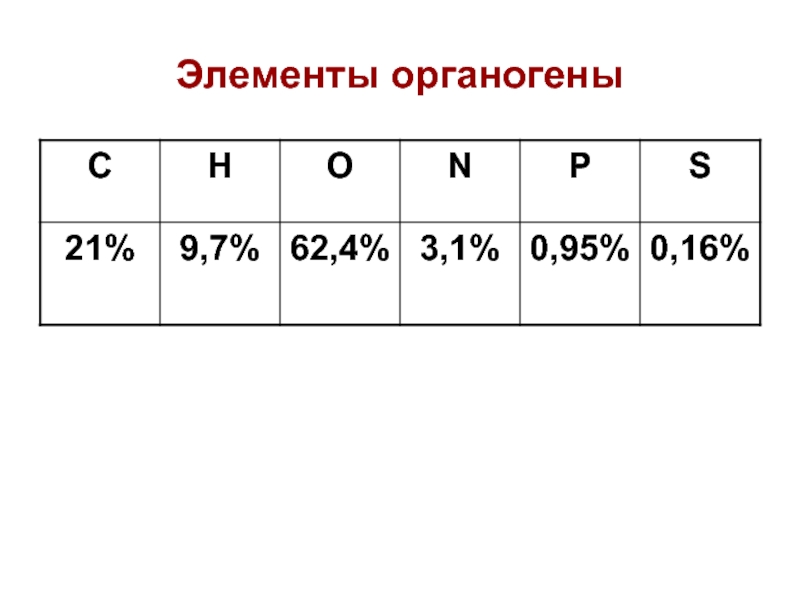
- 14. Элементы органогены
- 15. Элементы электролитного фона Na, К, Ca, Mg,
- 16. Металлы жизни K, Na, Ca, Mg,
- 17. Микроэлементы I, Cu, F, Br, Ba, Co
- 18. Ксенобиотики (от греч. xenos - чужой и
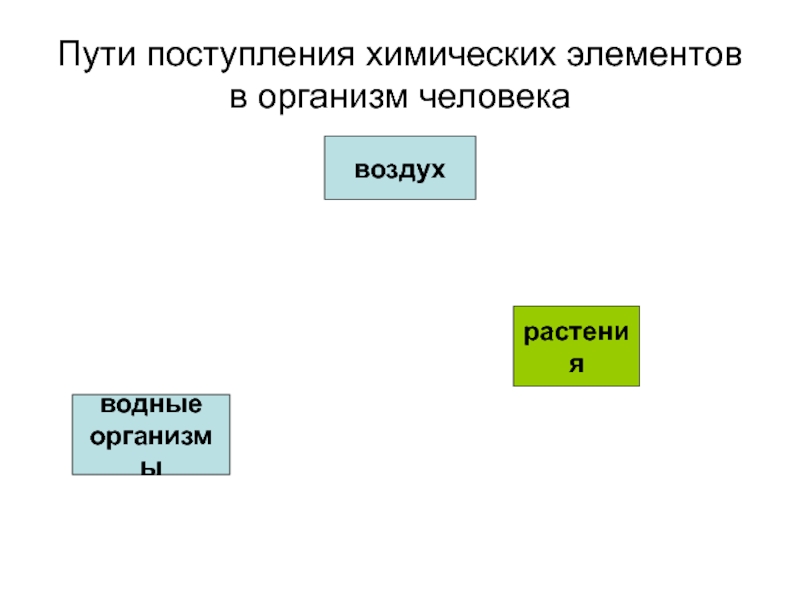
- 19. Пути поступления химических элементов в организм человекавоздухводные организмырастенияводапочвапыльсточные водыживотныечеловек
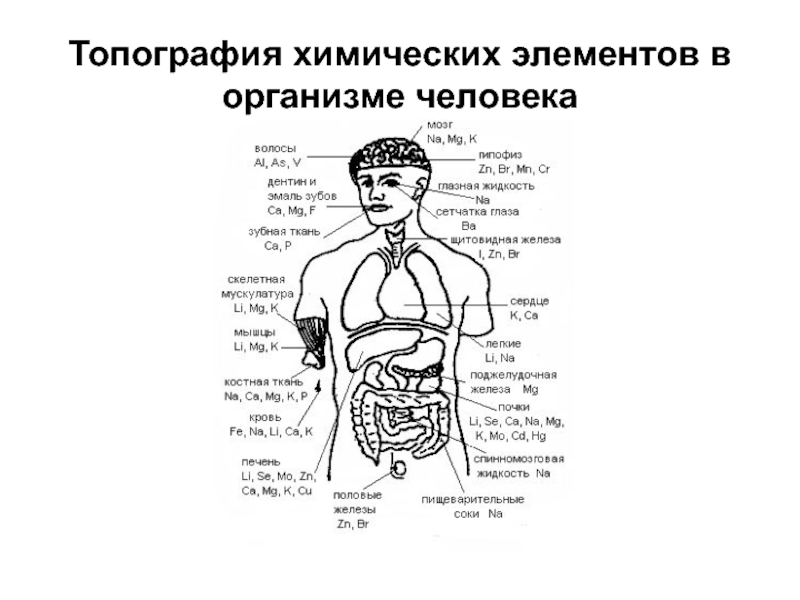
- 20. Топография химических элементов в организме человека
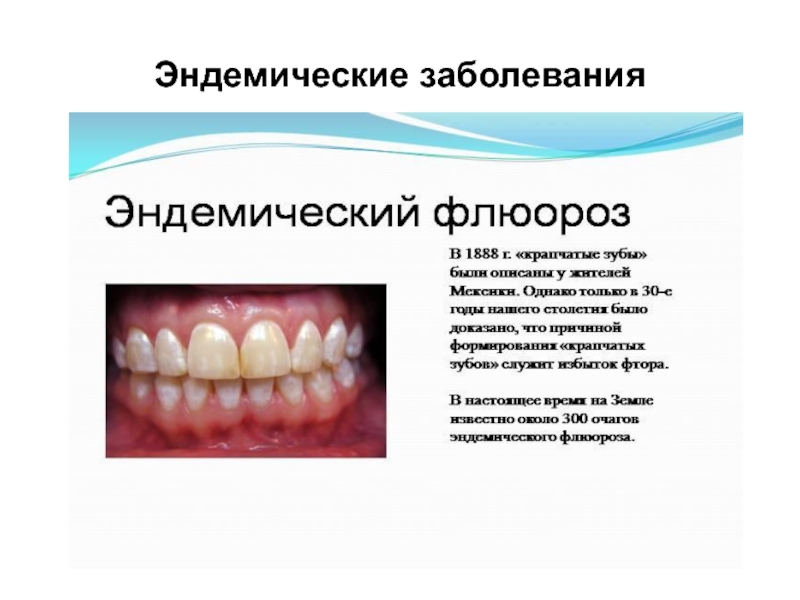
- 21. Эндемические заболевания
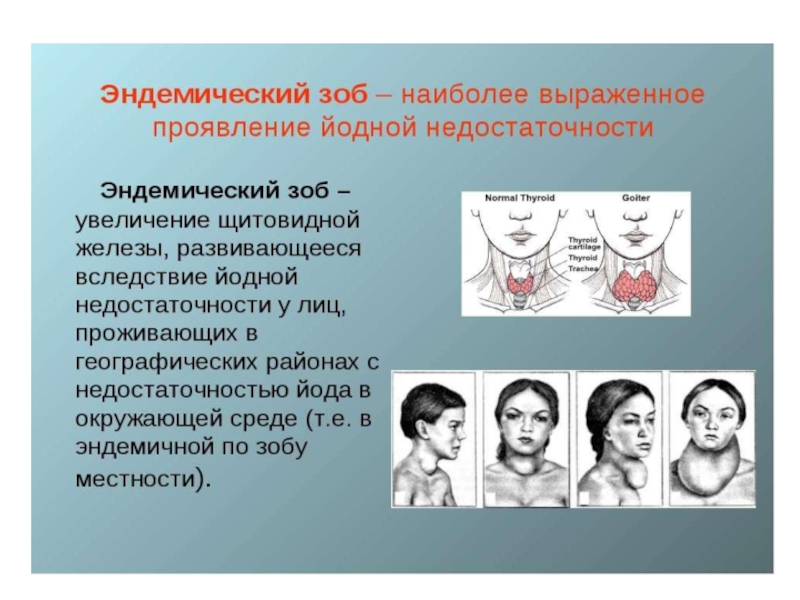
- 22. Слайд 22
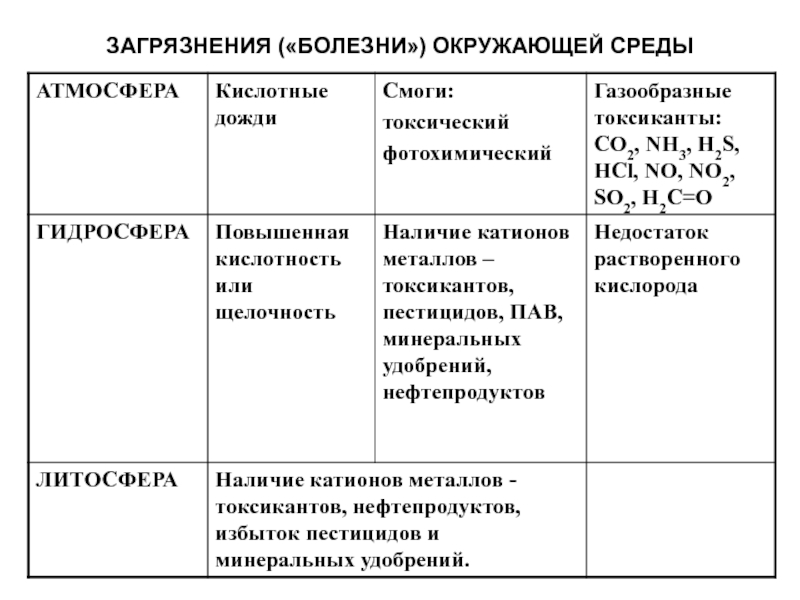
- 23. ЗАГРЯЗНЕНИЯ («БОЛЕЗНИ») ОКРУЖАЮЩЕЙ СРЕДЫ
- 24. ЛИТЕРАТУРА ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ1.Барковский Е.В. Введение в
- 25. Составить характеристику элементов С, О, Н, N,
- 26. Слайд 26
- 27. ХИМИЯ ЭЛЕМЕНТОВ ПЛАН ЛЕКЦИИ (ч.2) Общая характеристика
- 28. Периодическая система химических элементов
- 29. s-элементыКонфигурация валентного уровня: ns1;
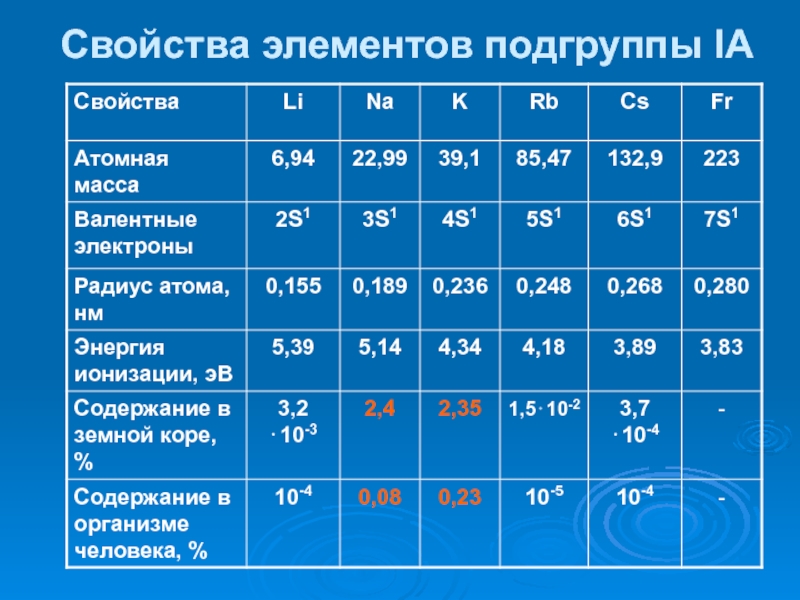
- 30. Свойства элементов подгруппы IA
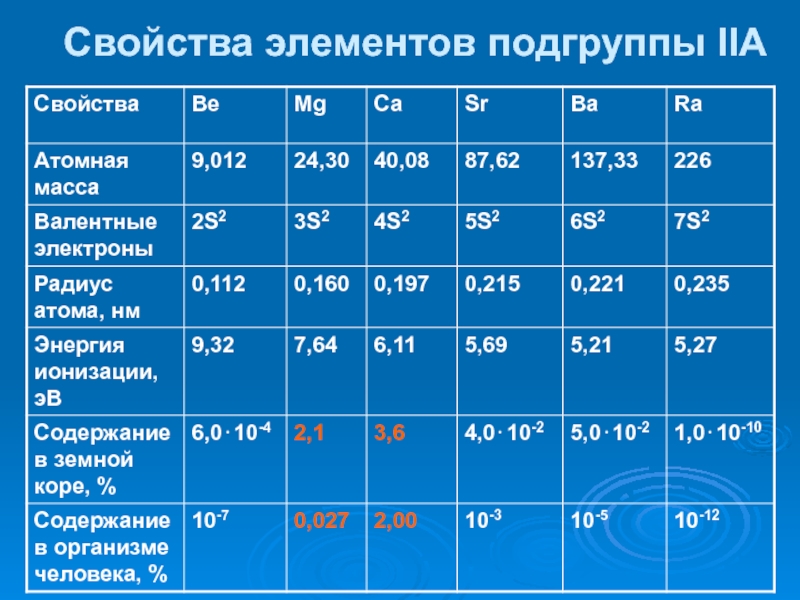
- 31. Свойства элементов подгруппы IIA
- 32. Кислотно-основные свойства Кислотные свойства не проявляются, основные
- 33. Комплексы s-элементовКристаллогидратыБура - Na2B4O710H2O, Квасцы -
- 34. Образование нерастворимых соединенийВсе соли s-элементов 1А группы
- 35. При отравлении солями бария применяют нетоксичные растворимые
- 36. Водородсимвол - H расположен в 1 группе,
- 37. Химические свойства При нагревании реагирует с кислородом, серой, хлором и др.2H2+O2 = 2H2OH2+Cl2 = 2HClH2+S = H2S
- 38. Нерастворимые соединенияВходит в состав некоторых малорастворимых кислых солей: CaHPO4, Ca(H2PO4),нерастворимых кислот SnO2·xH2O (x=1-2), H3SbO4.
- 39. d-элементыКонфигурация валентного уровня: (n-1)dansb; n- номер уровня,
- 40. d – металлы являются активными комплексообразователями. Основными
- 41. Нерастворимые соединенияКатионы d – элементов образуют много
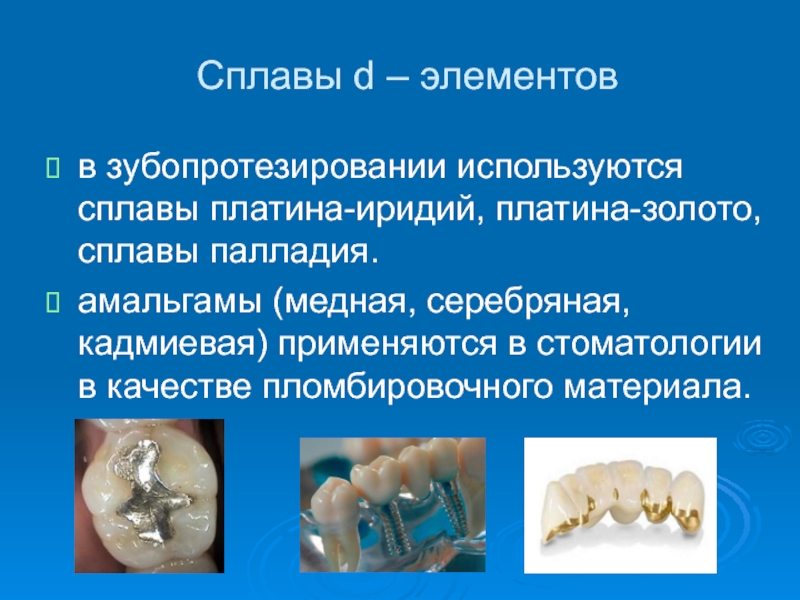
- 42. Сплавы d – элементовв зубопротезировании используются сплавы
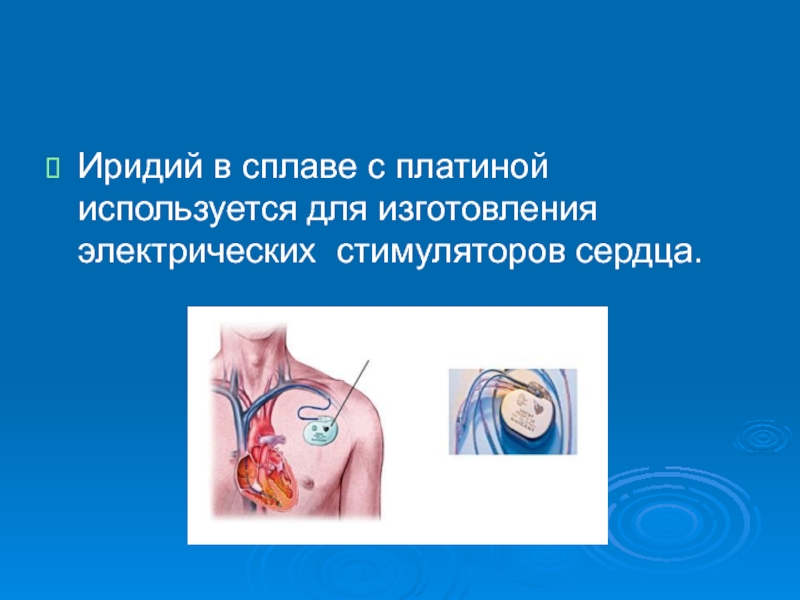
- 43. Иридий в сплаве с платиной используется для изготовления электрических стимуляторов сердца.
- 44. цинксимвол - Zn расположен во второй группе
- 45. Химические свойстваМеталл, синевато-белый, твердый, образует сплавы, например,
- 46. В соединениях степень окисления цинка +2, проявляет
- 47. Оказывает влияние на рост и развитиеПрепараты цинка:
- 48. p-элементыКонфигурация валентного уровня: ns2npa; n- номер уровня,
- 49. О-В свойстваОкислительные свойстваH20 + Ca0 = Ca+2H2-
- 50. Составить характеристику элементов С, О, Н,
- 51. План характеристики элементаПоложение в периодической системеВозможные и
- 52. 5. Кислотно-основные свойства (образование гидроксидов, кислот)6. Окислительно-восстановительные
- 53. литература1.Барковский Е.В. Введение в химию биогенных элементов.
- 54. Скачать презентанцию
Биосфера. Круговорот биогенных элементовРаздел геохимии, изучающий химические процессы в земной коре с участием живых организмов, называют биогеохимиейЧасть земной оболочки, занятая растительными и животными организмами называют биосферой
Слайды и текст этой презентации
Слайд 1ХИМИЯ БИОГЕННЫХ ЭЛЕМЕНТОВ
ПЛАН ЛЕКЦИИ (ч.1)
1. Биосфера, круговорот биогенных элементов
2. Понятие
биогенности химических элементов
Окружающая среда: химические аспекты экологииСлайд 2Биосфера. Круговорот биогенных элементов
Раздел геохимии, изучающий химические процессы в земной
коре с участием живых организмов, называют биогеохимией
Часть земной оболочки, занятая
растительными и животными организмами называют биосферойСлайд 3 Согласно
В.И. Вернадскому, живые организмы принимают активное участие в перераспределении
химических элементов в земной коре.
В.И. Вернадский
Слайд 7В живых организмах, в том числе и у человека можно
обнаружить те же элементы, которые есть в земной коре и
морской воде.Слайд 8
Среднее содержание элементов в живых организмах, земной коре, атмосфере,
гидросфере, в атмосфере Солнца и звезд выражается в кларках.
Термин
предложен А.Е. Ферсманом в 1923 г., в честь американского геохимика Ф.У. Кларка.
Академик
А.Е. Ферсман
Слайд 9Увеличение содержания элемента в организме по сравнению с окружающей средой
называют биологическим концентрированием
Слайд 10 Биогенными элементами называют элементы, необходимые для построения и жизнедеятельности различных
клеток организма.
Слайд 11Из 92 встречающихся в природе элементов 81 обнаружен в организме
человека. При этом 15 из них признаны эссенциальными, т.е. жизненно
необходимыми.Слайд 12Классификация биогенных элементов
Биотики-элементы экзогенного происхождения, имеющие способность:
- входить в состав
структур организма;
- участвовать в физиологических процессах;
- нормализовать функции организма;
-
повышать сопротивляемость организма;- быть пластическим (строительным ) материалом;
- создавать условия для протекания физиологических процессов (осматическое давление, рН среды и т.д.)
Слайд 13Классификация биогенных элементов по их функциональной роли
Органогены
Элементы электролитного фона
Микроэлементы
Ксенобиотики
Слайд 15 Элементы электролитного фона
Na, К, Ca, Mg, Сl
ионы данных
металлов составляют 99% общего содержания металлов в организме;
Слайд 17Микроэлементы
I, Cu, F, Br, Ba, Co Fe, Mn, Zn,Mo
входят в состав ферментов, витаминов, гормонов распределены между тканями
Слайд 18 Ксенобиотики
(от греч. xenos - чужой и bios - жизнь),
чужеродные для организмов соединения: промышленные загрязнения, пестициды, препараты бытовой химии,
лекарственные средства и т. п.Слайд 19Пути поступления химических элементов в организм человека
воздух
водные
организмы
растения
вода
почва
пыль
сточные
воды
животные
человек
Слайд 24ЛИТЕРАТУРА ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
1.Барковский Е.В. Введение в химию биогенных элементов.
стр. 38-43,
2. Ершов Ю.А. Общая химия. Химия биогенных элементов.
стр. 220-223, 3. Слесарев В.И. Химия. Основы химии живого. стр 284-331.
Слайд 25Составить характеристику элементов
С, О, Н, N, P, S, K,
Na, Ca, Mg, Mn, Fe, Cu, Zn, Be, I, Cr,
Pb, Cl, AlСлайд 27ХИМИЯ ЭЛЕМЕНТОВ
ПЛАН ЛЕКЦИИ (ч.2)
Общая характеристика s – элементов
Общая характеристика
d – элементов
Общая характеристика p – элементов
Слайд 29 s-элементы
Конфигурация валентного уровня: ns1;
ns2
Характерные степени окисления: +1; +2
Сильные восстановители
Образуют соединения с ионным
типом связи (Na+Cl-)исключение водород – ковалентная связь (Н2О)
Слайд 32Кислотно-основные свойства
Кислотные свойства не проявляются, основные свойства в пределах
подгруппы сверху вниз увеличиваются. Образуют гидроксиды общего состава МеОН и
Ме(ОН)2. Исключение бериллий – проявляет амфотерные свойстваСлайд 33 Комплексы s-элементов
Кристаллогидраты
Бура - Na2B4O710H2O,
Квасцы - KAl(SO4)212H2O
В водных растворах
- [Mg(NH3)4]Cl2 – хлоридтетрааммин магния
Комплексы магния с органическими лигандами:
хлорофилл, МgАТФ2-
и МgАДФ-Слайд 34Образование нерастворимых соединений
Все соли s-элементов 1А группы растворимы.
При переходе
к s-элементам 2А группы растворимость солей уменьшается, т. к. увеличения
прочность связи в молекулах. Катионы s-элементов 2А группы образуют трудно растворимые осадки хроматов (ВаCrO4), карбонатов (CaCO3), сульфатов (BaSO4), оксалатов (CaC2O4).Слайд 35
При отравлении солями бария применяют нетоксичные растворимые соли серной кислоты:
BaCl2
+ Na2SO4 = BaSO4+NaCl
BaCl2 + MgSO4 = BaSO4+MgCl2
Слайд 36Водород
символ - H
расположен в 1 группе, главной п/г, первого
перида ПС,
порядковый № 1,
атомная масса -1,008.
электронная формула -1s1,
на внешнем эн. уровне 1 е, s-элемент, неметалл, органоген.
Слайд 37Химические свойства
При нагревании реагирует с кислородом, серой, хлором и др.
2H2+O2
= 2H2O
H2+Cl2 = 2HCl
H2+S = H2S
Слайд 38Нерастворимые соединения
Входит в состав некоторых малорастворимых кислых солей: CaHPO4, Ca(H2PO4),
нерастворимых
кислот
SnO2·xH2O (x=1-2), H3SbO4.
Слайд 39d-элементы
Конфигурация валентного уровня:
(n-1)dansb; n- номер уровня, а=1-10, b=1-2
Проявляют переменную
степень окисления
Могут быть и окислителями и восстановителями
В промежуточной степени окисления
проявляют амфотерные свойства:MoO (основной оксид) - Mo2O3(амфотерный оксид) – MoO3 (кислотный оксид).
Слайд 40d – металлы являются активными комплексообразователями. Основными биолигандами являются белки,
содержащие,как правило, мягкие центры: группы –SH, -NH2, -COO-, поэтому они
с мягкими легкополяризуемыми катионами Cu2+,Co2+, Fe2+ образуют прочные комплексы, а с жесткими комплексообразователями Mn2+, Ca2+, Mg2+– неустойчивые комплексыСлайд 41Нерастворимые соединения
Катионы d – элементов образуют много нерастворимых соединений (сульфиды,
карбонаты, фосфаты, оксалаты, цианиды).
Образование в пищеварительном тракте нерастворимых солей
может быть причиной снижения всасывания микроэлементов. Слайд 42Сплавы d – элементов
в зубопротезировании используются сплавы платина-иридий, платина-золото, сплавы
палладия.
амальгамы (медная, серебряная, кадмиевая) применяются в стоматологии в качестве
пломбировочного материала.Слайд 44цинк
символ - Zn
расположен во второй группе побочной п/г, четвертого
периода,
порядковый № 30,
атомная масса -65,39.
на внешнем эн. уровне
2 е, d-элемент, металл, незаменимый микроэлемент, металл жизни.
Слайд 45Химические свойства
Металл, синевато-белый, твердый, образует сплавы, например, с медью –
латунь.
Цинк взаимодействуют с кислотами не окислителями с выделением водорода:
Zn + 2HCl = ZnCl2 + H2
Цинк образует оксид ZnO – белого цвета, не растворим в воде.
Ему соответствует гидроксид Zn(OH)2.
Оксид и гидроксид цинка проявляют амфотерные свойства.
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Гидроксид цинка растворяется в водных растворах аммиака
Zn(OH)2 + 6NH3 = [Zn(NH3)6](OH)6
Слайд 46В соединениях степень окисления цинка +2, проявляет восстановительные свойства
Склонен к
комплексообразованию, в комплексных соединениях является КО, входит в состав жизненно
важных металлоферментов (карбоангидраза), гормонов (инсулин)В организме человека больше всего цинка содержится в гипофизе, сетчатой оболочке глаза, печени, половых железах
Слайд 47Оказывает влияние на рост и развитие
Препараты цинка:
сульфат цинка –
глазные капли
хлорид цинка – антисептическое
средство, местный антисептик
оксид цинка, в
составе мазей, присыпок – противомикробное средство.Слайд 48p-элементы
Конфигурация валентного уровня:
ns2npa; n- номер уровня, а=1- 6
Способны проявляют
переменную степень окисления (S, Cl, C)
способны образовывать двухатомные молекулы Э2,
наиболее устойчивы N2, O2, F2 азот, кислород, фтор обладают способностью образовывать водородные связи
при переходе от р-элементов второго периода к последующим, увеличивается склонность к образованию комплексных соединений
Слайд 49О-В свойства
Окислительные свойства
H20 + Ca0 = Ca+2H2- – гидрид кальция
Восстановительные
свойства
Cu+2O + Н20 = Cu0 + Н2+O
Слайд 50Составить характеристику элементов
С, О, Н, N, P,
S, K, Na, Ca, Mg, Mn, Fe, Cu, Zn, Be,
B, Cr, Pb, Cl, AlСлайд 51План характеристики элемента
Положение в периодической системе
Возможные и характерные степени окисления
Физические
свойства элемента, как простого вещества (цвет, запах, растворимость в воде,
агрегат. сост.Химические свойства (взаимодействие с кислородом, водородом, галогенами, серой, кислотами, щелочами)
Слайд 525. Кислотно-основные свойства (образование гидроксидов, кислот)
6. Окислительно-восстановительные свойства
7. Склонность к
комплексообразованию
8. Медико-биологическое значение (топография, основные функции, патологические состояния, лекарственные препараты,
ВАДы содержащие данный элемент)Слайд 53литература
1.Барковский Е.В. Введение в химию биогенных элементов.
2. Ершов Ю.А.
Общая химия. Химия биогенных элементов.
3. Слесарев В.И. Химия. Основы
химии живого. 4. Саушкина Е.А., Юшкова Е.И., Королева И.П. Химические элементы. Часть 1. S-элементы
5. Скальный А.В., Рудаков И.А. Биоэлементы в медицине
6. Егоров А.С., Иванченко Н.М., Шацкая К.П. Химия внутри нас
7. Чернобельская Г.М., Чертков И.Н. Химия
























![ХИМИЯ БИОГЕННЫХ ЭЛЕМЕНТОВ
ПЛАН ЛЕКЦИИ (ч.1)
1. Биосфера, круговорот биогенных Комплексы s-элементовКристаллогидратыБура - Na2B4O710H2O, Квасцы - KAl(SO4)212H2O В водных растворах - Комплексы s-элементовКристаллогидратыБура - Na2B4O710H2O, Квасцы - KAl(SO4)212H2O В водных растворах - [Mg(NH3)4]Cl2 – хлоридтетрааммин магния Комплексы магния с](/img/tmb/3/272964/a7e7264b5ef772078277c353e3cf2d68-800x.jpg)