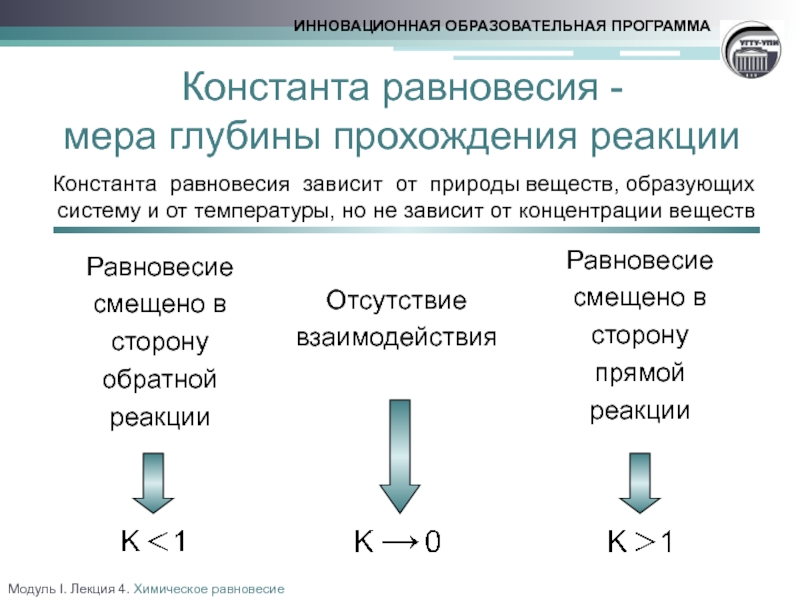
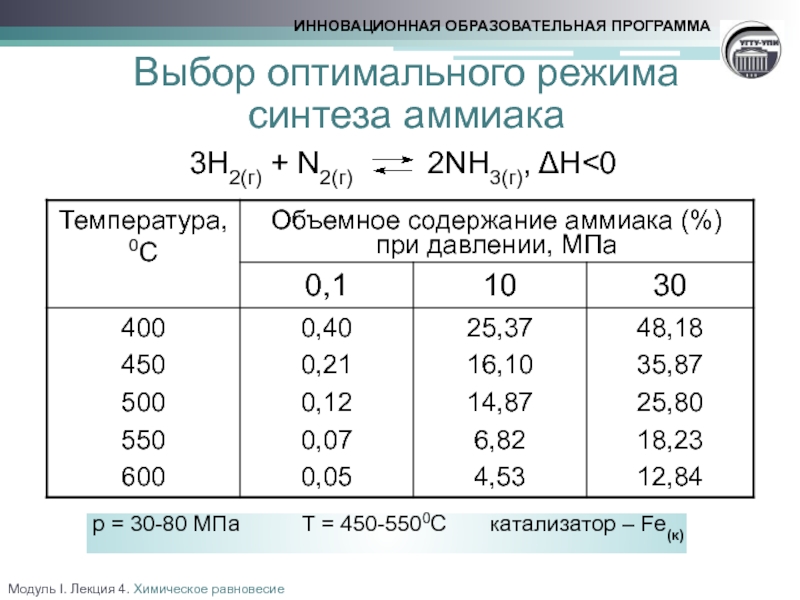
факторов на состояние химического равновесия. Принцип Ле Шателье
Влияние концентраций
(парциальных давлений)компонентов системы
Влияние давления
Влияние температуры
Влияние катализатора
Выбор оптимального технологического режима.
Кажущееся равновесие
Модуль I. Лекция 4. Химическое равновесие