Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ишеми?ческая боле?знь се?рдца
Содержание
- 1. Ишеми?ческая боле?знь се?рдца
- 2. Заболеваемость ИБС на 100 тыс. населения в
- 3. ИБС как самостоятельное заболеваниебыла выделена Всемирной Организацией
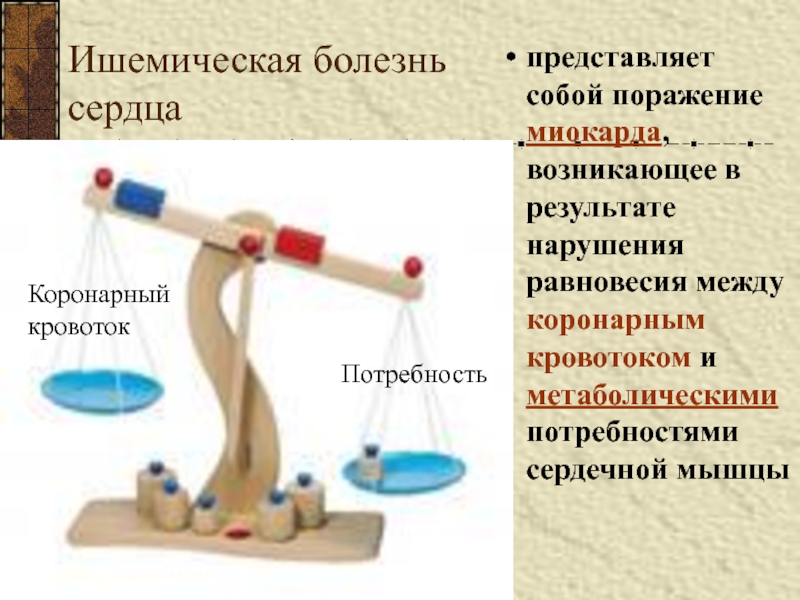
- 4. Ишемическая болезнь сердцапредставляет собой поражение миокарда, возникающее
- 5. ИБС может протекать. остро (в виде инфаркта миокарда), хронически (периодические приступы стенокардии).
- 6. Работоспособность сердца, характеристики
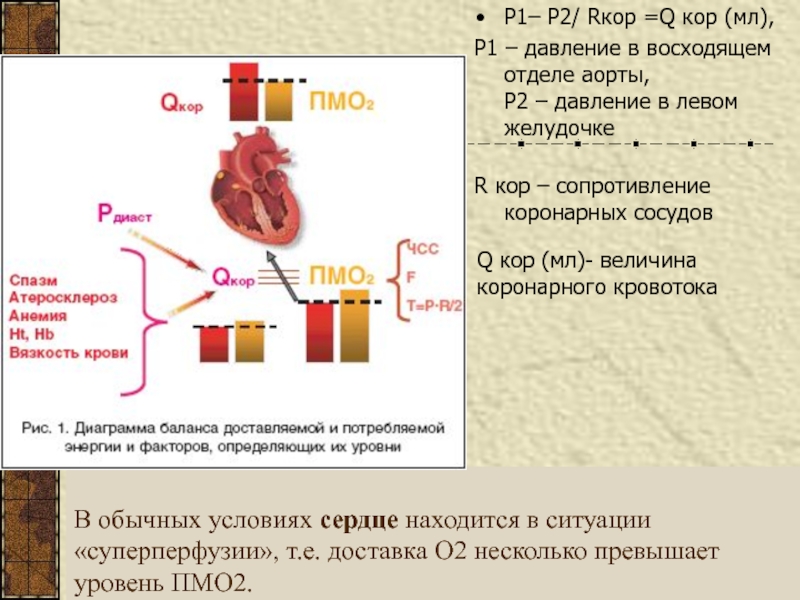
- 7. Работоспособность сердца как насоса определяется уровнем ПМО2,доставка
- 8. В обычных условиях сердце находится в ситуации
- 9. ИтакИшемическая болезнь сердца (ИБС) – несоответствие объема коронарного кровотока величине потребления миокардом кислорода (ПМО2)
- 10. Доставка О2 , следовательно энергетическое обеспечение насосной
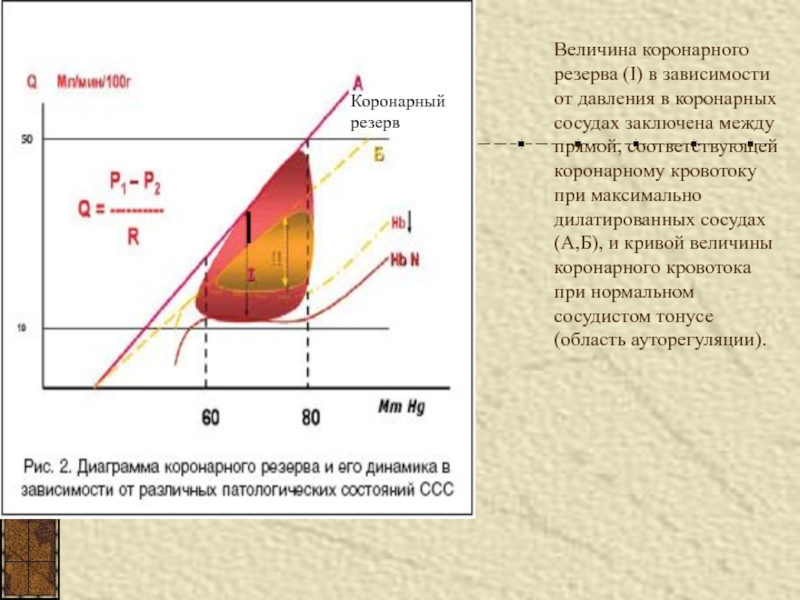
- 11. Величина коронарного резерва (I) в зависимости от
- 12. Коронарный резерв может менятьсяв сторону увеличения
- 13. При поражении коронарных артерийатеросклерозом или в результате
- 14. Снижены как область ауторегуляции, так и область
- 15. И наоборот, при увеличении массы миокарда(гипертрофия
- 16. Слайд 16
- 17. Острый коронарный синдром (ОКС) – остро возникшее
- 18. Это несоответствие может быть следствием различных причин:
- 19. 2.- спазмаполной или частичной окклюзии коронарных артерий на фоне нормальной величины ПМО2;
- 20. 2 – экстремального повышения ПМО2, превышающее величину коронарного резерва;
- 21. 3 – ограниченность коронарного резерва при физиологическом повышении уровня ПМО2
- 22. 4 – разнонаправленность измененийвеличины коронарного кровотока (уменьшение) и уровня ПМО2 (увеличение).
- 23. Итак, нарушение баланса между реальным кровоснабжением миокарда
- 24. ИБС может протекать остро (в виде инфаркта миокарда), а также хронически (периодические приступы стенокардии).
- 25. Почему сердце так чувствительно к недостатку кислорода?
- 26. Кардиомиоциты сокращаются 100 тысяч раз за сутки
- 27. Слайд 27
- 28. Почему сердце так чувствительно к недостатку кислородаСердце
- 29. Для обеспечения минутной циркуляции крови в пределах
- 30. Каждый день сердце вырабатывает достаточно энергии, чтобы
- 31. Сердце среднего взрослого человека ударяет примерно 72
- 32. Объем крови, перекачанной сердцем, может варьироваться в
- 33. За жизнь средней продолжительности сердце перекачивает около 5,7 млн литров крови
- 34. Обеспечивая максимально высокий кровоток
- 35. Кровоток в сердцеПарадоксальный кровоток в стенке левого
- 36. Особенности сердца:имея массу всего 0.5% массы тела
- 37. Соотношение капилляров и кардиомиоцитовсоставляет 1:1, что обеспечивает
- 38. Извлечение кислородаобщее количество циркулирующей через сердечную мышцу
- 39. Этому способствует необычно высокое содержание митохондрий в
- 40. Сердечная мышца извлекает из крови 70% кислорода.Коэффициент
- 41. Для сравнения:другие ткани забирают лишь 40-45% кислорода
- 42. Коронарный кровоток и его регуляция
- 43. Коронарное кровообращение зависитот величины АД в аорте.
- 44. 1. Положительный хронотропный эффект (тахикардия) уменьшает коронарный кровоток 2. Положительный инотропный эффект улучшает коронарный кровоток
- 45. Регуляция коронарного кровотокаделится на: местную нервную гуморальную Гуморальная регуляция: аналогия гуморальной регуляции сосудистого тонуса.
- 46. Местная (метаболическая) регуляция коронарного кровотокаСнижение О2 на
- 47. При нагрузке увеличиваетсяконцентрация ионов калия, водородных ионов,
- 48. Нервная регуляция за счёт вегетативной нервной системы.
- 49. Ещё одна разновидность нервных волокон, участвующих в
- 50. NO - оксид азота способствует перераспределению коронарного
- 51. Оксид азота – история открытия В 1998
- 52. Роберт Ферчготт1916-2009Луис Игнарро 1941Фрид Мурад 1936
- 53. Это открытие позволило объяснитьдействие нитроглицерина, который является
- 54. Метаболизм миокарда
- 55. Для получения энергии кардиомиоциты могут утилизировать.-свободные жирные кислоты(СЖК),-глюкозу,-молочную кислоту, -кетоновые тела, -аминокислоты
- 56. Как известно,основным субстратом для покрытия энергетических потребностей
- 57. При этом образуется 80-90% АТФ, потребляемого сердечной
- 58. Кислоты с короткой углеродной цепью (до 12
- 59. В транспорте таких кислотучаствует специальный белок карнитин.
- 60. Сердце использует в физиологических условиях 10% глюкозытранспорт
- 61. Фосфокреатинкиназная системаработает в клетке как внутриклеточная система
- 62. Креатин РРМиофибриллыИонные каналыСПРР
- 63. Запас макроэргических соединенийв миокарде практически отсутствует (его
- 64. При ишемии миокардаснижается приток крови, сопровождающийся уменьшением
- 65. Имеющихся резервов хватаетпримерно на 5 мин работы,
- 66. Общая стратегия в поведении кардиомиоцитов в пораженной
- 67. Энергетические потоки в физиологических условиях в сердце
- 68. Первые изменения происходят в митохондриях. По мере
- 69. По мере снижения содержания АТФ в клеткенаблюдается
- 70. Одной из первыхэнергоемких функций, от которой пораженный
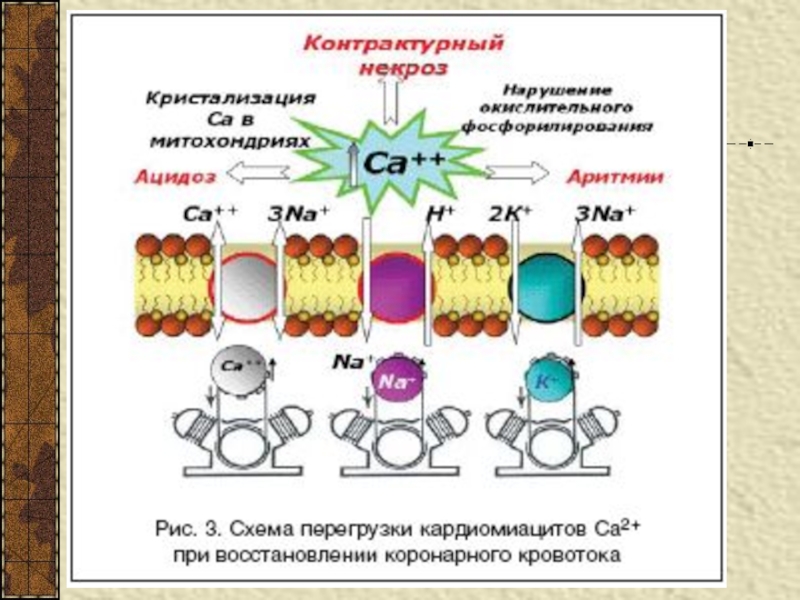
- 71. В первую очередь прекращаетсяэнергозависимый транспорт ионов Са2+
- 72. Это приводит к нарушениюпроцесса расслабления миофибрилл –
- 73. Одновременнонаблюдается снижение активности Na+,K* - АТФ-азы. Ионы
- 74. Нарушение концентраций ионов Na+ и К+ведет к
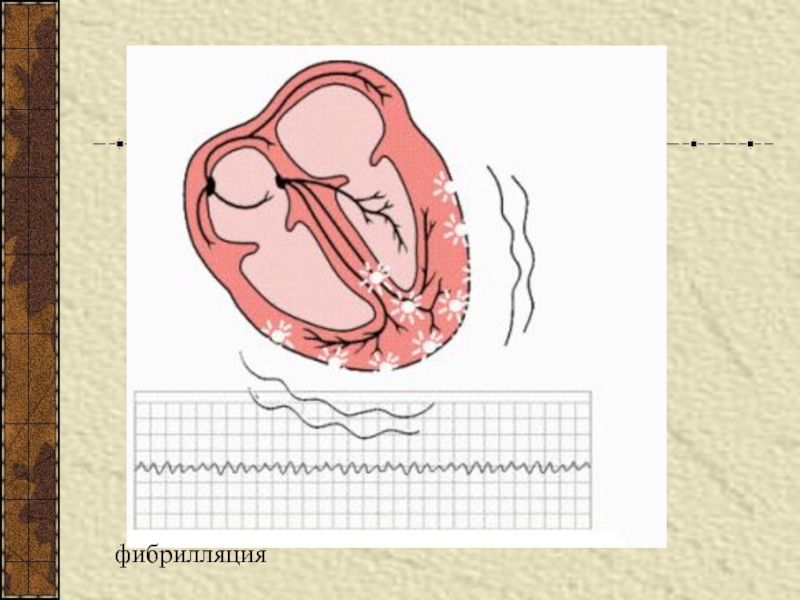
- 75. Экстрасистолия
- 76. Уменьшение активности Nа+,К+-АТФ-азысопровождается нарушением электрической стабильности сердца и способствует развитию аритмии вплоть до фибрилляции желудочка
- 77. фибрилляция
- 78. При значительных потерях ионов К+наблюдается изменение проводимости
- 79. В случае полного прекращения снабжения кровью миокардаобратимая
- 80. Ишемия –реперфузия основной вклад в повреждение миокарда
- 81. Особенно отчетливоповреждающее воздействие АФК на миокард проявляется
- 82. В клетках сердца существуют несколько потенциальных генераторов
- 83. При непродолжительной (до 15 мин) ишемии
- 84. При ишемии в тканях сердцапроисходит усиленный катаболизм
- 85. Ксантиноксидазаучаствует в последовательном окислении гипоксантина в ксантин,
- 86. Ксантиноксидза в значительных количествах содержится в клетках эндотелия, выстилающих сосудистое русло артерий и капилляров миокарда
- 87. КатехоламиныВажную роль в повреждении миокарда при хронической
- 88. Окись азотаДругой отличительной особенностью продолжительной ишемии является увеличение патологического воздействия на миокард окиси азота
- 89. При более продолжительной ишемии миокарда (не менее часа)главные генераторов АФК циркулирующие с кровью полиморфоядерные лейкоциты
- 90. Итак,При развитии ишемической болезни сердца и его
- 91. «Новые ишемические синдромы»В настоящее время на основании
- 92. Виды ишемических синдромов– «оглушенный миокард» («Myocardil Stunning»),
- 93. Впервые термин «новые ишемические синдромы», состояния миокарда
- 94. В 1996 году P.W. Hochachka с коллегамивысказали
- 95. В период кратковременной защитной реакциис точки зрения
- 96. Фаза выживания– это этап самосохранения миокарда в
- 97. ТерминыТермин «оглушенность» миокарда впервые ввели G.R. Heidricx
- 98. Итак, периоды ишемических эпизодов сопровождаютсяпоследовательно совмещенными или
- 99. Функциональная адаптация –«гибернация миокарда» - снижение сократительной функции миокарда
- 100. биологическая реабилитация– «оглушенность миокарда» (восстановление сократительной функции) или гибель миокардиальных клеток (апоптоз)
- 101. Прекондиционирование (Preconditioning)– метаболическая адаптация к ишемии после
- 102. В 1986 году в экспериментальных условиях на
- 103. Ранее считалось, что кардиопротективный эффект ишемического прекондиционированияпроявляется
- 104. Подобная, отдаленная фазатолерантности к ишемическому повреждению миокарда
- 105. Клинические ситуации«классического ишемического прекондиционирования» – синдром «разминки»
- 106. Возможно,что ишемическое прекондиционирование лежит в основе того,
- 107. Кардиопротективная роль прединфарктной стенокардииможет объясняться рядом механизмов:
- 108. Запуск ишемического прекондиционированияосуществляется взаимодействием эндогенных факторов (триггеры)
- 109. В качестве эндогенных медиаторов,запускающих активацию и синтез
- 110. Слайд 110
- 111. Формирование постишемического прекондиционирования обусловлено включением множества сложных
- 112. В 2002 году Y.P. Wang с коллегамипредставили
- 113. Другими причинамиэнергосберегающего эффекта ишемического прекондиционирования могут быть
- 114. При ишемическом прекондиционированиирегистрируется меньшее накопление недоокисленных продуктов
- 115. Было показано,что блокирование Na+/H+ – обменника сопровождается
- 116. В механизмы развития защитного эффекта ишемического прекондиционированиявовлечено
- 117. «Гибернация миокарда»– функциональная адаптация (угнетение сократительного состояния)
- 118. В 1990 г. V. Dilsizian с коллегами,используя
- 119. При этомимеются клинические симптомы проявления ишемии, но
- 120. По данным E.B. Carlson с сотрудниками, опубликованными
- 121. Минимизация обменных и энергетических процессовв мышце сердца
- 122. Оглушенность (Stunning) миокарда–дисфункция миокарда в виде нарушения
- 123. В эксперименте показано,что ишемия, длящаяся не менее
- 124. При окклюзии коронарной артериидо 1 часа восстановление
- 125. Слайд 125
- 126. Таким образом,нарушения сократительной функции кардиомиоцитов при оглушенном
- 127. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Заболеваемость ИБС на 100 тыс. населения в 2005 году по
данным ВОЗ.
жёлтый цвет — Россия;
зелёный цвет — Европейский союз;
красный
цвет — СНГ
Слайд 3ИБС как самостоятельное заболевание
была выделена Всемирной Организацией Здравоохранения (ВОЗ) лишь
в 1965 г., в связи с ростом частоты патологии и
определяющим участием в прогрессировании нарушений сердечной деятельности. В настоящее время в странах Северной Америки и Европейского региона на 1 млн населения приходится 30–40 тысяч больных ИБС.Слайд 4Ишемическая болезнь сердца
представляет собой поражение миокарда, возникающее в результате нарушения
равновесия между коронарным кровотоком и метаболическими потребностями сердечной мышцы
Коронарный
кровотокПотребность
Слайд 5ИБС может протекать
. остро (в виде инфаркта миокарда),
хронически (периодические
приступы стенокардии).
Слайд 7Работоспособность сердца как насоса определяется уровнем ПМО2,
доставка которого обеспечивается коронарным
кровотоком (Qкор).
Величина коронарного кровотока регулируется тоническим состоянием коронарных сосудов
и разницей давления в восходящем отделе аорты (устья коронарных артерий) и полости левого желудочкаСлайд 8В обычных условиях сердце находится в ситуации «суперперфузии», т.е. доставка
О2 несколько превышает уровень ПМО2.
Р1– Р2/ Rкор =Q кор (мл),
Р1
– давление в восходящем отделе аорты,
Р2 – давление в левом желудочке
R кор – сопротивление коронарных сосудов
Q кор (мл)- величина коронарного кровотока
Слайд 9Итак
Ишемическая болезнь сердца (ИБС) – несоответствие объема коронарного кровотока величине
потребления миокардом кислорода (ПМО2)
Слайд 10Доставка О2 , следовательно энергетическое обеспечение насосной функции сердца
от состояния
покоя до уровня максимальной нагрузки – происходит за счет коронарного
резерва.Коронарный резерв – способность коронарного сосудистого русла увеличить коронарный кровоток адекватно уровню потребности миокарда в О2 за счет дилятации коронарных сосудов
О2
Слайд 11Величина коронарного резерва (I) в зависимости от давления в коронарных
сосудах заключена между прямой, соответствующей коронарному кровотоку при максимально дилатированных
сосудах (А,Б), и кривой величины коронарного кровотока при нормальном сосудистом тонусе (область ауторегуляции).Коронарный резерв
Слайд 12Коронарный резерв
может меняться
в сторону увеличения или уменьшения в зависимости
от физиологических условий или патологии со стороны коронарных сосудов, физиологических
параметров крови, массы миокарда.У человека в покое коронарный кровоток в сердечной мышце составляет величину 80–100 мл/100 г/мин.
Слайд 13При поражении коронарных артерий
атеросклерозом или в результате воспалительных изменений сосудистой
стенки способность последних к максимальной дилятации значительно снижена, что влечет
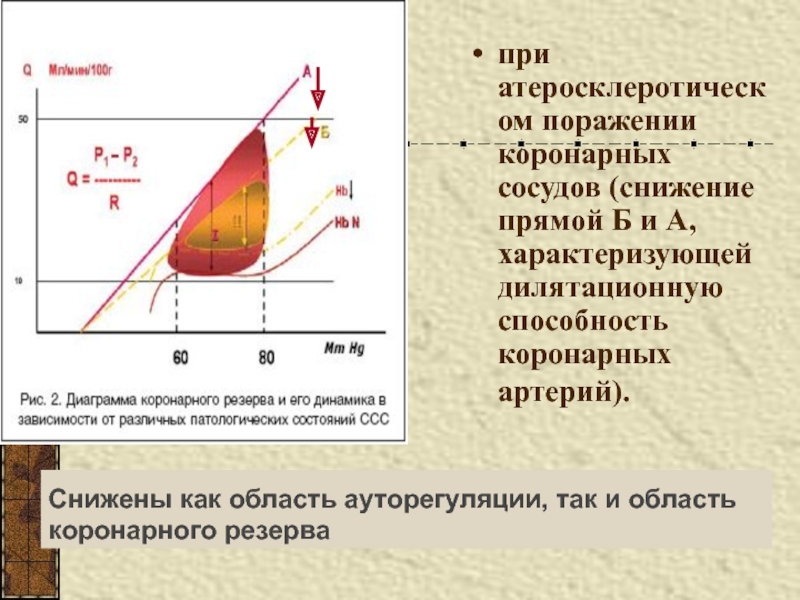
за собой снижение коронарного резерва.Слайд 14Снижены как область ауторегуляции, так и область коронарного резерва
при атеросклеротическом
поражении коронарных сосудов (снижение прямой Б и А, характеризующей дилятационную
способность коронарных артерий).Слайд 15И наоборот, при увеличении
массы миокарда
(гипертрофия левого желудочка – АГ,
гипертрофическая кардиомиопатия) или снижении уровня гемоглобина, для адекватного обеспечения ПМО2
необходимо увеличение коронарного кровотока в области ауторегуляции (перемещение кривой ауторегуляции вверх), что ведет к уменьшению коронарного резерва (II),Слайд 17Острый коронарный синдром (ОКС)
– остро возникшее несоответствие между доставкой
О2, определяемое величиной коронарного кровотока, и уровнем ПМО2.
Слайд 18Это несоответствие может быть следствием различных причин:
1 –
резкого падения коронарного кровотока в результате тромбообразования,
Слайд 192.- спазма
полной или частичной окклюзии коронарных артерий на фоне нормальной
величины ПМО2;
Слайд 224 – разнонаправленность изменений
величины коронарного кровотока (уменьшение) и уровня ПМО2
(увеличение).
Слайд 23Итак, нарушение баланса между реальным кровоснабжением миокарда и потребностями его
в кровоснабжении может произойти из-за следующий обстоятельств
1. Причины внутри
сосуда 2. Причины вне сосуда
Слайд 24ИБС может протекать остро (в виде инфаркта миокарда), а также
хронически (периодические приступы стенокардии).
Слайд 26Кардиомиоциты сокращаются 100 тысяч раз за сутки и перекачивает от
7 до 8 литров крови в минуту при систолическом артериальном
давлении 120 мм рт.ст.- совершают наиболее напряженную работу в организме, являются абсолютными рекордсменами среди клеток других тканей как по количеству вырабатываемой АТФ, так и по объему потребляемого кислорода.
Слайд 28Почему сердце так чувствительно к недостатку кислорода
Сердце выполняет функцию насоса,
который обеспечивает поступление свежей крови во все ткани организма, но
эту роль оно должно выполнять круглосуточно в условиях резко меняющихся нагрузок, получая лишь непродолжительные передышки во время каждой диастолыСлайд 29Для обеспечения минутной циркуляции крови в пределах сосудистой системы взрослого
человека
требуется 660млн эргов. На преодоление сопротивление артериального русла 550млн, на
перфузию капилляров- 60млн.эрг., на сопротивление вен - 40-50 млн.эрг Главное звено сопротивления - артериальные сосуды, сосуды активного сопротивления за счет изменения их тонуса.
Слайд 30Каждый день сердце вырабатывает достаточно энергии, чтобы проехать на машине
32 км. За всю жизнь это эквивалентно тому, чтобы съездить
на Луну и обратно
Слайд 31Сердце среднего взрослого человека ударяет примерно 72 раза в минуту,
100 000 раз в день, 3 600 000 раз в
год и 2,5 млрд раз в течение жизни.
Слайд 32Объем крови, перекачанной сердцем, может варьироваться в широком диапазоне, от
5 до 30 литров в минуту
Слайд 34
Обеспечивая максимально высокий кровоток в любом органе в период
систолы, когда артериальное давление максимально, сама сердечная мышца оказывается в
этом случае в крайне неблагоприятных условиях. В этот период кровоток в ней почти отсутствуетПочему сердце так чувствительно к недостатку кислорода
Слайд 35Кровоток в сердце
Парадоксальный кровоток в стенке левого желудочка возникает только
во время диастолы, когда сердечная мышца расслабляется и больше не
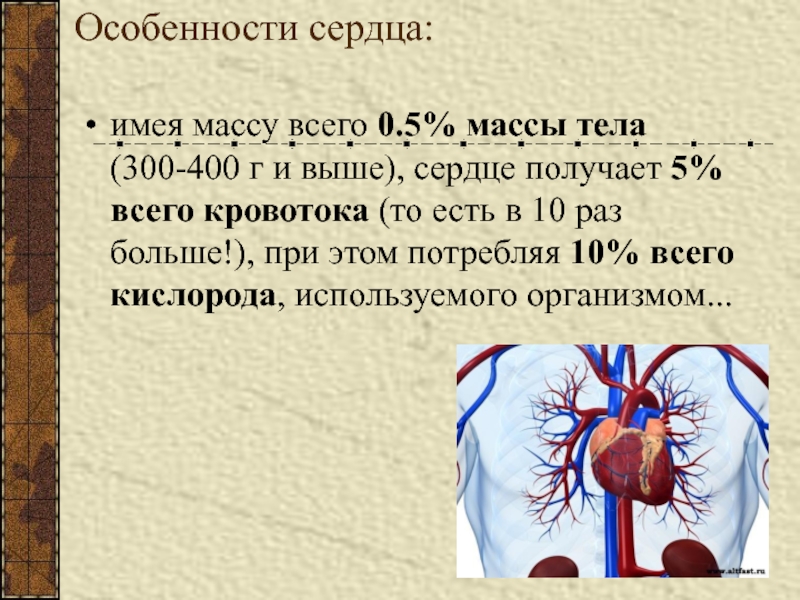
сдавливает стенки сосудов.Слайд 36Особенности сердца:
имея массу всего 0.5% массы тела (300-400 г и
выше), сердце получает 5% всего кровотока (то есть в 10
раз больше!), при этом потребляя 10% всего кислорода, используемого организмом...Слайд 37Соотношение капилляров и кардиомиоцитов
составляет 1:1, что обеспечивает поступление необходимого количества
кислорода для аэробного катаболизма, конечным продуктом которого является АТФ.
Слайд 38Извлечение кислорода
общее количество циркулирующей через сердечную мышцу крови невелико по
отношению к объему совершаемой работы, но извлечение кислорода из оксигемоглобина
оказывается максимально высоким по сравнению с другими тканямиСлайд 39Этому способствует
необычно высокое содержание митохондрий в кардиомиоцитах - 35%
от объема цитоплазмы.
расположение митохондрии и миофибрилл (Ф); ММК - межмитохондриальные
контакты; б - флуоресцирующие митохондрии в изолированном кардиомиоците, Слайд 40Сердечная мышца извлекает из крови 70% кислорода.
Коэффициент безопасности для миокарда
всего 1 – «степень уменьшения кровотока или степень повышения потребности
в кислороде, которая может быть компенсирована увеличением экстракции кислорода». Для сравнения в других тканях эта величина – 3.Слайд 41Для сравнения:
другие ткани забирают лишь 40-45% кислорода крови в покое
и 60-70% при нагрузке. Таким образом, сердце потребляет большие объемы
кислорода и “выжимает” из артериальной крови максимум. Потребление кислорода — его самое “слабое звено ”Слайд 43Коронарное кровообращение зависит
от величины АД в аорте.
Наилучшие условия для
коронарного кровообращения создаются при АД у взрослого человека, равном 110-140
мм рт.ст.Слайд 441. Положительный хронотропный эффект (тахикардия) уменьшает коронарный кровоток
2. Положительный
инотропный эффект улучшает коронарный кровоток
Слайд 45Регуляция коронарного кровотока
делится на: местную
нервную
гуморальную
Гуморальная регуляция: аналогия
гуморальной регуляции сосудистого тонуса.
Слайд 46Местная (метаболическая) регуляция коронарного кровотока
Снижение О2 на 5% приводит к
расширению коронарных сосудов.
Дилятация коронарных сосудов
наступает уже при снижении
СОДЕРЖАНИЯ кислорода на 0,01
мл в 1 мл крови
Слайд 47При нагрузке увеличивается
концентрация ионов калия, водородных ионов, молочной кислоты, двуокиси
углерода, появляются вазоактивные вещества (гистамин, кинины, простагландины группы Е), что
ведет к расширению сосудов и увеличению кровотока в миокарде.Слайд 48Нервная регуляция за счёт вегетативной нервной системы.
Ацетилхолин через М-холинорецепторы,
адреналин и норадреналин через β-адренорецепторы расширяют коронарные артерии.
Адреналин
и норадреналин через активацию α-адренорецепторов вызывают вазоконстрикторный эффект. Слайд 49Ещё одна разновидность нервных волокон, участвующих в регуляции тонуса коронарных
сосудов –
неадренергические/нехолинергические нервы (NANC – nonadrenergic-noncholinergic). Эти нервы способствуют расширению
коронарных сосудов посредством выделения таких нейромедиаторов, как ген-кальцитониновый пептид (CGRP – calcitonin gene-related peptide) и субстанция Р. CGRP вызывает эндотелий-независимую коронарную вазодилатацию Слайд 50NO - оксид азота
способствует перераспределению коронарного кровотока в пользу
мелких артерий и артериол
Способствует минимизации падения коронарного кровотока при ишемии
миокарда.оптимизирует потребление кислорода миокардом,тем самым облегчая метаболическую регуляцию коронарного кровотока.
Слайд 51Оксид азота – история открытия
В 1998 году Роберт Ферчготт
совместно с Луисом Игнарро и Феридом Мурадом были награждены Нобелевской
премией по медицине "за открытие роли оксида азота как сигнальной молекулы в регуляции сердечно-сосудистой системы". .Слайд 53Это открытие позволило объяснить
действие нитроглицерина, который является донором оксида азота.
были обнаружены: NOS-1 — нейрональная (nNOS), или мозговая (bNOS); NOS-2
— индуцибельная (iNOS), или макрофагальная (mNOS); NOS-3 — эндотелиальная (eNOS)Слайд 55Для получения энергии кардиомиоциты могут утилизировать
.
-свободные жирные кислоты
(СЖК),
-глюкозу,
-молочную кислоту,
-кетоновые
тела,
-аминокислоты
Слайд 56Как известно,
основным субстратом для покрытия энергетических потребностей миокарда в норме
являются жирные кислоты (до 80%). Последние с током крови поступают
из печени или жирового депо тканей. В матриксе митохондрий осуществляется β-окисление этих кислотСлайд 57При этом образуется 80-90% АТФ, потребляемого сердечной мышцей.
При полном окислении
одной молекулы пальмитиновой кислоты образуется 134, а стеариновой – 147
молекул АТФ, при аэробном окислении одной молекулы глюкозы образуются 32 молекулы АТФ.Но! для окисления жиров нужно больше О2, чем для окисления глюкозы.
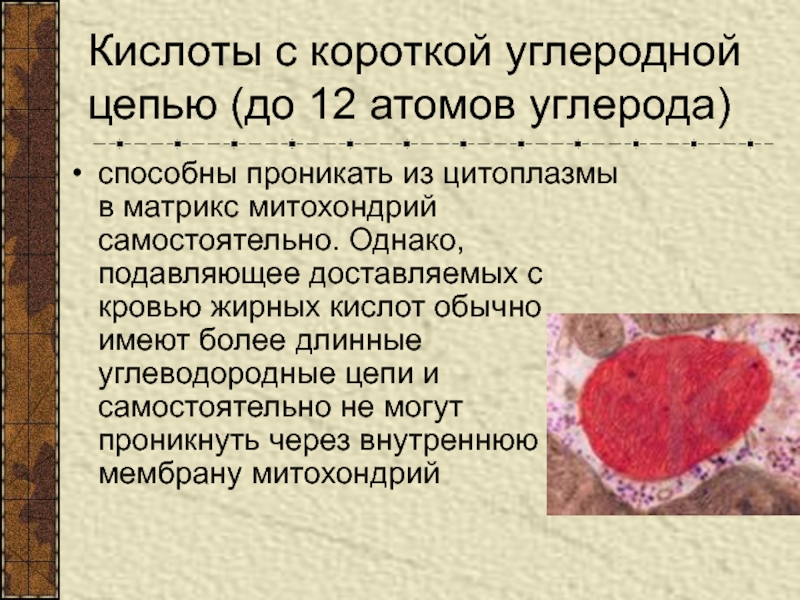
Слайд 58Кислоты с короткой углеродной цепью (до 12 атомов углерода)
способны проникать
из цитоплазмы в матрикс митохондрий самостоятельно. Однако, подавляющее доставляемых с
кровью жирных кислот обычно имеют более длинные углеводородные цепи и самостоятельно не могут проникнуть через внутреннюю мембрану митохондрийСлайд 59В транспорте таких кислот
участвует специальный белок карнитин. В межмембранном пространстве
митохондрий с участием АТФ он образует ацилкарнитин, который легко проходит
через внутреннюю мембрану митохондрий, а в матриксе превращается в ацил-КоА, который в результате ряда превращений трансформируется в ацетил-КоА - субстрат для цикла трикарбоновых кислотСлайд 60Сердце использует в физиологических условиях 10% глюкозы
транспорт глюкозы в кардиомиоцитах
осуществляется белками-переносчиками GLUT1 и GLUT4, транслокация которых стимулируется под действием
инсулина, ускоряется в условиях гипоксии и при увеличении совершаемой сердцем работы;Слайд 61Фосфокреатинкиназная система
работает в клетке как внутриклеточная система передачи энергии от
тех мест, где энергия запасается в виде АТФ (митохондрия и
реакции гликолиза в цитоплазме) к тем местам, где требуется энергия (миофибриллы в случае мышечного сокращения, саркоплазматический ретикулyм, для накачивания ионов кальция и во многих других местах).Слайд 63Запас макроэргических соединений
в миокарде практически отсутствует
(его достаточно лишь на
5—10 сокращений сердца), следовательно их образование полностью зависит от поступления
субстратов и кислорода с кровотоком.Слайд 64При ишемии миокарда
снижается приток крови, сопровождающийся уменьшением поступления как кислорода,
так и субстратов. В этом случае деятельность сердца поддерживается в
первую очередь запасов креатинфосфата.Слайд 65Имеющихся резервов хватает
примерно на 5 мин работы, в течение которых
происходит несколько этапов изменений функциональной и биохимической активности кардиомиоцитов, после
чего наступает их необратимое повреждение.Слайд 66Общая стратегия в поведении кардиомиоцитов в пораженной области миокарда
сводится
к поэтапному отключению ряда энергопотребляющих систем с цепью мобилизации остающихся
энергетических ресурсов на выполнение наиболее жизненно важных функций.Слайд 67Энергетические потоки в физиологических условиях в сердце
распределены следующим образом:
70 % - используется на сократительную функцию;
20 %
- на работу ионных каналов 10 % - на структурный синтез.
Слайд 68Первые изменения происходят в митохондриях
. По мере снижения содержания кислорода
для сохранения энергетического гомеостаза в клетке на первом этапе наблюдается
активация НАДН-зависимого окисления субстрата. Это проявляется в первую очередь в переходе митохондрий из состояния покоя (МС4) в состояние активного дыхания (МСЗ). Процесс стимулируется за счет увеличения содержания АДФ в клетке.Слайд 69По мере снижения содержания АТФ в клетке
наблюдается уменьшение АТФ -
зависимых реакций, в том числе синтеза ацилкарнитина, что нарушает доставку
жирных кислот через внутреннюю мембрану митохондрий. Для исключения субстратного дефицита в клетке происходит переключение энергетического потока с жирных кислот на глюкозу.Слайд 70Одной из первых
энергоемких функций, от которой пораженный ишемией участок миокарда
вынужден отказаться, является сократительная функция. В случае продолжающегося роста дефицита
макроэргов после прекращения мышечных сокращений происходит ограничение транспортных процессов.Слайд 71В первую очередь прекращается
энергозависимый транспорт ионов Са2+ внутрь митохондрий. Так
как в цитозоле митохондрий содержание данного иона в 1000 раз
больше, чем в цитоплазме, при снижении активности Са2+-АТФазы наблюдается самопроизвольный обратный поток ионов Са2+ из митохондрий в цитоплазму. Аналогичный поток ионов Са2+ наблюдается из другого депо ионов-саркоплазматического ретикулюмаСлайд 72Это приводит к нарушению
процесса расслабления миофибрилл – формируется «неполная диастола».
Более того, накопление ионов Са2+ в цитоплазме сопровождается активацией ряда
деструктивных Са2+ - зависимых ферментов, в том числе протеаз, липаз, фосфолипаз, что ведет к развитию дегенеративных изменений в кардиомиоцитахСлайд 73Одновременно
наблюдается снижение активности Na+,K* - АТФ-азы. Ионы Na+ устремляются внутрь
клетки, а ионы К+ вытекают из цитоплазмы в межклеточное пространство.
С увеличением в цитоплазме содержания ионов Na+ no законам осмоса в клетку устремляются потоки воды. Это ведет к отеку клеток.Слайд 74Нарушение концентраций ионов Na+ и К+
ведет к изменению биоэлектрической активности
клеток, уменьшению потенциала покоя, скорости и длительности потенциала действия. Нарушение
мембранного потенциала приводит к экстрасистолии.Слайд 76Уменьшение активности Nа+,К+-АТФ-азы
сопровождается нарушением электрической стабильности сердца и способствует развитию
аритмии вплоть до фибрилляции желудочка
Слайд 78При значительных потерях ионов К+
наблюдается изменение проводимости нервных импульсов, что
легко фиксируется по подъему сегмента ST на электрокардиограмме.
Слайд 79В случае полного прекращения снабжения кровью миокарда
обратимая ишемия может продолжаться
не более 5 мин, после чего наступает фаза необратимых изменений.
Это в первую очередь проявляется в появлении в крови клеточных ферментов, что свидетельствует о значительных повреждениях клеточных мембран.Слайд 80Ишемия –реперфузия
основной вклад в повреждение миокарда при ишемии, а
особенно в постишемический период, когда восстанавливается кровоток в ишемизированном сердце,
вносит нарушение баланса между прооксидантными системами и системой антиоксидантной защиты,Слайд 81Особенно отчетливо
повреждающее воздействие АФК на миокард проявляется в период реперфузии,
когда в ткани, находящийся в состоянии гипоксии, начинает поступать свежая
кровь, обогащенная кислородом.Слайд 82В клетках сердца существуют несколько потенциальных генераторов АФК,
однако, удельный
вес вклада каждого из них в суммарную продукцию свободных радикалов
зависит от условий развития ишемии и последующей реперфузии.Слайд 83При непродолжительной
(до 15 мин) ишемии
основная доля свободных радикалов
образуется за счет аномально функционирующих ферментов дыхательной цепи, ускоренного метаболизма
адениннуклеотидов и реакции Габера-Вейса.Слайд 84При ишемии в тканях сердца
происходит усиленный катаболизм АТФ и появляется
избыток гипоксантина и ксантина - субстратов ксантиноксидазной реакции.
Слайд 85Ксантиноксидаза
участвует в последовательном окислении гипоксантина в ксантин, a затем в
мочевую кислоту с участием кислорода в качестве окислителя. Конечными продуктами,
наряду с мочевой кислотой, являются О2- и Н2О2.Слайд 86Ксантиноксидза
в значительных количествах содержится в клетках эндотелия, выстилающих сосудистое
русло артерий и капилляров миокарда
Слайд 87Катехоламины
Важную роль в повреждении миокарда при хронической сердечной недостаточности отводят
чрезмерной активации нейроэндокринной системы и увеличению циркулирующих катехоламинов в крови.
И участием последних в процессе циклической генерации ион-радикалов О2 -0.Слайд 88Окись азота
Другой отличительной особенностью продолжительной ишемии является увеличение патологического воздействия
на миокард окиси азота
Слайд 89При более продолжительной ишемии миокарда (не менее часа)
главные генераторов АФК
циркулирующие с кровью полиморфоядерные лейкоциты
Слайд 90Итак,
При развитии ишемической болезни сердца и его последующей реперфузии кардиомиоциты
испытывают 2 стрессовые ситуаций, связанные вначале с гипоксией тканей и
многоуровневой перестройкой метаболизма в условиях энергетического дефицита, а затем при реперфузии ткани, адаптированной к гипоксии, клетки оказываются в состояний окислительного стресса.Слайд 91«Новые ишемические синдромы»
В настоящее время на основании данных, полученных при
патофизиологических исследованиях в эксперименте и клинических наблюдениях с позиций клеточных
– субклеточных и молекулярных механизмов функционирования кардиомиоцитов, сформулировано современное понимание «новых ишемических синдромов»Слайд 92Виды ишемических синдромов
– «оглушенный миокард» («Myocardil Stunning»),
«гибернирующий – уснувший
миокард» («Myocardil Hybernatin»),
«прекондиционирование» («Preconditioning»),
«прекондиционирование – второе окно защиты» («Second
Window Of Protection – SWOP»). Слайд 93Впервые термин «новые ишемические синдромы»,
состояния миокарда после различных эпизодов
ишемии, отображающих адаптивно–дезадаптивные изменения метаболизма и сократительного состояния кардиомиоцитов, предложил
южноафриканский кардиолог L.H. Opie в 1996 году на рабочей встрече Международного Кардиологического Общества в Кейптауне под эгидой Совета по молекулярной и клеточной кардиологииСлайд 94В 1996 году P.W. Hochachka с коллегами
высказали предположение, что жизнеспособность
миокарда в условиях ишемии обеспечивается адаптацией к гипоксии, которую можно
разделить на два этапа в зависимости от длительности ишемической «атаки»: кратковременную защитную реакцию и фазу «выживания».Слайд 95В период кратковременной защитной реакции
с точки зрения современного понимания патофизиологических
процессов метаболизм кардиомиоциотов переключается на анаэробный гликолиз
Слайд 96Фаза выживания
– это этап самосохранения миокарда в условиях длительной ишемии.
К наиболее значимым приспособительным реакциям миокарда относятся так называемые «новые
ишемические синдромы»: гибернация, прекондиционирование, прекондиционирование – второе окно защиты, оглушенность,.Слайд 97Термины
Термин «оглушенность» миокарда впервые ввели G.R. Heidricx с соавт. в
1975 году; понятие «гибернация» в 1985 году описал S.H. Rahimatoola;
«прекондиционирование» C.E. Murry c cотрудниками предложили в 1986 году, а «прекондиционирование – второе окно» – одновременно M.S. Marber c cотрудниками и T. Kuzuya с соавт. в 1993 годуСлайд 98Итак, периоды ишемических эпизодов сопровождаются
последовательно совмещенными или разнесенными по времени
адаптационно – дезадаптационными этапами: метаболическая адаптация – «ишемическое прекондиционирование» (реализация
различных путей внутриклеточного метаболизма),).Слайд 100биологическая реабилитация
– «оглушенность миокарда» (восстановление сократительной функции) или гибель миокардиальных
клеток (апоптоз)
Слайд 101Прекондиционирование (Preconditioning)
– метаболическая адаптация к ишемии после повторяющихся кратковременных эпизодов
снижения коронарного кровотока, проявляющаяся повышенной устойчивостью мышцы сердца к последующей,
более длительной ишемической атаке.Слайд 102В 1986 году в экспериментальных условиях на собаках C.E. Murry
с сотрудниками
убедительно продемонстрировали, что повторные короткие эпизоды региональной ишемии миокарда
адаптируют сердечную мышцу к следующим эпизодам ишемических атак, что документировано сохранностью внутриклеточного АТФ на достаточном уровне для функционирования кардиомиоцита с отсутствием некротического повреждения клеток. Слайд 103Ранее считалось, что кардиопротективный эффект ишемического прекондиционирования
проявляется непосредственно после кратковременных
эпизодов ишемия-реперфузия, а затем теряет свои защитные свойства через 1–2
часа. В 1994 году D. Yellon в соавторстве с G.F. Baxter показали, что феномен «постишемического прекондиционирования» может вновь развиться через 12–24 часа с длительностью до 72 часов, но в ослабленной форме.Слайд 104Подобная, отдаленная фаза
толерантности к ишемическому повреждению миокарда была определена авторами
как «второе окно защиты» («Second Window Of Protection – SWOP»),
в отличие от раннего «классического ишемического прекондиционирования».Слайд 105Клинические ситуации
«классического ишемического прекондиционирования» – синдром «разминки» (Warm–up Phenomen) или
«перехаживания» (Walk– Through–Angina), которые проявляются в постепенном уменьшении частоты и
интенсивности ангинозных приступов в течение продолжающейся умеренной физической или бытовой нагрузки.Слайд 106Возможно,
что ишемическое прекондиционирование лежит в основе того, что у пациентов
с прединфарктной стенокардией отмечается тенденция к более благоприятному прогнозу по
сравнению с теми больными, у которых ИМ развился на фоне предшествующего полного благополучия.Слайд 107Кардиопротективная роль прединфарктной стенокардии
может объясняться рядом механизмов:
1 – защитой
позднего постишемического прекондиционирования;
2 – раскрытие коллатерального кровообращения;
3 –
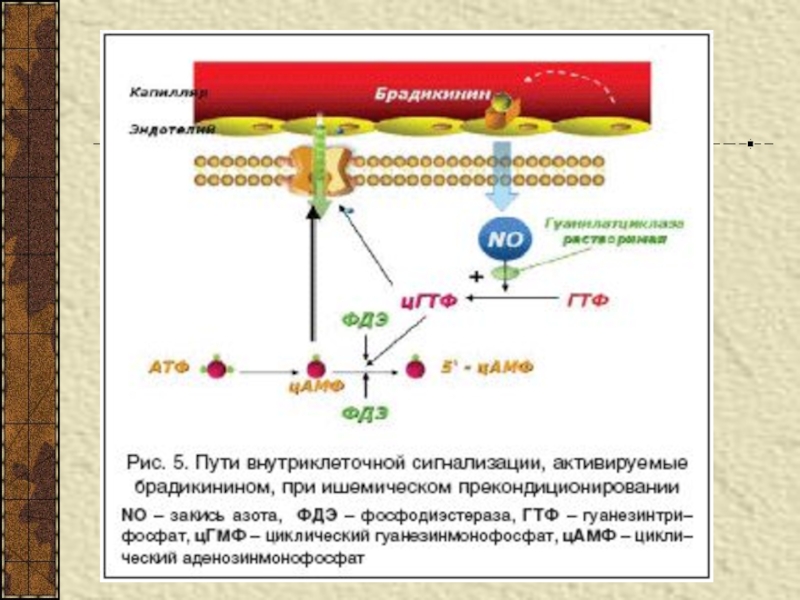
повышение чувствительности к тромболизису Слайд 108Запуск ишемического прекондиционирования
осуществляется взаимодействием эндогенных факторов (триггеры) с их специфическими
рецепторами. Триггеры – биологические активные вещества, выделяющиеся из кардиомиоцитов при
ишемических эпизодах и реперфузии (аденозин, брадикинин, простаноиды, катехоламины, эндорфины, NO, АФК и др.), реализуют свои эффекты разными путями внутриклеточной сигнализацииСлайд 109В качестве эндогенных медиаторов,
запускающих активацию и синтез iNOS, могут принимать
участие аденозин, ацетилхолин, брадикинин, липополисахариды, опиоды, свободные радикалы, серотонин.
Слайд 111Формирование постишемического прекондиционирования обусловлено включением множества сложных механизмов
адаптации, из которых
в настоящее время более изучены : А – снижение накопления
кардиомиоцитами продуктов распада, таких как ионы Н+, NH3, лактат, неорганические фосфаты, аденозин;Б – повышение активности или синтеза ферментных систем, оказывающих кардиопротективный эффект от ишемического повреждения.
Слайд 112В 2002 году Y.P. Wang с коллегами
представили убедительные данные, свидетельствующие
о кардиопотективном действии в фазе позднего прекондиционирования повышении продукции NO
посредством стимулирования выработки ее синтазы (Inducible Syntase NO – iNOS).Слайд 113Другими причинами
энергосберегающего эффекта ишемического прекондиционирования могут быть снижение активности ферментов,
катализирующих АТФ–зависимые метаболические реакции, меньшее использование АТФ миофибриллярной АТФ-азой ,
снижение активности сарколеммальной Na+, К+–АТФазы, Са++–АТФ-азы саркоплазматического ретикулума.Слайд 114При ишемическом прекондиционировании
регистрируется меньшее накопление недоокисленных продуктов гликолиза (пируватов, фосфоглицератов,
лактатов и др.), что способствует сохранению осмолярности и предупреждает внутриклеточный
отек кардиомиоцитов.Новой стратегией в фармакологической защите сердца от ишемических и реперфузионных повреждений является использование ингибиторов Na+/H+–обменника в сарколемме.