Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Катионы V Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ аналитической
Содержание
- 1. Катионы V Fe 2+, Fe 3+, Mg 2+, Mn 2+, Sb (III), Sb (V), Bi 3+ аналитической
- 2. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 3. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 4. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 5. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 6. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 7. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 8. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 9. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 10. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 11. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 12. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 13. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 14. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 15. Катионы V аналитической группы Fe2+, Fe3+, Mg2+,
- 16. Слайд 16
- 17. Скачать презентанцию
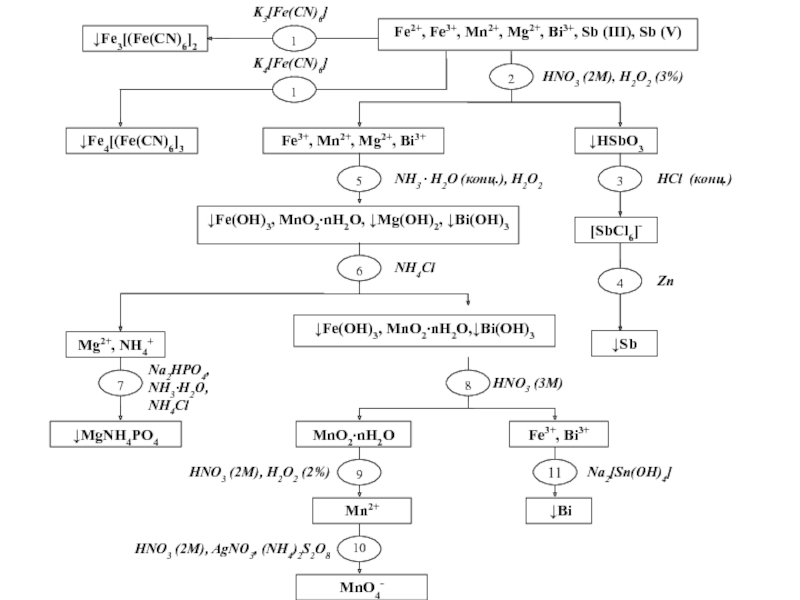
Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Групповой реагент концентрированный раствор аммиака (NH3H2O), который осаждает их в виде гидроксидов, нерастворимых в избытке реагента:FeCl2 + 2NH3H2O
Слайды и текст этой презентации
Слайд 2Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Групповой реагент концентрированный раствор аммиака (NH3H2O), который
осаждает их в виде гидроксидов, нерастворимых в избытке реагента:FeCl2 + 2NH3H2O → Fe(OH)2 + 2NH4Cl
FeCl3 + 3NH3H2O → Fe(OH)3 + 3NH4Cl
MgCl2 + 2NH3H2O → Mg(OH)2 + 2NH4Cl
MnCl2 + 2NH3H2O → Mn(OH)2 + 2NH4Cl
Слайд 3Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Na[SbCl6] + 5NH3H2O
HSbO3↓ + NaCl +
5NH4Cl + 2H2ONa3[SbCl6] + 3NH3H2O
Sb(OH)3 + 3NaCl + 3NH4Cl
Катионы висмута при действии раствора аммиака образуют белый осадок основной соли, состав которой изменяется в зависимости от концентрации раствора, температуры:
BiCl3 + 2NH3H2O Bi(OH)2Cl + 2NH4Cl
Bi(OH)2Cl BiOCl + H2O
Слайд 4Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Действие растворов натрия гидроксида или калия гидроксида
С
растворами NaOH или KOH катионы магния, марганца, висмута и сурьмы образуют белые аморфные осадки гидроксидов, зеленые – гидроксидов железа (II) и красно-бурые – гидроксидов железа (III):MgCl2 + 2NаOH Mg(OH)22NаCl
MnCl2 + 2NаOHMn(OH)22NаCl
FeCl2 + 2NаOHFe(OH)22NаCl
FeCl3 + 3NаOHFe(OH)3NаCl
BiCl3 + 3NаOН Bi(OH)3 + 3NаCl
Слайд 5Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Действие растворов натрия гидроксида или калия гидроксида
Na[SbCl6]
+ 5NаOНSb(OН)5 + 6NaClSb(OH)5 HSbO3 +2H2O
Na3[SbCl6] + 3NаOН Sb(OH)3 + 6NaCl
Все гидроксиды катионов V аналитической группы растворяются в кислотах, например:
Fe(OH)3 + 3HCl FeCl3 + 3H2O
Слайд 6Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Действие растворов натрия гидроксида или калия гидроксида
Гидроксиды
Sb (III) и Sb (V) за счет амфотерных свойств растворяются в избытке щелочей:Sb(OH)3 + 3NаOH Nа3[Sb(OH)6]
Sb(OH)5 + NаOH Nа[Sb(OH)6]
Гидроксиды магния, марганца (II) и железа (II) растворимы также в насыщенном растворе NH4Cl, например:
Mg(OH)2 +2NH4Cl MgCl2 + 2NH3H2O
Слайд 7Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Реакция ионов магния
Действие раствора натрия гидрофосфата Na2HPO4
Катионы
магния образуют с раствором натрия гидрофосфата в присутствии аммиачного буферного раствора белый кристаллический осадок:MgCl2 + Nа2HPO4 + NH3H2O
MgNH4PO4 +2NаCl + H2O
Эту реакцию можно выполнять как микрокристаллоскопическую.
Слайд 8Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Реакция ионов железа (II)
Действие раствора калия гексацианоферрата
(III) K3[Fe(CN)6]Катионы железа (II) образуют с раствором калия
гексацианоферрата (III) осадок “турнбулевой сини” синего цвета:
3FeCl2+2К3[Fe(CN)6]
Fe3[Fe(CN6)]2КCl
Осадок разлагается в щелочах:
Fe3[Fe(CN)6]2 + 6КOH
3Fe(OH)2 + 2К3[Fe(CN)6]
Слайд 9Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Реакции ионов железа (III)
Действие растворов калия гексацианоферрата
(II) K4[Fe(CN)6]Катионы железа (III) образуют с раствором калия
гексацианоферрата (II) темно-синий осадок “берлинской лазури”:
4FeCl3 + 3К4[Fe(CN)6]
Fe4[Fe(CN6)]3КCl
В щелочах осадок разлагается:
Fe4[Fe(CN)6]3 + 12КOH
4Fe(OH)3 + 3К4[Fe(CN)6]
Слайд 10Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Реакции ионов железа (III)
Действие тиоционат-ионов
Катионы железа
(III) образуют с тиоцианат-ионами комплексныесоединения железа (III), которые окрашивают раствор в красный
цвет:
FeCl3 + 3NH4NCS [Fe(NCS)3] + 3NH4Cl
Слайд 11Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
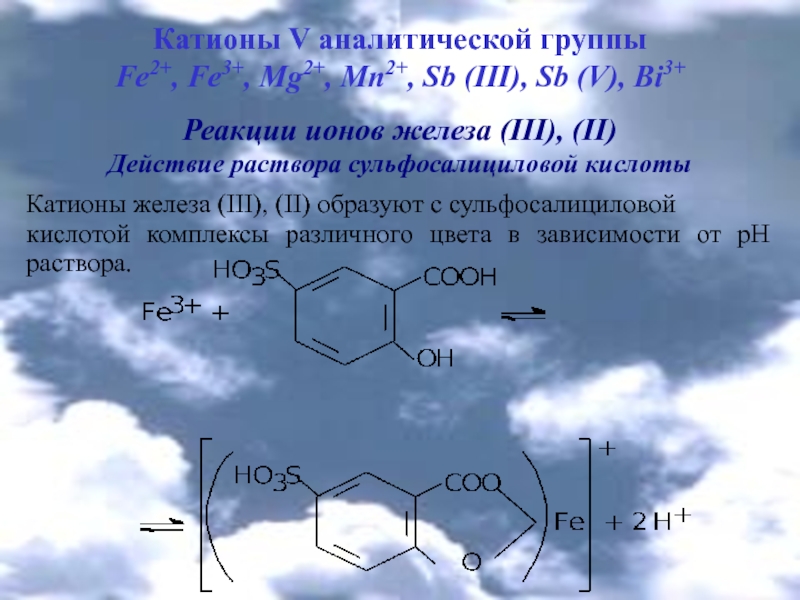
Реакции ионов железа (ІІІ), (ІІ)
Действие раствора сульфосалициловой
кислоты Катионы железа (III), (ІІ) образуют с сульфосалициловой
кислотой комплексы различного цвета в зависимости от рН раствора.
Слайд 12Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
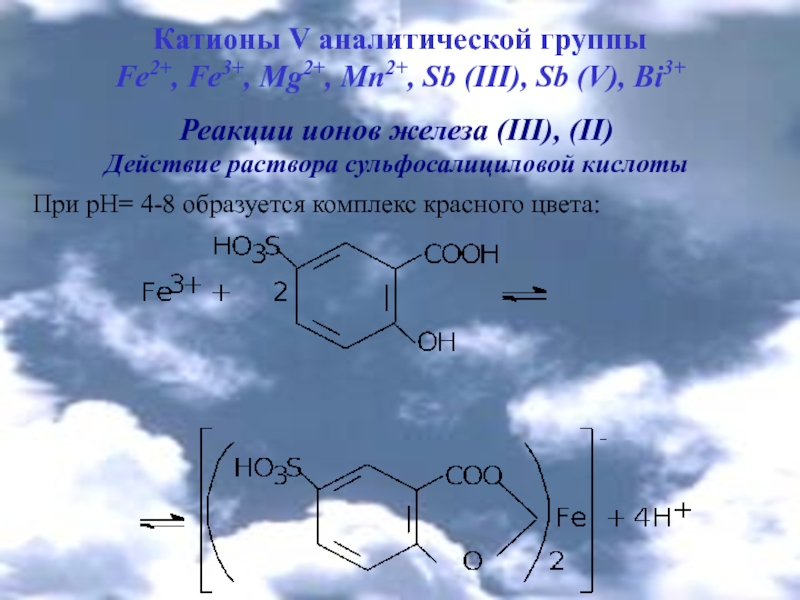
Реакции ионов железа (ІІІ), (ІІ)
Действие раствора сульфосалициловой
кислоты При рН= 4-8 образуется комплекс красного цвета:
Слайд 13Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
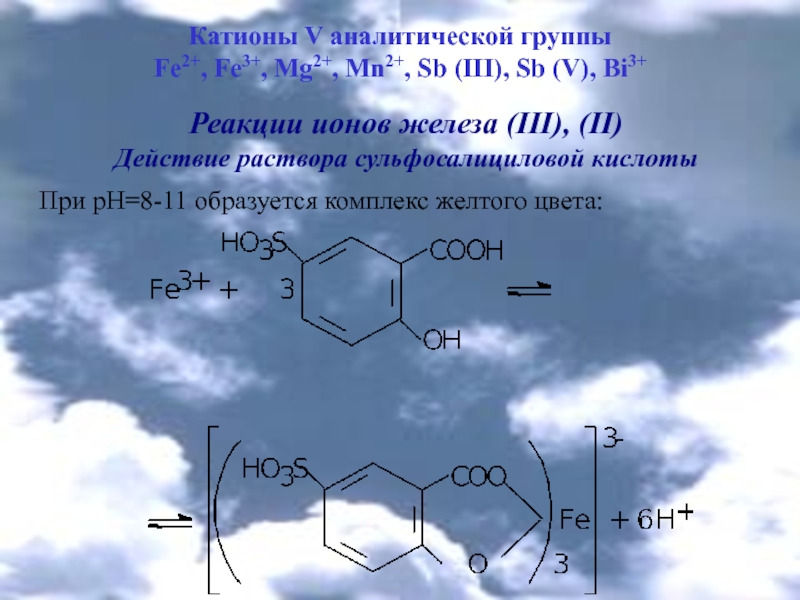
Реакции ионов железа (ІІІ), (ІІ)
Действие раствора сульфосалициловой
кислотыПри рН=8-11 образуется комплекс желтого цвета:
Слайд 14Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Реакции ионов марганца
Действие персульфата аммония (NH4)2S2O8
Сильные окислители,
например, персульфат аммония (NH4)2S2O8,окисляют Mn (II) до ионов MnO4-, которые окрашивают раствор
в красный цвет:
2MnSO4 + 5(NH4)2S2O8 + 8H2O
2НMnO4 + 5(NH4)2SO4 + 7H2SO4
Слайд 15Катионы V аналитической группы
Fe2+, Fe3+, Mg2+, Mn2+, Sb (III),
Sb (V), Bi3+
Реакции ионов висмута
Действие натрия гексагидроксостанита (ІІ) Na2[Sn(OH)4]
Гексагидроксостанит
(ІІ)-ионы восстанавливают ионы Bi3+ до металлического висмута черного цвета:
SnCl2 + 4NaOH Na2[Sn(OH)4] + 2NaCl
Bi(NO3)3 + 3NaOH Bi(OH)3 + 3NaNO3
2Bi(OH)3 + 3Na2[Sn(OH)4]
2Bi + 3Na2[Sn(OH)6]


![Катионы V
Fe 2+, Fe 3+, Mg 2+, Mn 2+,
Sb (III), Sb (V), Bi 3+ аналитической Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Na[SbCl6] + 5NH3H2O HSbO3↓](/img/thumbs/3564e5a642c939382a3d8bc2c2712673-800x.jpg)












![Согласные звуки [р], [р’] - Буквы Р р](/img/thumbs/3aaadc8ad1f65f8b5d2fddf400dbe593-800x.jpg)















