Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация неорганических веществ
Содержание
- 1. Классификация неорганических веществ
- 2. Цели урокаОбобщить и закрепить знания о классификации
- 3. Основные понятияВещества простые- металлы, неметаллы; сложные- оксиды,
- 4. ОборудованиеКоллекция «Металлы», «Неметаллы» - сера, графит;
- 5. План урокаКлассификация веществ.Определение простых и сложных веществ.Классификация
- 6. Классификация веществ
- 7. Химические элементы
- 8. Химические соединения
- 9. Неорганические вещества
- 10. Классификация простых веществВсе простые вещества на основании
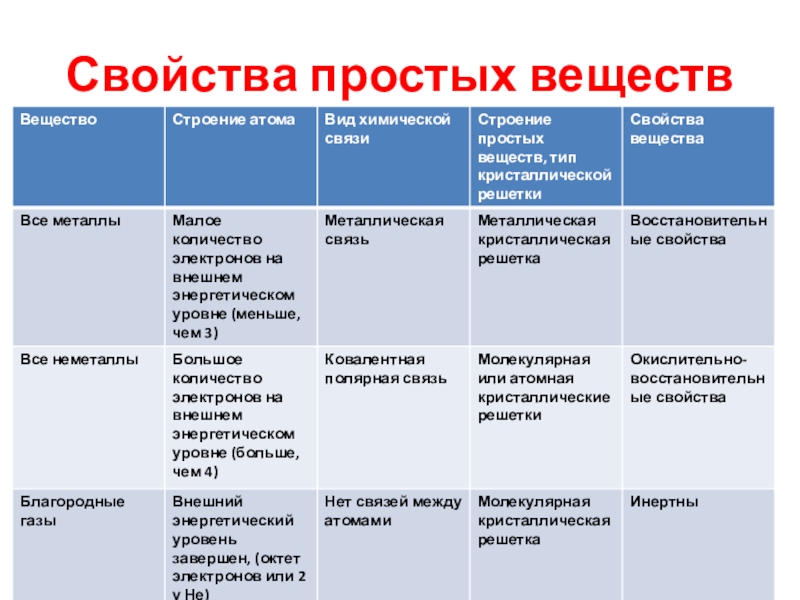
- 11. Свойства простых веществ
- 12. Слайд 12
- 13. План характеристики сложного веществаОпределение классаКлассификации; название.Признаки (химическая связь) строения вещества.Физические свойства.Значение вещества в повседневной жизни.
- 14. Оксиды - ЭмOn Это сложные вещества,
- 15. Слайд 15
- 16. По свойствам
- 17. Солеобразующие оксидыОбразованы переходными элементамиZnO,Al2O3Zn(OH)2,Al(OH)3
- 18. Несколько степеней окисленияВ названии оксида обязательно указывается
- 19. Несолеобразующие оксиды (безразличные)СО – оксид углерода (II)NO - оксид азота (II)N2O - оксид азота (I)
- 20. Химическая связь и кристаллические решетки у оксидовОксиды,
- 21. Демонстрация коллекций минералов и горных породКварц (SiO2)Корунд
- 22. В состав воздуха входят (оксиды):Оксид углерода (IV)
- 23. Применение оксидовH2O – важнейший минерал Земли участвует
- 24. Основания- М+у(ОН)у где у – число гидроксогрупп,
- 25. Классификация оснований по растворимости в воде
- 26. Химическая связь и кристаллические решетки у основанийОснования
- 27. Амфотерные основания- это сложные вещества, которые проявляют
- 28. Применение основанийNaOH- гидроксид натрия, «едкий натр»; очистка
- 29. Применение основанийAl(OH)3- гидроксид алюминия, медицина – алмагель,
- 30. Кислоты- НхАс где Ас – кислотный остаток
- 31. По наличию кислорода в молекуле
- 32. По количеству атомов водорода в молекуле
- 33. Химическая связь и кристаллические решетки у кислотХимическая
- 34. Использование кислотH2SO4 – серная кислота; производство минеральных
- 35. Использование кислотН3РО4 – фосфорная кислота; производство удобрений;HCl
- 36. Соли это сложные вещества, состоящие из катионов металла ( иона аммония) и анионов кислотных остатков.
- 37. Слайд 37
- 38. Средние солиэто продукты полного замещения атомов водорода
- 39. Кислые солиэто продукты неполного замещения атомов водорода
- 40. Основные солиэто продукты неполного замещения гидроксогрупп в
- 41. Двойные и комплексные соли отличаются друг
- 42. Координационная теория А.ВернераКомплексные (координационные) соединения построены так:
- 43. Координационная теория А.ВернераОбщее число лигандов, непосредственно связанных
- 44. Координационная теория А.ВернераНаиболее характерны:Кч=2 (Cu+, Ag+,
- 45. Строение тетрагидроксоцинката натрия
- 46. Классификация комплексных солей
- 47. Катионные комплексы [Cu(NH3)4]2+SO42-cульфат-тетраммин меди (II)название составляется,
- 48. Анионные комплексы Na2+[Zn(OH)4]2-тетрагидроксоцинкат натрияион- комплексообразователь называем по латыни с суффиксом «ат»
- 49. Нейтральные комплексыИон-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо
- 50. Значение комплексных соединений в природе Огромное: Хлорофилл-
- 51. Химическая связь и кристаллические решетки у солей
- 52. Значение солейВ повседневной жизни соли имеютогромное значение:
- 53. Значение солейминеральные удобрения: азотные NH4NO3- нитрат аммония,
- 54. ИсточникиХимия. 11 класс. Профильный уровень:учеб.для общеобразоват.учреждений/О.С.Габриелян, Г.Г.Лысова.-М.:Дрофа,
- 55. Автор: Калитина Тамара Михайловна Место работы: МБОУ
- 56. Скачать презентанцию
Цели урокаОбобщить и закрепить знания о классификации неорганических веществ; научить на основании состава молекулы вещества правильно называть вещества; рассмотреть взаимосвязь и взаимообусловленность состава, строения и свойства вещества; дать представление о значении
Слайды и текст этой презентации
Слайд 3Основные понятия
Вещества простые- металлы, неметаллы; сложные- оксиды, кислоты, соли; гидроксиды-
основания, гидроксиды – кислоты, амфотерность; двойные и комплексные соли; ион-комплексообразователь,
лиганд, внутренняя сфера, внешняя сфера, координационное число.Слайд 4Оборудование
Коллекция «Металлы», «Неметаллы» - сера, графит;
модели
типов кристаллических решеток, таблица; Br2,I2, фосфор красный;
оксиды: Fe2O3, СuO, Al2O3, CaO,Cr2O3;кислоты: H2SO4,HCl,HNO3;
щелочи: NaOH, KOH; соли:Na2CO3,NaHCO3,(CuOH)2CO3,KMnO4,
NH3.H2O,CuSO4;
коллекция «Минералы и горные породы»; пробирки.
Слайд 5План урока
Классификация веществ.
Определение простых и сложных веществ.
Классификация простых веществ: металлы
и неметаллы. Строение атомов, виды химической связи, типы кристаллических решеток,
особенность свойств.Классиикация сложных веществ: оксиды, гидроксиды, кислоты, основания, соли.
Характеристика сложного вещества по плану.
Слайд 10Классификация простых веществ
Все простые вещества на основании строения атомов, вида
химической связи, типа кристаллических решеток, физических и химических свойств делятся
на металлы и неметаллы.Слайд 13План
характеристики сложного вещества
Определение класса
Классификации; название.
Признаки (химическая связь) строения вещества.
Физические
свойства.
Значение вещества в повседневной жизни.
Слайд 14
Оксиды - ЭмOn
Это сложные вещества, состоящие из двух химических элементов,
один из которых – кислород в степени окисления -2.
Слайд 18Несколько степеней окисления
В названии оксида обязательно указывается С.О., если образующий
элемент имеет несколько С.О.
+4-2
SO2 – оксид серы (IV)
+6-2
SO3 – оксид серы (VI)
Слайд 19Несолеобразующие оксиды
(безразличные)
СО – оксид углерода (II)
NO - оксид азота (II)
N2O
- оксид азота (I)
Слайд 20Химическая связь и кристаллические решетки у оксидов
Оксиды, образованные:
металлами, имеют
ионную связь,
переходными металлами- ковалентную полярную ,
Кристаллические решетки могут
быть ионными и атомными: BaO - ионная К.Р. Al2O3 – атомная К.Р. Минералы: корунд, сапфир, рубин.3) неметаллами, имеют, ковалентную полярную связь, молекулярные (СО2, «сухой лед»), атомные (SiO2,(кварц, горный хрусталь, агат и т.д.)) К.Р.
Слайд 21Демонстрация коллекций минералов и горных пород
Кварц (SiO2)
Корунд (Al2O3)
Асбест (СаО .
3МgО . 4SiO2)
Тальк (3 MgO . 4SiO2.H2O)
Глина белая, красная; в
состав входят оксиды: Al2O3. nH2O – белая; ,боксит Fe2O3 входит в состав красной глины.Руды железа: Fe2O3 – красный железняк, Fe3O4 – магнитный железняк.
Слайд 22В состав воздуха входят (оксиды):
Оксид углерода (IV) - СО2
Вода -
H2O
Вредные примеси, СО – угарный газ, который образуется при неполном
сжигании топлива.Слайд 23Применение оксидов
H2O – важнейший минерал Земли участвует в круговороте веществ.
SiO2
- оксид кремния, входит в состав большинства минералов, встречающихся в
природе: кремнезем, тальк, асбест, яшма, горный хрусталь, полевой шпат.Fe2O3, Fe3O4 – руды для производства чугуна и стали.
СО2 – углекислый газ, круговорот веществ в природе, фотосинтез.
Слайд 24Основания- М+у(ОН)у
где у – число гидроксогрупп, равное степени окисления
металла М+у
Основания- это сложные вещества, состоящие из атомов металла и
одной или несколько гидроксогрупп (-ОН)Слайд 26Химическая связь и кристаллические решетки у оснований
Основания имеют ионную связь
между металлом и гидроксогруппой, в гидроксогруппе- ковалентная полярная связь.
Кристаллическая решетка
– ионная, твердая.Слайд 27Амфотерные основания- это сложные вещества, которые проявляют и свойства кислот,
и свойства оснований.
нерастворимы в воде, им соответствуют амфотерные оксиды со
С.О. +2, +3, +4ZnO - Zn(OH)2 ↔ Н2ZnО2
Al2O3 - Al(OH)3 ↔ Н3AlО3
GeO2 – Ge(OH)4 ↔ Н4GeO4
Для них возможны ковалентные полярные связи и молекулярные кристаллические решетки.
Слайд 28Применение оснований
NaOH- гидроксид натрия, «едкий натр»; очистка нефтепродуктов, отбеливание бумаги,
производство мыла, осушка газов в органическом синтезе.
Ca(OH)2 – гидроксид кальция,
каменная известь; в смеси с песком- известковый раствор, побелка; производство сахарозы.NH3.H2O (NH4OH)- гидрат аммиака (гидроксид аммония), нашатырный спирт – медицина, аммиачная вода- жидкое азотное удобрение.
Слайд 29Применение оснований
Al(OH)3- гидроксид алюминия, медицина – алмагель, препарат, обладающий обволакивающим
адсорбирующим действием.
AlCl3+3 NH4OH= Al(OH)3↓+3NH4Cl – получение в лаборатории
Fe(OH)3- гидроксид железа
(III)- компонент желтого пигмента красок и эмалей, поглотительная масса для очистки природного газа; катализатор в органическом синтезе.Слайд 30Кислоты- НхАс
где Ас – кислотный остаток (от англ. -
acid-кислота), х- число атомов водорода, равное заряду иона кислотного остатка.
Кислоты-
это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.Слайд 33Химическая связь и кристаллические решетки у кислот
Химическая связь между атомами
в кислотах ковалентная полярная.
Строение веществ – молекулярное.
Слайд 34Использование кислот
H2SO4 – серная кислота; производство минеральных удобрений, солей бескислородных
кислот; очистка нефтепродуктов, поверхностей металлов; органический синтез; производство волокон, краски,
лаков, лекарственных препаратов; взрывотехника; заливка аккумуляторов.HNO3- азотная кислота; производство азотных удобрений, лекарственных препаратов; органический синтез; окислитель ракетного топлива.
Слайд 35Использование кислот
Н3РО4 – фосфорная кислота; производство удобрений;
HCl – соляная кислота;
травление металлов, производство солей, пищевая промышленность, медицина, органический синтез.
Слайд 36Соли
это сложные вещества, состоящие из катионов металла ( иона
аммония) и анионов кислотных остатков.
Слайд 38Средние соли
это продукты полного замещения атомов водорода в молекуле кислоты
атомами металла (иона аммония) или полного замещения гидросогрупп в молекуле
основания кислотными остатками.Н3РО4 → Na3PO4 Ba(OH)2- BaCl2
(NH4)3PO4
Слайд 39Кислые соли
это продукты неполного замещения атомов водорода в молекулах многоосновных
кислот атомами металла (иона аммония).
Н3РО4 → NaH2PO4
Na2HPO4Слайд 40Основные соли
это продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными
остатками.
Fe(OH)3 → (FeOH)Cl2
Fe(OH)2ClСлайд 41Двойные и комплексные соли
отличаются друг от друга характером
диссоциации в водных растворах.
Двойные соли диссоциируют в одну ступень на
катионы металлов и анионы кислотных остатков.KAl(SO4)2↔K+ +Al3+ + 2 SO42-
Комплексные соли при диссоциации образуют сложные комплексные ионы, которые устойчивы в водных растворах.
[Cu(NH3)4]SO4↔ [Cu(NH3)4]2+ + SO4 2-
Слайд 42Координационная теория А.Вернера
Комплексные (координационные) соединения построены так: в центре находится
атом или ион-комплексообразователь (им может быть металл, в основном d-элементы-
имеющие свободные орбитали, а также элемент, имеющий неподеленные пары), а вокруг него – атомы, молекулы или ионы (лиганды), образовавшие с ним в основном ковалентные связи по донорно-акцепторному механизму.Лигандами могут быть анионы кислот, некоторые молекулы небольшого размера (H2O, NH3, CO)имеющие атомы с неподелёнными электронными парами.
Слайд 43Координационная теория А.Вернера
Общее число лигандов, непосредственно связанных с центральным атомом,
называется координационным числом.
Ион- комплексообразователь и лиганды составляют внутреннюю сферу комплексного
соединения, которую записывают в квадратные скобки. Число лиганд соответствуют координационному числу иона-комплексообразователя.
[Cu(NH3)4]SO4
Слайд 44Координационная теория А.Вернера
Наиболее характерны:
Кч=2 (Cu+, Ag+, Au+)
Кч=4 (Cu2+,
Au3+,Zn2+,Pb2+,Pt2+,Al3+)
Кч=6 (Fe2+, Fe3+, Ni2+, Al3+, Pt4+,Cr3+)
Заряд внутренней сферы равен
сумме зарядов иона- комплексообразователя и лиганд.Ионы, не вошедшие во внутреннюю сферу, образуют внешнюю сферу.
Слайд 45Строение тетрагидроксоцинката натрия
внутренняя среда
внешняя сфера
Na2 [Zn(OH)4]
комплексообразователь лиганды
координационное число=4
Уравнение диссоциации:
Na2 [Zn(OH)4] →2Na++ [Zn(OH)4]2-
Слайд 47
Катионные комплексы
[Cu(NH3)4]2+SO42-
cульфат-тетраммин меди (II)
название составляется, начиная с аниона молекулы; ион-комплексообразователя
назван по-русски в родительном падеже.
Слайд 48
Анионные комплексы
Na2+[Zn(OH)4]2-
тетрагидроксоцинкат натрия
ион- комплексообразователь называем по латыни с суффиксом «ат»
Слайд 49Нейтральные комплексы
Ион-комплексообразователь называем по-русски в именительном падеже:
[Fe(CO)5]
пента-карбонил-железо
Слайд 50Значение комплексных соединений в природе
Огромное: Хлорофилл- комплексное
соединение, ионом-комплексообразователем
является магний;
хлорофилл отвечает за фотосинтез.
Гемоглобин- комплексное соединение, ионом
комплексообразователем является железо.
Гемоглобин отвечает
за газообмен в клетке: снабжаетклетку кислородом и удаляет углекислый газ.
Витамин-В12 –комплексное соединение кобальта.
От комплексных соединений в живых организмах
зависит обмен веществ.
Слайд 51Химическая связь и кристаллические решетки у солей
В солях
присутствует ионная связь, ковалентная полярная связь, а в комплексных соединениях
между ионом-комплексообразователем и лигандами – связь по донорно-акцепторному механизму.Слайд 52Значение солей
В повседневной жизни соли имеют
огромное значение: в быту NaHCO3
-
гидрокарбонат натрия, пищевая сода;
CaCO3 - карбонат кальция, мел, известняк,
мрамор;
стеарат Na,K –твердое и жидкое мыло;
KMnO4 - дезинфицирующее средство;
Слайд 53Значение солей
минеральные удобрения: азотные NH4NO3- нитрат аммония, калийные KCl –
хлорид калия, фосфорные (NH4)2HPO4- гидрофосфат аммония.
В промышленности: соли катализаторы AlCl3,
FeBr3.Биологическое значение: соли NaCl, KCl, Na2HPO4,NaHPO4,NaHCO3,CaF2,Ca3(PO4)2.
Малахит (CuOH)2CO3- минерал.
Слайд 54Источники
Химия. 11 класс. Профильный уровень:учеб.для общеобразоват.учреждений/О.С.Габриелян, Г.Г.Лысова.-М.:Дрофа, 2008.
Троегубова Н.П. Поурочные
разработки по химии:11 класс. – М.:ВАКО, 2011.
Слайд 55
Автор: Калитина Тамара Михайловна
Место работы: МБОУ СОШ №3 с.Александров-Гай
Саратовской области
Должность: учитель химии, биологии, экологии.
Дополнительные сведения: сайт http://kalitina.okis.ru/
Мини-сайт http://www.nsportal.ru/kalitina-tamara-mikhailovna













































![Классификация неорганических веществ Катионные комплексы [Cu(NH3)4]2+SO42-cульфат-тетраммин меди (II)название составляется, начиная с аниона молекулы; Катионные комплексы [Cu(NH3)4]2+SO42-cульфат-тетраммин меди (II)название составляется, начиная с аниона молекулы; ион-комплексообразователя назван по-русски в родительном падеже.](/img/tmb/7/630789/b373016155422244ae22b63767b343f9-800x.jpg)
![Классификация неорганических веществ Анионные комплексы Na2+[Zn(OH)4]2-тетрагидроксоцинкат натрияион- комплексообразователь называем по латыни с суффиксом «ат» Анионные комплексы Na2+[Zn(OH)4]2-тетрагидроксоцинкат натрияион- комплексообразователь называем по латыни с суффиксом «ат»](/img/tmb/7/630789/f9e87c6e1b4ba1cfa2d8e09da900350e-800x.jpg)
![Классификация неорганических веществ Нейтральные комплексыИон-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо Нейтральные комплексыИон-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо](/img/tmb/7/630789/49eabdab359b1b43892b3b826856f8cc-800x.jpg)

























