Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекарственные средства на основе рекомбинантных микроорганизмов
Содержание
- 1. Лекарственные средства на основе рекомбинантных микроорганизмов
- 2. Антитела (Antibody) =иммуноглобулины Белки макроорганизма, синтезируемые и экскретируемые
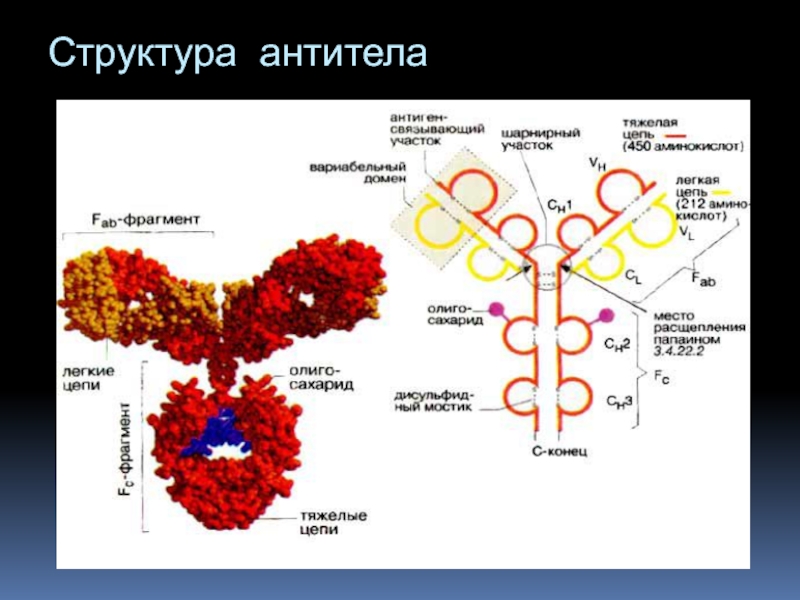
- 3. Структура антитела
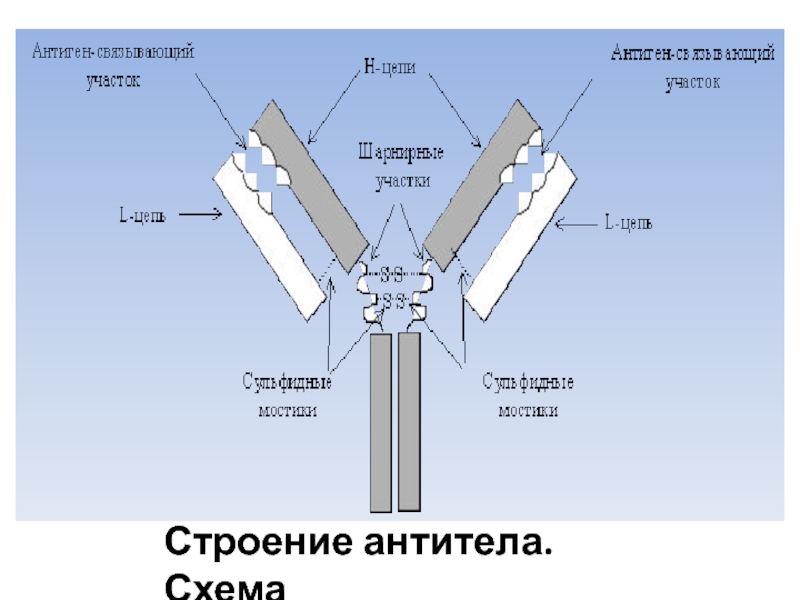
- 4. Строение антитела. Схема
- 5. Вариабельные области молекулы антитела Состоят из трех
- 6. Константные области молекулы антителаКаждая L-цепь содержит одну
- 7. Система АНТИГЕН – АНТИТЕЛО
- 8. Взаимодействие АТ с системами естественного иммунитета собственного организма
- 9. Опсонизация (от др.-греч. ὀψώνιον — снабжение пищей)
- 10. Современные направления использования МАТ в фармакотерапии -
- 11. ИСПОЛЬЗОВАНИЕ МАТ ДЛЯ ДОСТАВКИ ЛВ К МИШЕНЯМ
- 12. Технология «золотых пуль»А - молекулы ЛВ присоединяют
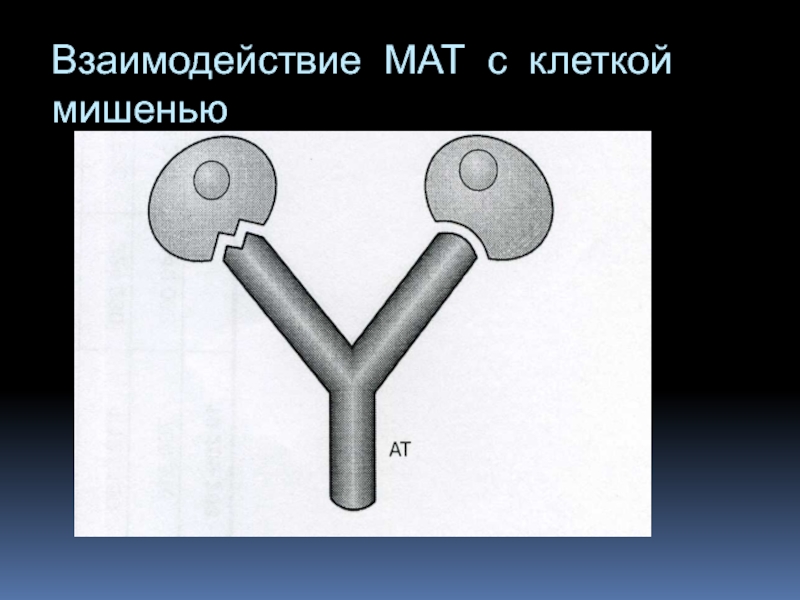
- 13. Взаимодействие МАТ с клеткой мишенью
- 14. Рекомбинантное МАТ (гуманизированное, приближённое к человеческому), которое
- 15. Тромболитики и антикоагулянты Тромб состоит из молекул
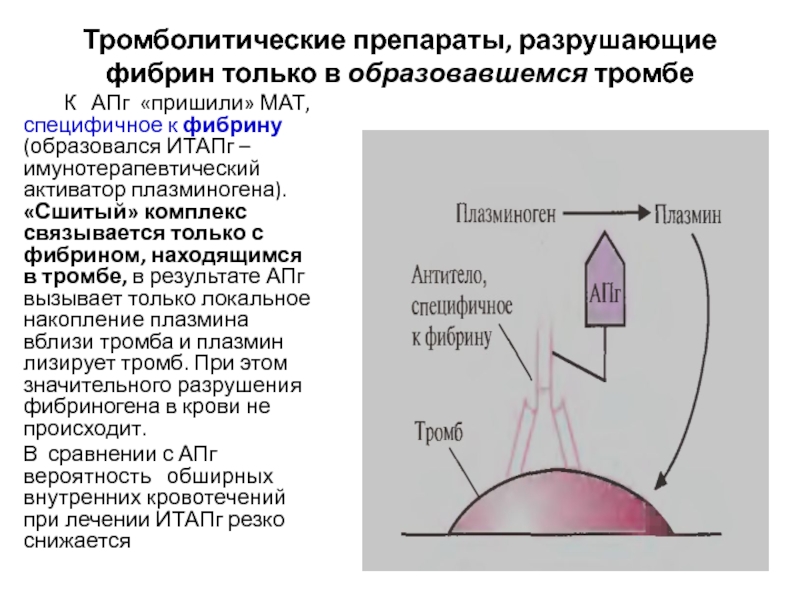
- 16. Тромболитические препараты, разрушающие фибрин только в образовавшемся
- 17. Тромболитики первого поколенияСтрептокиназа (РУП Белмедпрепараты). Активатор
- 18. Активаторы плазминогена тканевого типа (тАПг)тАПг используется для
- 19. Активаторы плазминогена урокиназного типаУрокиназа – активатор плазминогена,
- 20. ПОЛУЧЕНИЕ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ЧЕЛОВЕКА
- 21. l. Иммунные стволовые клетки человека трансплантируют Scid
- 22. 2. Использование гибридомных технологий. Гены В-лимфоцитов человека
- 23. 3. Генноинженерный метод (схема)В генах, кодирующих L-
- 24. Скачать презентанцию
Антитела (Antibody) =иммуноглобулины Белки макроорганизма, синтезируемые и экскретируемые В- лимфоцитами в ответ на попадание в организм различных антигенов и специфически с ними взаимодействующие Антиген (Antigen) – вещество, воспринимаемое организмом как чужеродное и вызывающее
Слайды и текст этой презентации
Слайд 1ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПОЛУЧЕННЫЕ НА ОСНОВЕ РЕКОМБИНАНТНЫХ МИКРООРГАНИЗМОВ
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА (МАТ) КАК
ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Слайд 2Антитела (Antibody) =иммуноглобулины
Белки макроорганизма, синтезируемые и экскретируемые В- лимфоцитами в
ответ на попадание в организм различных антигенов и специфически с
ними взаимодействующиеАнтиген (Antigen) – вещество, воспринимаемое организмом как чужеродное и вызывающее специфический иммунный ответ – выработку антител
- бактерии
- вирусы
- чужеродные белки и токсины
- и т.д.
Слайд 5Вариабельные области молекулы антитела
Состоят из трех участков каждая. Определяют
комплементарность антитела к антигену – антигенсвязывающие участки - CDR1, CDR2
и CDR3 (англ. Complementarity-determining regions) . Эти участки образуют вариабельные области (VH и VL) на N-концах тяжелых и легких цепей. В совокупности они образуют Fv- вариабельный домен . Для CDR характерна очень высокая изменчивость последовательности аминокислот, что обеспечивает огромную вариабельность антител.Слайд 6Константные области молекулы антитела
Каждая L-цепь содержит одну постоянную (константную) область
(СL),
Каждая Н-цепь – три константных области (СН1, СН2, СН3)
Константные области
молекулы антитела обеспечивают присоединение к собственным клеткам макроорганизма, обеспечивающим иммунную защиту (к фагоцитам, к эффекторным клеткам и т.д.) и активизируют ихСлайд 9Опсонизация (от др.-греч. ὀψώνιον — снабжение пищей) — процесс адсорбции
опсонинов на поверхности антигенов (АГ), который стимулирует и облегчает фагоцитоз
данных частиц. Функцию опсонинов могут выполнять как антитела так и комплемент. Антитела связывают патоген фрагментами Fa и Fb, а фрагмент Fc может связываться со специфическими рецепторами фагоцитов, лейкоцитов (моноциты, нейтрофилы, эозинофилы, естественные киллеры), которые синтезируют цитокины или выделяют токсичные вещества, убивающие опсонизированные клетки. Этот процесс вызывает воспаление и повреждает соседние здоровые клетки.Система комплемента — комплекс белков, постоянно присутствующих в крови. Это каскадная система протеолитичес-ких ферментов, предназначенная для гуморальной защиты организма от действия чужеродных агентов. Она участвует в реализации иммунного ответа организма. Является важным компонентом как врождённого, так и приобретённого иммунитета.
Слайд 10Современные направления использования МАТ в фармакотерапии
- для нейтрализации токсинов,
- для борьбы с бактериями, вирусами,
- для лечения онкологических
заболеваний, - для обеспечения направленной доставки ЛВ к мишеням
Слайд 12Технология «золотых пуль»
А - молекулы ЛВ присоединяют непосредственно к МАТ,
специфичным по отношению к белкам, находящимся на поверхности строго определенных
клеток мишеней, например раковых.Б - в организм вводится ЛВ в неактивной форме. К МАТ присоединяют фермент, переводящий инертную форму ЛВ в активную только в непосредственной близости от клетки-мишени.
В обоих случаях МАТ связывается со специфическим белком на поверхности клетки-мишени.
Слайд 14Рекомбинантное МАТ (гуманизированное, приближённое к человеческому), которое селективно связывается с
фактором роста эндотелия сосудов (vascular endothelial growth factor - VEGF)
опухоли и нейтрализует его.В результате VEGF не связывается с его рецепторами (Flt-1, KDR) на поверхности эндотелиальных клеток, что приводит к угнетению роста опухоли
Авастин (бевацизумаб)
Слайд 15Тромболитики и антикоагулянты
Тромб состоит из молекул фибрина, образующих сеть.
Сетчатая структура создается под влиянием факторов свертываю-щей системы крови в
ответ на повреждение стенки кровеносного сосуда.В норме молекулы фибрина в образовавшемся тромбе расщепляются ферментом – плазмином сериновой протеиназы (фибринолизином). Плазмин образуется из плазминогена под действием активатора. Часто эта система работает неэффективно, что приводит к закупорке артерий.
Для повышения уровня плазмина в крови было предложено использовать активатор плазминогена (АПг) в качестве ЛС.
Однако плазмин способен разрушать и фибриноген (предшественник фибрина). И если уровень фибриногена в результате применения АПг снизится слишком сильно, то могут произойти обширные внутренние кровотечения.
Слайд 16Тромболитические препараты, разрушающие фибрин только в образовавшемся тромбе
К
АПг «пришили» МАТ, специфичное к фибрину (образовался ИТАПг –имунотерапевтический активатор
плазминогена). «Сшитый» комплекс связывается только с фибрином, находящимся в тромбе, в результате АПг вызывает только локальное накопление плазмина вблизи тромба и плазмин лизирует тромб. При этом значительного разрушения фибриногена в крови не происходит.В сравнении с АПг вероятность обширных внутренних кровотечений при лечении ИТАПг резко снижается
Слайд 17 Тромболитики первого поколения
Стрептокиназа (РУП Белмедпрепараты).
Активатор плазминогена. Получают из
β-гемолитического стрептококка группы С. Это непрямой фибринолитик. Стимулирует перевод имеющегося
в крови проактиватора в активатор плазминогена. Стрептокиназа проникает внутрь тромба и активирует фибринолиз внутри. Этим выгодно отличается от плазмина.Антитела к стрептокиназе исчезают в течение 6 месяцев, иммунологическая побочная реакция появляется лишь у пациентов, перенесших стрептококковую инфекцию.
Ф. «Phillips Petrolium» (США) запатентовала метод экспрессии стрептокиназы в клетках дрожжей.
Германия запатентовала получение плазмиды, содержащей ген стрептокиназы. Трансформация плазмиды в клетки стрептококка тпривела к повышению выхода продукта.
Стрептодеказа
Пролонгированный препарат стрептокиназы, относящийся к группе иммобилизированных ферментов. Стрептокиназа нанесена на водорастворимую матрицу полисахаридной природы. Длительность действия возрастает до 72 часов после введения средней терапевтической дозы.
Слайд 18Активаторы плазминогена тканевого типа (тАПг)
тАПг используется для тромболитической терапии острого
инфаркта миокарда, закупорки мозговых и коронарных артерий, эмболии легких.
Выделенный из
различных органов и тканей тАПг различается по м.м.Ранее получали природный тАПг методом культивирования линии клеток меланомы человека. Очищают меланомный тАПг методом аффинной хроматографии с использованием пяти аффинных сорбентов (конканавалина А, п-аминобензамидина, имидиноди-уксусной кислоты, борной кислоты, лизина).
В 80-х годах 20 века разработана технология рекомбинантного тАПг. Ген тАПг расположен у человека в хромосоме №8. Его клонирование и экспрессия в клетках E. Coli и дрожжевых клетках позволили получить тАПг в промышленных масштабах.
Сравнительное изучение меланомного тАПг и рекомбинантного тАПг в отношении тромболизиса при инфаркте миокарда показало полную их идентичность.
Лидеры производства рТАПг – фирмы «Genentech» и «Boehringer Ingelheim»
Торговые названия соответственно – activase и actilyse
Слайд 19Активаторы плазминогена урокиназного типа
Урокиназа – активатор плазминогена, содержащийся в моче
человека. Состоит из двух полипептидных цепей, соединенных дисульфидным мостиком. Встречается
в высоко- и низкомолекулярной форме, м.м. соответственно 55000 и 34000.Получают из культуры клеток почки эмбриона человека. Способна активировать фибринолиз внутри тромба (эндотромболизис) и на его поверхности (экзотромболизис). Урокиназа не обладает выраженными антигенными свойствами, поэтому при ее применении опасность аллергических реакций меньше и ее можно назначать повторно.
В настоящее время также получают методом генной инженерии. Ген урокиназы локализуется в 10 хромосоме человека. Продукт экспрессии гена урокиназы, клонирован в E. Coli.
Рекомбинантная урокиназа обладает лучшей тромбоселективностью и меньшим числом побочных явлений, в сравнении с природной урокиназой, выделенной из мочи.
Слайд 21l. Иммунные стволовые клетки человека трансплантируют Scid мышам, лишенным собственной
иммунной системы. Клетки приживаются.
В ответ на введение АГ мыши
вырабатывают АТ человека, которые далее собирают и используют как ЛСScid - Severe combined immunologic deficiency
генетическое заболевание , которое характеризуется отсутствием или атипичной формой Т и В лимфоцитов (мыши-мутанты)
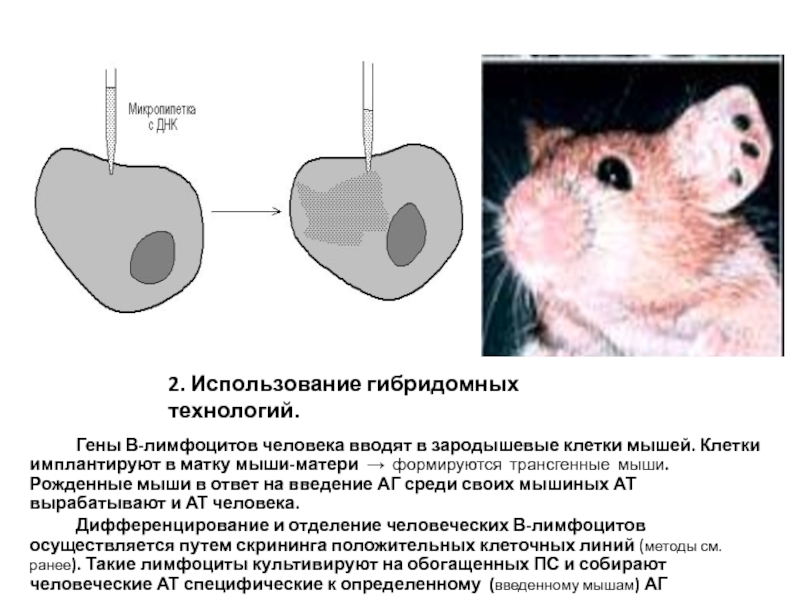
Слайд 222. Использование гибридомных технологий.
Гены В-лимфоцитов человека вводят в зародышевые
клетки мышей. Клетки имплантируют в матку мыши-матери → формируются трансгенные
мыши. Рожденные мыши в ответ на введение АГ среди своих мышиных АТ вырабатывают и АТ человека.Дифференцирование и отделение человеческих В-лимфоцитов осуществляется путем скрининга положительных клеточных линий (методы см. ранее). Такие лимфоциты культивируют на обогащенных ПС и собирают человеческие АТ специфические к определенному (введенному мышам) АГ
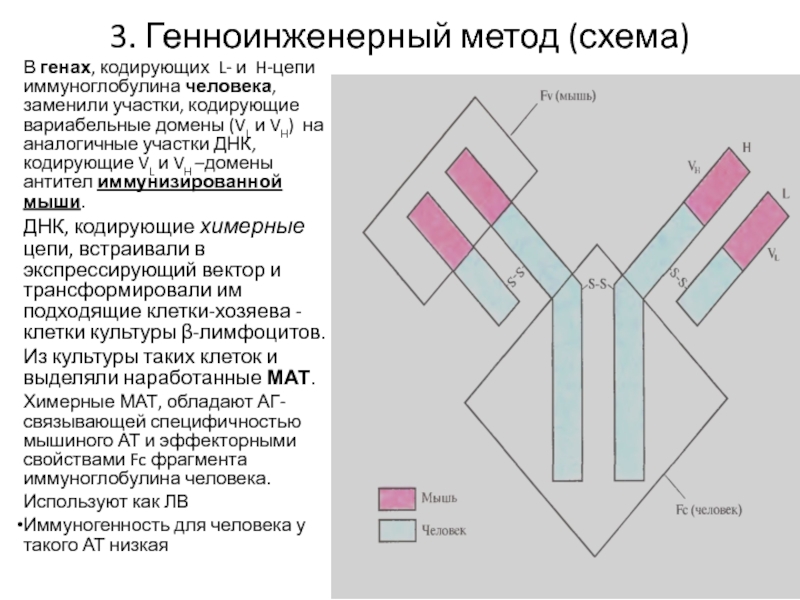
Слайд 233. Генноинженерный метод (схема)
В генах, кодирующих L- и H-цепи иммуноглобулина
человека, заменили участки, кодирующие вариабельные домены (VL и VH) на
аналогичные участки ДНК, кодирующие VL и VH –домены антител иммунизированной мыши.ДНК, кодирующие химерные цепи, встраивали в экспрессирующий вектор и трансформировали им подходящие клетки-хозяева - клетки культуры β-лимфоцитов.
Из культуры таких клеток и выделяли наработанные МАТ.
Химерные МАТ, обладают АГ-связывающей специфичностью мышиного АТ и эффекторными свойствами Fc фрагмента иммуноглобулина человека.
Используют как ЛВ
Иммуногенность для человека у такого АТ низкая