Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
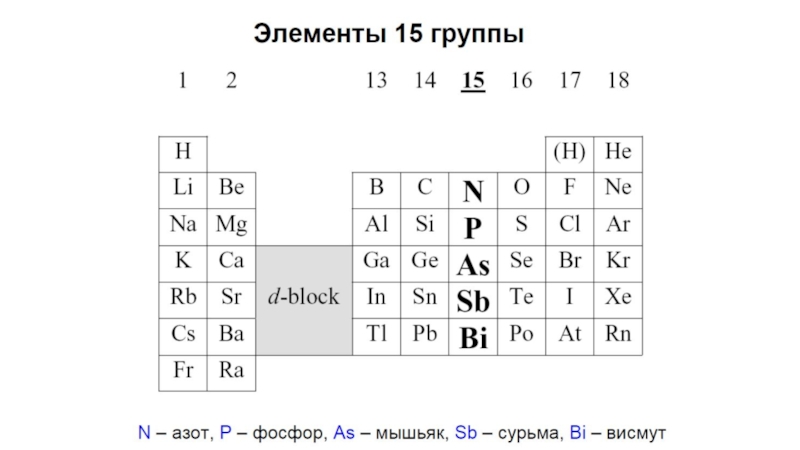
Лекция 23 р-элементы V группы (пниктогены) N, P, As, Sb, Bi Сборная 8 классов
Содержание
- 1. Лекция 23 р-элементы V группы (пниктогены) N, P, As, Sb, Bi Сборная 8 классов
- 2. 2
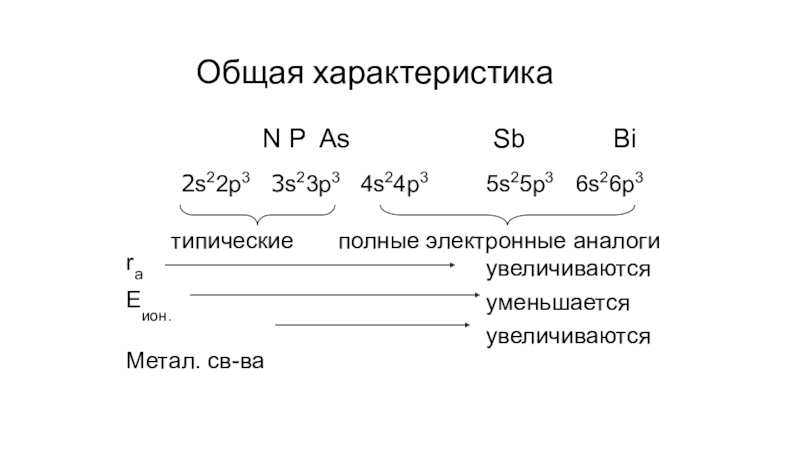
- 3. Общая характеристикаN P As2s22p3 3s23p3 4s24p3Sb5s25p3Bi6s26p3типическиеrа Еион.Метал. cв-ваполные электронные аналогиувеличиваются уменьшается увеличиваются
- 4. Общая характеристикаN - неметалл P – неметалл,Pчерный –п/пAs, Sbжелтый- немет.Sbсерый- мет.Bi - металл
- 5. Общая характеристикаP + HNO3(конц.) → H3PO4 +
- 6. Степени окисленияХарактерные УстойчивыеNP-3 ÷ +5-3 +1 +3 +5+5+5+3,+5+3
- 7. Природные cоединенияКларкAs 5·10-4 As2S3Sb 5·10-5 Sb2S3Bi 2·10-5 Bi2S3N P0,04 0,09NaNO3 Ca3(PO4)2 KNO3Ca3(PO4)2·CaF2N2 78.09% в атмосфере
- 8. Азот, его свойства и значение
- 9. Слайд 9
- 10. Слайд 10
- 11. Открытие азота12 сентября 1772 года — Даниель
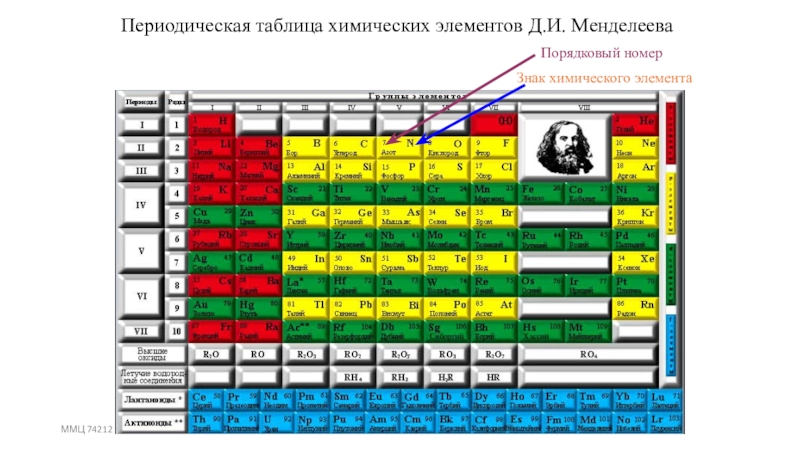
- 12. ММЦ 74212Периодическая таблица химических элементов Д.И. МенделееваПорядковый номерЗнак химического элемента
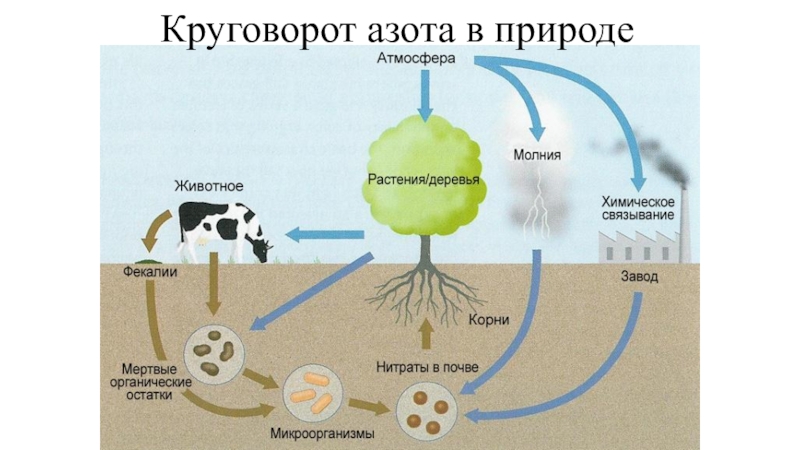
- 13. Круговорот азота в природе
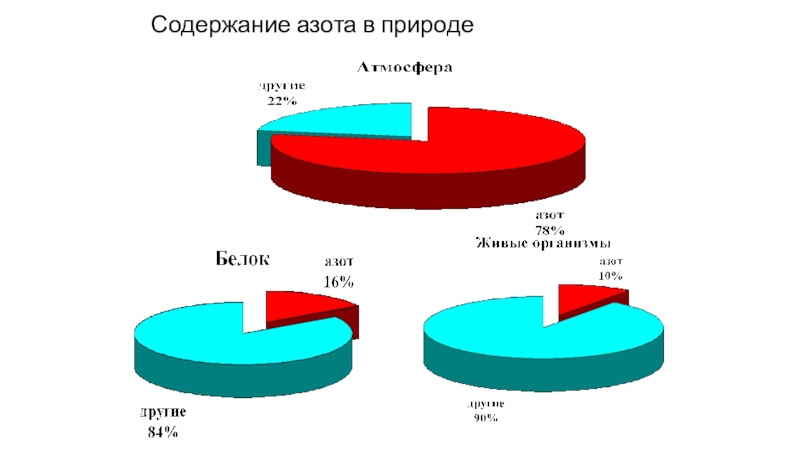
- 14. Содержание азота в природе
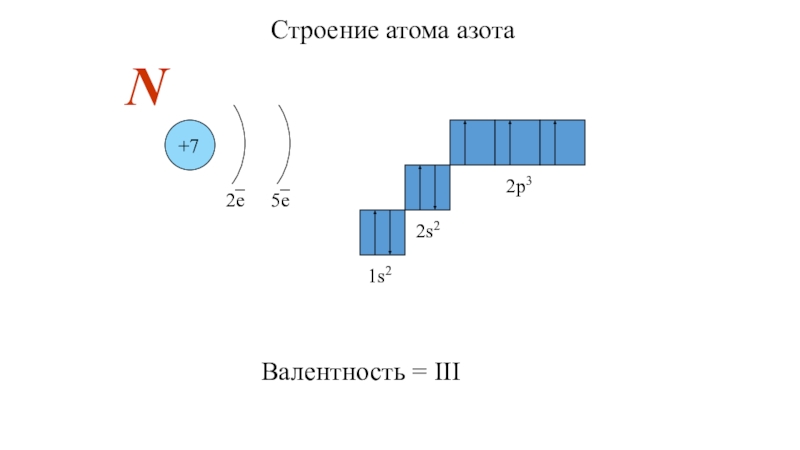
- 15. Строение атома азота+72е5еN1s22s22p3Валентность = III
- 16. Азот - простое веществоN2NNNNМолекулярная формулаЭлектронная формулаСтруктурная формулаковалентная
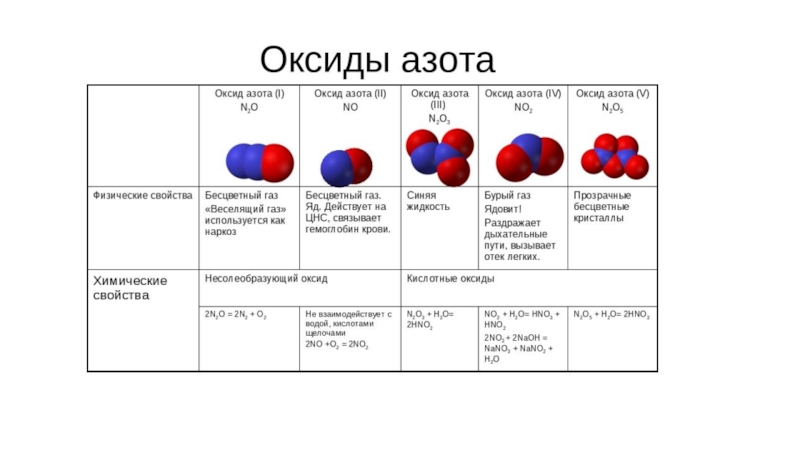
- 17. Азот[аzоо] - безжизненный N …2s22p3 Ст.окисления:-3 -2 -1 -1/3NH3 N2H4 NH2OH HN3 NH4+NH2- NH2-0 +1 +2 +3N2 N2O NO N2O3HNO2+4 +5NO2 N2O5HNO3
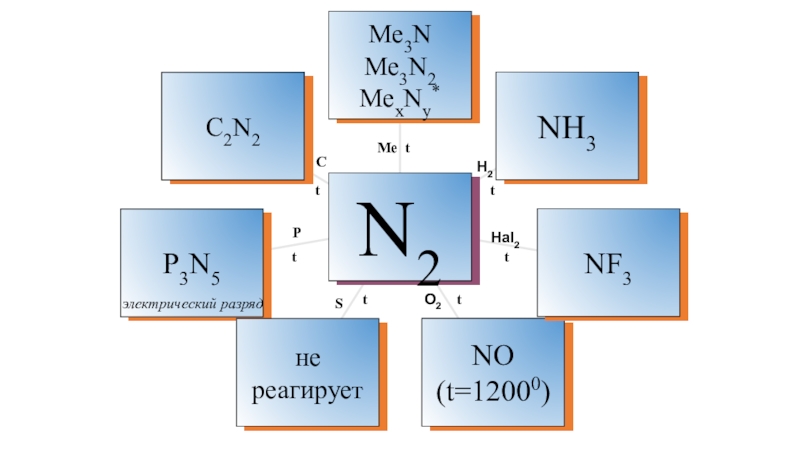
- 18. МеН2Hal2O2SPC t t t t t t t электрический разряд
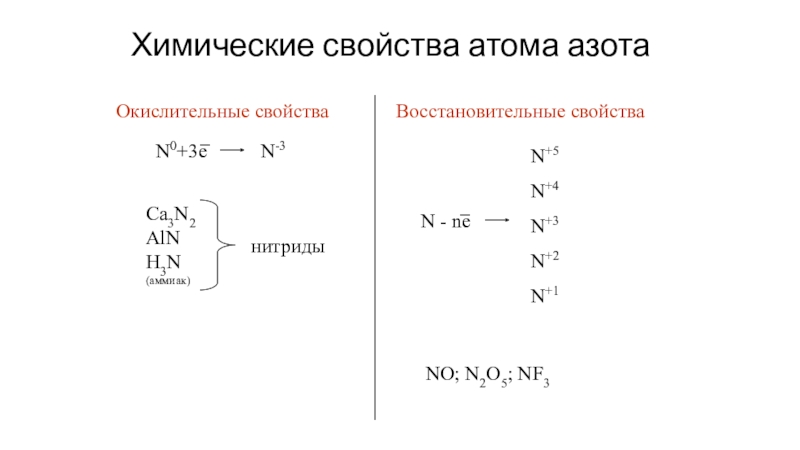
- 19. Химические свойства атома азотаОкислительные свойстваN0+3eN-3Ca3N2AlNH3N(аммиак)нитридыВосстановительные свойстваN - neN+4N+5N+2N+3N+1NO; N2O5; NF3
- 20. Слайд 20
- 21. Химические свойства вещества азотаОкислительные свойстваВосстановительные свойства Взаимодействие
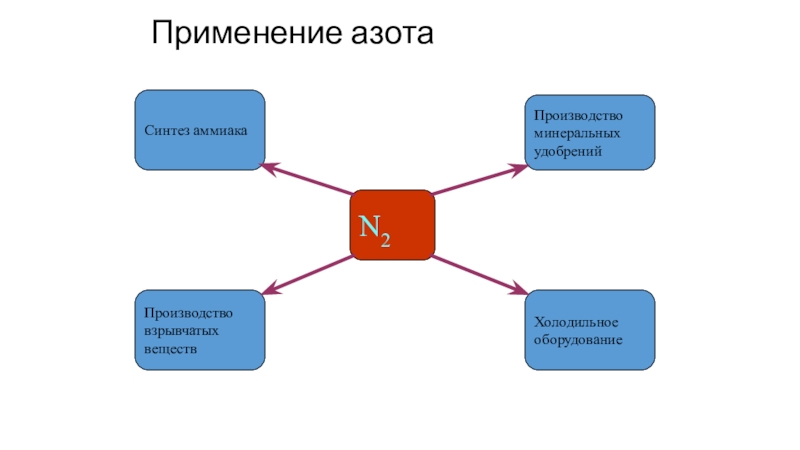
- 22. Применение азотаN2Синтез аммиакаХолодильноеоборудованиеПроизводствовзрывчатыхвеществПроизводствоминеральныхудобрений
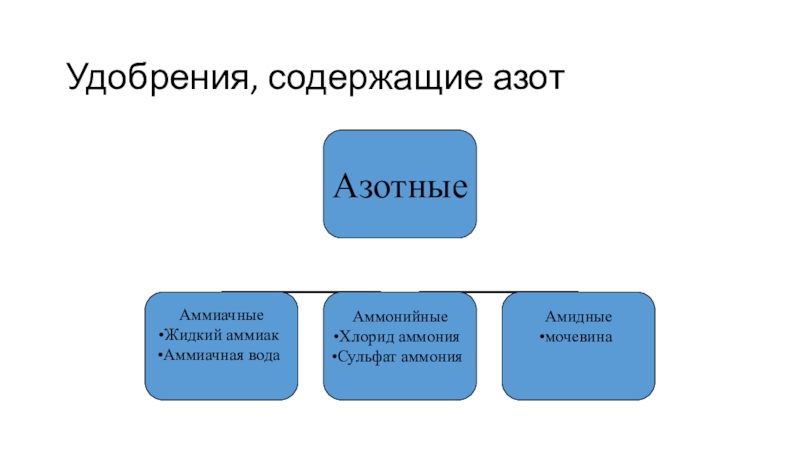
- 23. Удобрения, содержащие азот
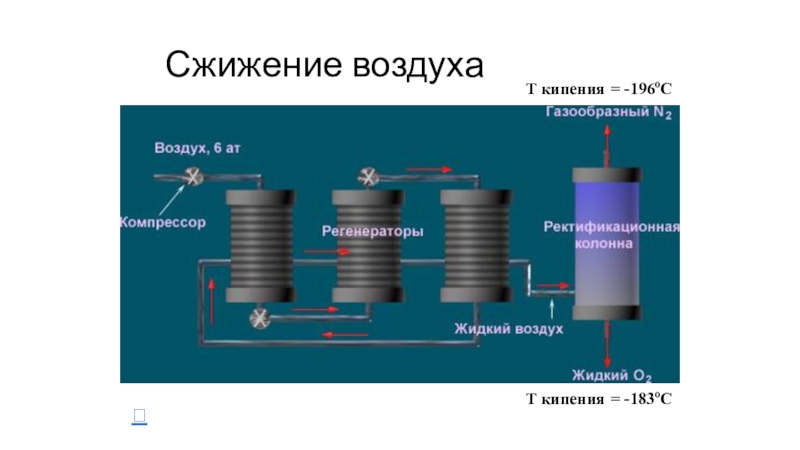
- 24. Получение азота Сжижение воздуха Взаимодействие нитрита натрия с хлоридом аммония
- 25. Сжижение воздухаT кипения = -196oCT кипения = -183oC
- 26. Реакция получения N2NaNO2нитритнатрия+NH3Clхлоридаммония=NaCl+N22H2O+
- 27. Слайд 27
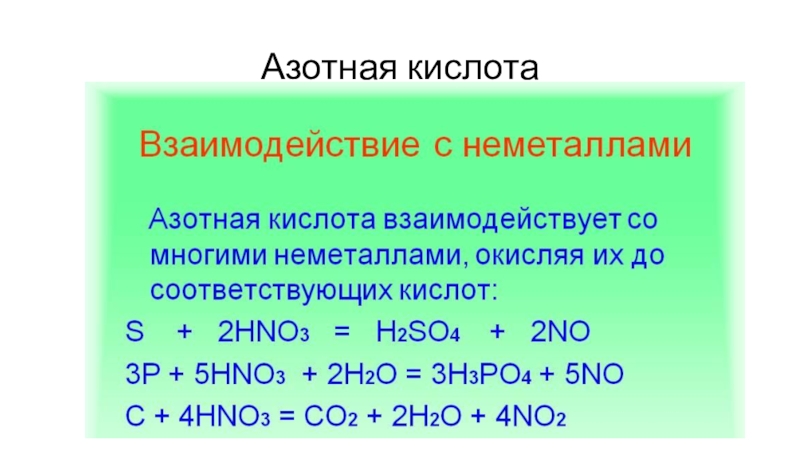
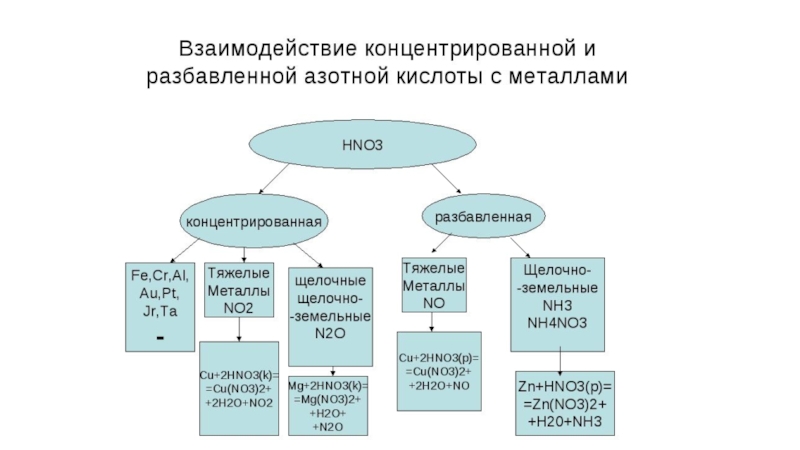
- 28. Азотная кислота
- 29. Слайд 29
- 30. Слайд 30
- 31. Получение аммиакаN2 + 3H2 ↔ 2NH3t =
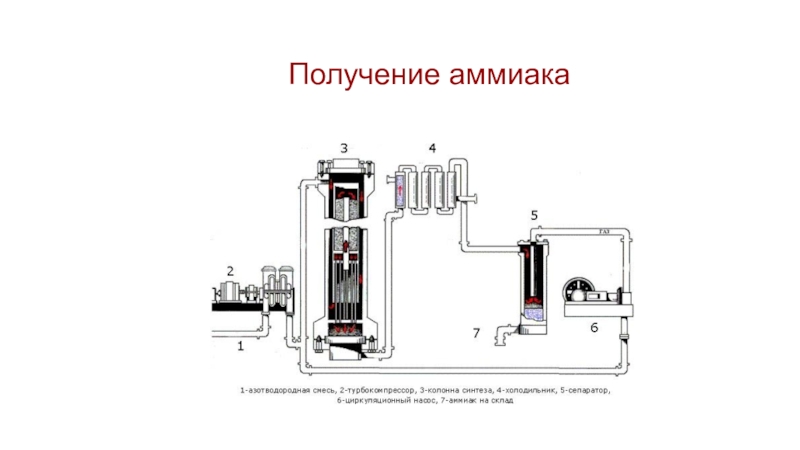
- 32. Получение аммиака
- 33. Физические cв-ва NH3Газ, с резким запахом, токсичен. tк = - 33оС
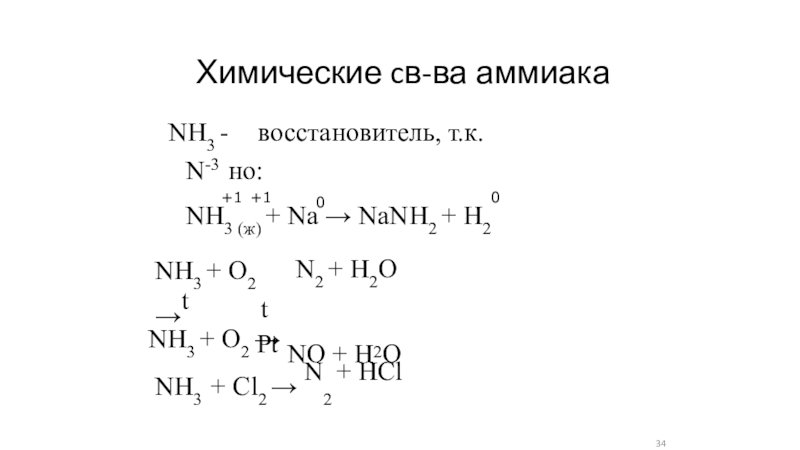
- 34. Химические cв-ва аммиакаNH3 - восстановитель, т.к. N-3 но:NH3
- 35. Химические cв-ва аммиакаNH3 - основание Льюиса NH3 + HCl NH4ClNH3 + H2SO4 (разб.) → NH3 + H3PO4 →
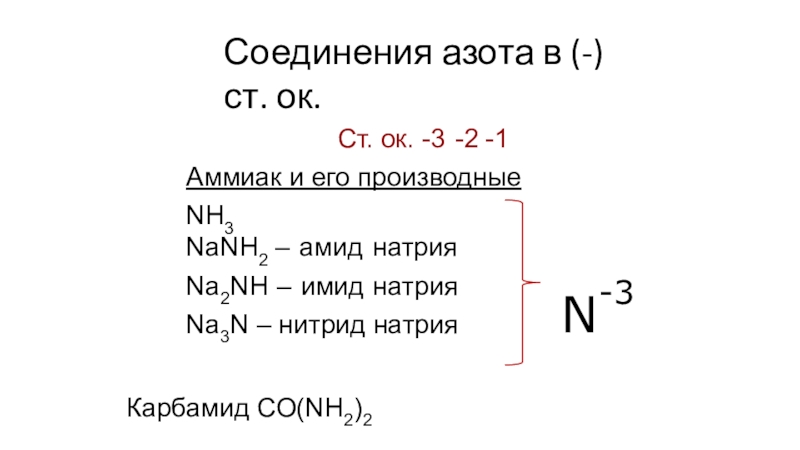
- 36. Соединения азота в (-) ст. ок.Ст. ок.
- 37. 2Na + 2NH3(ж) = 2NaNH2 + H2 NaNH2 +
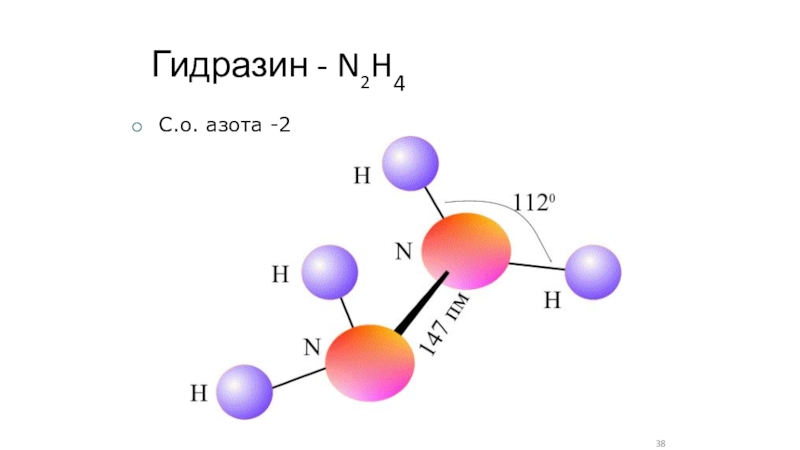
- 38. Гидразин - N2H4C.о. азота -2
- 39. N2H4 – жидкость2 5N2H4 +H2ON2H5OH OH- + N
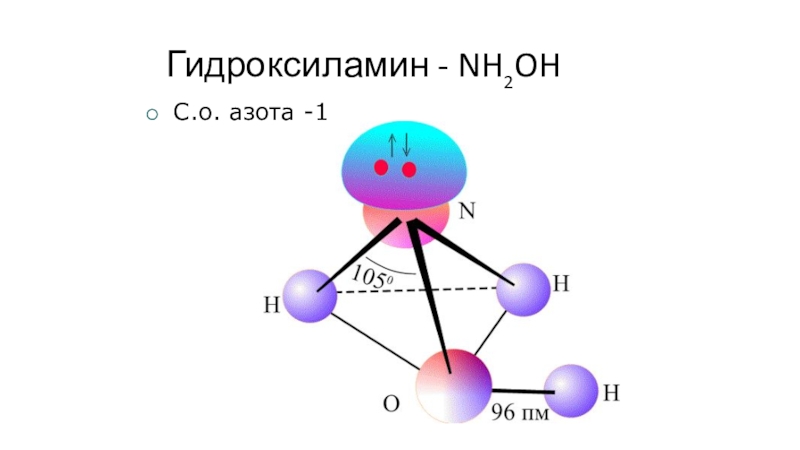
- 40. Гидроксиламин - NH2OHС.о. азота -1
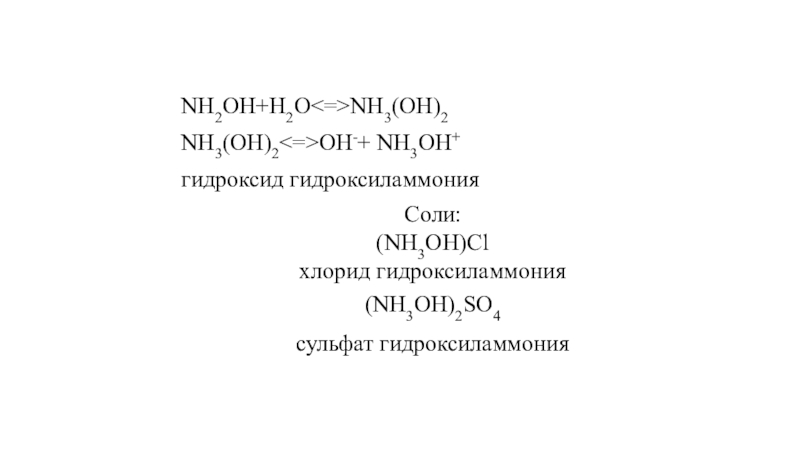
- 41. NH2OH+H2ONH3(OH)2 NH3(OH)2OH-+ NH3OH+гидроксид гидроксиламмонияСоли:(NH3OH)Clхлорид гидроксиламмония (NH3OH)2SO4сульфат гидроксиламмония
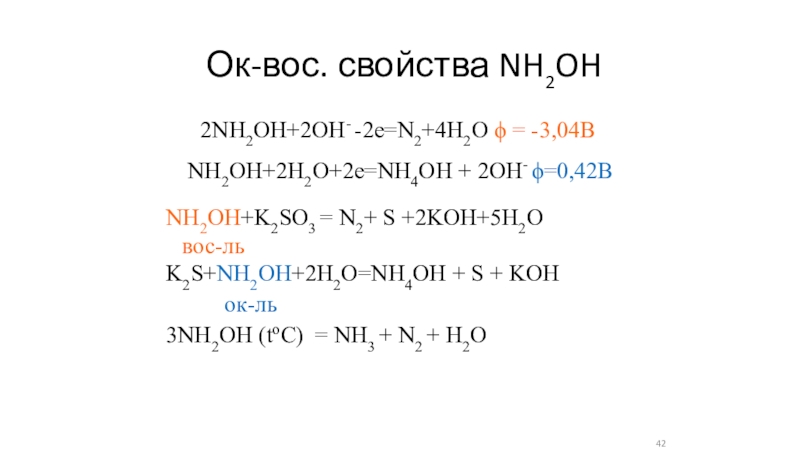
- 42. Ок-вос. свойства NH2OH2NH2OH+2OH- -2e=N2+4H2O = -3,04В
- 43. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Общая характеристика
N P As
2s22p3 3s23p3 4s24p3
Sb
5s25p3
Bi
6s26p3
типические
rа Еион.
Метал. cв-ва
полные электронные аналоги
увеличиваются уменьшается увеличиваются
Слайд 4Общая характеристика
N - неметалл P – неметалл,
Pчерный –
п/п
As, Sbжелтый- немет.
Sbсерый
- мет.
Bi
- металл
Слайд 5Общая характеристика
P + HNO3(конц.) → H3PO4 + NO2 + H2O
As
+ HNO3(конц.) → HAsO3 + NO2 + H2O Sb +
HNO3(конц.) → HSbO3 + NO2 + H2O Bi + HNO3(разб.) → Bi(NO3)3 + NO + H2OСлайд 7Природные cоединения
Кларк
As 5·10-4 As2S3
Sb 5·10-5 Sb2S3
Bi 2·10-5 Bi2S3
N P
0,04 0,09
NaNO3 Ca3(PO4)2 KNO3
Ca3(PO4)2·CaF2
N2 78.09% в
атмосфере
Слайд 11Открытие азота
12 сентября 1772 года — Даниель Резерфорд
1771 - 1773
гг. — Г. Кавендиш и Дж. Пристли
1770 -1777 гг. —
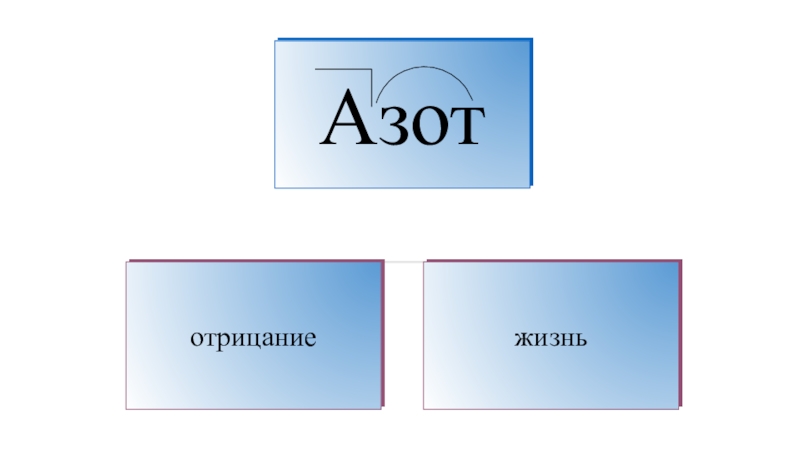
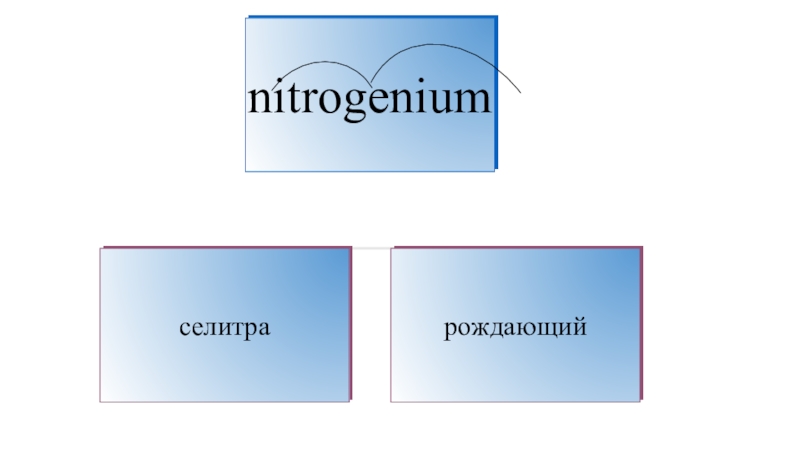
К. Шееле1787 год — А. Лавуазье, Л. Гитоном де Морво и А. Фуркруа было предложено название «азот» (от греч., означающего безжизненный)
Антуан Лоран Лавуазье
Слайд 12ММЦ 74212
Периодическая таблица химических элементов Д.И. Менделеева
Порядковый номер
Знак химического элемента
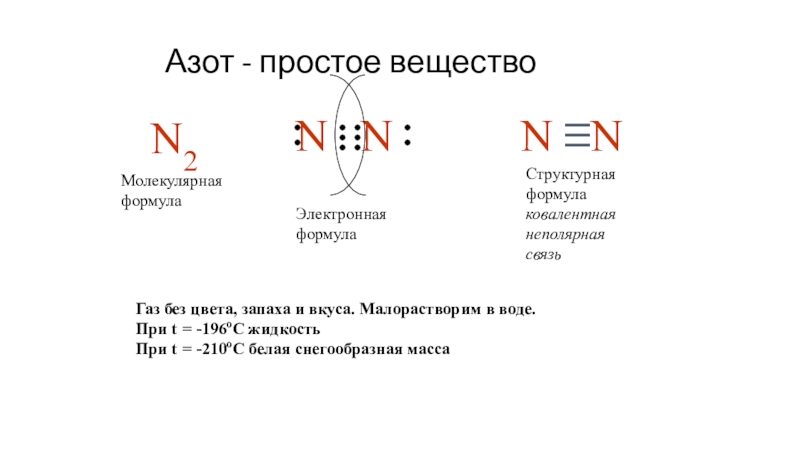
Слайд 16Азот - простое вещество
N2
N
N
N
N
Молекулярная формула
Электронная формула
Структурная формула
ковалентная неполярная связь
Газ без
цвета, запаха и вкуса. Малорастворим в воде.
При t =
-196oC жидкостьПри t = -210oC белая снегообразная масса
Слайд 17Азот
[аzоо] - безжизненный N …2s22p3 Ст.окисления:
-3 -2 -1 -1/3
NH3 N2H4 NH2OH HN3 NH4+
NH2- NH2-
0 +1 +2 +3
N2 N2O NO N2O3
HNO2
+4 +5
NO2 N2O5
HNO3
Слайд 19Химические свойства атома азота
Окислительные свойства
N0+3e
N-3
Ca3N2
AlN
H3N
(аммиак)
нитриды
Восстановительные свойства
N - ne
N+4
N+5
N+2
N+3
N+1
NO; N2O5; NF3
Слайд 21Химические свойства вещества азота
Окислительные свойства
Восстановительные свойства
Взаимодействие с металлами (to,
с литием при комнатной to):
3Mg + N2 = Mg3N2 нитрид
магния0
0
+2
-3
в-ль
о-ль
Взаимодействие с водородом:
N2 + 3H2
2NH3 + Q
Kat.
в-ль
о-ль
аммиак
0
0
-3
+1
Взаимодействие с кислородом
N2 + O2
Классификация реакции:
соединения
обратимая
каталитическая
ОВР
экзотермическая
гомогенная
2NO - Q
3000 - 4000oС
0
0
-2
+2
о-ль
в-ль
Слайд 22Применение азота
N2
Синтез аммиака
Холодильное
оборудование
Производство
взрывчатых
веществ
Производство
минеральных
удобрений
Слайд 31Получение аммиака
N2 + 3H2 ↔ 2NH3
t = 850оС Р = 5000
атм
t = 450оС Р = 300 атм
Катал.: Fe
Выход аммиака: 30% Циркуляционный
процессСлайд 34Химические cв-ва аммиака
NH3 - восстановитель, т.к. N-3 но:
NH3 (ж) + Nа
→ NаNH2 + H2
0
0
+1 +1
N2 + H2O
NH3 + O2 →t
t
Pt
NH3 +
Cl2 → N2 + HClNH3 + O2 → NO + H2O
Слайд 35Химические cв-ва аммиака
NH3 - основание Льюиса NH3 + HCl NH4Cl
NH3 +
H2SO4 (разб.) → NH3 + H3PO4 →
Слайд 36Соединения азота в (-) ст. ок.
Ст. ок. -3 -2 -1
Аммиак и его
производные
NH3
NaNH2 – амид натрия Na2NH – имид натрия Na3N –
нитрид натрияКарбамид СО(NH2)2
N-3
Слайд 372Na + 2NH3(ж) = 2NaNH2 + H2 NaNH2 + H2O = NaOH
+ NH3 М + N2 (toC) = МxNy
ионные нитриды:Ca3N2, Na3N, Mg3N2
ковалентные нитриды:
BN, AlN, Sn3N4Металлоидные нитриды: d-мет.
Соединения азота в (-) ст. ок.
Слайд 39N2H4 – жидкость
2 5
N2H4 +H2ON2H5OH OH- + N H +
гидроксид гидрозония
N2H5Cl - хлорид гидрозония (N2H5)2SO4 - сульфат гидрозония
N2H4 - более
сильный вос-ль, чем NH3N2H4+4KMnO4+4KOH=N2+4K2MnO4+4H2O







![Лекция 23
р-элементы V группы (пниктогены)
N, P, As, Sb, Bi
Сборная 8 классов Азот[аzоо] - безжизненный N …2s22p3 Ст.окисления:-3 -2 -1 -1/3NH3 N2H4 NH2OH HN3 NH4+NH2- NH2-0 +1 +2 +3N2 N2O NO N2O3HNO2+4 +5NO2 N2O5HNO3 Азот[аzоо] - безжизненный N …2s22p3 Ст.окисления:-3 -2 -1 -1/3NH3 N2H4 NH2OH HN3 NH4+NH2- NH2-0 +1 +2 +3N2 N2O NO N2O3HNO2+4 +5NO2 N2O5HNO3](/img/tmb/7/650676/e305b0b96bc2316b9860b47eda3bd2cd-800x.jpg)