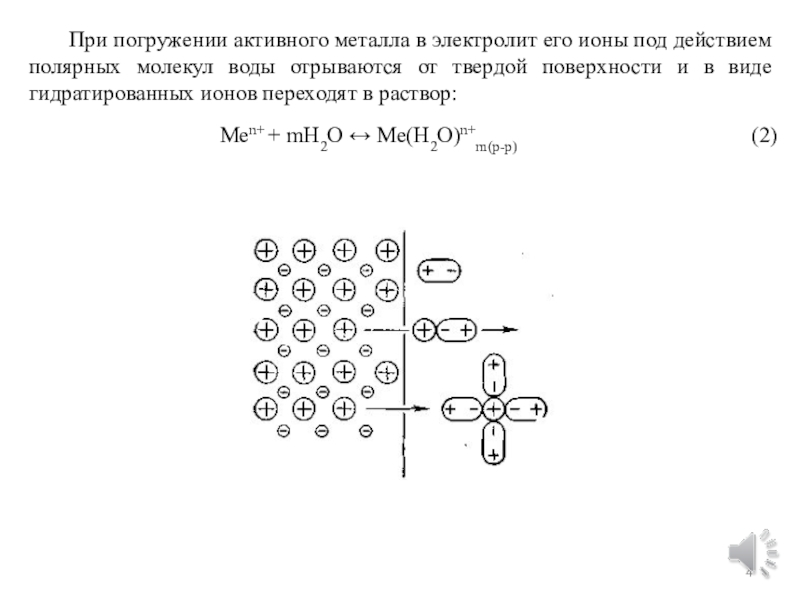
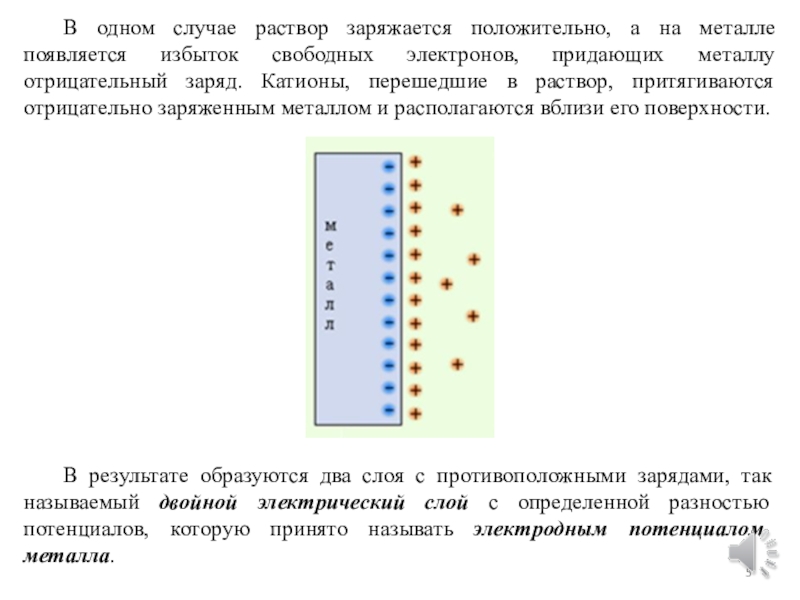
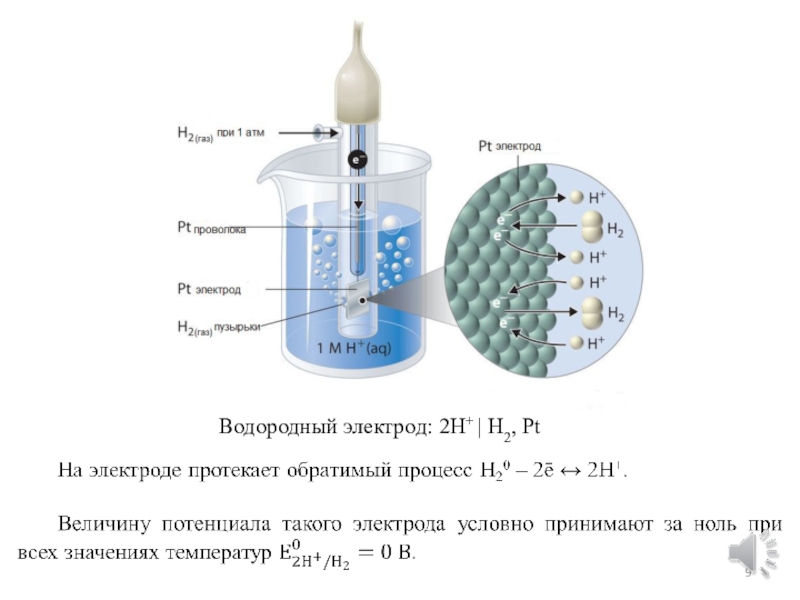
химической форм энергии.
Электрохимические процессы протекают на границе раздела фаз «электрод
– электролит»: в гальваническом элементе; при электролизе; в случае электрохимической коррозии металлов.1