Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
МЕТАБОЛИЗМ И ОСНОВЫ БИОЭНЕРГЕТИКИ
Содержание
- 1. МЕТАБОЛИЗМ И ОСНОВЫ БИОЭНЕРГЕТИКИ
- 2. Живые системы (клетка организм)
- 3. Специфические функции метаболизма: Извлечение энергии из окружающей
- 4. Процесс жизнедеятельности связан с выполнением
- 5. Метаболизм объединяет противоположно направ-ленные процессы:
- 6. Анаболизм – ферментативный синтез полимерных молекул
- 7. Катаболизм и анаболизм протекают в
- 8. Метаболический путь – последовательность хими-ческих
- 9. КатаболизмАнаболизм
- 10. Слайд 10
- 11. катаболизманаболизмТри стадии катаболизма и анаболизмаобход необратим. стадийМетаболиты
- 12. Катаболизм и анаболизм в основе процессов жизнедеятельности
- 13. Формы аккумулирования энергии в клетке: АТФ. Другие
- 14. 2. Пиридиновые и флавиновые нуклеотиды:
- 15. 3. Трансмембранный градиент протонов (Н+) на внутренней мембране митохондрий, создаваемый дыхательной цепью.
- 16. Энергетический цикл в клетке
- 17. Передача восстановительной способности через НАДФН
- 18. НАД+,НАДФ+ / НАДН,НАДФНВ молекуле НАД+ R =
- 19. ФАД+
- 20. Происхождение атомов Н, отщепляемые различными дегидрогеназами на
- 21. Челночный механизм – способ до-ставки атомов Н
- 22. Энергетические взаимосвязи между катаболическими и анаболическими путямиATP, NADH, FADH2, NADPH
- 23. Согласно определению В.П.Скулачева: Биоэнергетика
- 24. Законы биоэнергетики Липмана I закон биоэнеретики:
- 25. Система АТФ АДФ + Фн работает
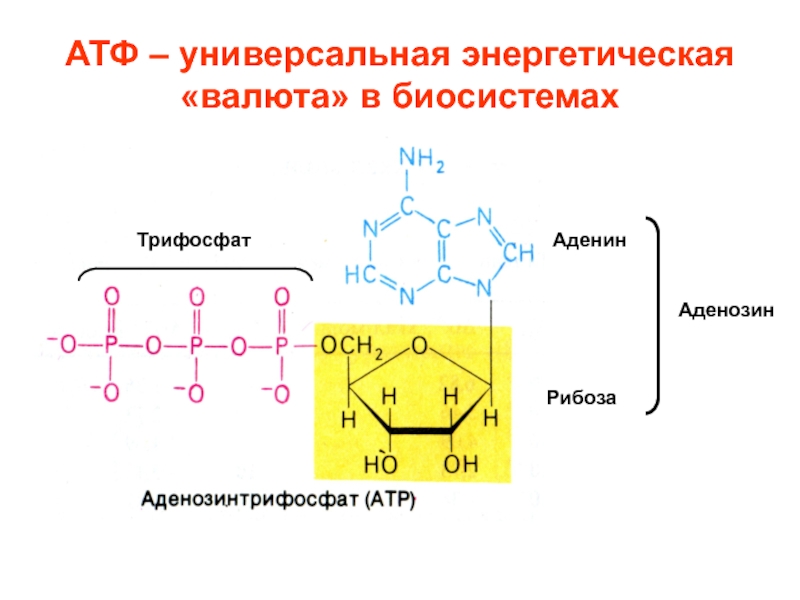
- 26. АТФ – универсальная энергетическая «валюта» в биосистемахАденинРибозаТрифосфатАденозин
- 27. Молекулы АТФ и АДФ при нейтральном значении
- 28. Слайд 28
- 29. АТФ и АДФ всегда связаны с Mg2+
- 30. Изменение свободной энергии компонентов спонтанно протекающей химической
- 31. Спонтанные химические процессы протекают до
- 32. Стандартная свободная энергия гидролиза АТФ (DGo):
- 33. Чему равно изменение свободной энергии (DG) гидролиза
- 34. Причины относительно высокой DGo гидролиза АТФТри структурных
- 35. Величина DGo гидролиза АТФ существенно зависит от
- 36. При «классическом» гидролизе АТФ
- 37. Показателем энергетического статуса клетки
- 38. АТФ – непосредственно используемый донор
- 39. Изменение стандартной свободной энергии (DGo) гидролиза биологически
- 40. Перенос фосфатных групп от фосфогенов (доноров фосфатных
- 41. Перенос высокоэнергетических фосфатных групп, помимо АТФ, происходит
- 42. Различные нуклеозид-5’-трифосфаты служат каналами, по которым энергия от АТФ направляется на специфические биосинтезы
- 43. Окислительное фосфорилирование ОФ – процесс образования АТФ,
- 44. Атомы водорода доставляются в дыхательную
- 45. Во внутренней мембране митохондрий нахо-дятся
- 46. Свойства внутренней мембраны митохондрий Эта мембрана
- 47. Переносчики Н+ и е- в дыхательной
- 48. Электронпереносящие комплексы, составля-ющие дыхатель-ную цепьАТФАТФАТФЭти комплексыможно выделить из митохондрий в виде функциональных ансамблей.Комплекс VАТФ синтетаза
- 49. Последовательность переносчиков е- в дыха-тельной
- 50. DGo, обусловленное переносом пары е- вдоль дыхательной
- 51. Характерная локализация отдельных комплексов, цитохрома с и АТФ-синтетазы во внутренней мембране митохондрийМежмебранное пространство(снаружи)Матрикс митохондрий(внутри)Пункты выброса Н+
- 52. Слайд 52
- 53. СТРОЕНИЕ КОМПЛЕКСОВ ДЫХАТЕЛЬНОЙ ЦЕПИКомплекс I – НАДН
- 54. Пространственное расположение атомов Fe и S в
- 55. Комплекс II – Сукцинат: убихинон оксидоредуктаза
- 56. Кофермент Q (коэнзим Q) Производное хинона
- 57. Кофермент Q – принимает Н+
- 58. Комплекс III – Убихинол : цитохром с
- 59. Цитохромы – железосодержащие гемопротеиды,
- 60. Комплекс IV – цитохром с-оксидаза (цитохромокси-
- 61. Комплекс V – АТФ – синтетаза (FoF1-АТФаза)Фермент,
- 62. Слайд 62
- 63. Эволюция взглядов на механизмы сопряжения дыхания с
- 64. В 1940 г. Белицер установил, что
- 65. Гипотезы о механизмах окислительного фосфорилирования
- 66. За всю историю существования этой
- 67. 2. Химио-осмотическая гипотеза (Питер Митчел,
- 68. Сопряжение переноса е- с синтезом АТФ, согласно
- 69. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Живые системы (клетка организм) – открытые
системы:
обмениваются с окружающей их средой ма-
Метаболизм – высокоинтегрированный и целена-правленный процесс, реализующийся в форме после-довательных мультиферментых реакций, которые обеспечивают обмен веществом и энергией между живой системой и средой её обитания.Слайд 3Специфические функции метаболизма:
Извлечение энергии из окружающей среды (хим.
энергию
из орган. веществ, либо энергию квантов
солнечного света) и аккумулирование
этой энергиив форме макроэргических связей АТФ и восстано-
вительной способности НАДФН;
Использование энергии АТФ и НАДФН для биосин-
теза de novo биомолекул (химическая работа), а
также для выполнения осмотической, механичес-
кой и электрической работы;
Синтез и распад молекул «специального» назначе-
ния (гормонов, медиаторов, цитокинов, факторов
роста, кофакторов и пр.).
Слайд 4 Процесс жизнедеятельности связан с выполнением следующих видов работы:
Механическая работа. Организм и его части движутся, преодолевая сопротивление среды.
2.
Химическая работа. Синтез биоорганических молекул (разрыв одних хим. связей и образование других).3. Осмотическая работа. Создает и поддерживает разность концентраций ионов или молекул.
4. Электрическая работа. Создает и поддерживает разность электрических потенциалов.
Слайд 5 Метаболизм объединяет противоположно направ-ленные процессы: катаболизм и анаболизм.
Катаболизм – ферментативное расщепление слож-ных, полимерных молекул (жиров,
углеводов, белков) на простые компоненты (лактат, ацетат, аммиак, моче-вина) входе преимущественно реакций окисления. На определенных стадиях процесс сопровождается вы-делением свободной энергии. Большая часть свободной энергии аккумулируется (не запасается) в форме энергии фосфоангидридных связей молекулы АТФ (главное высокоэнергетичес-кое соединение). Меньшая часть извлечённой сво-бодной энергии аккумулируется в форме атомов водорода в молекулах НАДФН.
Слайд 6 Анаболизм – ферментативный синтез полимерных молекул из сравнительно простых
по химическому строению предшественников (прекурсоров). Как всякий синтез, анаболизм потребляет
свободную энергию, которая поставляется молекулами АТФ и НАДФН.Вновь синтезированные биомолекулы необходи-мы для обновления структурно-функциональных элементов клеток и тканей. Преимущественно проис-ходят реакции восстановления.
Амфиболические пути - объединяют пути синтеза и распада (ПФП, ЦТК).
Слайд 7 Катаболизм и анаболизм протекают в клетках одно-временно.
Они пространственно разделены (разобщены) путем компартментализации и/или с помощью различных
условий катализа (требуются разные ферменты и коферменты, ферменты имеют различную локали-зацию).Скорости реакций катаболизма и анаболизма регули-руются независимо.
Слайд 8 Метаболический путь – последовательность хими-ческих реакций, катализируемых мультиферментны-ми
системами (от 2 до 20 ферментов).
Все ферменты пути
действуют совместно, в опреде-ленной последовательности: P одной реакции стано-вится S следующей реакции и т.д. Продукты последовательных превращений – обра-зуют промежуточные продукты (метаболиты).
В основном, метаболические пути бывают линей-ными или циклическими.
Активность любого метаболического пути регули-руют несколько «ключевых» ферментов: они катали-
зируют необратимые химические реакции. Эти реак-ции определяют направление биохимических превра-щений. (Иначе, по закону действующих масс, продук-ты начнут превращаться в исходные молекулы).
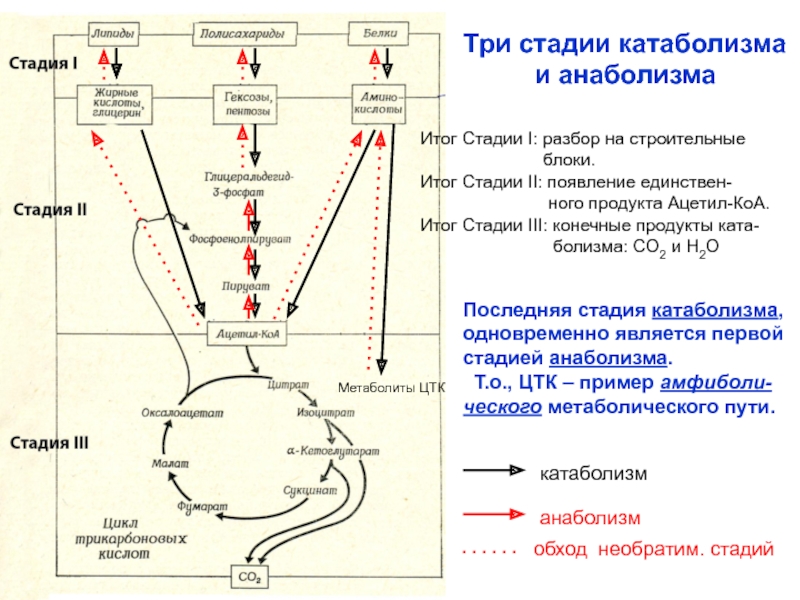
Слайд 11катаболизм
анаболизм
Три стадии катаболизма
и анаболизма
обход необратим. стадий
Метаболиты ЦТК
Итог Стадии I:
разбор на строительные
блоки.Итог Стадии II: появление единствен-
ного продукта Ацетил-КоА.
Итог Стадии III: конечные продукты ката-
болизма: СО2 и Н2О
Последняя стадия катаболизма,
одновременно является первой
стадией анаболизма.
Т.о., ЦТК – пример амфиболи-
ческого метаболического пути.
Слайд 13Формы аккумулирования энергии
в клетке:
АТФ. Другие нуклеозид-трифосфаты: Гуано-
зин-ТФ, Уридин-ТФ и Цитидин-ТФ. Содержат-
ся в
небольших количествах, имеют сходнуюс АТФ величину DGo гидролиза. Поставляют
энергию в строго определеные биосинтети-
ческие пути:
АТФ + нуклеозид-ДФ АДФ + нуклеозид-ТФ
АТФ постоянно образуется и потребляется.
Это главный непосредственно используемый
донор свободной энергии в биосистемах.
Слайд 14 2. Пиридиновые и флавиновые нуклеотиды:
НАДН, НАДФН
и ФАДН2.
2.1. НАДН и ФАДН2 – специфические перенос-
чики Н от окисляемых «топливных» мо-лекул в дыхательную цепь митохондрий,
где синтезируется основная часть АТФ
(более 90%).
2.2. НАДФН – главный донор Н для биосинте-
тических путей: молекулы субстратов
биосинтетических реакций более окис-
лены по сравнению с продуктами.
Поэтому, помимо энергии АТФ требуются
восстановительные эквивалентны. (Вос-
становительный биосинтез).
Слайд 153. Трансмембранный градиент протонов (Н+)
на внутренней мембране митохондрий,
создаваемый дыхательной цепью.
Слайд 16Энергетический цикл в клетке
Цикл АТФ – АДФ
В результате
катаболического расщепления химических связей вмолекулах «топлива», высвобож-дается свободная энергия, которая аккумулируется (не запасается) в форме химической энергии – энер-гии фосфоангидридной связи молекулы АТФ.
Свободная энергия (DG) – часть общей энергии (DE), которая может быть использована для совершения работы (при Р = const. и Т = const.)
DE = DG +TDS
где: TDS – тепловой эффект реакции.
Живые системы изотермичны!!!
Использование тепловой энергии для совершения хим. и мех. работы невоз-можно.
Слайд 17 Передача восстановительной способности через НАДФН
В катаболических реакциях
окисления, от S отнимаются
атомы Н. Эти атомы переда-
ются в
реакции биосинтеза (для восстановления двойных
связей) с помощью кофер-
ментов – переносчиков Н,
главный из них НАДФН. Ме-
нее значимым являет ФАД.
На схеме – передача восста-
новительной способности
посредством НАДФН.
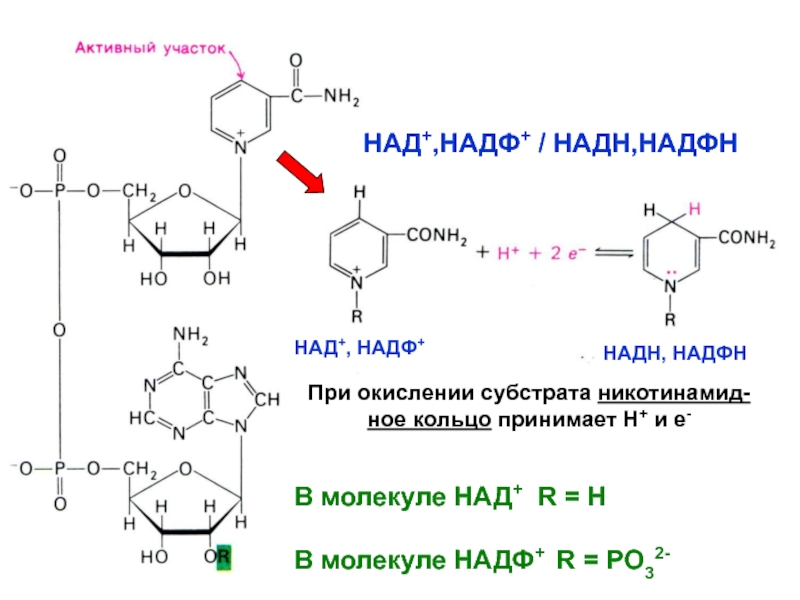
Слайд 18НАД+,НАДФ+ / НАДН,НАДФН
В молекуле НАД+ R = H
В молекуле НАДФ+
R = PO32-
При окислении субстрата никотинамид-
ное кольцо принимает Н+ и
е-НАД+, НАДФ+
НАДН, НАДФН
Слайд 20Происхождение атомов Н, отщепляемые различными дегидрогеназами на I и II
стадиях катаболизма.
Эти атомы Н переносят НАДН и ФАДН2 в
дыхательную цепь, где происходит разде-ление зарядов (Н+ и е-) и в результате окислительного фосфорилирования синтези-руется основное количество АТФ.Слайд 21Челночный механизм – способ до-
ставки атомов Н из цитоплазмати-
ческого НАДН
в дыхательную цепь
митохондрий.
Мембрана митохондрий непроницаема
для цитоплазматического НАДН
Глицерофосфатный
челночный механизм
(односторонний)Малат-аспартатный
челночный механизм (работает
в обоих направлениях).
Для поступления цитозольного НАДН
необходимо, чтобы в цитозоле отноше-
ние НАДН/НАД+ было больше, чем в
матриксе митохондрий.
НАД-зависимая ДГ
ФАД-зависимая ДГ
трансаминирование
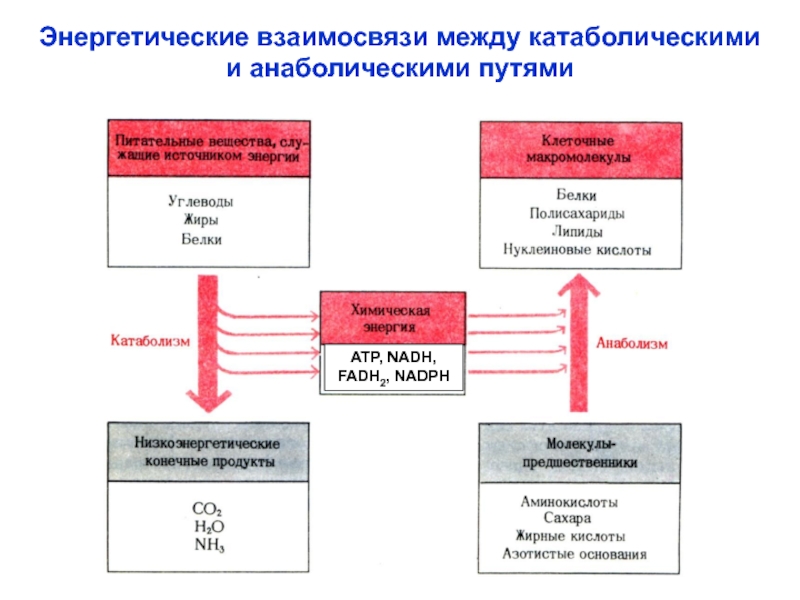
Слайд 22Энергетические взаимосвязи между катаболическими
и анаболическими путями
ATP, NADH,
FADH2, NADPH
Слайд 23Согласно определению В.П.Скулачева:
Биоэнергетика – раздел биохимии
(биологии), изучающая превращение энергии внешних ресурсов в биологи-чески полезную работу.
Слайд 24Законы биоэнергетики Липмана
I закон биоэнеретики: катаболические процессы сопровождаются
аккумулировани-ем энергии (в основном – АТФ). Все анаболи-ческие процессы сопровождаются
потребле-нием энергии АТФ.II закон биоэнергетики: последовательное сокращение многообразия источников энер-гии до унифицированной молекулы (ацетил-КоА), позволяет достигнуть единообразия процессов преобразования энергии (ЦТК
дыхательная цепь митохондрий).
Слайд 25Система АТФ АДФ + Фн работает как центральный переносчик
свободной энергии.
1929 г. – Фиске и Суббароу выделили АТФ из
кислогоэкстракта мышц.
1948 г. – Тодд подтвердил строение молекулы АТФ с
помощью химического синтеза.
1938 – 1941 гг. – Липман и Калькар доказали, что АТФ
играет центральную роль в переносе хими-
ческой энергии в клетке.
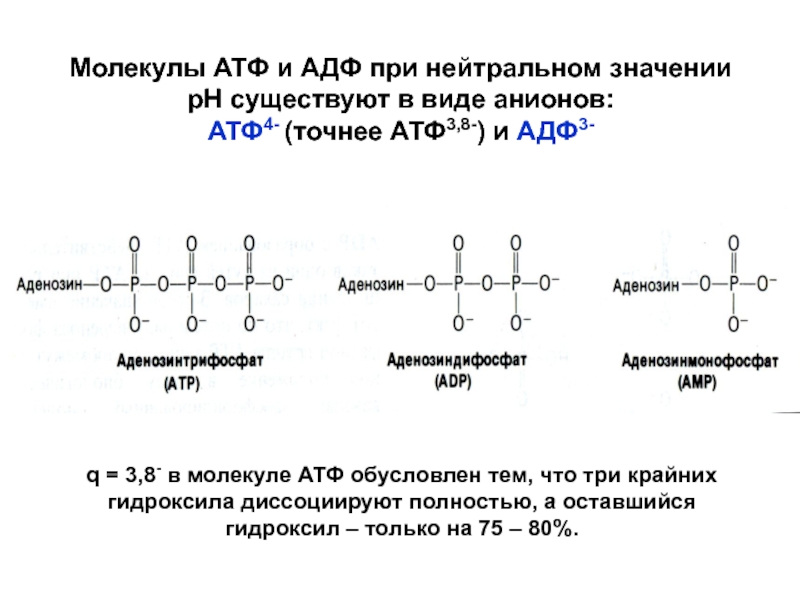
Слайд 27Молекулы АТФ и АДФ при нейтральном значении рН существуют в
виде анионов:
АТФ4- (точнее АТФ3,8-) и АДФ3-
q = 3,8- в молекуле
АТФ обусловлен тем, что три крайних гидроксила диссоциируют полностью, а оставшийся
гидроксил – только на 75 – 80%.
Слайд 28
O- O- O-
| | |
Аденозин – О – Р – О – Р -- О – Р –О-
|| || ||
O O O
Сложноэфирная связь
Две фосфоангидридные связи
Липман предложил термин «высокоэнергетическая фосфатная связь» (макроэргическая связь) и «высо-коэнергетические фосфатные группы», которые он предложил обозначать символом ( ~ ):
Аденозин – Р ~ Р ~ Р
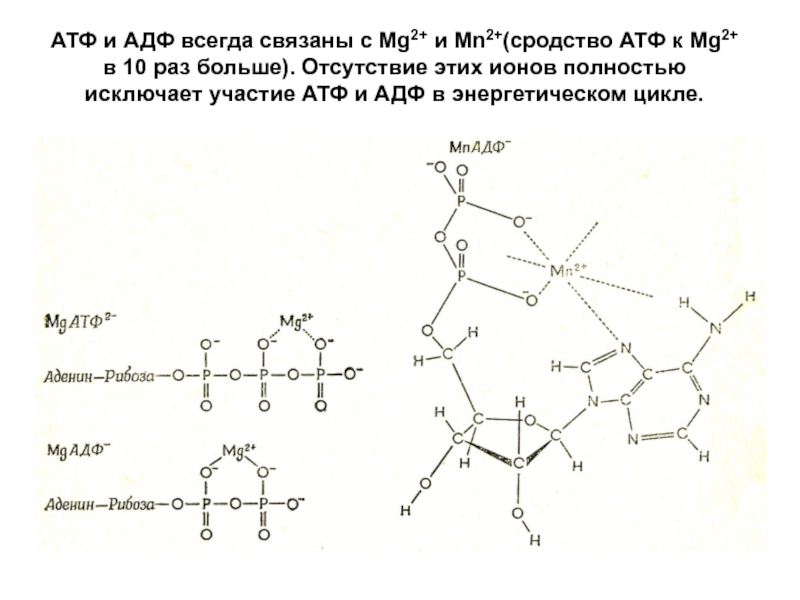
Слайд 29АТФ и АДФ всегда связаны с Mg2+ и Mn2+(сродство АТФ
к Mg2+ в 10 раз больше). Отсутствие этих ионов полностью
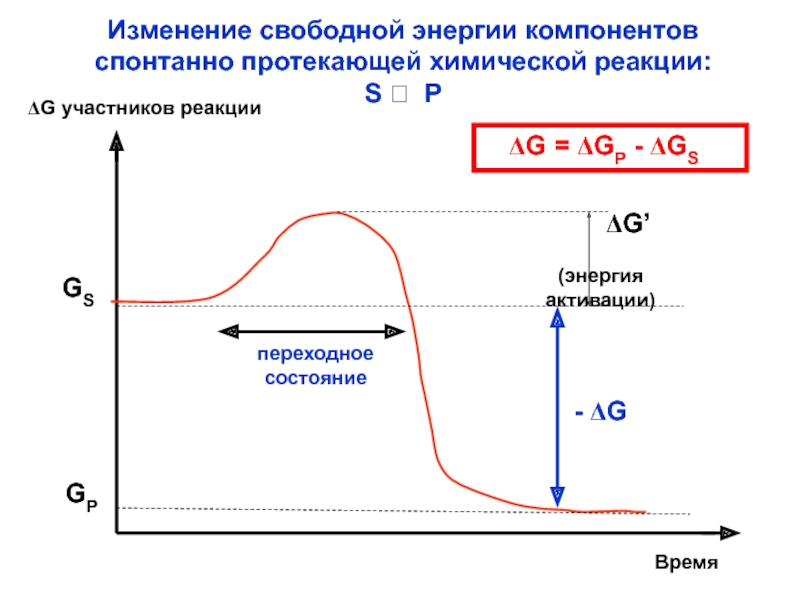
исключает участие АТФ и АДФ в энергетическом цикле.Слайд 30Изменение свободной энергии компонентов спонтанно протекающей химической реакции:
S P
DG
участников реакции
GS
GP
- DG
DG’
(энергия активации)Время
переходное
состояние
DG = DGP - DGS
Слайд 31 Спонтанные химические процессы протекают до тех пор, пока
не достигнут состояния равновесия:
aA + bB cC + dD
Согласно
закону действующих масс, константа рав-новесия (Keq) будет:[C]C [D]d
Keq = --------------
[A]a [B]b
Рассчитать величину изменения свободной энергии (DG) конкретного химического превращения можно:
DG = DGo + RT ln Keq
где: DGo – изменение стандартной свободной энергии, то есть в стандартных условиях: [S] и [P] = 1 моль/л, То = 37оС, рН 7,0
Р = 1 атм. и [Mg2+]избыт.
Слайд 32Стандартная свободная энергия гидролиза АТФ (DGo):
Установлено, что DGo
для реакации гидролиза концевой фосфоангидридной (макроэргической) связи АТФ:
АТФ + Н2О АДФ + ФнDGo АТФ = - 7,3 ккал/моль
Для любого конкретного вещества, вступающего в химическую реакцию, DGo является константой.
* * *
В живых системах не обнаружен фермент, который мог бы катализировать гидролиз АДФ согласно уравнению:
АДФ + Н2О АМФ + Фн
Слайд 33Чему равно изменение свободной энергии (DG) гидролиза АТФ в интактных
клетках?
DGo АТФ = - 7,3 ккал/моль (определено в стандартных условиях).
В клетке [АТФ], [АДФ] и [Фн], во-первых, не равны между собой; во-вторых, они намного меньше 1 моль/л; в-третьих, рН также отличается от 7,0 (рН 7,35 – 7,4).Если учесть реальные значения вышеперечислен-ных параметров в интактном эритроците, то расчет покажет, что DG АТФ = - 12,4 ккал/моль
Для большинства клеток DG АТФ лежит в диапазоне:
от -12 до -16 ккал/моль
Слайд 34Причины относительно высокой DGo гидролиза АТФ
Три структурных фактора:
При рН =
7,0 молекула АТФ полностью ионизирована (АТФ4-):
АТФ4- + Н2О АДФ3-
+ НРО42- + Н+ равновесия реакции сдвинуто вправо.
2. В трифосфате АТФ высока плотность - q, что приводит к их сильному взаимооталкиванию. После гидролиза концевой фосфатной связи это взаимооталкивание ослабевает, а продукты (АДФ3- и Фн2-), несущие одноименный заряд, не позволяют вновь образовать АТФ.
3. Продукты гидролиза АТФ (АДФ3- и Фн2-) имеют структуру, для которой характерен переход части электронов на низкоэнергетические уровни. Поэтому запас свободной энергии продуктов существенно меньше, чем в негидролизованной АТФ.
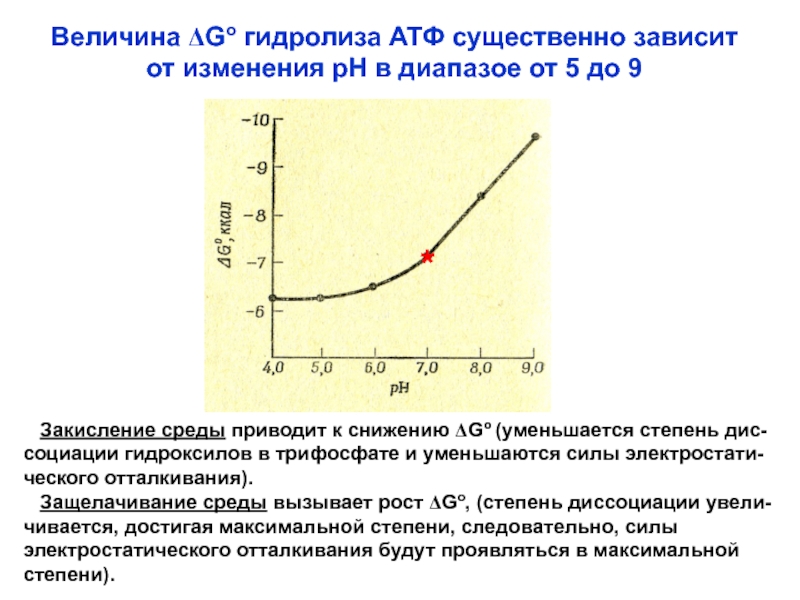
Слайд 35Величина DGo гидролиза АТФ существенно зависит от изменения рН в
диапазое от 5 до 9
Закисление среды приводит к
снижению DGo (уменьшается степень дис-социации гидроксилов в трифосфате и уменьшаются силы электростати-
ческого отталкивания).
Защелачивание среды вызывает рост DGo, (степень диссоциации увели-
чивается, достигая максимальной степени, следовательно, силы
электростатического отталкивания будут проявляться в максимальной
степени).
*
Слайд 36 При «классическом» гидролизе АТФ теряет одну концевую
ортофосфатную группу - ортофосфатное расщепление АТФ:
АТФ + Н2О АДФ
+ Фн(DGo = - 7,3 ккал/моль)
Происходит также пирофосфатное расщепление АТФ - отщепляется пирофосфат :
АТФ АМФ + ФФн
(DGo = - 7,7 ккал/моль)
Пример: активация ЖК, когда образуется КоАэфир ЖК.
Аденилаткиназа: АМФ + АТФ 2 AДФ
Слайд 37 Показателем энергетического статуса клетки служит
энергетический заряд (ЭЗ) по Д. Аткинсону:
[ATP] + ½ [ADP]Энергетический заряд (ЭЗ) =
[ATP] + [ADP] + [AMP]
½ ADP – молекула содержит 1 фосфоангидридную
cвязь, а ATP – 2 таких связи
ЭЗ = 0, когда в системе есть только АМФ
ЭЗ = 1, когда в системе есть только АТФ
В большинстве типов клеток ЭЗ = 0,80 – 0,95
АТФ-синтезирующие пути ингибируются высоким ЭЗ
АТФ-потребляющие пути активируются высоким ЭЗ
Слайд 38 АТФ – непосредственно используемый донор сво-бодной энергии. Это
не форма запасания свободной энергии. АТФ постоянно синтезируется и постоянно
расходуется. В физиологических условиях внутри-клеточная концентрация АТФ варьирует в очень узком диапазоне значений.В клетке есть резервный запас свободной энергии в форме высокоэнергетических фосфорилирован-ных соединений (фосфагенов). Они обмениваются фосфорилом с АДФ в результате чего образуется молекула АТФ. Эти реакции катализируются специфическими киназами (класс фосфотрансфе-разы):
Х-Ф + АДФ Х + АТФ
Слайд 39Изменение стандартной свободной энергии (DGo) гидролиза биологически значимых высокоэнергетических фосфорилированных
соединений - фосфагенов
Условная граница проходит на уровне глюкозо-1-фосфата.
Фосфоенолпируват и
3-фосфогли-церат - сверхвысокоэнергетичес-кие соединения. Наряду с креатин-фосфатом их называют фосфагенами.АТФ занимает промежуточное положение на шкале, что обус-ловливает его функцию – служить посредником при переносе фос-фатных групп от высокоэнерге-тических соединений к их акцепто-рам – лежащим на шкале ниже АТФ.
Слайд 40Перенос фосфатных групп от фосфогенов
(доноров фосфатных групп) через АДФ
к различным
соединениям - акцепторам
ФЕП + АДФ АТФ
3-ФГФ +
АДФ АТФКреатин-Ф + АДФ АТФ
Слайд 41Перенос высокоэнергетических фосфатных групп, помимо АТФ, происходит с помощью других
нуклеозид-5’-трифосфатов
Трифосфат
Трифосфат
Рибоза
ГУАНИН
Рибоза
ЦИТОЗИН
УРАЦИЛ
Рибоза
Трифосфат
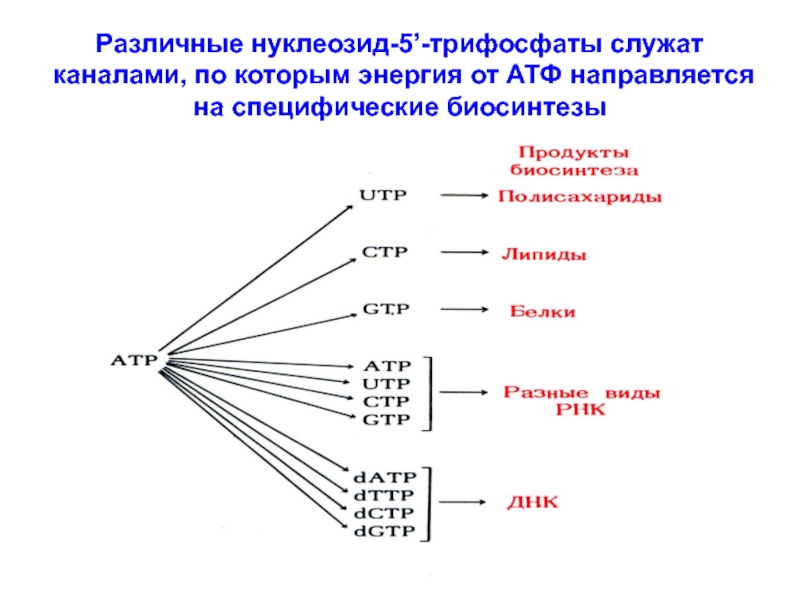
Гуанозин трифосфат, ГТФ (GTP)
Цитидин трифосфат, ЦТФ (CTP)
Уридин трифосфат, УТФ (UTP)
Эти
нуклеозид- 5’-трифосфаты содержатся в клетках в значительно меньших количествах, чем АТФ, но имеют такую же величину DGo гидролиза.Нуклеозид-5’-трифосфаты используются в строго специфических био-синтезах. Свои концевые фосфатные группы они получают от АТФ. Процесс катализируют нуклеозиддифосфокиназы. В общем виде уравнение этой реакции:
АТФ + нуклеозид- 5’-ДФ АДФ + нуклеозид- 5’-ТФ
Слайд 42Различные нуклеозид-5’-трифосфаты служат каналами, по которым энергия от АТФ направляется
на специфические биосинтезы
Слайд 43Окислительное фосфорилирование
ОФ – процесс образования АТФ, сопряженный с транс-
портом
е- по цепи переносчиков от НАДН (ФАДН2) к О2.
Митохондрия
имеет двойную мембрану [Паллад и Сьёстранд – электронная микроскопия].
ОФ происходит в митохондриях, во внутреннюю мемб-
рану которых «встроена» цепь переносчиков е-.
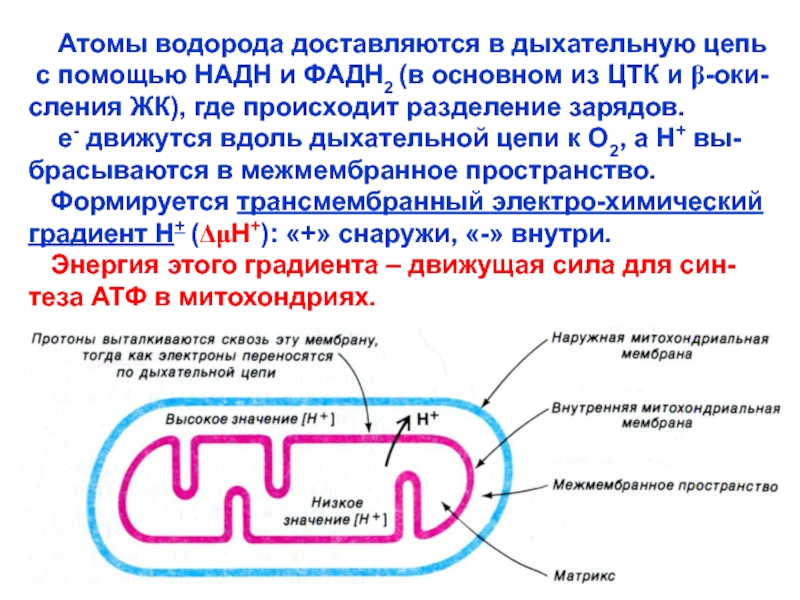
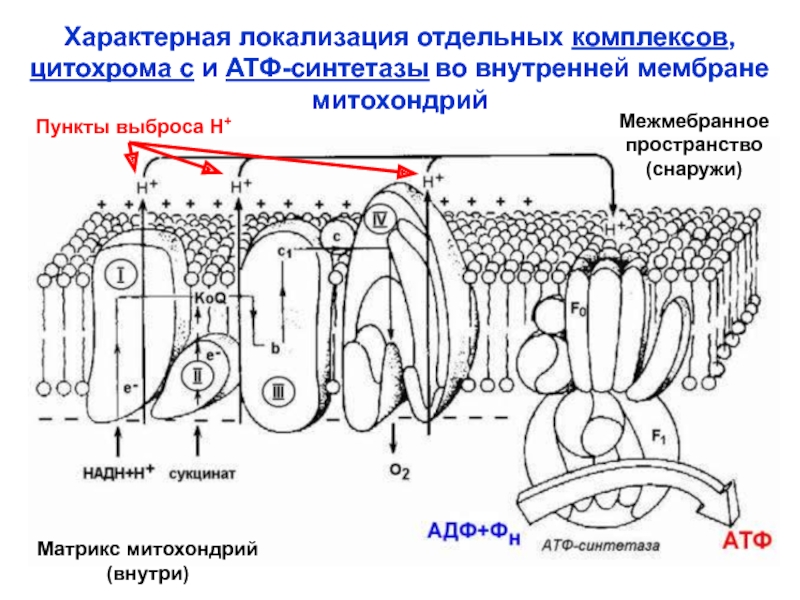
Слайд 44 Атомы водорода доставляются в дыхательную цепь
с
помощью НАДН и ФАДН2 (в основном из ЦТК и b-оки-
сления
ЖК), где происходит разделение зарядов. е- движутся вдоль дыхательной цепи к О2, а Н+ вы-брасываются в межмембранное пространство.
Формируется трансмембранный электро-химический
градиент Н+ (DmH+): «+» снаружи, «-» внутри.
Энергия этого градиента – движущая сила для син-теза АТФ в митохондриях.
Слайд 45 Во внутренней мембране митохондрий нахо-
дятся переносчики е- ,
составляющие дыха-
тельную цепь, и ферменты, синтезирующие
АТФ из АДФ и
Фн (Н+-АТФ-синтетазы). Перенос-чики являются сложными белками на долю
которых приходится до 75% массы внутренней
мембраны органелл [Кеннеди и Лениджер в ко-
нце 40-х годов ХХ века разработали метод
выделения митохондрий из тканей и доказа-
ли существование переносчиков е-].
Слайд 46Свойства внутренней мембраны митохондрий
Эта мембрана не проницаема для
Н+ и большинства
ионов, пиридиновых нуклеотидов, а также для многих
незаряженных
молекул.Во внутренней мембране находятся:
Высокоспецифичный переносчик – адениннуклео-
тидтранслоказа: обеспечивает перенос цитозоль-
ного АДФ в матрикс митохондрий с одновременным
переносом АТФ из матрикса в цитозоль (антипорт).
2. Высокоспецифичный переносчик для пирувата.
3. Переносчик для карнитиновых эфиров длинноцепо-
чечных жирных кислот.
4. Сукцинатдегидрогеназа.
Слайд 47 Переносчики Н+ и е- в дыхательной цепи
организованы в
форме пяти структурно
обособленных комплексов, которые функцио-
нально связанны между собой.
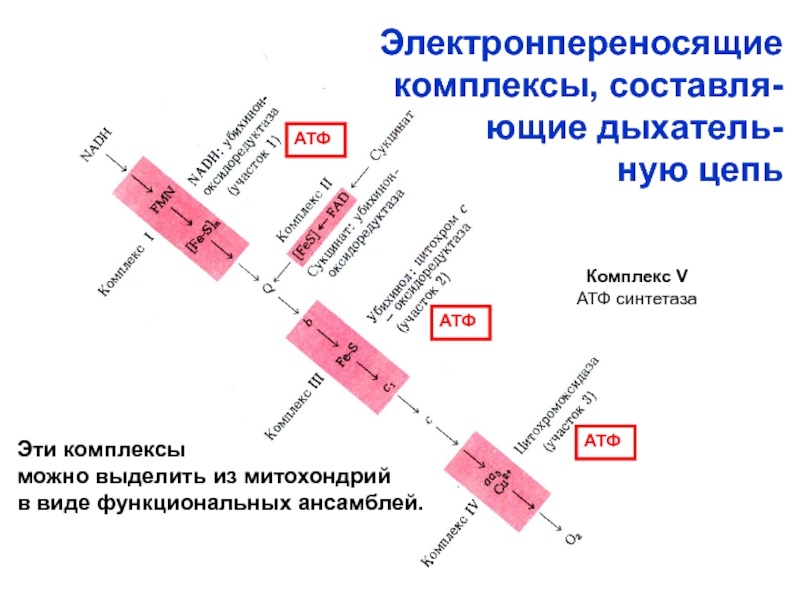
Слайд 48 Электронпереносящие
комплексы, составля-
ющие дыхатель-
ную цепь
АТФ
АТФ
АТФ
Эти комплексы
можно выделить из
митохондрий
в виде функциональных ансамблей.
Комплекс V
АТФ синтетаза
Слайд 49 Последовательность переносчиков е- в дыха-
тельной цепи находится в
строгом соответст-вии с величиной их окислительно-восстанови-тельного потенциала (Ео, вольт).
Стандартные
Е’о основных окисл.-восст. пар дыха-тельной цепи:НАДН / НАД+ …….. -0,32 В
цитохром b ……... -0,07 В
цитохром с ……… +0,22 В
Н2О / ½ О2 ………. +0,82 В
Восстановители (доноры е-) имеют -Ео, в то время как окислители (акцепторы е-) имеют +Ео.
Окисл.-восст. пары с –Ео будут отдавать е- окисл.-восст.парам с +Ео. Этим определяется направление переноса е- вдоль дыхатель-ной цепи.
Слайд 50DGo, обусловленное переносом пары е- вдоль
дыхательной цепи к О2
Установлено
3 участка, где величина DGo достаточна для синтеза молекулы АТФ.
Комплекс
I (1 молекула АТФ)
Комплекс III
(1 молекула АТФ)
Комплекс IV
(1 молекула
АТФ)
Слайд 51Характерная локализация отдельных комплексов,
цитохрома с и АТФ-синтетазы во внутренней
мембране
митохондрий
Межмебранное
пространство
(снаружи)
Матрикс митохондрий
(внутри)
Пункты выброса Н+
Слайд 53СТРОЕНИЕ КОМПЛЕКСОВ ДЫХАТЕЛЬНОЙ ЦЕПИ
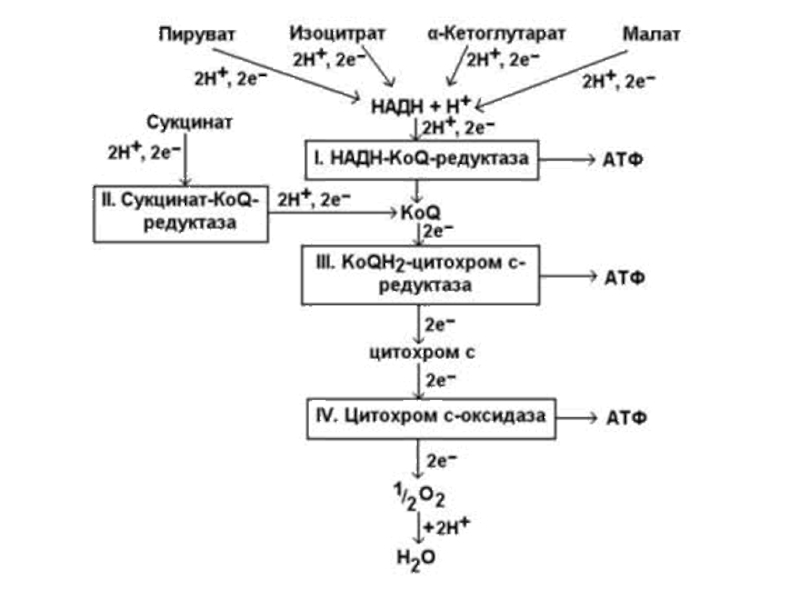
Комплекс I – НАДН : убихинон оксидоредуктаза
Сначала 2 е- от НАДН передаются на простетическую группу дегидрогеназы – на флавинмононуклеотид (ФМН). Затем 2 е- поступают в Fе-S центры (содержит-ся 2 вида центров). Далее 2 е- передаются на кофер-мент Q (коэнзим Q).
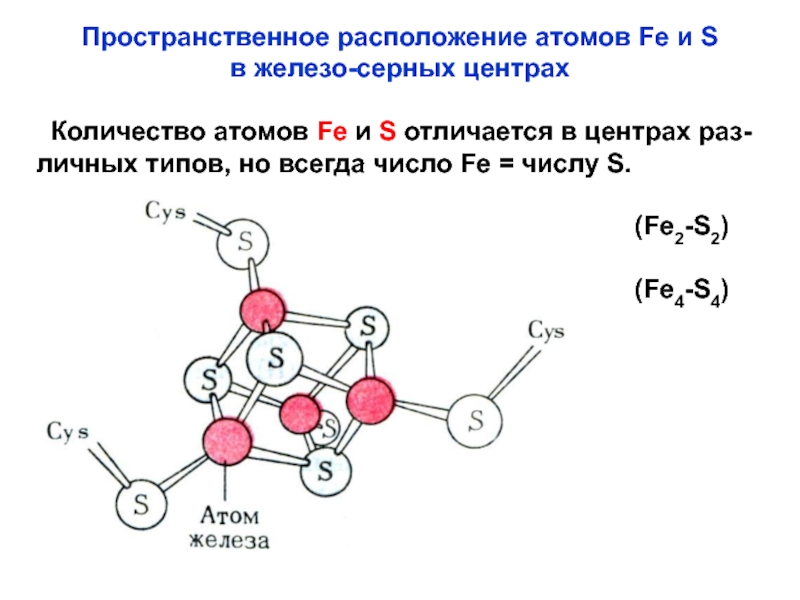
Слайд 54Пространственное расположение атомов Fe и S
в железо-серных центрах
Количество
атомов Fe и S отличается в центрах раз-личных типов, но
всегда число Fe = числу S.(Fe2-S2)
(Fe4-S4)
Слайд 55Комплекс II – Сукцинат: убихинон оксидоредуктаза
(Сукцинат-ДГ = СДГ)
СДГ – флавопротеин, содержит ковалентно связан-ный ФАД (простетическая группа) и 2 Fe-S центра.
В ходе реакции сукцинат дегидрируется с образова-нием фумарата:
Сукцинат + Е-ФАД Фумарат + Е-ФАДН2
Отщеплённые от сукцината 2Н+ и 2е- передаются на
коэнзим Q.
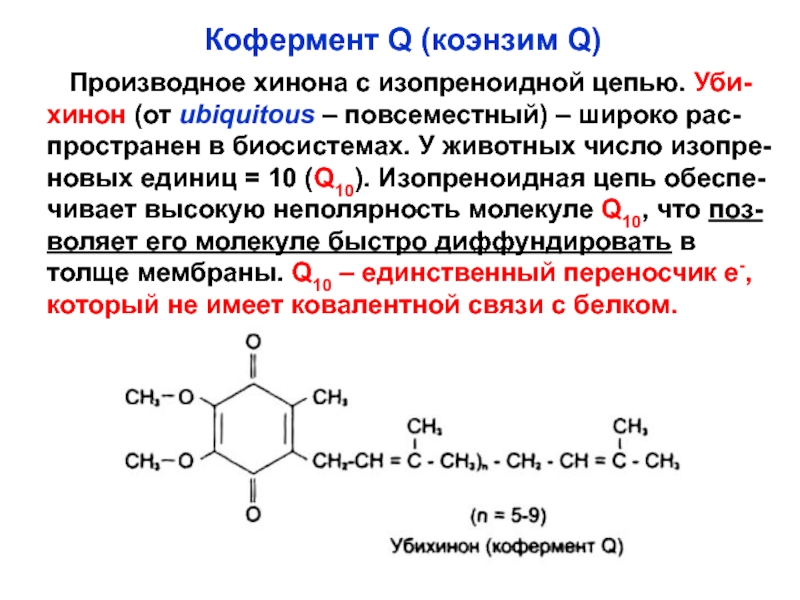
Слайд 56Кофермент Q (коэнзим Q)
Производное хинона с изопреноидной цепью.
Уби-
хинон (от ubiquitous – повсеместный) – широко рас-
пространен в биосистемах.
У животных число изопре-новых единиц = 10 (Q10). Изопреноидная цепь обеспе-
чивает высокую неполярность молекуле Q10, что поз-
воляет его молекуле быстро диффундировать в
толще мембраны. Q10 – единственный переносчик е-,
который не имеет ковалентной связи с белком.
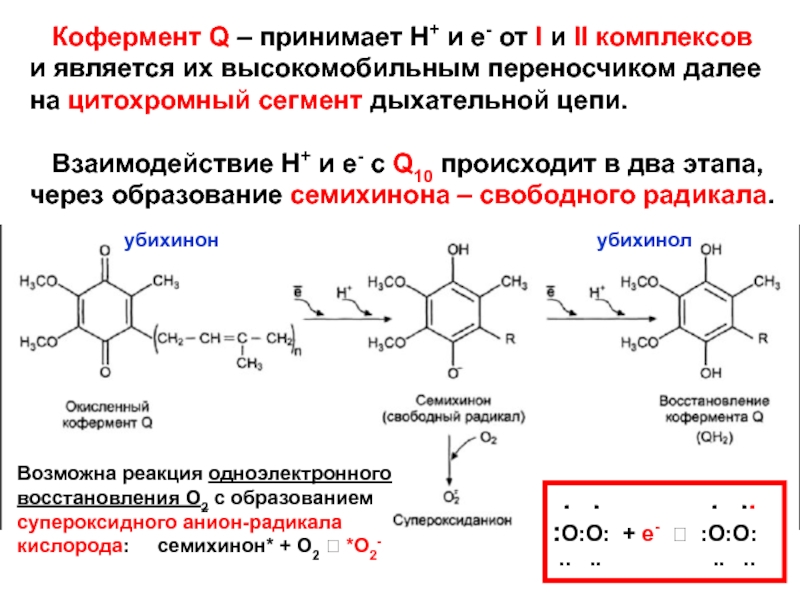
Слайд 57 Кофермент Q – принимает Н+ и е- от
I и II комплексов
и является их высокомобильным переносчиком далее
на цитохромный сегмент дыхательной цепи.
Взаимодействие Н+ и е- с Q10 происходит в два этапа,
через образование семихинона – свободного радикала.
Возможна реакция одноэлектронного
восстановления О2 с образованием
супероксидного анион-радикала
кислорода: семихинон* + О2 *O2-
. . . ..
:О:О: + е- :О:О:
.. .. .. ..
убихинон
убихинол
Слайд 58Комплекс III – Убихинол : цитохром с оксидоредуктаза
Содержит
цитохромы b и c1, а также Fe-S центры.
Переносит е- от
коэнзима QH2 (убихинола) на цитохром b, затем на Fe-S центр, затем на цитохром с1 и далее – на цитохром с. Поскольку убихинол приносит 2 е-, то он передаёт их yа 2 молекулы цитохрома b. Fe в составе гема может одномоментно принять только 1 е-.
Цитохром с - водорастворимый мембранный гемопротеид. Обращен на внешнюю поверхность внутренней мембраны митохондрий, легко отделяется от неё.
Этот цитохром, подобно Q10, является переносчиком е- между III и IV комплексами дыхательной цепи.
Слайд 59 Цитохромы – железосодержащие гемопротеиды, участвующие в переносе
е- [Кейлин, 1925]. Простети-ческая группа – гем.
В цит.
с и с1 гем ковалентно связан с белком, в цит. b – нет ковалентной связи с белком.В процессе переноса е- происходит: Fe3+ Fe2+
Гем в цитохромах с и с1.
Слайд 60Комплекс IV – цитохром с-оксидаза (цитохромокси-
даза)
Содержит цитохромы а и а3. Их гемы отличаются от цитохромов с и с1 по строению боковых углеводо-родных цепей. Цитохром а3 содержит Сu (2+ 1+).
Восстановленный цитохром с отдает е- сначала на цитохром а, затем на цитохром а3 и далее – на О2.
Происходит реакция:
О2 + 4Н+ + 4е- 2H2O
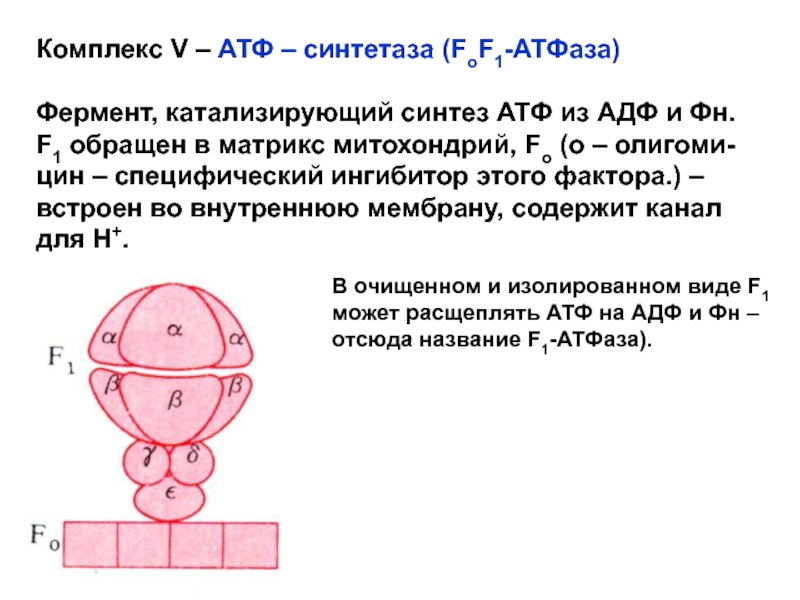
Слайд 61Комплекс V – АТФ – синтетаза (FoF1-АТФаза)
Фермент, катализирующий синтез АТФ
из АДФ и Фн.
F1 обращен в матрикс митохондрий, Fo (о
– олигоми-цин – специфический ингибитор этого фактора.) – встроен во внутреннюю мембрану, содержит канал для Н+.В очищенном и изолированном виде F1
может расщеплять АТФ на АДФ и Фн –
отсюда название F1-АТФаза).
Слайд 63Эволюция взглядов на механизмы сопряжения
дыхания с фосфорилированием
В начале 30-х годов ХХ века Энгельгардт (СССР) высказал идею
о сопряжении между фосфорилирова-нием АДФ и аэробным дыханием. Правильность идеи была подтверждена после 1937 г. поле открытия ЦТК. Белицер и Калькар (Дания) показали in vitro, что при окислении интермедиатов ЦТК из среды инкуба-ции исчезал Фн, который далее обнаруживался в составе АТФ и др. органических фосфатов. При этом цианид (ингибитор дыхания) – отменял эффект такого фосфорилирования. Следовательно, фосфорилиро-вание АДФ связано с дыханием (а не с гликолизом) и является механизмом аэробного извлечения энергии из «питательных» веществ.Слайд 64 В 1940 г. Белицер установил, что в результат переноса
2е-
от субстрата к О2 образуется более 1 молекулы АТФ:
отношение
Р/О около 3.В 1948 – 50 гг. Лумис и Липман описали эффект
2,4-ДНФ: с его помощью можно разобщить дыхание и
фосфорилирование – останавливается синтез АТФ, а
дыхание сохраняется и даже усиливается.
В 1948 г. Кеннеди и Лениджер впервые показали, что
изолированные митохондрии способны реализовать
окислительное фосфорилирование (синезировать АТФ
в ходе окисления метаболитов ЦТК). Фактически, эти
исследователи экспериментально доказали гипотезу
Белицера.
Слайд 65 Гипотезы о механизмах окислительного фосфорилирования
1. Гипотеза
химического сопряжения.
В основе концепция, согласно которой перенос е-
происходит виде серии последовательных реакций,
имеющих промежуточный продукт, содержащий высо-коэнергетическую связь:
Аred. + I + Box. Aox.~I + Bred.
Aox.~I + E Aox.+ E~I
E~I + P I + E~P
E~P + ADP E + ATP
А, В –переносчики е-; I - фактор сопряжения; Е – фермент для синтеза АТФ
Слайд 66 За всю историю существования этой гипотезы и
поисков
промежуточного высокоэнергетического сое-
динения (Aox.~I) – его так и не удалось
обнаружить.Гипотеза не учитывала факта: окислительное фос-
форилирование происходит только в препарате натив-
ных митохондрий – замкнутая мембранная структура.
Слайд 67 2. Химио-осмотическая гипотеза (Питер Митчел, 1961)
Основные положения:
Наличие замкнутой мембраны, непроницаемой для Н+.
Дыхательная
цепь митохондрий осуществляет разде-ление зарядов: е- движутся к О2, а Н+ выбрасываются
наружу – создаётся трансмембранный электро-хими-
ческий градиент Н+.
Энергия градиента используется для синтеза АТФ из
АДФ и Фн с участием АТФ-синтетазы (градиент – дви-
жущая сила для образования АТФ).
2,4-ДНФ, как липофильное соединение, встраивается в мембрану митохондрий и образует искусственные каналы для Н+. Градиент рассеивается, дыхание сохраняется, но синтез АТФ прекращается.
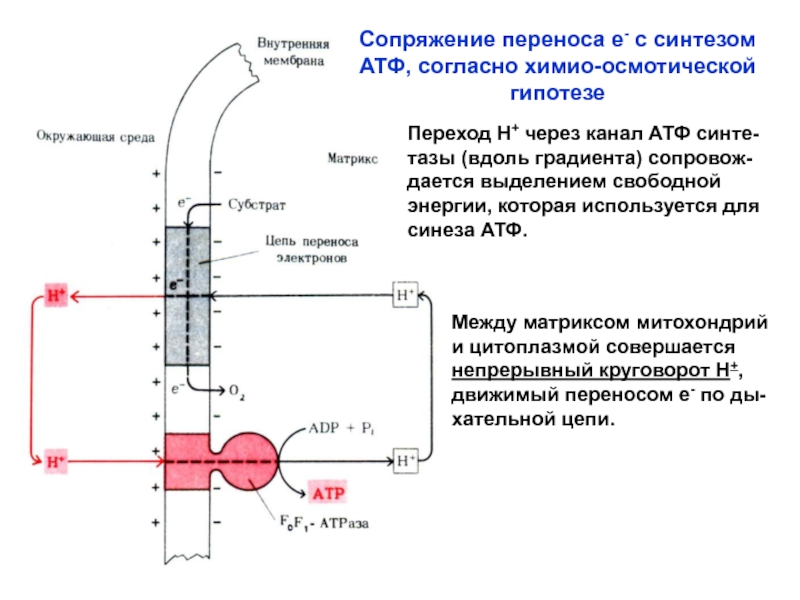
Слайд 68Сопряжение переноса е- с синтезом АТФ, согласно химио-осмотической гипотезе
Переход Н+
через канал АТФ синте-
тазы (вдоль градиента) сопровож-
дается выделением свободной
энергии,
которая используется для синеза АТФ.
Между матриксом митохондрий
и цитоплазмой совершается
непрерывный круговорот Н+,
движимый переносом е- по ды-
хательной цепи.










































![МЕТАБОЛИЗМ
И
ОСНОВЫ
БИОЭНЕРГЕТИКИ Цитохромы – железосодержащие гемопротеиды, участвующие в переносе е- [Кейлин, Цитохромы – железосодержащие гемопротеиды, участвующие в переносе е- [Кейлин, 1925]. Простети-ческая группа – гем.](/img/thumbs/0555fd0f299c5e7d9c9a76622465f587-800x.jpg)