Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обмен и функции аминокислот
Содержание
- 1. Обмен и функции аминокислот
- 2. Белки – незаменимые высокомолекулярные соединения
- 3. Основные функции белковСтруктурнаяКаталитическая (ферментативная)РецепторнаяИнформационная ГуморальнаяИммунологическая
- 4. Белок в организме не депонируется. При его
- 5. Азотистый балансИнтегральный показатель общего уровня белкового обмена
- 6. Азотистый баланс Нулевой азотистый баланс (количество поступающего
- 7. . По биологической
- 8. Метионин обеспечивает дезинтоксикационные процессы,
- 9. Триптофан необходим для производства витамина B3 (ниацина)
- 10. Заменимые аминокислоты Аланин нормализует
- 11. Глицин (аминоуксусная кислота)
- 12. Цистеин - серосодержащая аминокислота
- 13. Пути обмена белков в организмеПереваривание и всасывание
- 14. Промежуточный обмен аминокислот Аминокислоты, образовавшиеся при
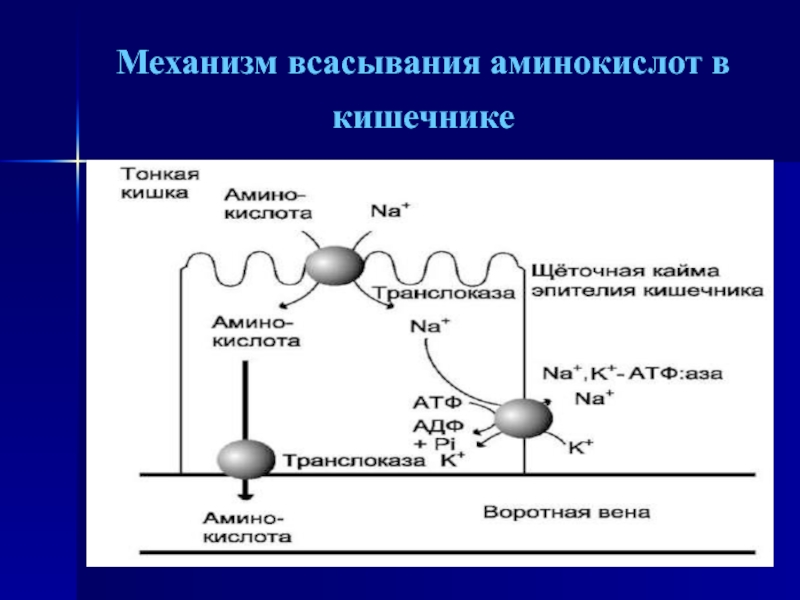
- 15. Механизм всасывания аминокислот в кишечнике
- 16. L-аминокислота поступает в энтероцит путём
- 17. Различная скорость проникновения аминокислот через
- 18. Одна из специфических транспортных систем для некоторых
- 19. γ-Глутамильный цикл: Система состоит из
- 20. Аминокислоты как и белки не накапливаются и
- 21. Общие пути обмена АКТрансаминирование(переаминирование)Прямое окислительное дезаминированиеНепрямое окислительное дезаминированиеНеокислительное дезаминированиеВнутримолекулярное дезаминированиеДекарбоксилирование
- 22. Трансаминирование - реакция переноса а-аминогруппы с аминокислоты
- 23. Аминотрансферазы обнаружены как в цитоплазме, так и
- 24. Органоспецифичные аминотрансферазы АЛТ и АСТ Чаще всего
- 25. Слайд 25
- 26. Аминотрансферазы обладают субстратной специфичностью к
- 27. АЛТ катализирует реакцию трансами-нирования между
- 28. . Биологическое значение трансаминирования Реакции
- 29. Биологическое значение реакций трансаминирования1. Синтез 10
- 30. Диагностическое значение определения аминотрансфераз в клинической практике
- 31. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТДезаминирование аминокислот -
- 32. Окислительное дезаминирование Наиболее активно в тканях происходит
- 33. Слайд 33
- 34. Непрямое дезаминирование (трансдезаминирование) Большинство аминокислот не способно
- 35. Слайд 35
- 36. Биологическая роль непрямого дезаминирования. А - при
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
- 40. Пути обмена безазотистого остатка аминокислот В ходе
- 41. При недостатке глюкозы в организме
- 42. ГЛИКОГЕННЫЕ И КЕТОГЕННЫЕ АМИНОКИСЛОТЫ Катаболизм всех аминокислот
- 43. Некоторые аминокислоты в процессе катаболизма превращаются в
- 44. Классификация аминокислот по судьбе безазотистого остатка Классификация
- 45. Включение безазотистого остатка аминокислот в общий путь катаболизма
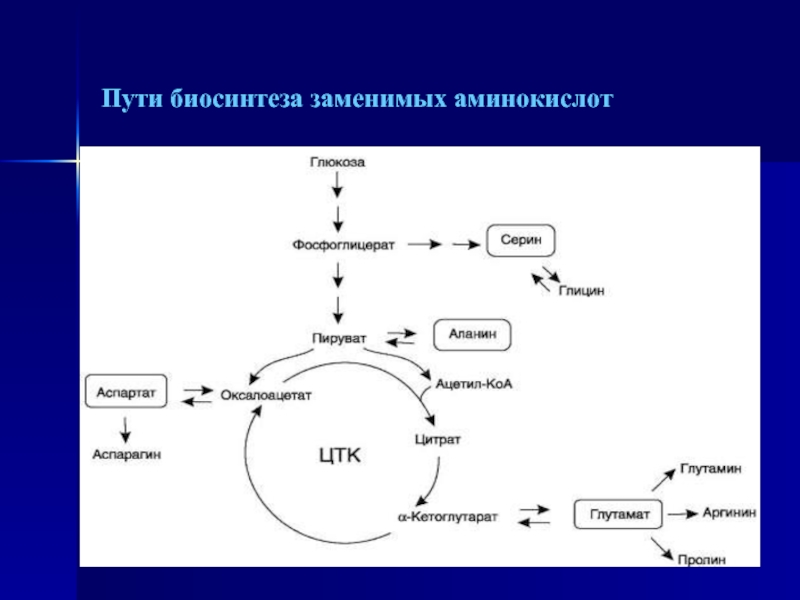
- 46. Пути биосинтеза заменимых аминокислот
- 47. Слайд 47
- 48. ДекарбоксилированиеНекоторые аминокислоты и их производные могут подвергаться
- 49. Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами.
- 50. Слайд 50
- 51. Синтез и биологическая роль серотонина
- 52. Серотонин - биологически активное вещество
- 53. Синтез и биологическая роль ацетилхолина Ацетилхолин синтезируется
- 54. Слайд 54
- 55. В нервных клетках декарбоксилирование глутамата
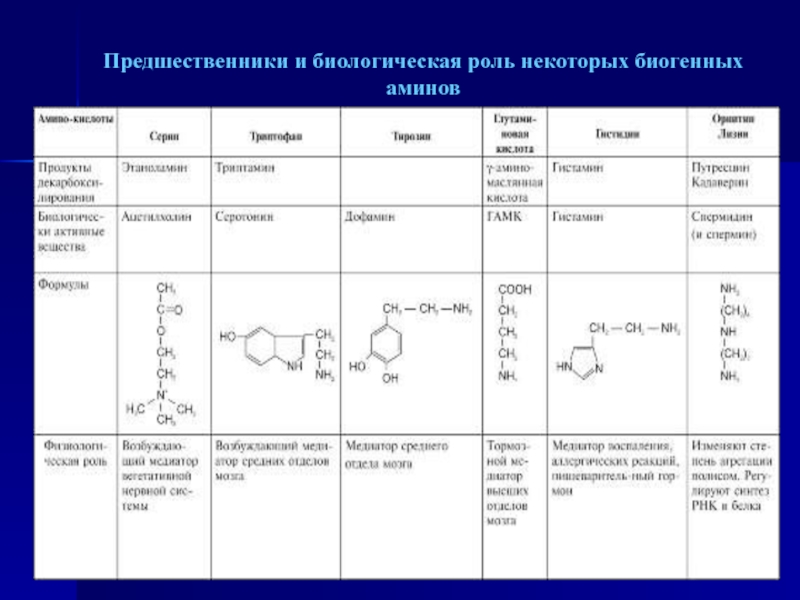
- 56. Предшественники и биологическая роль некоторых биогенных аминов
- 57. ОБМЕН
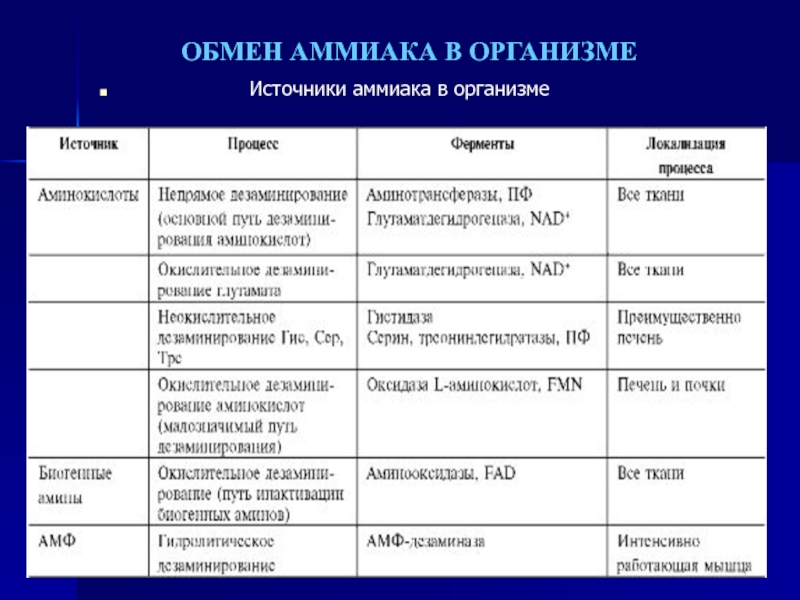
- 58. Высокая интенсивность процессов дезаминирования аминокислот в тканях
- 59. Слайд 59
- 60. Высокий уровень глутамина в крови и лёгкость
- 61. Слайд 61
- 62. Основной путь обезвреживания аммиака в
- 63. Слайд 63
- 64. 2-я реакция и 3 реакции
- 65. 4-й этап
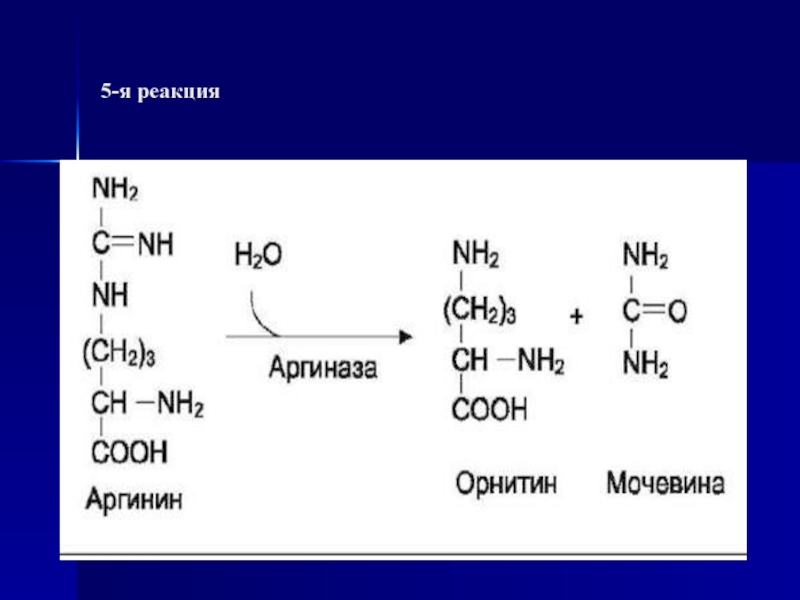
- 66. 5-я реакция
- 67. Слайд 67
- 68. Слайд 68
- 69. Слайд 69
- 70. Слайд 70
- 71. Ферменты орнитинового цикла распределены между митохондриями и
- 72. Биологическое значение орнитинового цикла1. Обезвреживание аммиака в
- 73. Источники азота , углерода и кислорода в
- 74. Гипераммониемия – повышение концентрации аммиака в крови.
- 75. Спасибо за внимание!
- 76. Скачать презентанцию
Белки – незаменимые высокомолекулярные соединения в организме человека, они содержат азот и не могут быть синтезированы из липидов и углеводов , поступают с пищей в количестве 100 г в
Слайды и текст этой презентации
Слайд 1Пути поступления аминокислот
Основные реакции
Реакции трансаминирования
Реакции дезаминирования
Реакции декарбоксилирования
Обмен аммиака
Обмен отдельных аминокислот
Обмен
и функции аминокислот
Слайд 2 Белки – незаменимые высокомолекулярные соединения в организме человека,
они содержат азот и не могут быть синтезированы из липидов
и углеводов , поступают с пищей в количестве 100 г в сутки.Слайд 3Основные функции белков
Структурная
Каталитическая (ферментативная)
Рецепторная
Информационная
Гуморальная
Иммунологическая
Слайд 4
Белок в организме не депонируется. При его дефиците мобилизуются белки
мышц, кожи, костей, а при более тяжёлых состояниях — паренхиматозных
органов (мозга — в последнюю очередь).Обмен белка отличается высокой интенсивностью. Время полужизни многих белковых молекул колеблется от нескольких часов до нескольких суток. За 24 ч обновляется около 1 г/кг белка организма. Цикл полной замены молекул белка в организме взрослого человека составляет 130—160 сут.
Слайд 5Азотистый баланс
Интегральный показатель общего уровня белкового обмена — азотистый баланс:
суточная разница между поступающим в организм азотом, и количеством азота,
выделяемого из организма (в том числе с мочой и калом в составе мочевины, мочевой кислоты, креатина, солей аммония, аминокислот и т.д.).Слайд 6Азотистый баланс
Нулевой азотистый баланс (количество поступающего и выводящегося азота
совпадает).
Положительный азотистый баланс (количество азота, поступающего в организм, выше,
чем выводящегося). Наблюдается как в норме (например, при регенерации тканей или беременности), так и при патологии (например, при гиперпродукции СТГ или полицитемии). Отрицательный азотистый баланс (количество азота, поступающего в организм, меньше, чем выводящегося). Наблюдается при голодании, стресс-реакциях, тяжёлом течении СД, гиперкортицизме.
Слайд 7.
По биологической ценности белки классифицируют как полноценные
и неполноценные, что связано с количественным и качественным составом аминокислот
в белке. Белки , содержащие 53% незаменимых аминокислот, являются полноценнымиНезаменимые аминокислоты
Лизин входит в состав практически любых белков. Лизин также понижает уровень триглицеридов в сыворотке крови. Эта аминокислота оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес и острые респираторные инфекции. Хорошо сочетается с витамином С и биофлавоноидами.
Биологическая ценность белков определяется их аминокислотным составом
Слайд 8 Метионин обеспечивает дезинтоксикационные процессы, прежде всего по
связыванию тяжелых металлов, эндогенных и экзогенных токсинов, а также при
токсикозе беременности. Метионин оказывает выраженное антиоксидантное действие, так как является хорошим источником серы, инактивирующей свободные радикалы. Помогает переработке жиров, предотвращая их отложение в печени и стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Метионин в организме переходит в цистеин, который является предшественником глутатиона. Треонин поддерживает липотропную функцию печени совместно с метионином и аспартамом. Треонин играет важную роль в образовании коллагена и эластина. Он повышает иммунитет, участвует в производстве антител. Фенилаланин принимает активное участие в синтезе белков, повышает умственную активность, память. Он способствует улучшению секреторной функции поджелудочной железы и печени. Из фенилаланина может образовываться тирозин, который используется для синтеза нейротрансмиттеров (передатчиков нервных импульсов), способствующих улучшению умственного восприятия, усиливая выработку гормонов щитовидной железы, также обладающих антидепрессантными свойствами.Слайд 9Триптофан необходим для производства витамина B3 (ниацина) и серотонина-важнейшего нейромедиатора,
передающего нервные импульсы. Серотонин нормализует сон, стабилизирует настроение, снижает аппетит.
Триптофан снижает содержание жиров, образующих холестерин в крови, также обладает гипотензивным свойством, расширяя кровеносные сосуды. Участвует в синтезе альбуминов и глобулинов, усиливает выделение гормона роста. Валин необходим для восстановления поврежденных тканей и метаболических процессов в мышцах при тяжелых нагрузках и для поддержания нормального обмена азота в организме, оказывает стимулирующее действие. Относится к разветвленным аминокислотам, может быть использован мышцами в качестве источника энергии вместе с лейцином и изолейцином. Лейцин, действуя вместе с валином и изолейцином, защищают мышечные ткани и является источником энергии, также способствует восстановлению костей, кожи, мышц. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. Изолейцин необходим для образования гемоглобина, стабилизирует уровень сахара в крови, восстанавливает мышечные ткани, ускоряет процесс выработки энергии.Слайд 10Заменимые аминокислоты
Аланин нормализует метаболизм углеводов. Является
составной частью таких незаменимых нутриентов как пантотеновая кислота и коэнзим
А.Аргинин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность вилочковой железы, которая вырабатывает T-лимфоциты. Его также применяют при заболеваниях печени (цирроз и жировая дистрофия), он способствует дезинтоксикационным процессам в печени (прежде всего обезвреживанию аммиака). Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме. Стимулирует выработку гормона роста, что вызывает некоторое уменьшение запасов жира в организме. Аргинин повышает половую активность у мужчин за счет восстановления эректильной функции и стимуляции сперматогенеза. Аспарагиновая кислота в организме присутствует в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ. Участвует в образовании пиримидиновых оснований мочевины. Биологическое действие аспарагиновой кислоты: иммуномодулирующее, повышающее физическую выносливость, нормализующее баланс возбуждения и торможения в ЦНС. Гистидин усиливает секрецию соляной кислоты и пепсина в желудке. Стимулирует образование гемоглобина и кроветворение в целом. Гистидин способствует улучшению половой функции, так как гистамин (производное гистидина) положительно влияет на эректильную функцию и усиливает половое возбуждение.
Слайд 11 Глицин (аминоуксусная кислота) является центральным нейромедиатором
тормозного типа действия, оказывает седативное действие, улучшает метаболические процессы в
тканях мозга, ослабляет влечение к алкоголю, оказывает положительное влияние при мышечных дистрофиях, уменьшает повышенную раздражительность, нормализует сон.Глутаминовая кислота (глутамин) обладает уникальным свойством присоединять дополнительный атом азота, тем самым, являясь организатором синтеза различных белков (перенос азота), либо связывая избыток азота (в том числе аммиак), который может вызывать нарушение работы различных органов, но, прежде всего мозга и печени. В центральной нервной системе глутаминовая кислота является возбуждающим нейромедиатором. Глутаминовая кислота является важной составляющей мышечной ткани, воздействует на гормон роста.
Пролин участвует в синтезе коллагена, восстанавливает структуру соединительной ткани (в том числе опорно-двигательного аппарата, паренхиматозных органов, сердца). Тирозин является предшественником нейромедиаторов норадреналина и дофамина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза. Симптомами дефицита тирозина также являются пониженное артериальное давление, низкая температура тела и синдром беспокойных ног. Тирозин может синтезироваться из фенилаланина в организме человека.
Слайд 12 Цистеин - серосодержащая аминокислота играет важную роль
в процессах формирования тканей кожи. Имеет значение для дезинтоксикационных процессов.
Цистеин входит в состав альфа-керотина, основного белка ногтей, кожи и волос. Он способствует формированию коллагена и улучшает эластичность кожи. Цистеин входит в состав и других белков организма, в том числе некоторых пищеварительных ферментов. Цистеин помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации. Он представляет собой один из самых мощных антиоксидантов. Цистеин является предшественником глютатиона - вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, в том числе содержащихся в сигаретном дыме. Эта аминокислота образуется в организме из метионина, при обязательном присутствии витамина B6.Слайд 13Пути обмена белков в организме
Переваривание и всасывание - белки лишаются
своей видовой и тканевой специфичности и распадаются до аминокислот
Промежуточный (межуточный)
обмен – в клетках печени и всех тканей, включающий процессы переаминирования, дезаминирования, восстановительного аминирования, декарбоксилирования, биосинтеза заменимых аминокислот и др.Образование и выведение из организма конечных продуктов распада белков
Слайд 14Промежуточный обмен аминокислот
Аминокислоты, образовавшиеся при переваривании белков, быстро
всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную
систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30- 50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь . Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Na+-зависимых механизмов симпорта, подобно переносу глюкозы.Слайд 16 L-аминокислота поступает в энтероцит путём симпорта с ионом
Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь.
Обмен ионов натрия между клетками осуществляется путём первичного активного транспорта с помощью Na+, К+-АТФ-азы.Слайд 17 Различная скорость проникновения аминокислот через мембраны клеток указывает
на наличие транспортньгх систем, обеспечивающих перенос аминокислот как через внешнюю
плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот:• нейтральных, с короткой боковой цепью (аланин, серин, треонин);
• нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолей-цин);
• с катионными радикалами (лизин, аргинин);
• с анионными радикалами (глутаминовая и аспарагиновая кислоты);
• иминокислот (пролин, оксипролин). Причём к числу Na+-зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин).
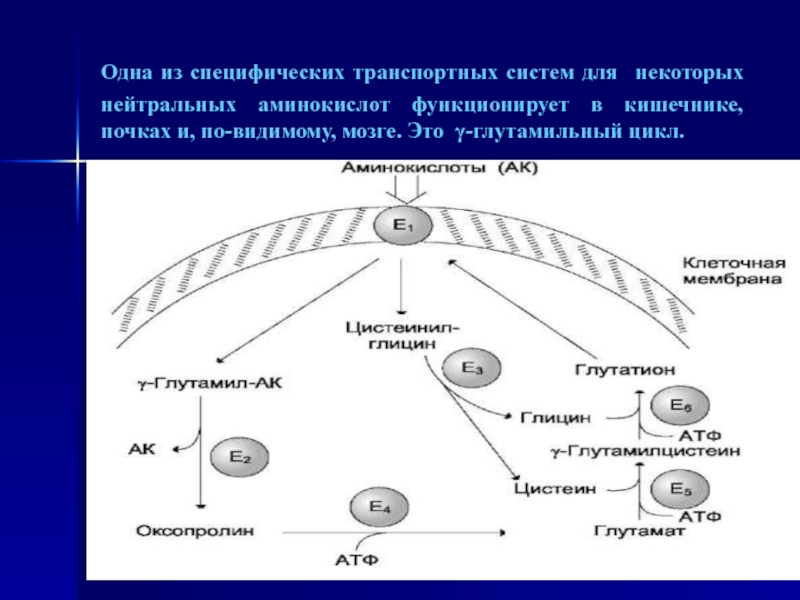
Слайд 18Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует
в кишечнике, почках и, по-видимому, мозге. Это γ-глутамильный цикл.
Слайд 19 γ-Глутамильный цикл: Система состоит из одного мембранного и
пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе
с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты.E1 - γ-глутамилтрансфераза; E2 - γ-глутамилциклотрансфераза; E3- пептидаза; E4 - оксопролиназа;
E5 - γ-глутамилцистеинсинтетаза;
E6 - глутатионсинтетаза.
Слайд 20Аминокислоты как и белки не накапливаются и не запасаются в
тканях
Промежуточный обмен аминокислот –
это совокупность превращений аминокислот в организме человека
от момента поступления их в кровь до выведения из организма в виде мочевины, углекислого газа и водыУсловно промежуточный обмен делят :
Общие пути обмена аминокислот
Специфические (индивидуальные ) пути превращения аминокислот
Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы.
Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования и дезаминирования.
Слайд 21Общие пути обмена АК
Трансаминирование(переаминирование)
Прямое окислительное дезаминирование
Непрямое окислительное дезаминирование
Неокислительное дезаминирование
Внутримолекулярное дезаминирование
Декарбоксилирование
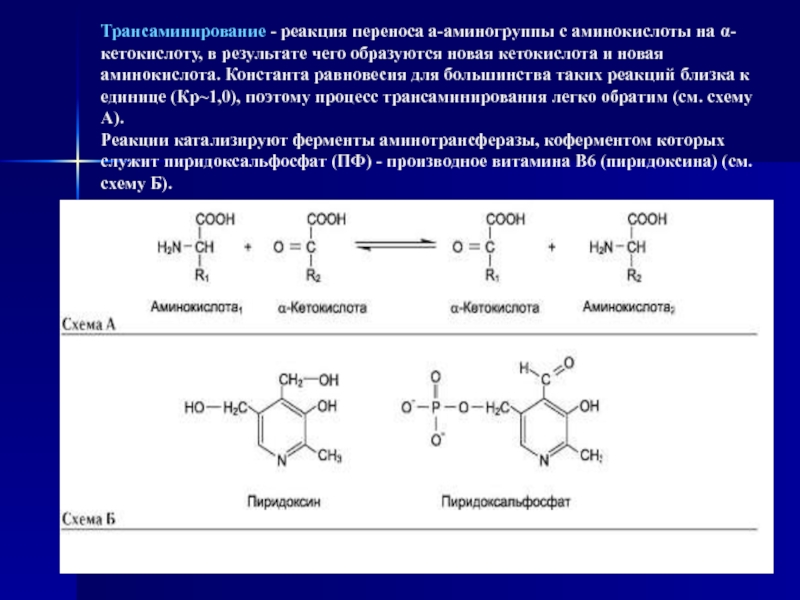
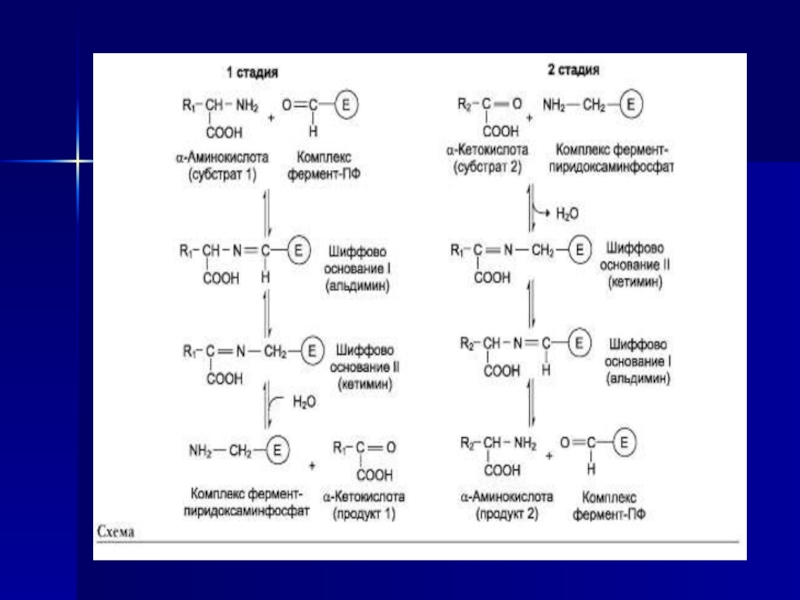
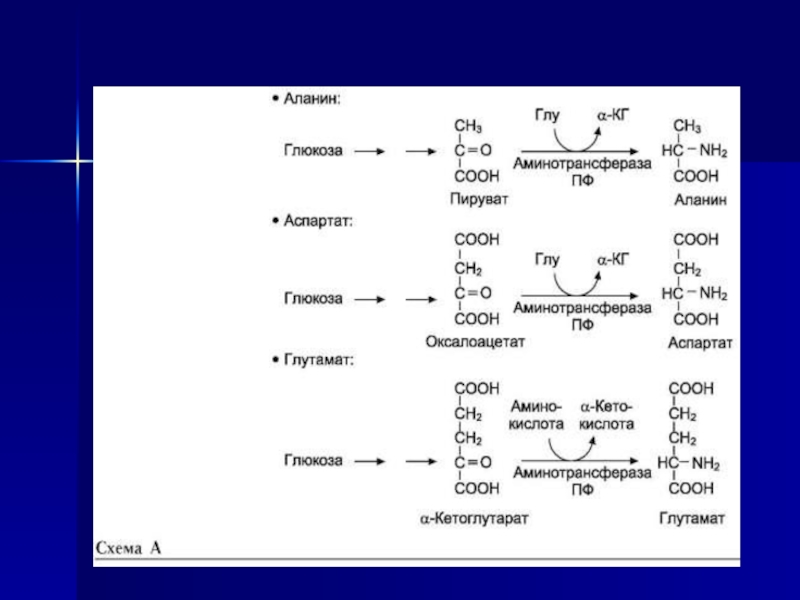
Слайд 22Трансаминирование - реакция переноса а-аминогруппы с аминокислоты на α-кетокислоту, в
результате чего образуются новая кетокислота и новая аминокислота. Константа равновесия
для большинства таких реакций близка к единице (Кр~1,0), поэтому процесс трансаминирования легко обратим (см. схему А). Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6 (пиридоксина) (см. схему Б).Слайд 23Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток
эукариотов. Причём митохондриальные и цитоплазматические формы ферментов различаются по физико-химическим
свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина.Слайд 24Органоспецифичные аминотрансферазы АЛТ и АСТ Чаще всего в реакциях трансаминирования участвуют
аминокислоты, содержание которых в тканях значительно выше остальных - глутамат,
аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат. Суммарно эти реакции можно представить в виде схемы:Слайд 26 Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В
тканях человека обнаружено более 10 разных аминотрансфераз.
Наиболее распространёнными
ферментами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ), по обратной реакции - глутаматпируватаминотрансфераза (ГПТ) и аспартатаминотрансфераза (АСТ), по обратной реакции - глутаматоксалоацетата-минотрансфераза (ГОТ).Слайд 27 АЛТ катализирует реакцию трансами-нирования между аланином и α-кетоглутаратом.Локализован
этот фермент в цитозоле клеток многих органов, но наибольшее его
количество обнаружено в клетках печени и сердечной мышцы.АСТ катализирует реакцию трансаминирования между аспартатом и α-кетоглутаратом. В результате образуются оксалоацетат и глутамат. АСТ имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени.
Так как наибольшее количество АЛТ и АСТ сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
Слайд 28. Биологическое значение трансаминирования
Реакции трансаминирования играют
большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты
аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование - заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.Слайд 29Биологическое значение реакций трансаминирования
1. Синтез 10 заменимых АК
2.
Первая стадия в реакции непрямого окислительного дезаминирования
3. Доставка аминогрупп
АК из мышц в печень в цикле «аланин – глюкоза»4. Доставка аминогруппы АК печени через аспартат в биосинтезе мочевины
Слайд 30Диагностическое значение определения аминотрансфераз в клинической практике
В клинической практике широко используют определение активности АСТ и АЛТ
в сыворотке крови для диагностики некоторых заболеваний.В норме в крови активность этих ферментов очень мала и составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку АСТ и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов . В клетках сердечной мышцы количество АСТ значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови.
Соотношение активностей АСТ/АЛТ называют «коэффициент де Ритиса».
В норме этот коэффициент равен 1,3. При инфаркте миокарда активность АСТ в крови увеличивается в 8- 10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко активность АСТ увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ~8-10 раз по сравнению с нормой, а АСТ - в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы АСТ.
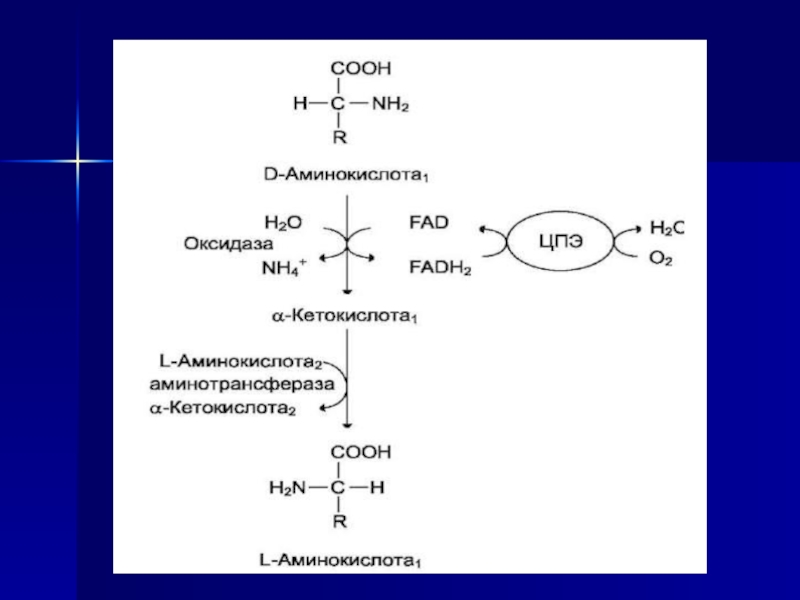
Слайд 31 ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
Дезаминирование аминокислот - реакция отщепления α-аминогруппы
от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток)
и выделяется молекула аммиакаАммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кетогенеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
• окислительное;
• непрямое (трансдезаминирование);
• неокислительное;
• внутримолекулярное.
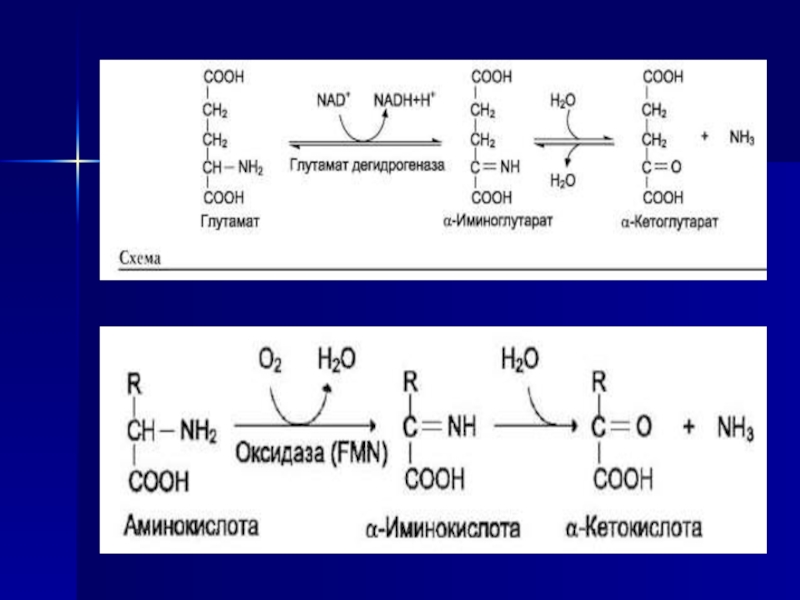
Слайд 32Окислительное дезаминирование
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты.
Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт
в 2 этапа:ферментативное дегидрирование глутамата и образование α-иминоглутарата,
неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат
Окислительное дезаминирование глутамата -
обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование α-кетоглутарата.
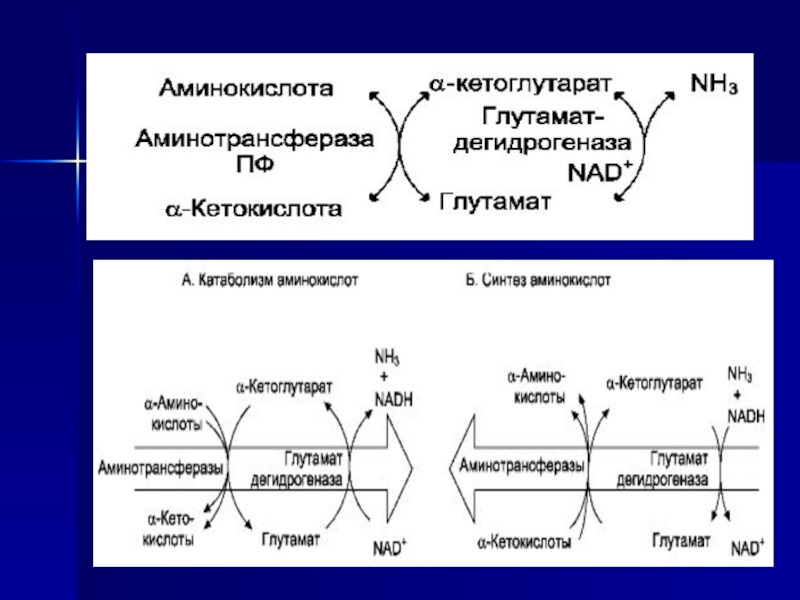
Слайд 34Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в
одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования
переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:Слайд 36Биологическая роль непрямого дезаминирования.
А - при катаболизме почти все
природные аминокислоты сначала передают аминогруппу на a-кетоглутарат в реакции трансаминирования
с образованием глутамата и соответствующей кетокислоты.Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются a-кетоглутарат и аммиак;
Б - при необходимости синтеза аминокислот и наличии необходимых a-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования a-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей a-кетокислотой, что приводит к синтезу новой аминокислоты.
Слайд 38 Неокислительное дезаминирование
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот
серина, треонина и гистидина неокислительным путём.Неокислительное дезаминирование серина катализирует сериндегидратаза.
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза. Механизм реакции аналогичен дезаминированию серина.
Эти ферменты пиридоксальфосфатзависимые.
Неокислительное дезаминирование гистидина под действием фермента гистидазы (гистидинаммиаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. Эта реакция происходит только в печени и коже.
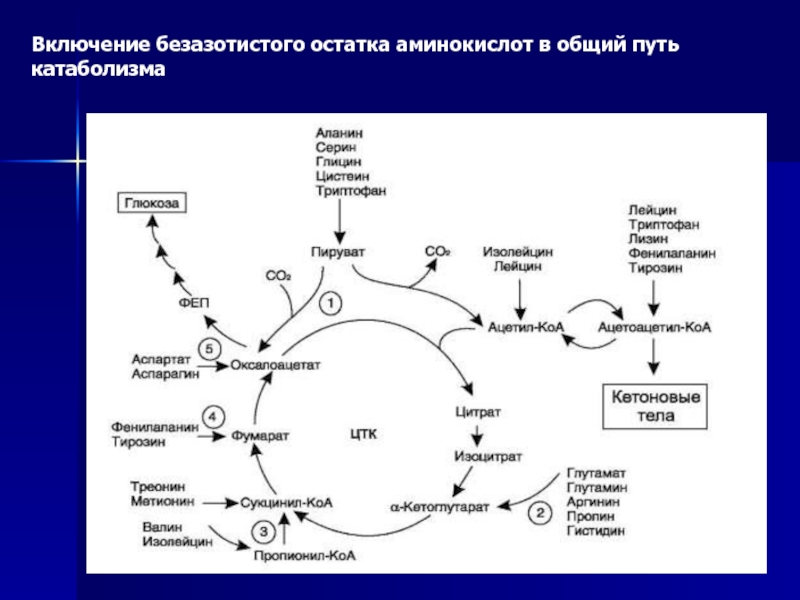
Слайд 40Пути обмена безазотистого остатка аминокислот
В ходе катаболизма аминокислот происходит
отщепление аминогруппы и выделение аммиака. Другим продуктом дезаминирования аминокислот служит
их безазотистый остаток в виде α-кетокислот. Катаболизм аминокислот происходит практически постоянно. За сутки в норме в организме человека распадается примерно 100 г аминокислот, и такое же количество должно поступать в составе белков пищи.Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно, либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируватки-назы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи.
Слайд 41 При недостатке глюкозы в организме фос-фоенолпируват включается в
глюконеогенез (см. раздел 7). Это происходит при голодании, длительной физической
работе, при сахарном диабете и других тяжёлых хронических заболеваниях, сопровождающихся распадом собственных белков организма. Скорость глюконеогенеза из аминокислот регулируется гормонами. Так, под действием глюкагона увеличивается активность регуляторных ферментов процесса, а кортизол индуцирует синтез ферментов глюконеогенеза в печени. Активация глюконеогенеза из аминокислот происходит и при преимущественно белковом питании.Слайд 42ГЛИКОГЕННЫЕ И КЕТОГЕННЫЕ АМИНОКИСЛОТЫ
Катаболизм всех аминокислот сводится к образованию
шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат,
сукцинил-КоА, фумарат, оксалоацетатАминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот.
Слайд 43Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат или ацетил-КоА
и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют
кетогенными.Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат или ацетил-КоА . Такие аминокислоты называют смешанными, или глико-кетогенными.
Слайд 44Классификация аминокислот по судьбе безазотистого остатка
Классификация аминокислот по судьбе
безазотистого остатка
Классификация аминокислот по судьбе безазотистого остатка
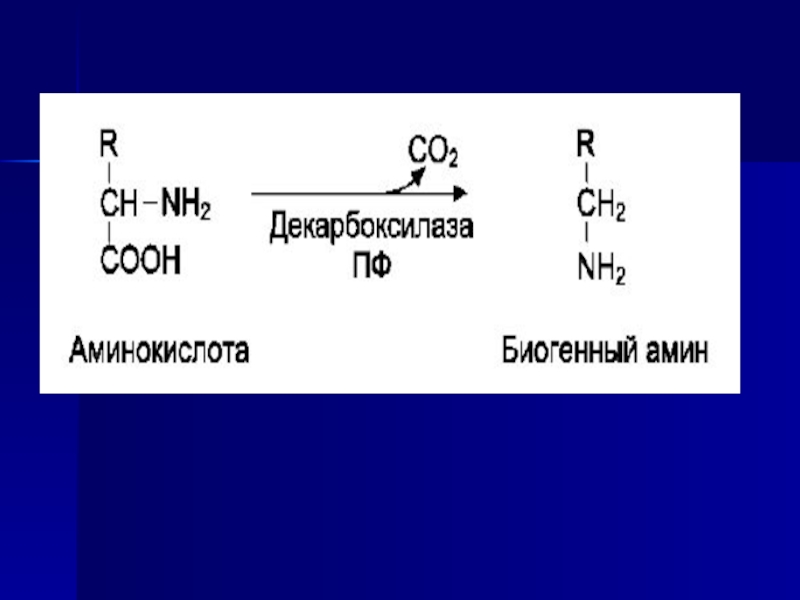
Слайд 48Декарбоксилирование
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению
α-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд
аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Арг, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):Слайд 49Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз
в клетках животных - пиридоксальфосфат. Некоторые декарбоксилазы микроорганизмов могут содержать
вместо ПФ остаток пирувата - гистидин-декарбоксилаза Micrococcus и Lactobacilus, SAM-декарбоксилаза E. coli и др. Механизм реакции напоминает реакцию трансаминирования с участием пиридоксальфосфата и также осуществляется путём формирования шиффова основания ПФ и аминокислоты на первой стадии.Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.).
Слайд 51Синтез и биологическая роль серотонина
Серотонин -
нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты
5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксилирует также фенилаланин) Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функцииСлайд 52 Серотонин - биологически активное вещество широкого спектра действия.
Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД,
температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клеткахСлайд 53Синтез и биологическая роль ацетилхолина
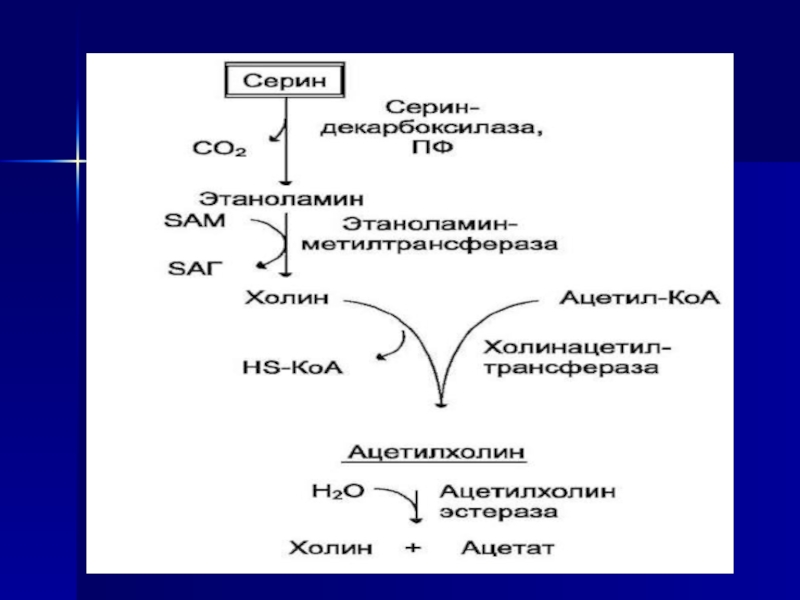
Ацетилхолин синтезируется в нервной ткани
и служит одним из важнейших возбуждающих нейромедиаторов вегетативной нервной системы.
Его предшественник - аминокислота серин:Слайд 55 В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы)
приводит к образованию γ-аминомасляной кислоты (ГАМК), которая служит основным тормозным
медиатором высших отделов мозга.Слайд 58Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий
уровень аммиака в крови свидетельствуют о том, что в клетках
активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций.Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы:
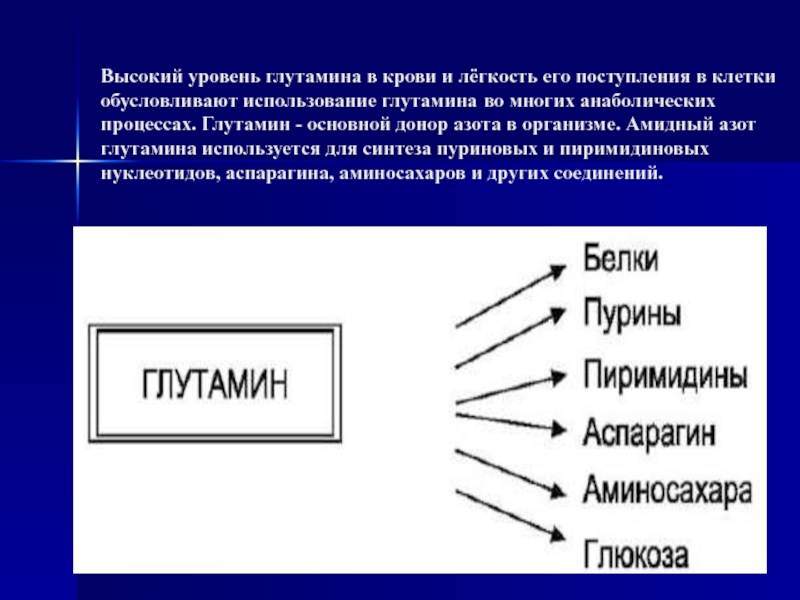
Слайд 60Высокий уровень глутамина в крови и лёгкость его поступления в
клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин -
основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений.Слайд 61
Пять путей обезвреживания аммиака
Биосинтез мочевины в печени
Восстановительное аминирование в тканях
Образование
амидов кислот в тканяхОбразование пиримидиновых оснований в цитозоле клеток
Образование аммонийных солей в прчках
Слайд 62 Основной путь обезвреживания аммиака в
организме – биосинтез мочевины в печени.
В печень аммиак поступает в
виде глютамина (мозг и др.), из мышц и кишечника – в виде аланинаБиосинтез мочевины протекает в пять этапов:
1 и 2 й – в митохондриях клеток печени, 3,4,5 –й этапы – цитозоль клеток печени
Ферменты биосинтеза мочевины:
1.Карбомаилфосфатсинтетаза 1
2. Орнитинкарбомаилфосфатсинтетаза
3.Аргининосукцинатсинтаза
4. Аргининсукциназа
5. Аргиназа
Слайд 63
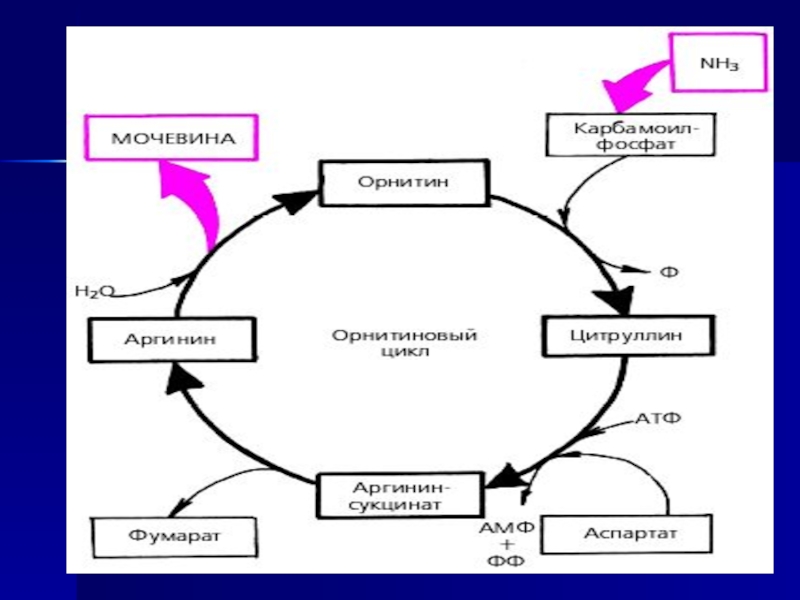
Орнитиновый цикл
Суммарное уравнение синтезе мочевины печени:
СО2+NH3+аспартат+3 АТФ+2
Н20=Мочевина+фумарат+2АДФ+2H3P04+АМФ +Н4Р2О7
1 реакция:
Слайд 70 Энергетический
баланс процесса
В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх
молекулАТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат:
• при включении фумарата в ЦТК на стадии дегидрирования малата образуется NADH, который обеспечивает синтез 3 молекул АТФ (рис. 9-18);
• при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - ещё 3 молекулы
АТФ.
Затраты энергии происходят также и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины (рис. 9-18). Первые две реакции орнитинового цикла происходят в митохондриях, а последующие три - в цито-золе. Цитруллин, образующийся в митохондрии, должен быть перенесён в цитозоль, а орнитин, образующийся в цитозоле, необходимо транспортировать в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит путём активного транспорта за счёт градиента ионов натрия, создаваемого К+,Na+-АТФ-азой, что тоже сопряжено с энергозатратами.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются не только в печени, но и в других клетках. В энтероцитах, например, имеется карбамоилфосфатсинтетаза I и орнитинкарбамоилтранс-фераза, следовательно, может синтезироваться
цитруллин. В почках обнаружены аргинино-сукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гид-ролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
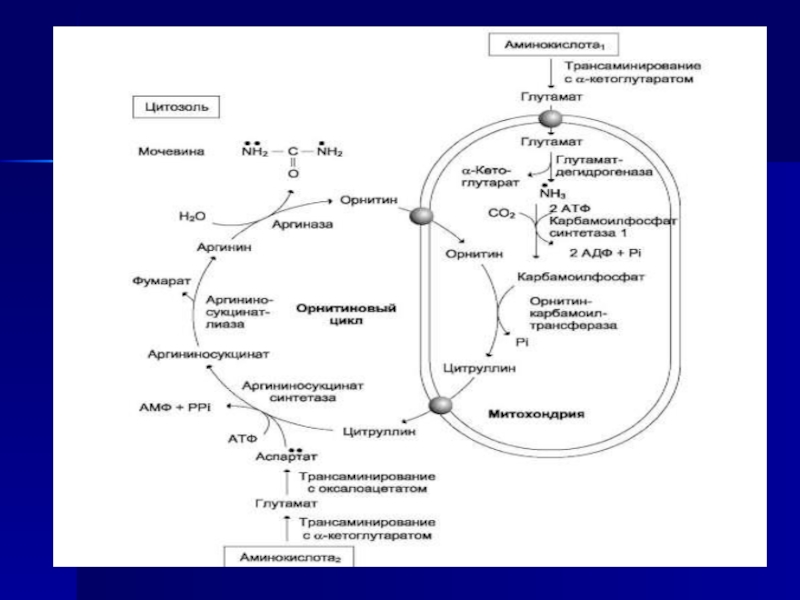
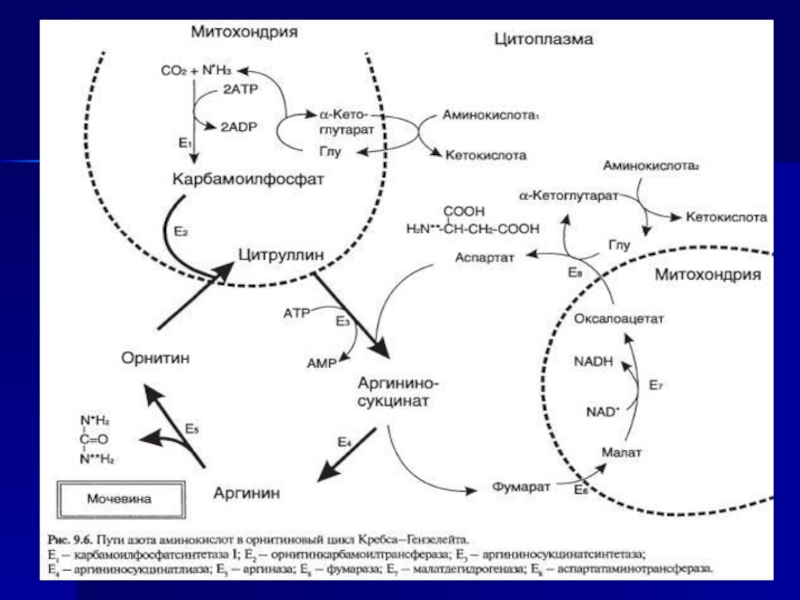
Слайд 71Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим
трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ.
На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины:одна аминогруппа - в виде аммиака в матриксе митохондрии; вторую аминогруппу поставляет аспартат цитозоля.Аспартат, необходимый для синтеза арги-ниносукцината, образуется в печени путём транс-аминирования аланина с оксалоацетатом. Аланин поступает главным образом из мышц и клеток кишечника. Источником оксалоацетата, необходимого для этой реакции, можно считать превращение фумарата, образующегося в реакциях орнитинового цикла. Фумарат в результате двух реакций цитратного цикла превращается в оксалоацетат, из которого путём трансаминирования образуется аспартат Таким образом, с орнитиновым циклом сопряжён цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле из аланина, используется для глюконеогенеза.
Ещё одним источником аспартата для орнитинового цикла является трансаминирование глутамата с оксалоацетатом.
Слайд 72Биологическое значение орнитинового цикла
1. Обезвреживание аммиака в организме
2.Регуляция азотистого баланса
в организме- при поступлении большого количества белка в организм скорость
цикла возрастает3.Поставляет фумарат в ЦТК
4. Биосинтез заменимых аминокислот через оксалоацетат
5. Поставляет оксалоацетат для биосинтеза глюкозы
Слайд 73Источники азота , углерода и кислорода в цикле мочевины
1-я амминогруппа
- из свободного аммиака, образовавшегося при окислительном дезаминировании глутамата .
2-я амминогруппа – поставляется аспартатом, образовавшимся в реакции трансаминирования оксалоацетата с аминокислотами
Углерод – из молекул СО2, образовавшегося в митохондриях в процессе дыхания
Кислород - из молекул воды