схемы, отдельных аппаратов, при проектировании новых производств, разработке и проектировании
новых аппаратов, для отыскания важнейших технологических показателей, составляют материальный и тепловой балансы либо всего технологического производства, либо той его части, которая непосредственно связана с конструированием аппарата или определяемым показателем.На основе знаний о закономерностях и ходе рассчитываемого химико-технологического процесса с учетом известных для данного процесса величин, составляется методика расчета, зависящая от:
рода производства;
способа переработки исходных материалов;
качества сырьевых материалов;
режима работы аппаратов;
условий производства;
и других факторов.
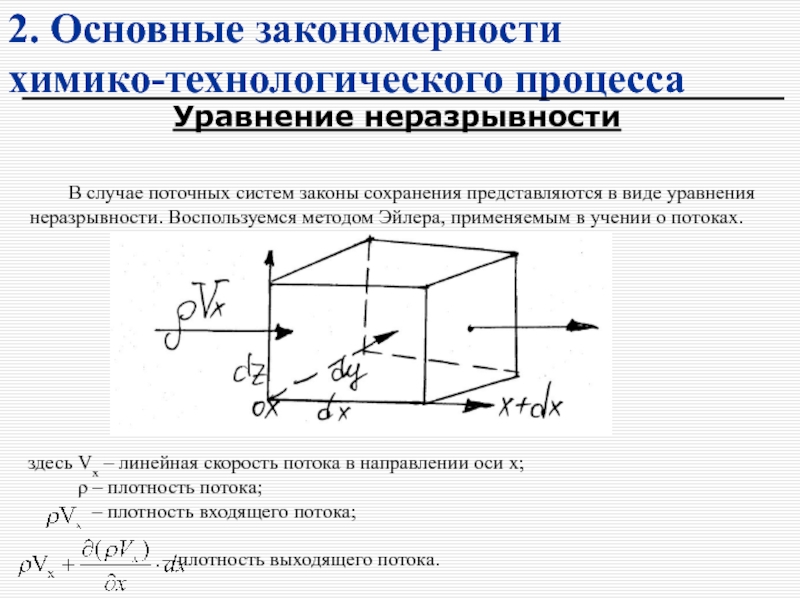
В основе всех химико-технологических процессов лежат законы сохранения!
(массы, энергии и импульса)