способах управления этими превращениями.
Традиционно химия делится на неорганическую, органическую и
физическую. Живые (биологические) системы состоят в основном из углерода, водорода, азота и кислорода. Правильное понимание биологии, и в частности молекулярной биологии, должно быть основано на детальном знании структур, свойств и реакционной способности биомолекул. Эти фундаментальные знания приобретаются при изучении химии.
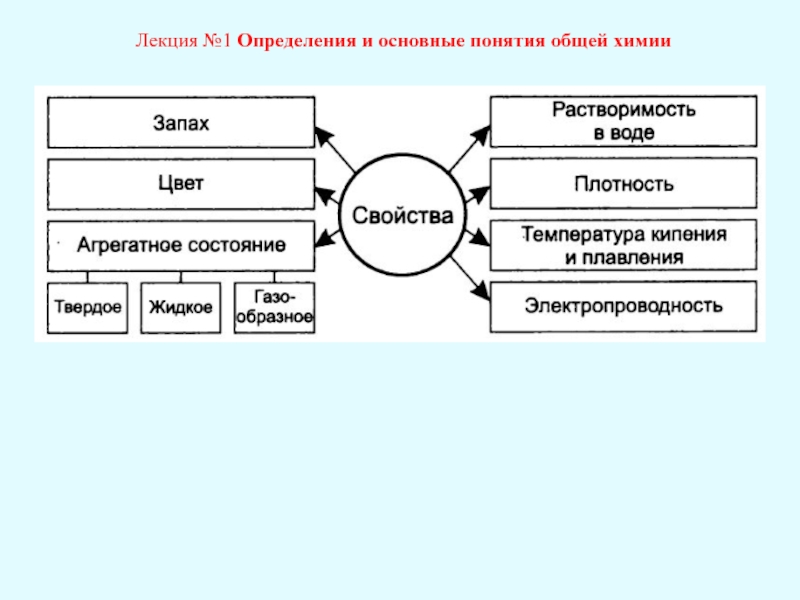
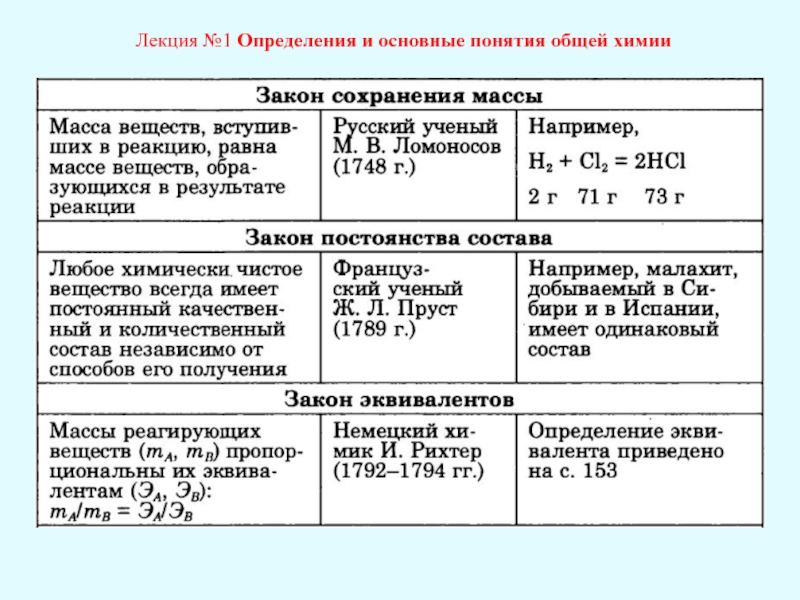
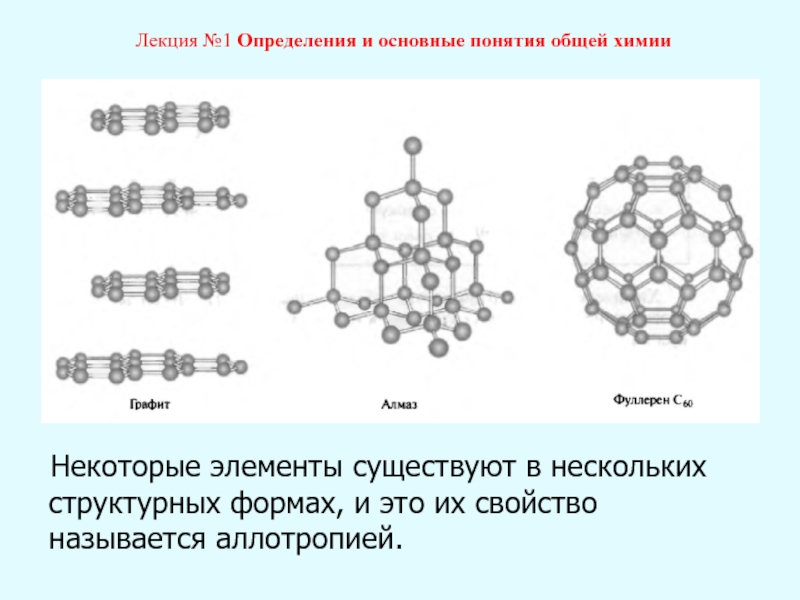
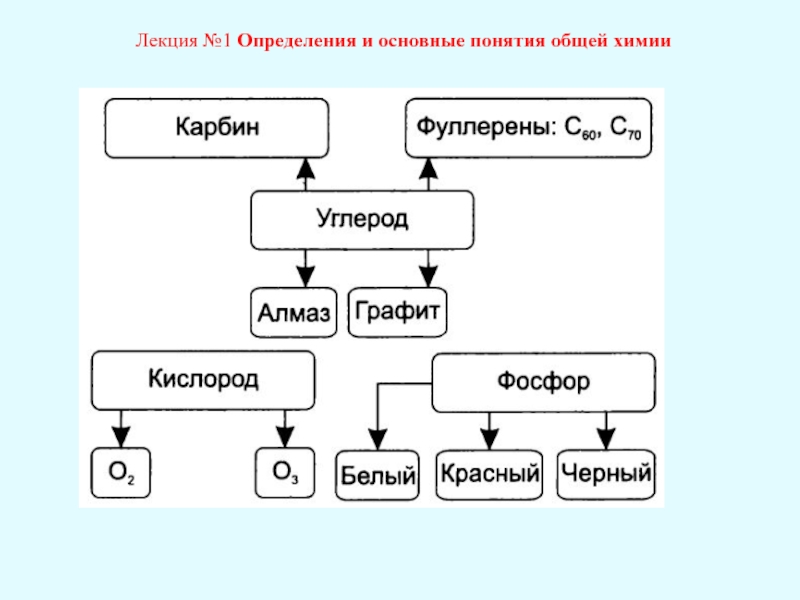
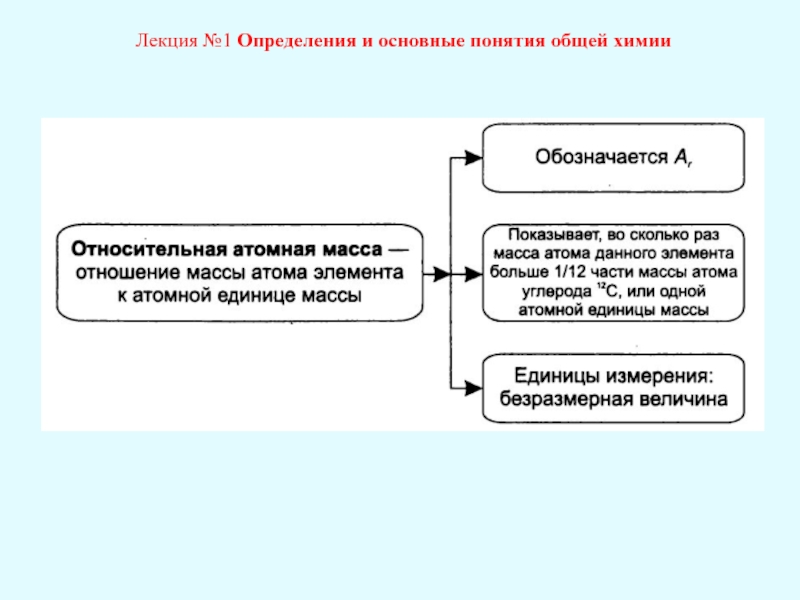
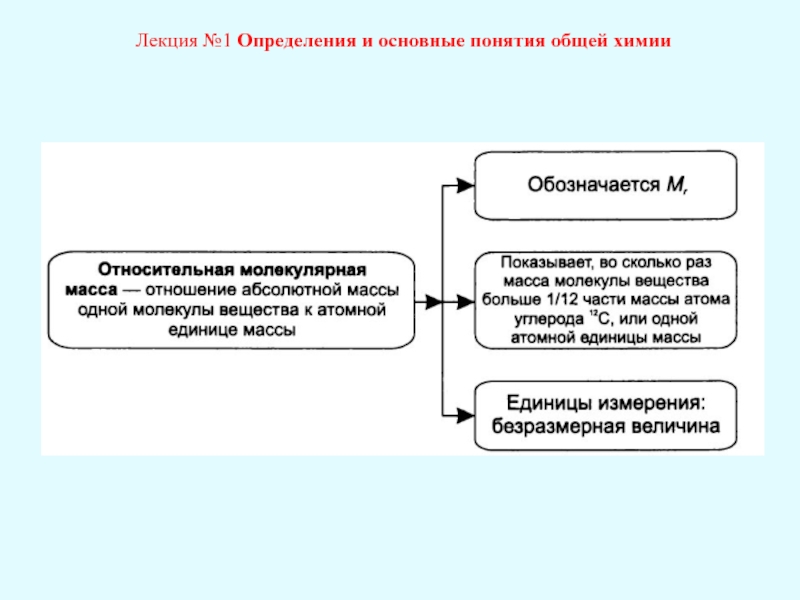
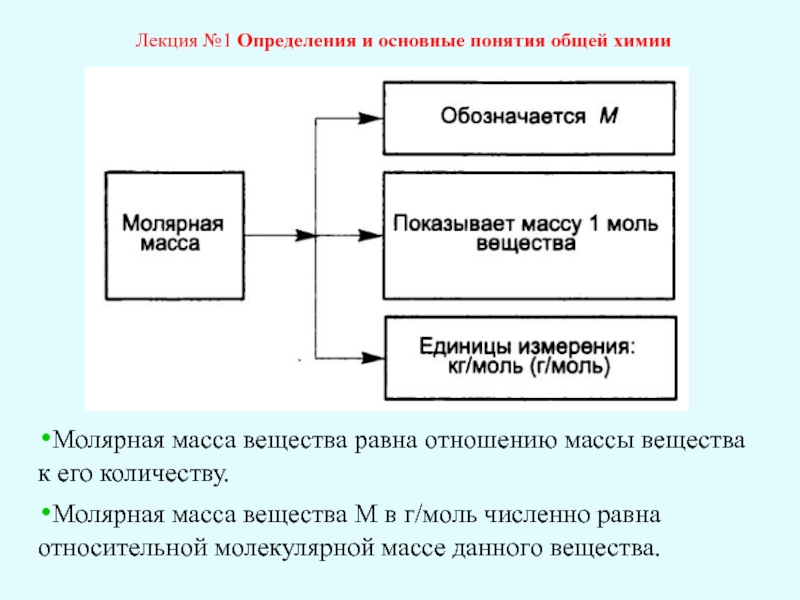
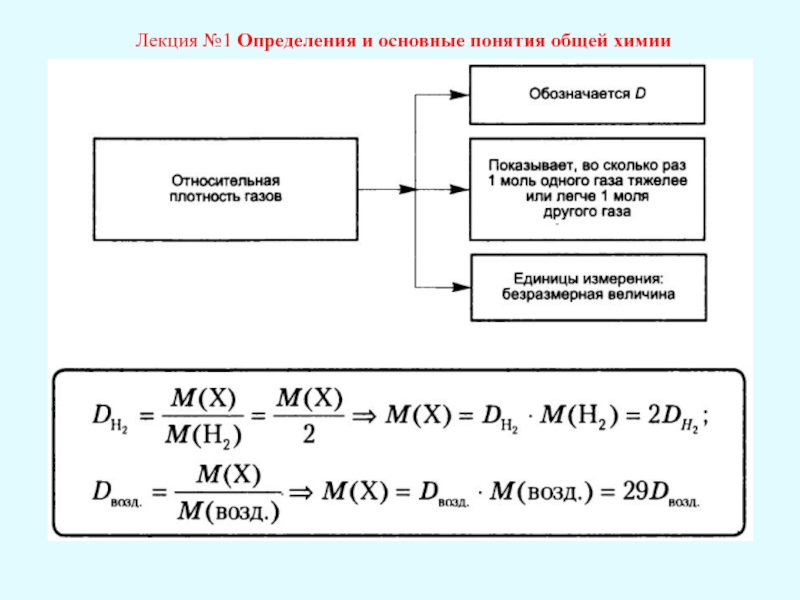
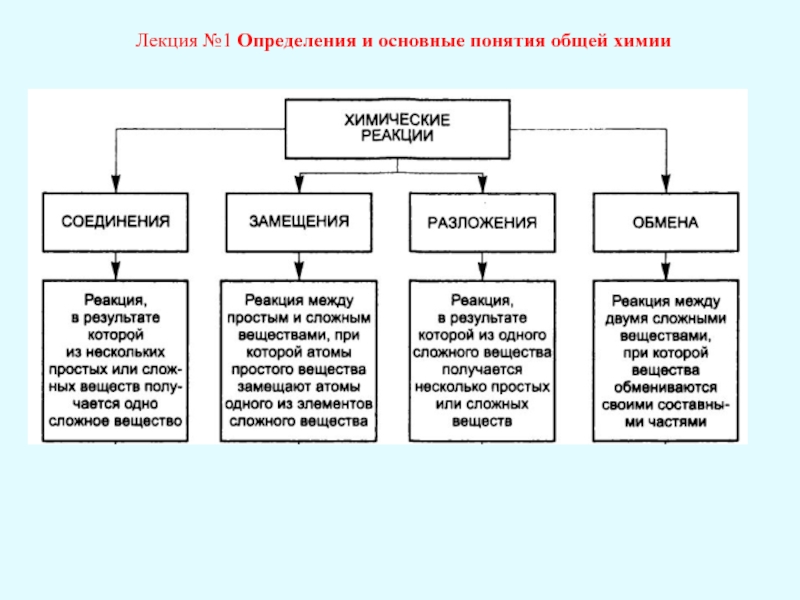
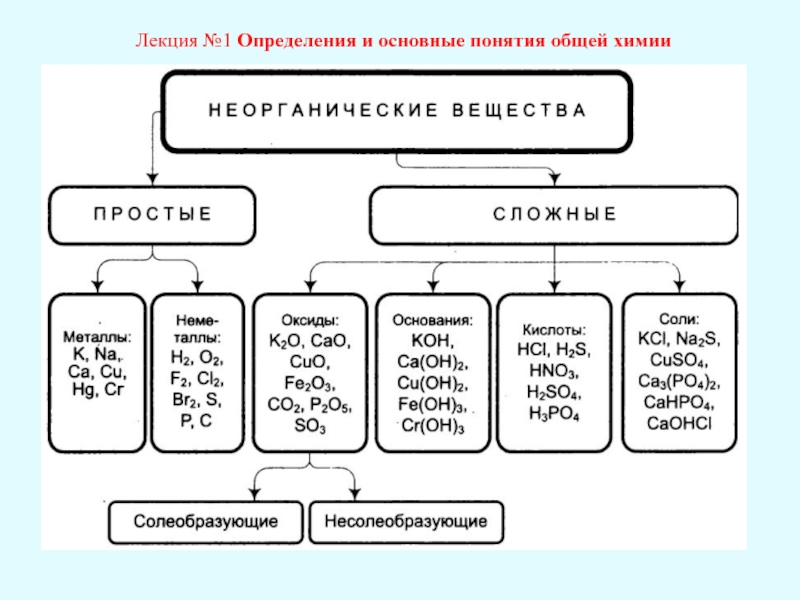
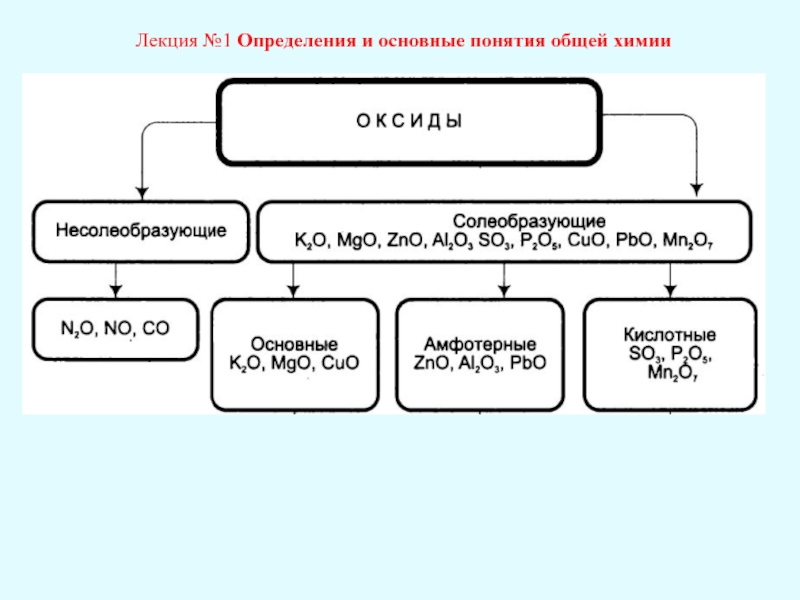
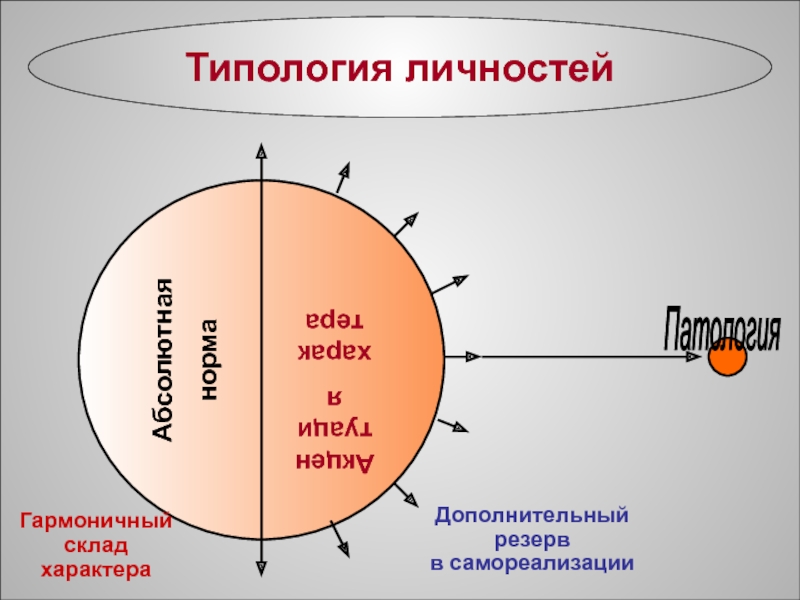
Лекция №1 Определения и основные понятия общей химии