Слайд 1ОРГАНИЧЕСКАЯ ХИМИЯ
Алов Евгений Михайлович
д.х.н., профессор
Слайд 2Рекомендуемая литература
1. Травень, В.Ф. Органическая химия: Учебник для вузов в
2-х томах. – М.: Академкнига, 2004. - Т. 1. –
727 с., Т.2. – 582 с.
2. Шабаров, Ю.С. Органическая химия: Учебник для вузов в 2-х кн. – М.: Химия, 1996. – Т. 1. – 496 с., Т.2. – 352 с.
3. Нейланд, О.Я. Органическая химия: Учеб. для хим. спец. вузов. – М.: Высш. шк., 1990. – 751 с.
Слайд 3Перечень пособий, методических указаний к проведению учебных занятий и самостоятельной
работы студентов
Углеводороды. Галогенпроизводные углеводородов. Учебное пособие/ И.С. Колпащикова, Е.Р. Кофанов,
Е.М. Алов. Яросл. гос. тех. ун-т. - Ярославль, 2007. - 247 с.
Решение задач по органической химии/ А.В. Колобов, В.В. Плахтинский, В.В. Соснина. Яросл. гос. тех. ун-т. - Ярославль, 2013. - 79 с.
Методические указания к лабораторному практикуму по органической химии для студентов химико-технологического факультета. Ч. I . Учебное пособие/ Басаев Р.М., Колпащикова И.С., Кофанов Е.Р., Обухова Т.А.. - Яросл. политехн. ин-т, Ярославль.: 1999. - 32 с.
Методические указания к лабораторному практикуму по органической химии Ч.2. Учебное пособие/ Басаев Р.М., Колпащикова И.С., Кофанов Е.Р., Обухова Т.А. - Яросл. гос. тех. ун-т. - Ярославль, 1997. - 23 с.
Номенклатура органических соединений : учеб. пособие/ М.С. Белышева, И. С. Колпащикова, В. В. Плахтинский ; Яросл. гос. техн. ун-т. - Ярославль, 2009. - 76 с.
Сборник задач по органической химии : учеб. пособие / И. С. Колпащикова, А. Ф. Бетнев, Е. М. Алов ; Яросл. гос. техн. ун-т. - Ярославль, 2010. - 206 с.

Слайд 4Дополнительная литература
Органикум (практикум по органической химии) т.1 и т.2
"Мир",1980 г.
А.А.Терней, Современная органическая химия, т. 1,2, «Мир», Москва,
1981 г.
Р.Моррисон, Р.Бойд, Органическая химия, «Мир», Москва, 1974 г.
Дж.Робертс, М.Кассерио, Основы органической химии, «Мир», Москва, 1978 г.
5. Справочно-информационная система «Химический ускоритель», http://www.reakor.ru/leos/index.php
6. On-Line Learning Center for "Organic Chemistry" (Francis A. Carey), http://www.mhhe.com/physsci/chemistry/carey5e/
7. Химический навигатор-поиск по химии, http://chemnavigator.hotbox.ru
Слайд 5СТРУКТУРА КУРСА
2 семестр
Лекции
26 ч
Лабораторные занятия 58 ч
Самостоятельная работа 96
Контрольная работа 5
Расчетно-графическое задание 1
Экзамен +
Слайд 6Цель курса
На основе знаний о состоянии и достижений современной
органической химии научить обучающегося:
1. Применять полученные теоретические знания
для решения конкретных практических задач;
2. Предвидеть физические и химические свойства органических соединений на основе их структуры, предсказывать превращения органических веществ в окружающей среде и прогнозировать последствия этих превращений;
3. Привить практические навыки по синтезу, выделению, очистке и идентификации органических веществ;
4. Научить грамотно обрабатывать, анализировать и оформлять результаты эксперимента.
Слайд 7ОРГАНИЧЕСКАЯ ХИМИЯ
Термин «органический» сохранился с давних пор, когда вещества делили
на неорганические (полученные из минералов) и органические соединения растительного и
животного
происхождения.
Соединения, полученные из живых организмов, объединяло то что все они содержали углерод.
Фридрих Вёлер
Слайд 8Органическая химия – это химия
соединений углерода
Особая роль углерода в нашем
мире обусловлена уникальной способностью его атомов образовывать связи друг с
другом. Ни один другой элемент не обладает такой способностью. Эта уникальность углерода делает возможным существование самой жизни.
Мы сами, окружающие нас предметы, животные, растения – есть суть соединений углерода.
Число соединений углерода во много раз больше числа соединений, не содержащих углерода.
Одна из основных проблем органической химии – определение расположения атомов в молекулах, т. е. установление структуры
соединения.
Слайд 9Основные этапы развития химии
1. Предалхимический период: до III в. н.э.
2. Алхимический период:
III – XVII вв.
3. Период становления (объединения): XVII – XVIII вв.
4. Период
количественных законов (атомно-молекулярной
теории): 1789 – 1860 гг.
5. Период классической химии: 1860 г. – конец XIX в.
6. Современный период: с начала XX века по настоящее время.
Слайд 10ОСНОВЫ ТЕОРИИ СТРОЕНИЯ
Основой современной органической химии является ТЕОРИЯ СТРОЕНИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, созданная на базе теории химического строения А.М. Бутлерова
и электронных (квантовохимических) представлений о строении атома и природе химической связи.
Современная теория строения позволяет предсказывать основные химические и физические свойства органических соединений, исходя из их химического, пространственного и электронного строения.
Теория строения играет ключевую роль в изучении и систематизации огромного фактического материала органической химии и открывает широкие возможности для получения веществ с заданными свойствами.
Слайд 11Бутлеров Александр Михайлович
(1828-1886)
Слайд 12Структурная теория А.М.Бутлерова
Сущность этой теории можно сформулировать в виде следующих
положений:
1. Атомы, входящие в состав молекулы органического вещества, не находятся
в беспорядочном состоянии, а соединены между собой в определенной последовательности химическими связями (согласно валентности этих атомов).
Последовательность соединения атомов в молекуле А.М. Бутлеров назвал химическим строением.
2. От строения молекул, т. е. от того, в каком порядке соединены между собой атомы в молекуле, зависят свойства вещества.
3. Зная свойства вещества, можно установить его строение, и, наоборот, химическое строение органического соединения может многое сказать о его свойствах.
Слайд 13Структурная теория А.М.Бутлерова
4. Химические свойства атомов и атомных группировок неявляются
постоянными, а зависят от других атомов (атомных групп), находящихся в
молекуле. При этом наиболее сильное влияние атомов наблюдается в том случае, если они связаны друг с другом непосредственно.
5. Строение молекулы можно выразить при помощи структурной формулы, которая для данного вещества является единственной.
Сегодня сущность этой теории можно выразить так: физические и химические свойства органических соединений определяются составом их молекул, а также химическим, пространственным и электронным строением.
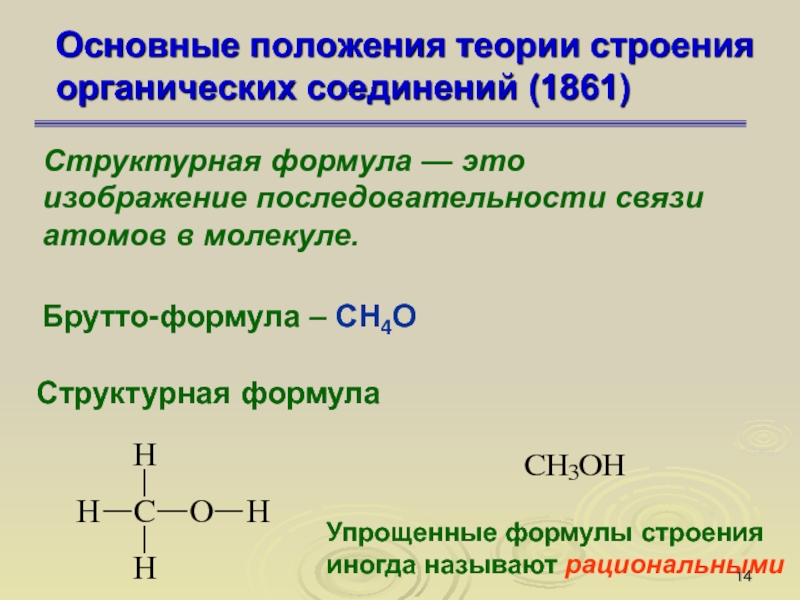
Слайд 14Основные положения теории строения органических соединений (1861)
Структурная формула — это
изображение последовательности связи атомов в молекуле.
Брутто-формула – СН4О
Структурная
формула
Упрощенные формулы строения иногда называют рациональными
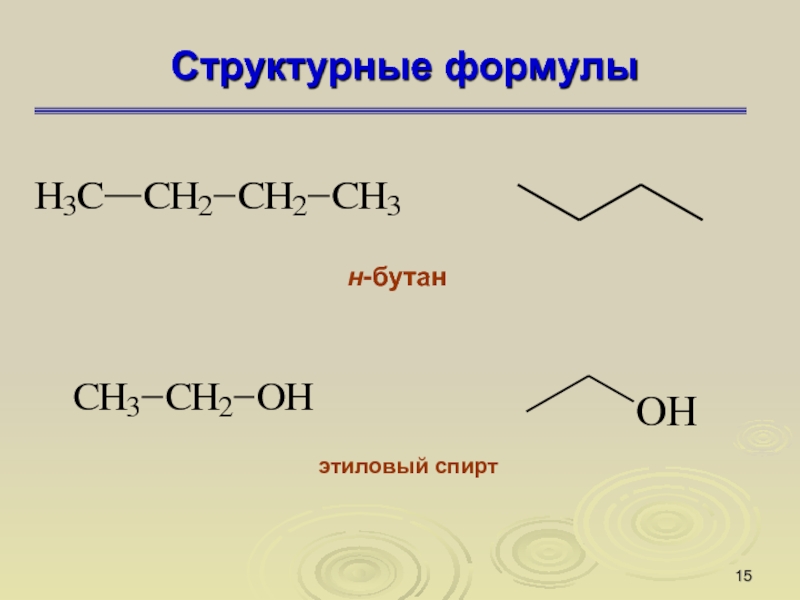
Слайд 15Структурные формулы
н-бутан
этиловый спирт
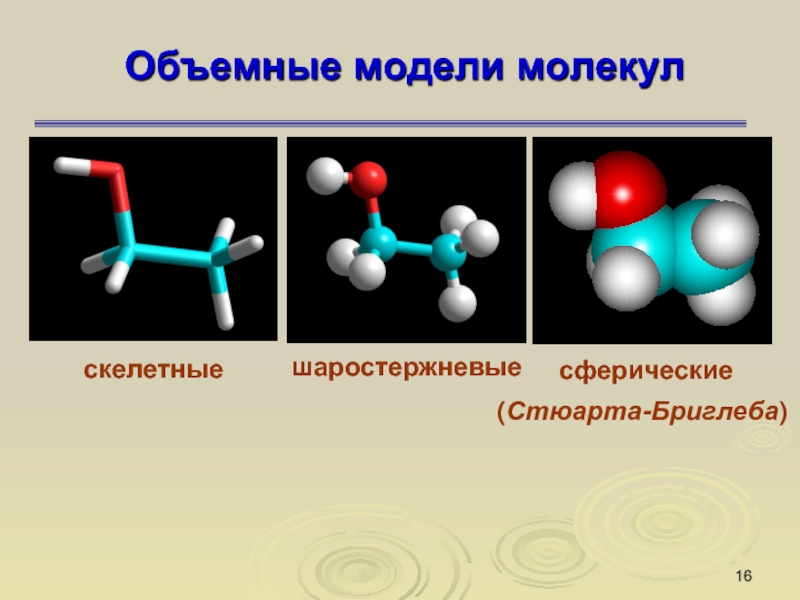
Слайд 16Объемные модели молекул
скелетные
шаростержневые
сферические
(Стюарта-Бриглеба)
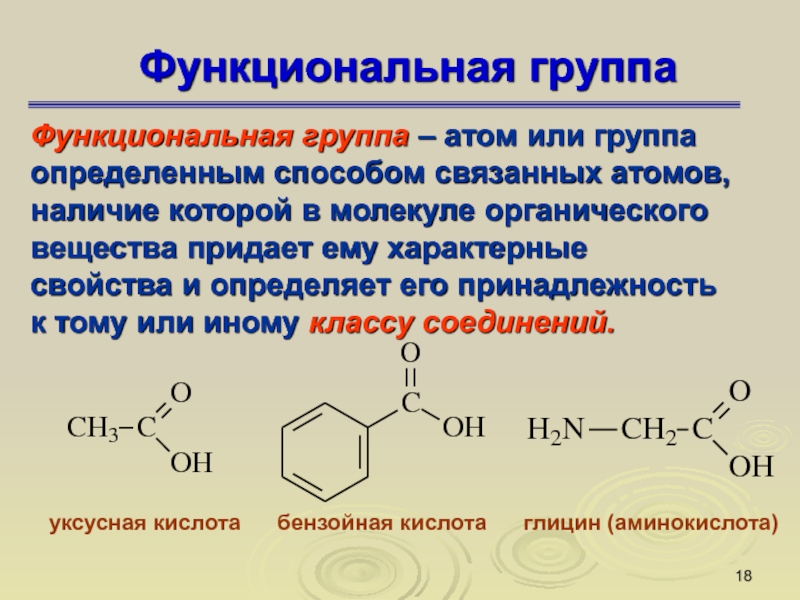
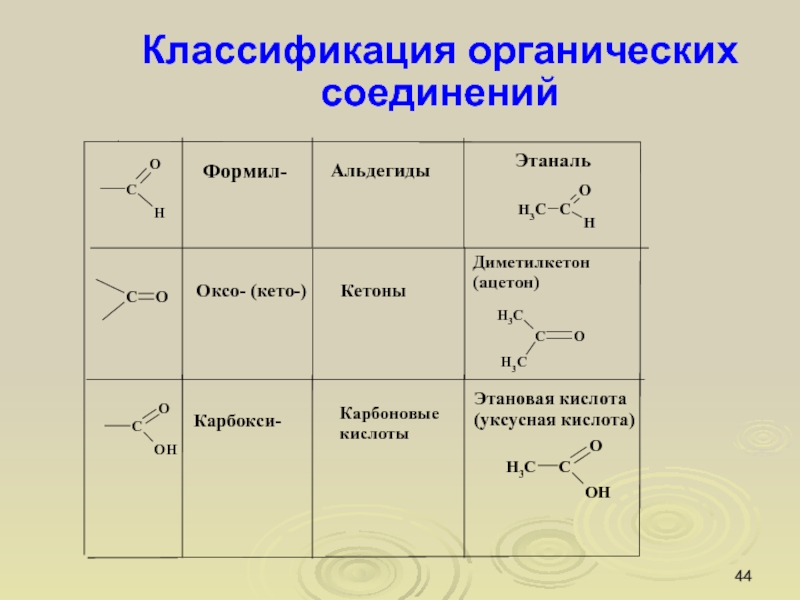
Слайд 18Функциональная группа
Функциональная группа – атом или группа определенным способом связанных
атомов, наличие которой в молекуле органического вещества придает ему характерные
свойства и определяет его принадлежность к тому или иному классу соединений.
уксусная кислота бензойная кислота глицин (аминокислота)
Слайд 19Формулы для описания органических веществ
В молекулах предельных углеводородов, каждый атом
углерода может быть связан с одним, двумя, тремя или четырьмя
атомами углерода, поэтому различают атомы:
первичный – связан только с одним атомом углерода
вторичный - связан с двумя атомами углерода
третичный – связан с тремя атомами углерода
четвертичный – связан с четырьмя атомами углерода
первичный
вторичный
третичный
четвертичный
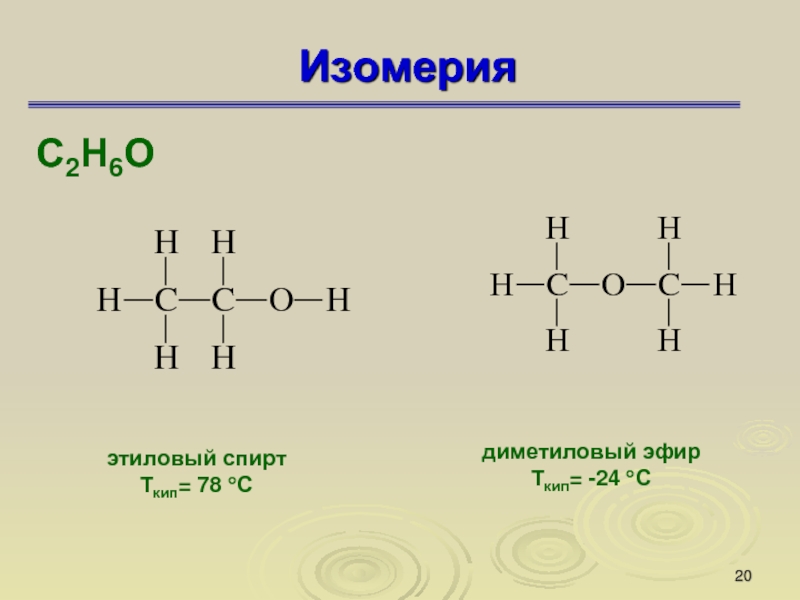
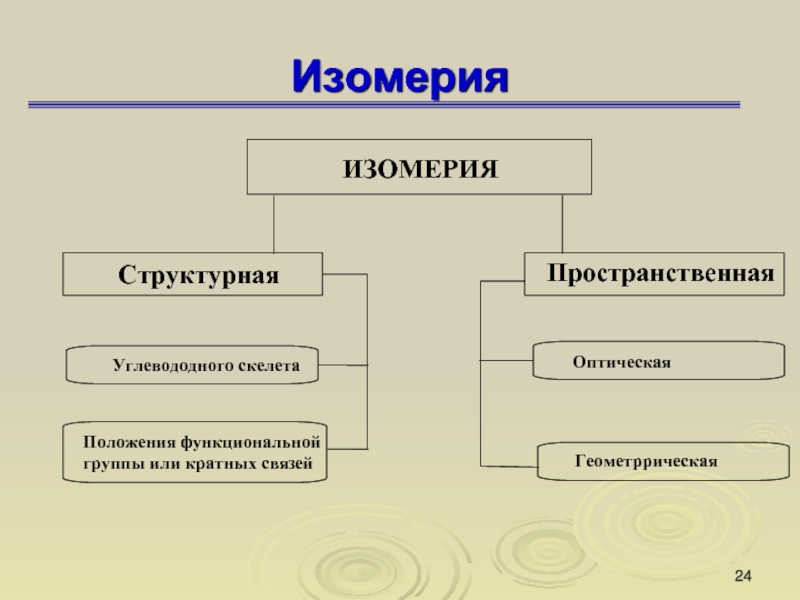
Слайд 20Изомерия
С2Н6О
этиловый спирт
Ткип= 78 °С
диметиловый эфир
Ткип= -24 °С
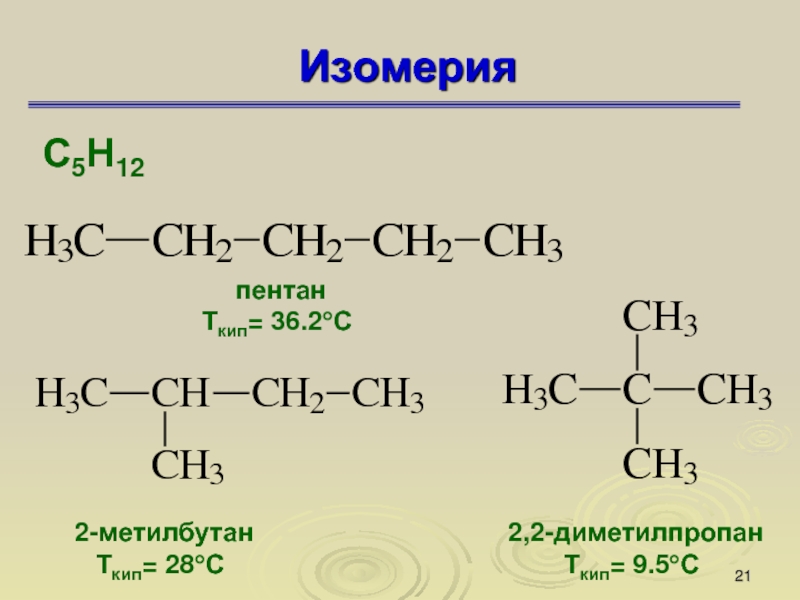
Слайд 21Изомерия
С5Н12
пентан
Ткип= 36.2°С
2-метилбутан
Ткип= 28°С
2,2-диметилпропан
Ткип= 9.5°С
Слайд 22Изомерия
Изомеры — это вещества, которые имеют одинаковую молекулярную формулу, но
различное химическое строение, а поэтому обладают разными свойствами.
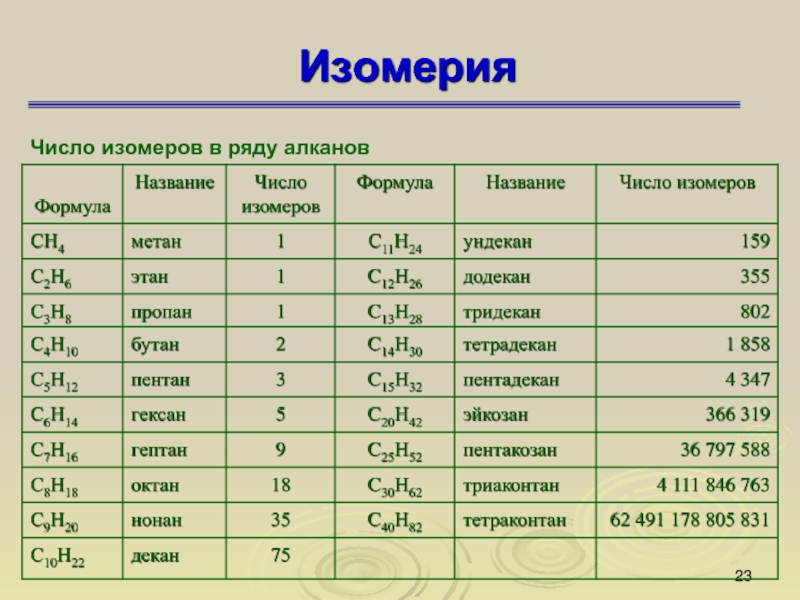
Слайд 23Изомерия
Число изомеров в ряду алканов
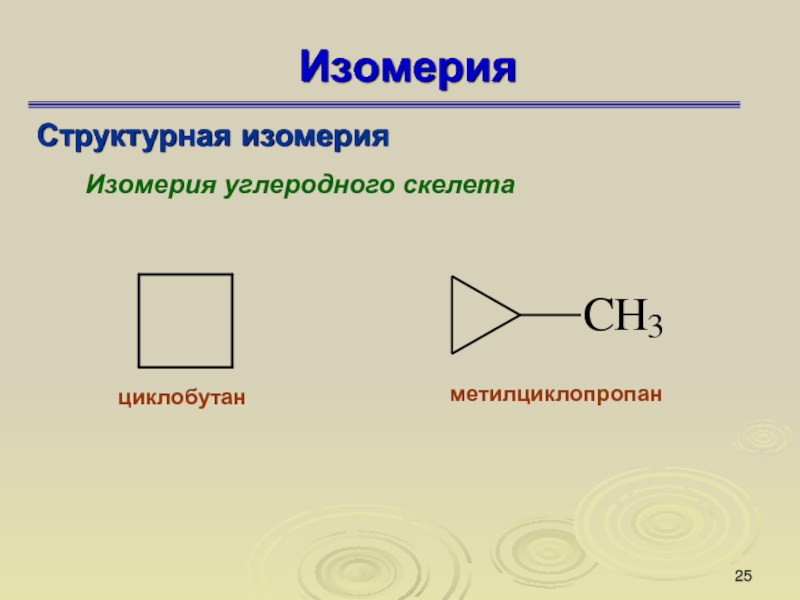
Слайд 25Изомерия
Структурная изомерия
Изомерия углеродного скелета
циклобутан
метилциклопропан
Слайд 26Изомерия
Структурная изомерия
Изомерия положения функциональной группы
бутанол-1
бутанол-2
бутен-1
бутен-2
Слайд 27Изомерия
Структурная изомерия
Изомерия положения функциональной группы
α-аминопропионовая кислота
β-аминопропионовая кислота
Слайд 28Пространственная изомерия
1) геометрическая изомерия;
2) оптическая изомерия.
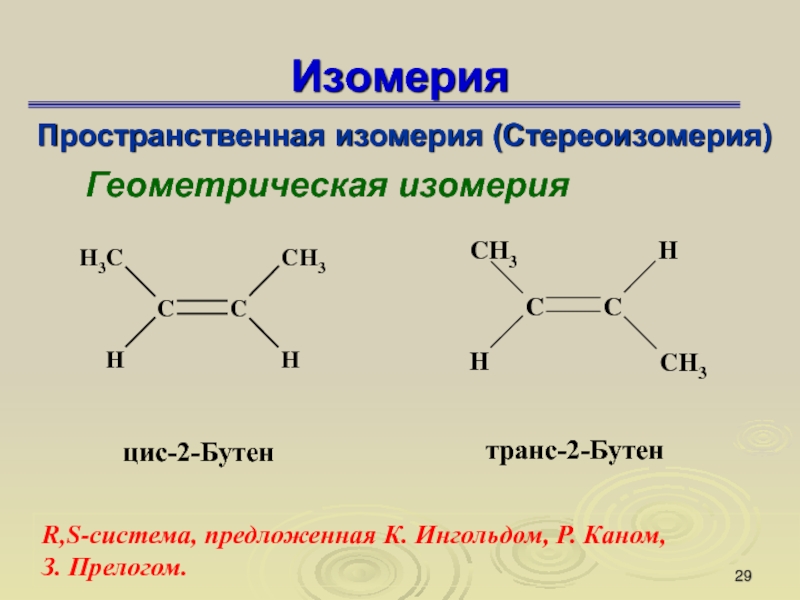
Слайд 29Изомерия
Пространственная изомерия (Стереоизомерия)
Геометрическая изомерия
R,S-система, предложенная К. Ингольдом, Р. Каном,
З.
Прелогом.
Слайд 30Геометрическая изомерия
Геометрическая изомерия свойственна соединениям, содержащим двойные связи (С=С ,
С=N, N=N). В таких соединениях невозможно свободное вращение заместителей вокруг
двойной связи, для этого необходим разрыв π-связи.
Изомер, у которого заместители находятся по обе стороны от плоскости двойной связи, называется транс-изомером, если по одну сторону – цис-изомером:
Слайд 31Изомерия
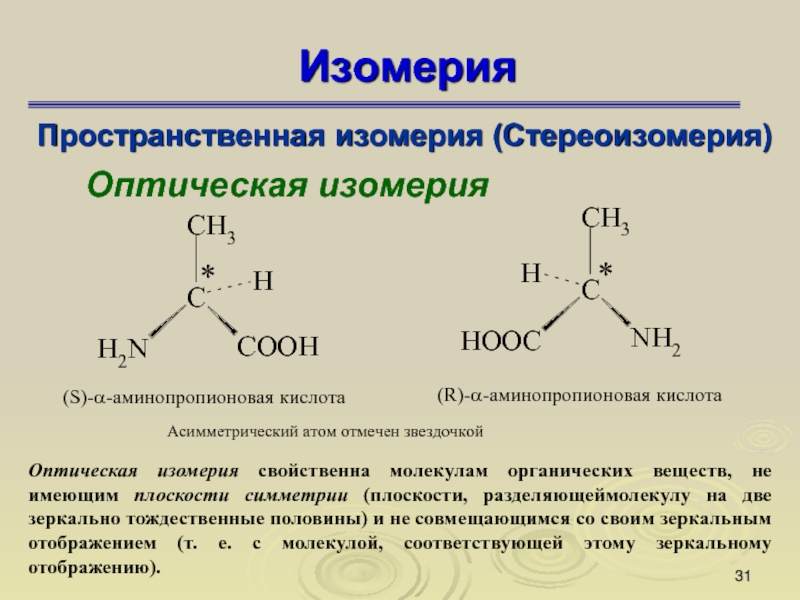
Пространственная изомерия (Стереоизомерия)
Оптическая изомерия
Оптическая изомерия свойственна молекулам органических веществ, не
имеющим плоскости симметрии (плоскости, разделяющеймолекулу на две зеркально тождественные половины)
и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению).
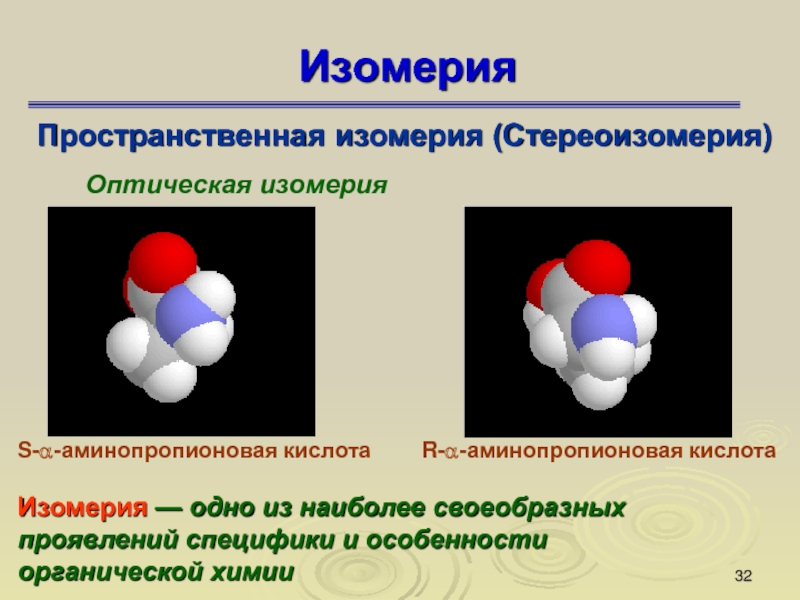
Слайд 32Изомерия
Пространственная изомерия (Стереоизомерия)
Оптическая изомерия
S-α-аминопропионовая кислота
R-α-аминопропионовая кислота
Изомерия — одно из наиболее
своеобразных проявлений специфики и особенности органической химии
Слайд 33Изомерия
.
Оптические изомеры – пространственные изомеры, имеющие
одинаковый количественный и качественный
состав, одинаковое
химическое строение, идентичные по всем физическим и химиче-
ским свойствам,
но отличающиеся оптической активностью – спо-
собностью вращения плоскополяризованного света и образования
при кристаллизации кристаллов, являющихся зеркальными отра-
жениями друг друга.
Оптическая активность обусловлена наличием в молекуле хирального центра – асимметричного атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями.
Два соединения - предмет и его зеркальное изображение (I и II), несовместимые друг с другом, называются энантиомерами (от греческого “энантио” - противоположный).
Свойство соединения существовать в виде энантиомеров называется хиральностью (от греческого “хирос” - рука), а само соединение - хиральным
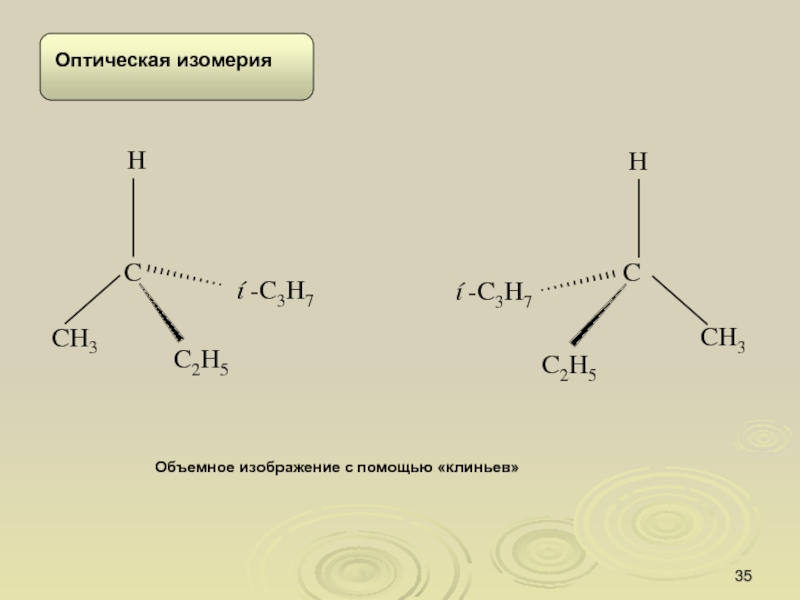
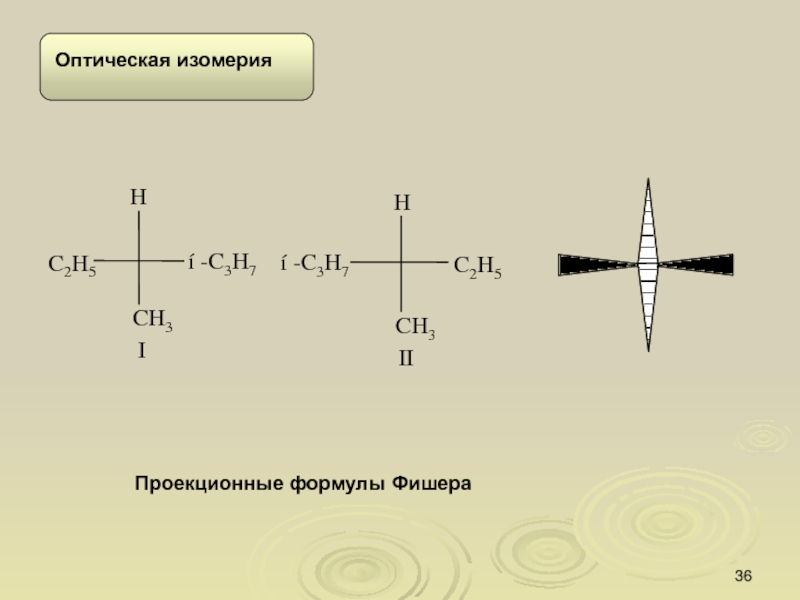
Слайд 34Изомерия
.
Молекула, в которой при атоме углерода находятся две или
более одинаковых групп, имеет плоскость симметрии и, следовательно, не обладает
хиральностью, поскольку молекула и ее зеркальное изображение идентичны. Такие молекулы называются ахиральными.
Слайд 35Объемное изображение с помощью «клиньев»
Слайд 37Отличить один энантиомер от другого можно по знаку вращения плоскополяризованного
света. Энантиомеры вращают плоскость поляризованного света на один и тот
же угол, но в разные стороны: один – по часовой стрелке, другой – на такой же угол, но против часовой стрелки.
Слайд 38Гомология
Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся
друг от друга по количеству групп CH2 в углеродной цепи,
составляют гомологический ряд.
Гомологический ряд метана
и т.д.
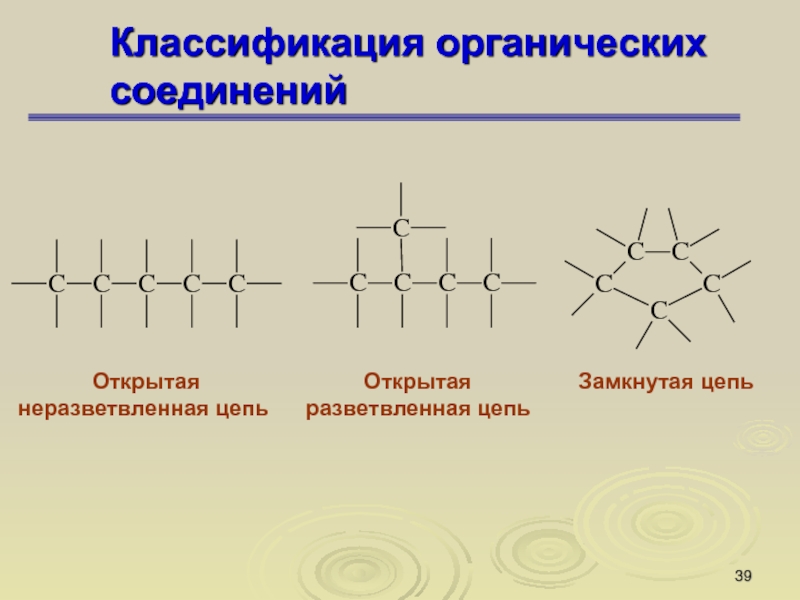
Слайд 39Классификация органических соединений
Открытая
неразветвленная цепь
Открытая
разветвленная цепь
Замкнутая цепь
Слайд 40Классификация органических соединений
Слайд 41По расположению атомов углерода в молекуле органические
соединения делятся на:
ациклические
соединения - соединения с открытой (незамкнутой)
цепью углеродных атомов
CH3-CH2-CH3 CH2=CH2 CH3-CH=CH2 и т.д.
и их прозводные, содержащие различные характеристические
группы (функции). Насыщенные (алканы), ненасыщенные (алкены, алкины)
карбоциклические соединения - соединения с циклами из углеродных атомов:
алициклические соединения - циклические углеводороды и их производные с различной величиной цикла и числом циклов, разным числом двойных связей, кроме шестичленных циклов с тремя двойными связями:
ароматические соединения (арены) и их производные - циклические углеводороды и их производные, которые построены из шестичленных циклов с тремя двойными связями:
3. Гетероциклические соединения и их производные - циклические соединения, циклы которых построены не только из атомов углерода
Слайд 42Классификация органических соединений
В большинстве органических молекул, помимо углерода и
водорода,
содержатся атомы других элементов. Именно от них
в первую очередь
зависят химические свойства органических
веществ.
Эти атомы (кислород, азот, сера и др.) входят в состав особых
группировок, называемых функциональными группами.
Присутствие той или иной функциональной группы,
связанной с радикалом (углеводородный остаток), определяет
принадлежность органических соединений к определенным
классам.
Слайд 43Классификация органических соединений
Функциональные группы и классы органических соединений
Слайд 44Классификация органических соединений
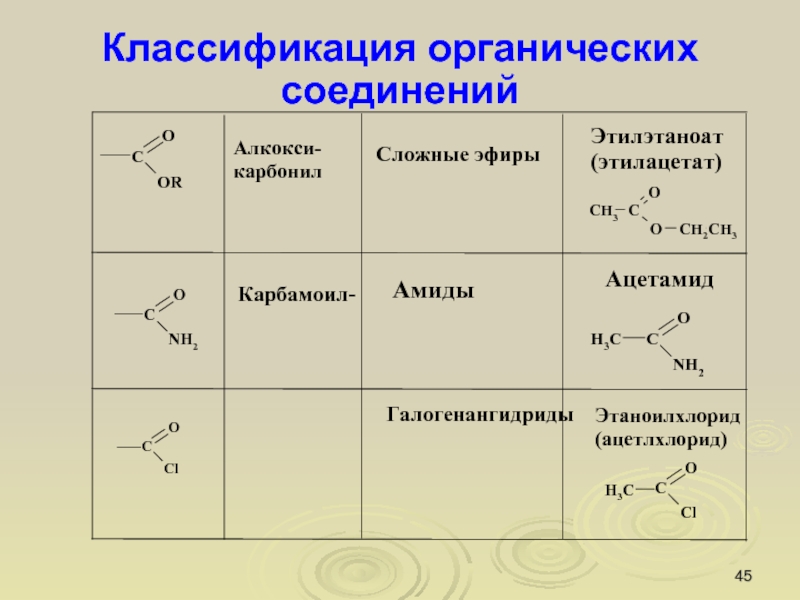
Слайд 45Классификация органических соединений
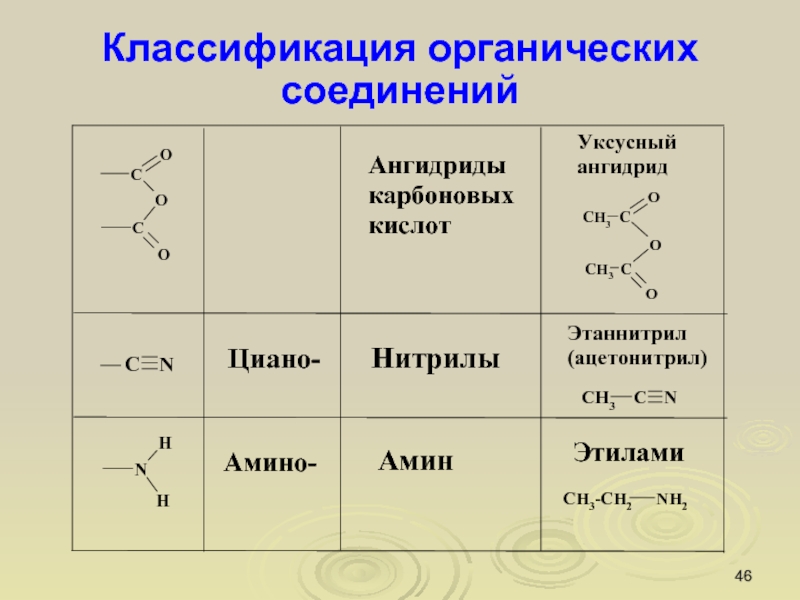
Слайд 46Классификация органических соединений
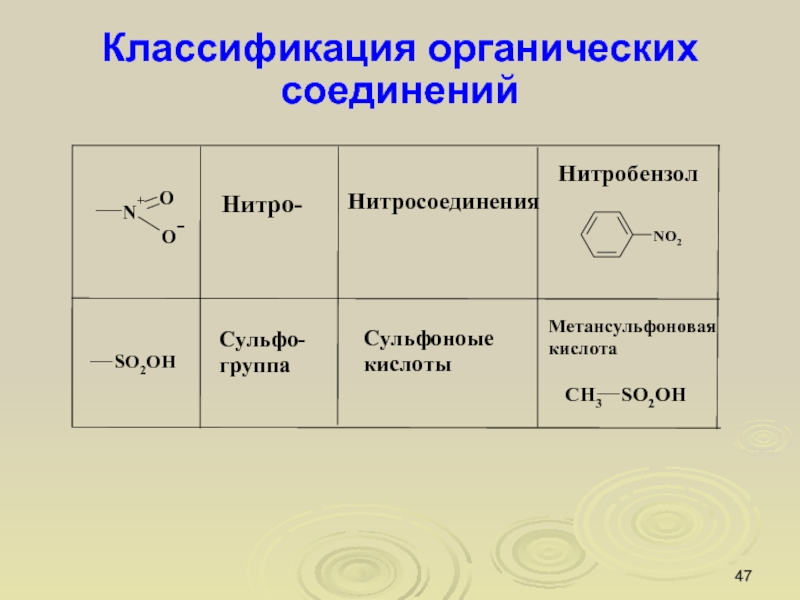
Слайд 47Классификация органических соединений
Слайд 48Классификация органических соединений
Соединения могут содержать не одну, а несколько функциональных
групп. Если эти группы одинаковые, то соединения называются полифункциональными.
хлороформ
глицерин
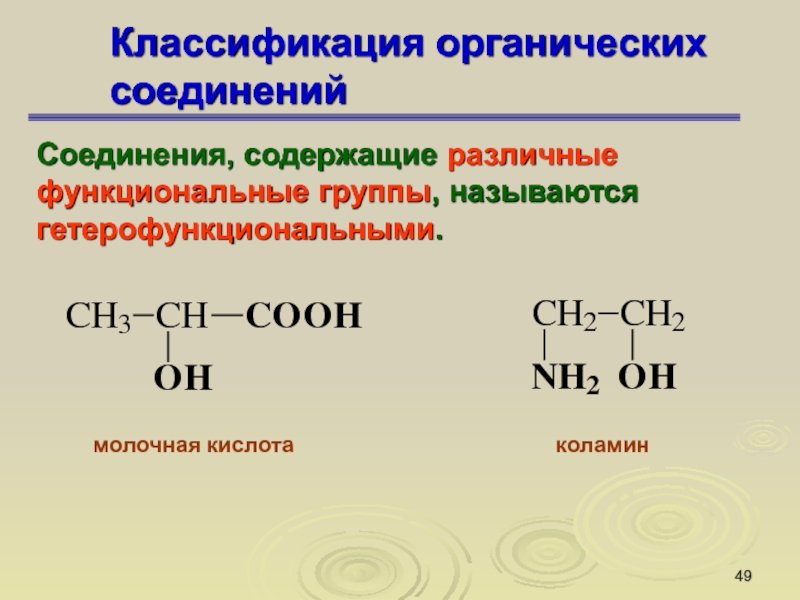
Слайд 49Классификация органических соединений
Соединения, содержащие различные функциональные группы, называются гетерофункциональными.
молочная
кислота
коламин
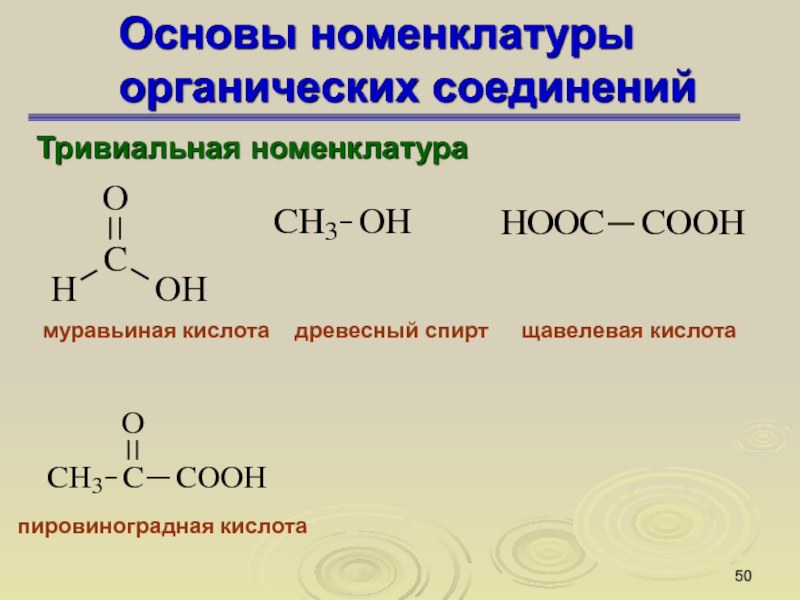
Слайд 50Основы номенклатуры органических соединений
Тривиальная номенклатура
муравьиная кислота
древесный спирт
щавелевая кислота
пировиноградная кислота
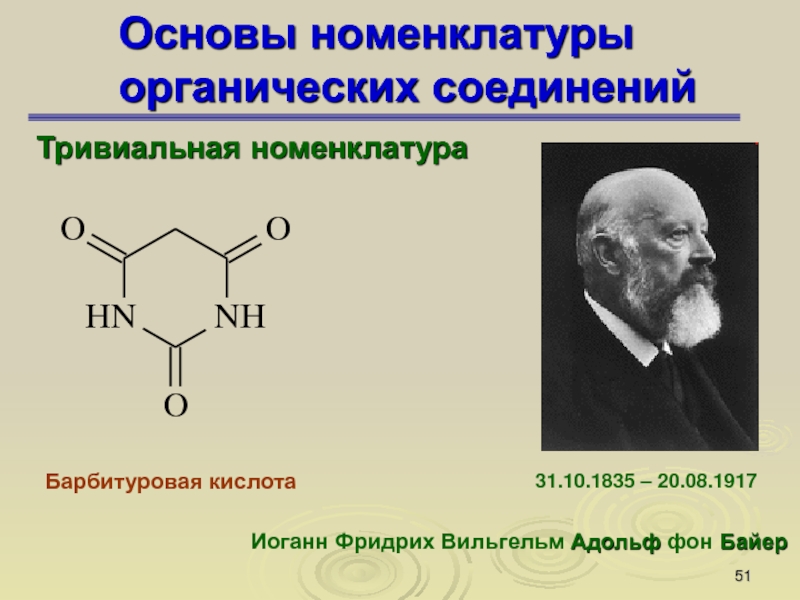
Слайд 51Основы номенклатуры органических соединений
Тривиальная номенклатура
Барбитуровая кислота
Иоганн Фридрих Вильгельм Адольф фон
Байер
31.10.1835 – 20.08.1917
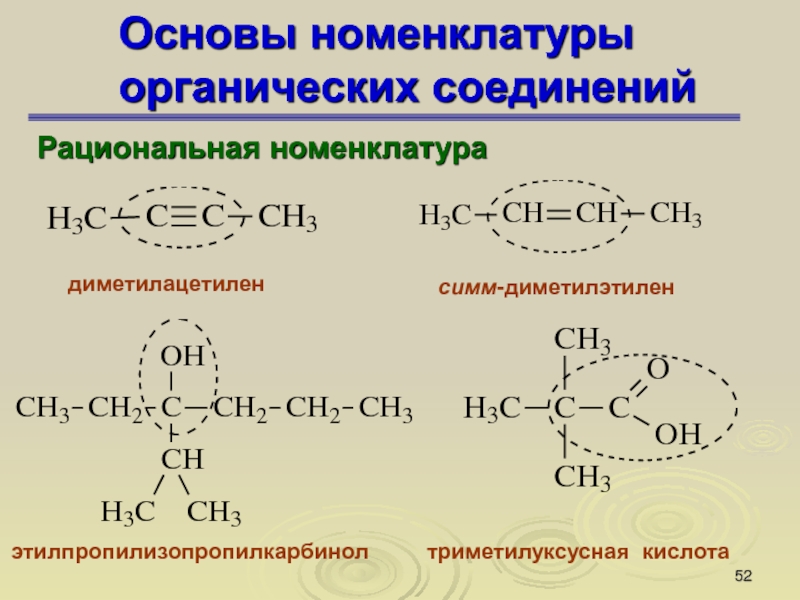
Слайд 52Основы номенклатуры органических соединений
Рациональная номенклатура
диметилацетилен
симм-диметилэтилен
этилпропилизопропилкарбинол
триметилуксусная кислота
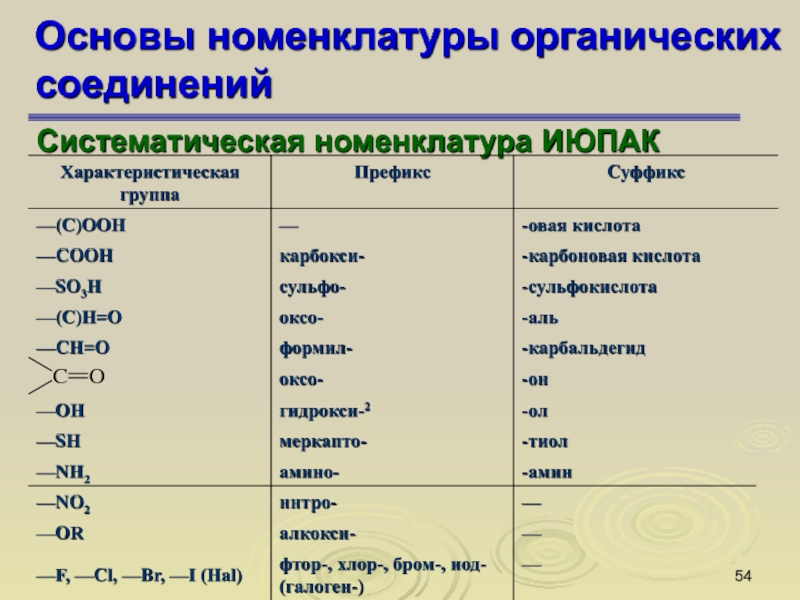
Слайд 53Основы номенклатуры органических соединений
Систематическая номенклатура ИЮПАК
ИЮПАК [от английского названия Международного
союза чистой и прикладной химии — International Union of Pure
and Applied Chemistry (IUPAC)]
Систематические названия составлены из слов, специально созданных или выбранных для описания структурных особенностей соединения.
Слайд 54Основы номенклатуры органических соединений
Систематическая номенклатура ИЮПАК
Слайд 55ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
Слайд 56Электронная структура атома углерода
в органических соединениях
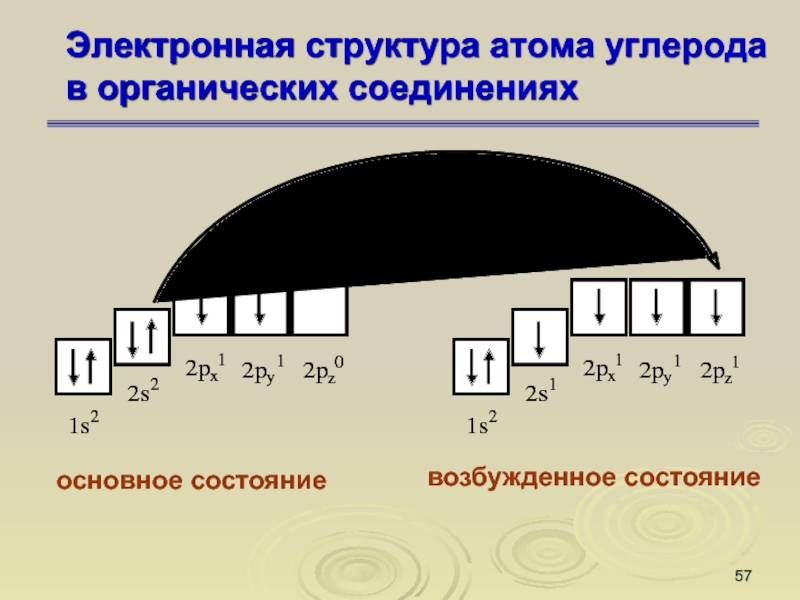
Слайд 57Электронная структура атома углерода
в органических соединениях
основное состояние
возбужденное состояние
Слайд 58Гибридизация атомных орбиталей
Из четырех неэквивалентных атомных орбиталей (одной S и
трех Р) «образуется» ЧЕТЫРЕ эквивалентные «гибридизованные» - SP3 – гибридные
орбитали.
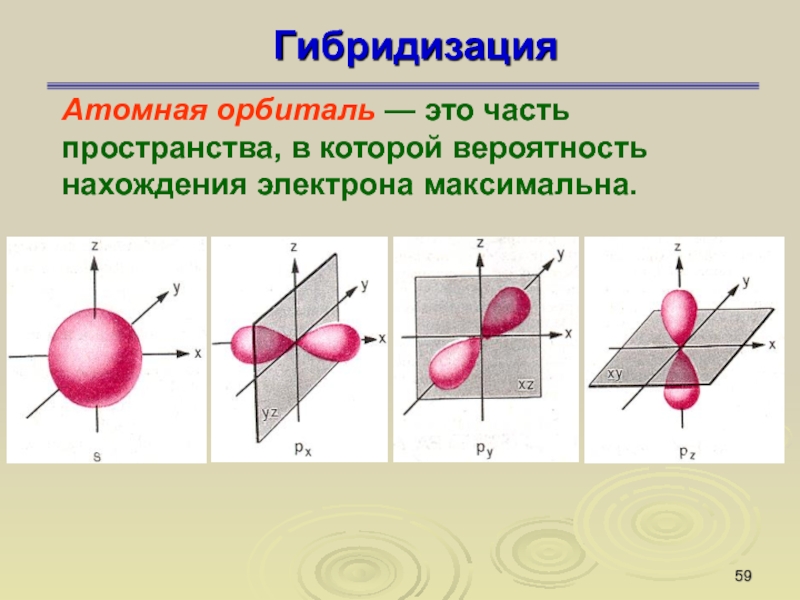
Слайд 59Гибридизация
Атомная орбиталь — это часть пространства, в которой вероятность
нахождения электрона максимальна.
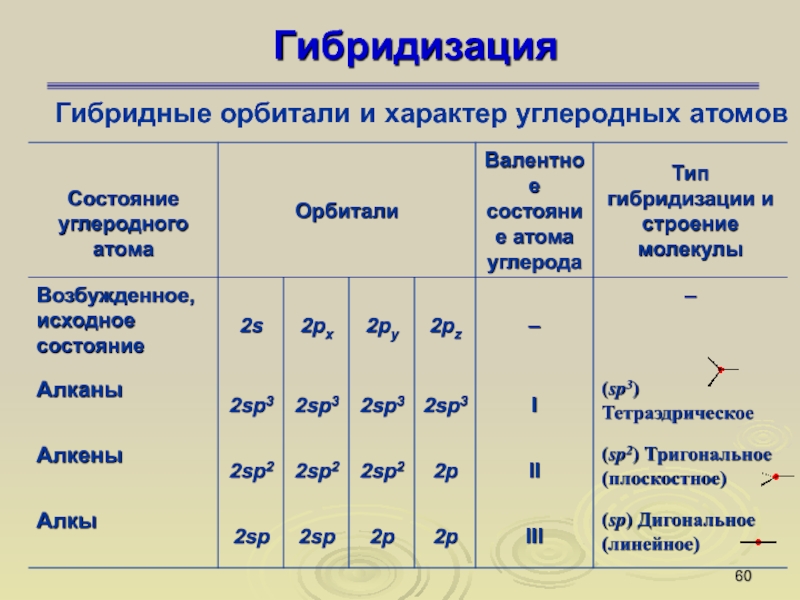
Слайд 60Гибридизация
Гибридные орбитали и характер углеродных атомов
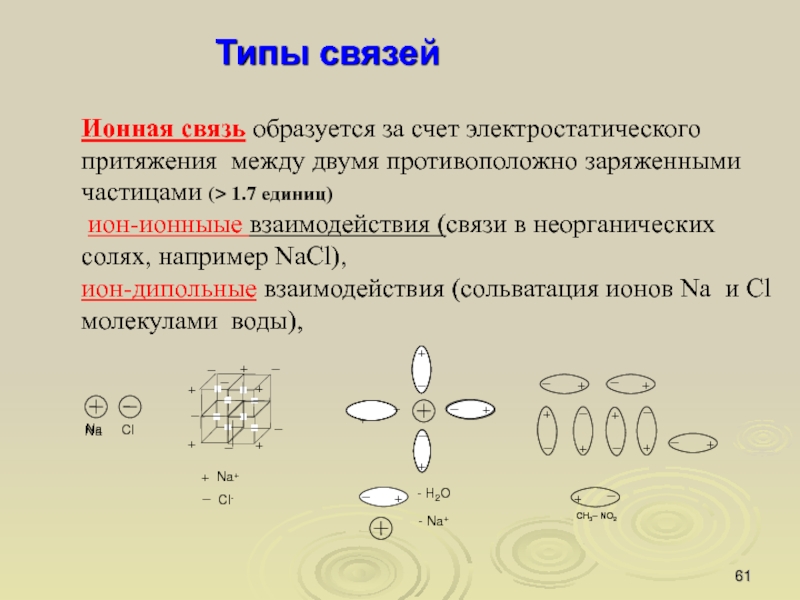
Слайд 61Типы связей
Ионная связь образуется за счет электростатического притяжения между двумя
противоположно заряженными частицами (> 1.7 единиц)
ион-ионныые взаимодействия (связи в
неорганических солях, например NaCl),
ион-дипольные взаимодействия (сольватация ионов Na и Cl молекулами воды),
+
_
+
+
+
_
_
_
_
_
+
Na
Cl
_
+
_
+
+
_
_
+
+ Na+
_
Cl-
_
+
- H2O
- Na+
_
+
_
+
_
+
CH3– NO2
_
+
+
+
+
+
_
_
_
_
Na
Слайд 62Необходимое условие образования связи -
наличие двух электронов (по одному
от каждого атома или два от любого из атомов, образующих
связь)
Ковалентная связь
Слайд 63Ковалентная связь
В рамках классической теории химического строения ковалентная связь объясняется
как образование электронных пар, общих для связываемых атомов и достраивающих
их электронные оболочки в молекуле до замкнутых (с числом электронов 8, 18 и т.д.).
Квантовохимимическое описание ковалентной связи . проводят обычно в рамках метода валентных связей (валентных схем) или методов молекулярных орбиталей.
Слайд 64Ковалентная связь образуется за счет обобществления двумя
атомами двух электронов.
(И,Лэнгмюр, 1919 г.)
Принцип дублета-октета:
устойчивым считается атом,
содержащий на внешней оболочке
(орбитали) два или восемь электронов
Дж.Н.Льюис, В.Кессель,
1916 г.
Ковалентная связь
Слайд 65Ковалентная связь может образовываться двумя способами:
каждая частица, участвующая в образовании
связи,
предоставляет по одному электрону:
2. одна частица предоставляет пару электронов,
другая - незаполненную орбиталь:
Ковалентная связь, образованная за счет пары электронов
только одного атома, называется семиполярной,
донорно-акцепторной или координационной связью.
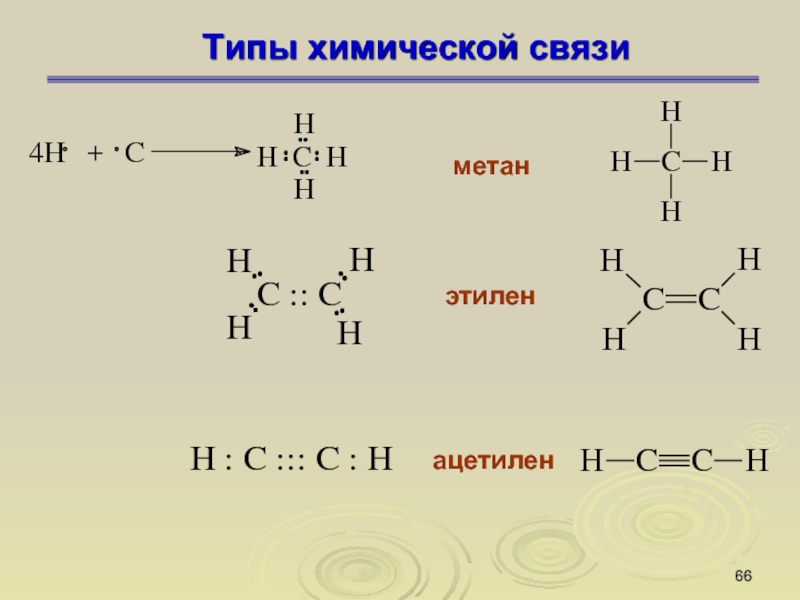
Слайд 66Типы химической связи
метан
этилен
ацетилен
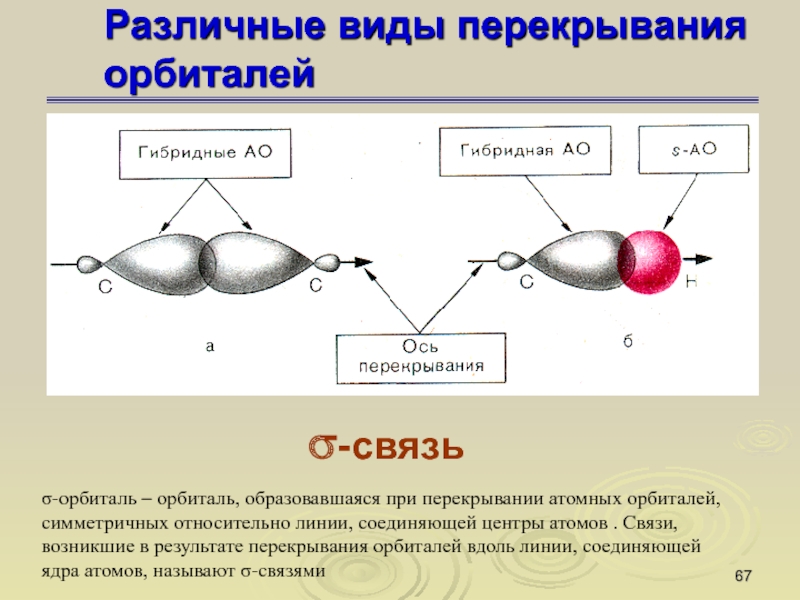
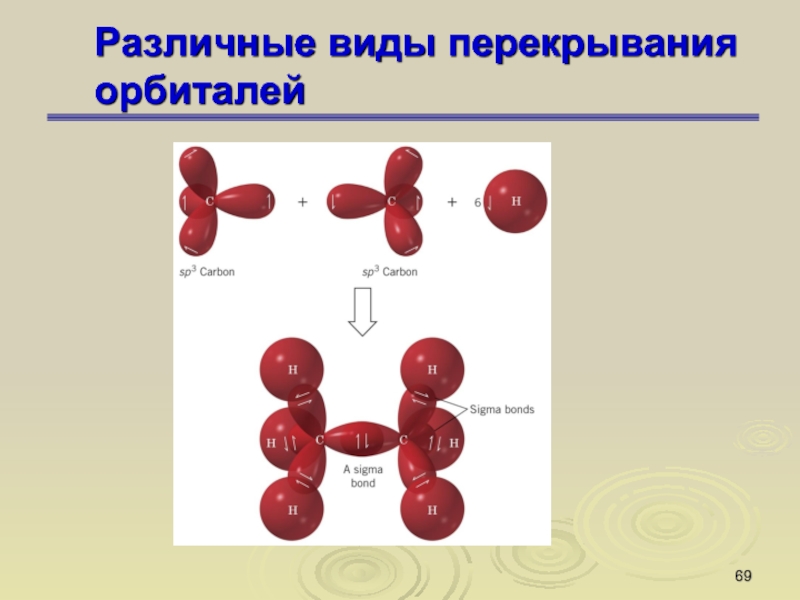
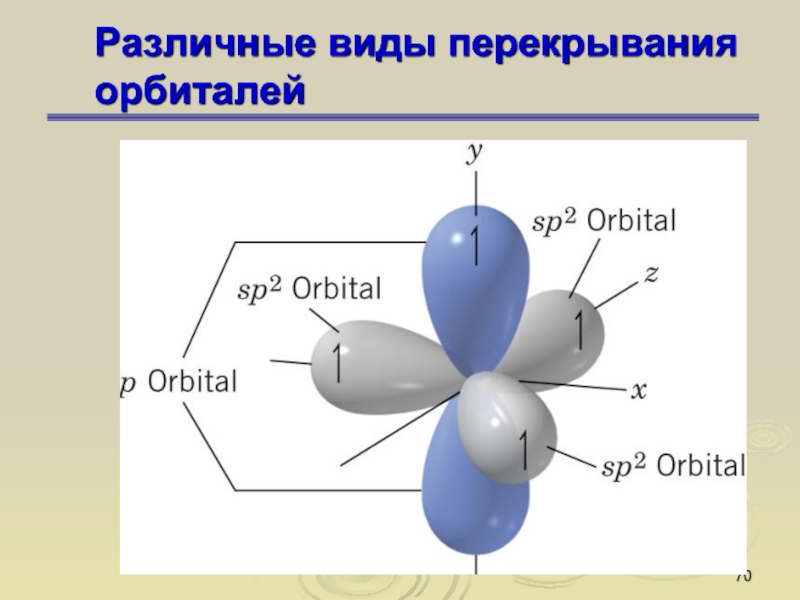
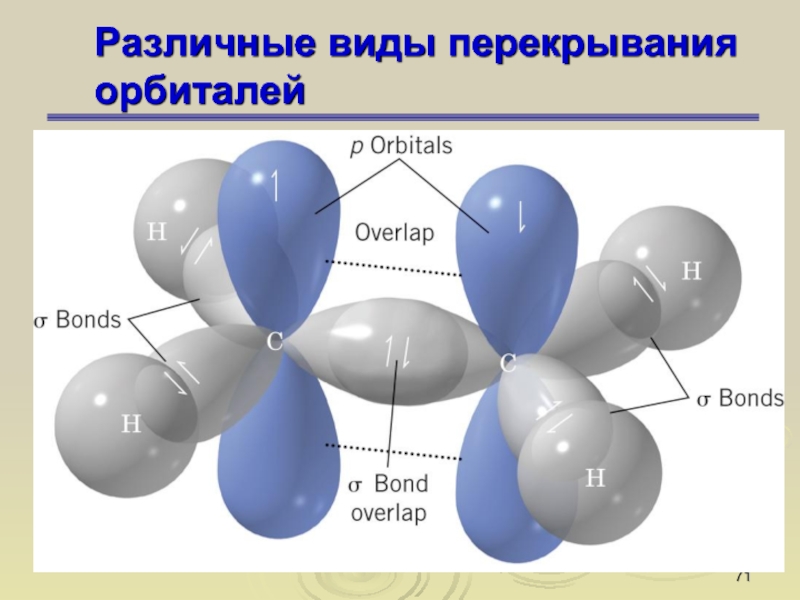
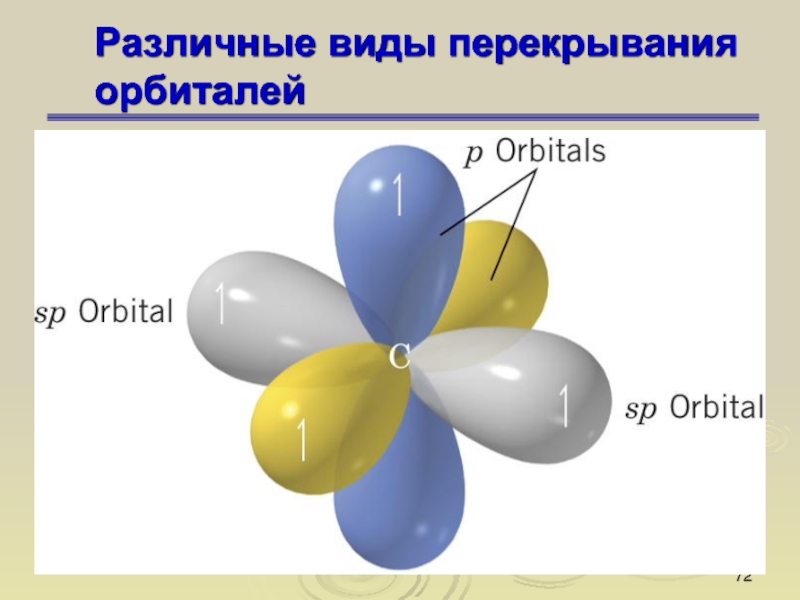
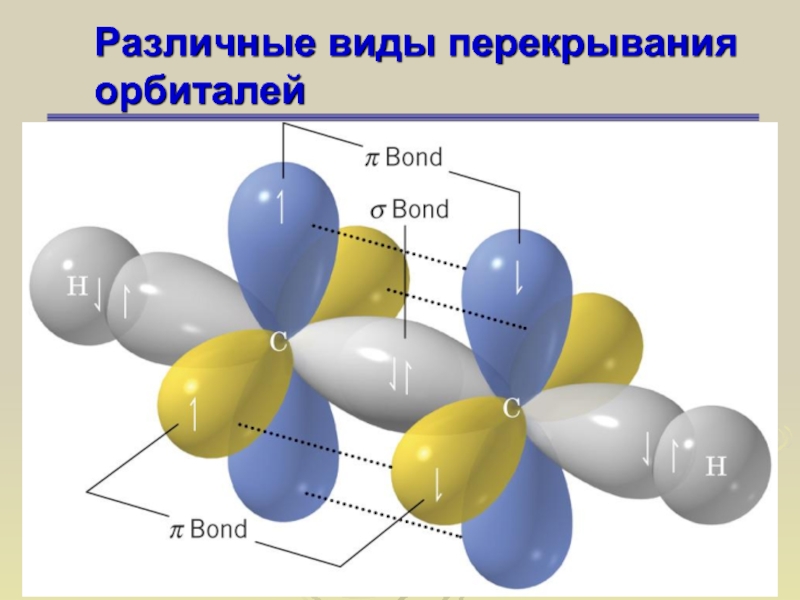
Слайд 67Различные виды перекрывания орбиталей
σ-связь
σ-орбиталь – орбиталь, образовавшаяся при перекрывании
атомных орбиталей, симметричных относительно линии, соединяющей центры атомов . Связи,
возникшие в результате перекрывания орбиталей вдоль линии, соединяющей ядра атомов, называют σ-связями
Слайд 68Различные виды перекрывания орбиталей
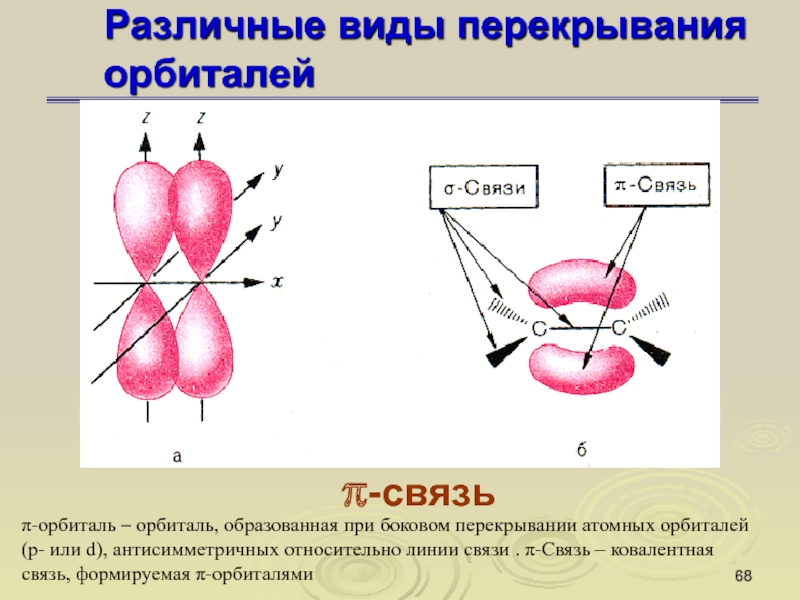
π-связь
π-орбиталь – орбиталь, образованная при боковом
перекрывании атомных орбиталей (р- или d), антисимметричных относительно линии связи
. π-Связь – ковалентная связь, формируемая π-орбиталями
Слайд 69Различные виды перекрывания орбиталей
Слайд 70Различные виды перекрывания орбиталей
Слайд 71Различные виды перекрывания орбиталей
Слайд 72Различные виды перекрывания орбиталей
Слайд 73Различные виды перекрывания орбиталей
Слайд 74Свойства ковалентных связей
Энергия (прочность)
Длина
Полярность
Валентный угол
Поляризуемость
Слайд 75Энергия связи – средняя энергия, которая необходима для гомолитического разрыва
связи (энергия диссоциации).
Гомолитический разрыв связи – разрыв связи, приводящий к
образованию двух частиц, каждая из которых имеет один неспаренный
электрон.
Радикал – частица, имеющая неспаренный электрон.
Гетеролитический разрыв связи – разрыв связи, приводящий к
образованию двух ионов.
Карбокатион - электронодефицитная, положительно заряженная
частица, в которой заряд сосредоточен на одном или делокализован
на нескольких атомах углерода.
Карбоанион – электроноизбыточная , отрицательно заряженная частица …
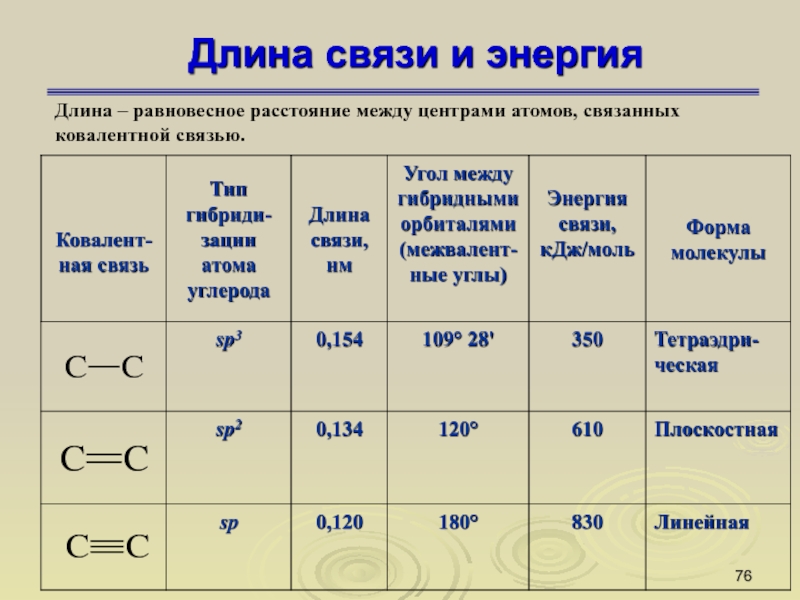
Слайд 76Длина связи и энергия
Длина – равновесное расстояние между центрами атомов,
связанных
ковалентной связью.
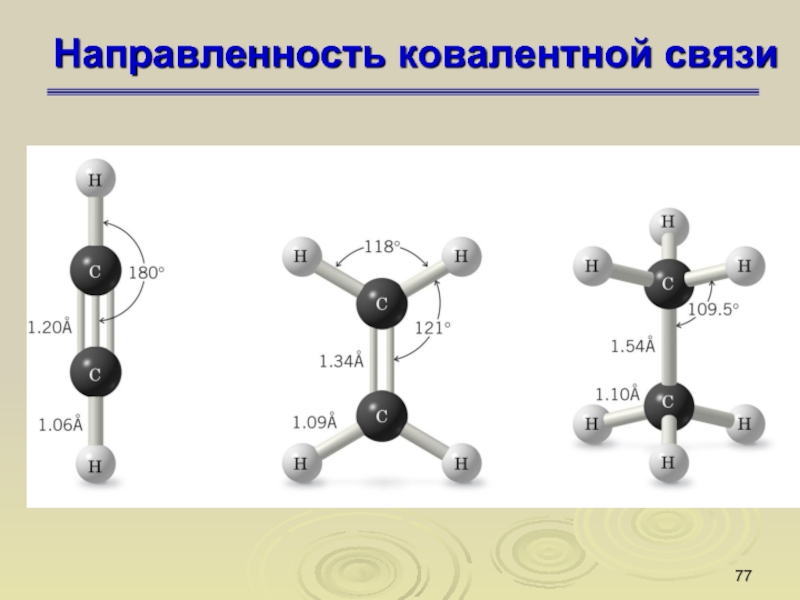
Слайд 77Направленность ковалентной связи
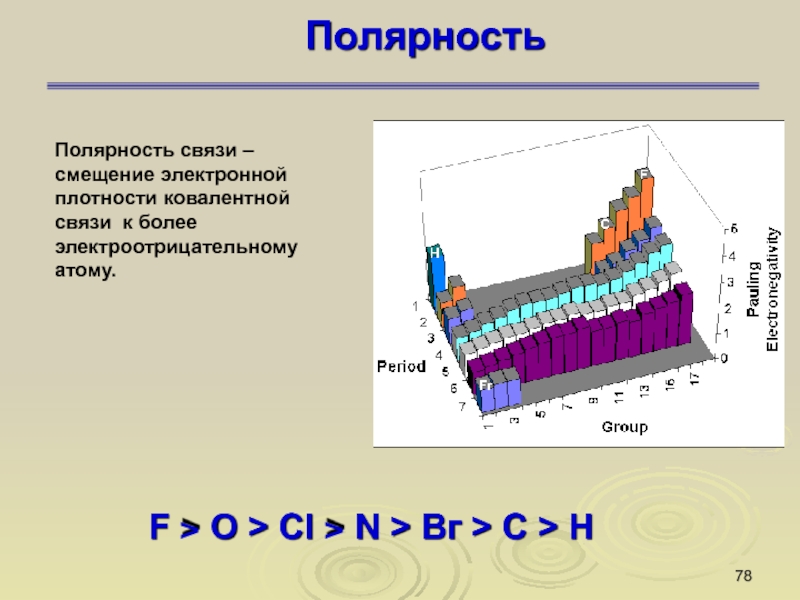
Слайд 78Полярность
F > O > Сl > N > Вг >
С > Н
Полярность связи – смещение электронной плотности ковалентной
связи к более электроотрицательному атому.
Слайд 80Поляризуемость
Ковалентная связь обладает поляризуемостью — способностью изменять свою полярность, например,
под влиянием внешнего воздействия.
π-связи поляризуются гораздо легче, чем σ-связи
Слайд 81
Реакционная способность органических соединений
Элементарный акт реакции это процесс, в котором
происходит разрыв одной и образование другой химической связи.
Реакционный центр
это атом, у которого происходит разрыв или образование связей.
Механизм реакции это схема, в которой изображены элементарные акты реакции, показаны реакционные центры, исходные и конечные продукты.
Под этим термином подразумевается детальное
описание превращения исходных соединений в продукты с возможно более подробным описанием состава, строения и других характеристик промежуточных продуктов и переходных состояний.
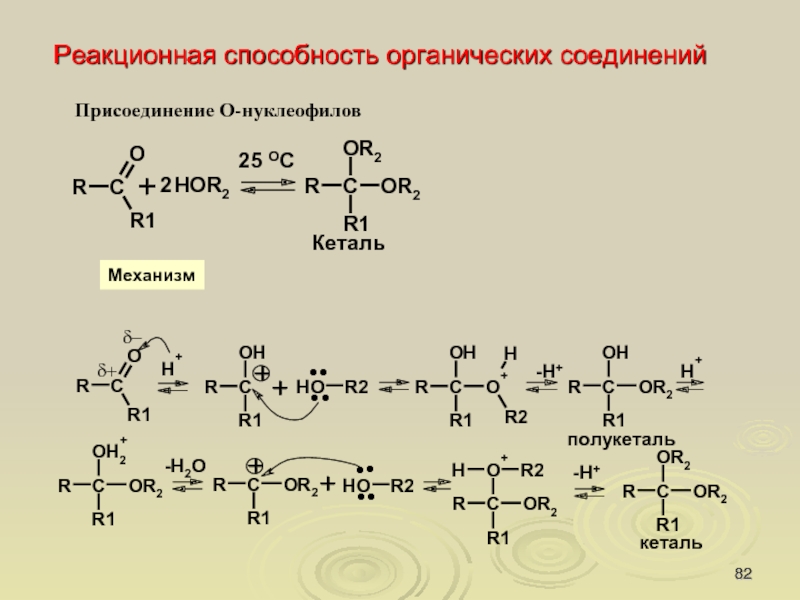
Слайд 82
Реакционная способность органических соединений
Присоединение О-нуклеофилов
Механизм
Слайд 83
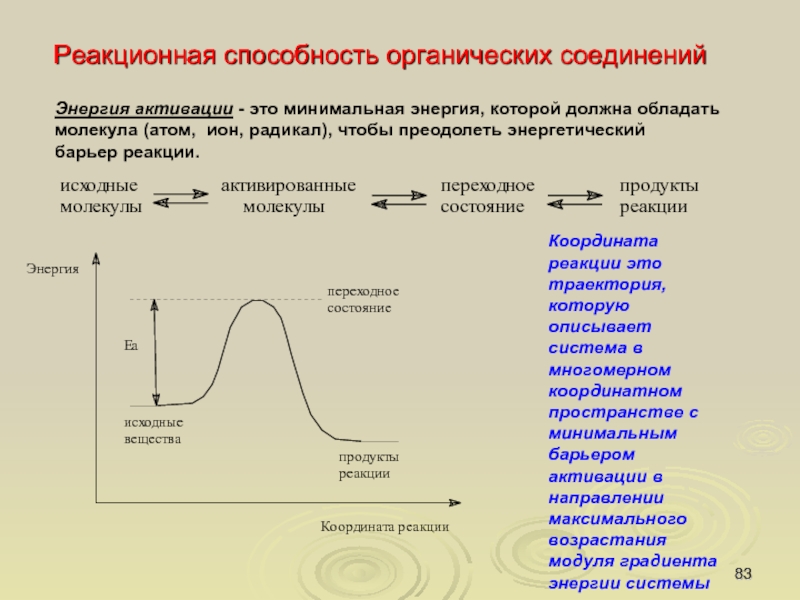
Реакционная способность органических соединений
Энергия активации - это минимальная энергия, которой
должна обладать
молекула (атом, ион, радикал), чтобы преодолеть энергетический
барьер
реакции.
Координата реакции это траектория, которую описывает система в
многомерном координатном пространстве с минимальным барьером
активации в направлении максимального возрастания модуля градиента
энергии системы
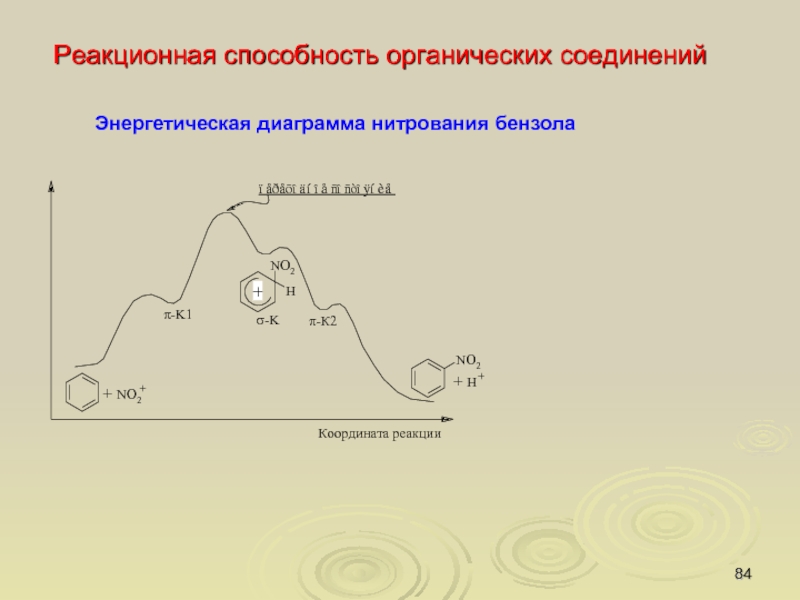
Слайд 84
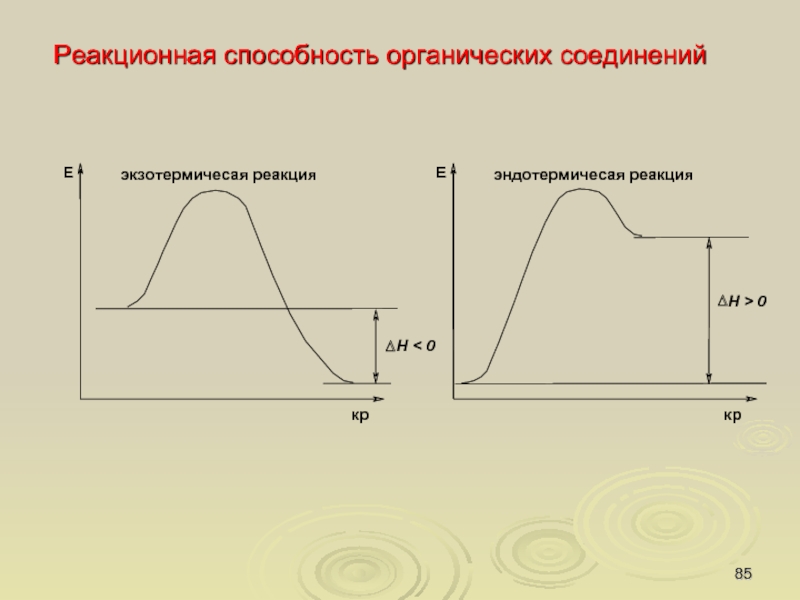
Реакционная способность органических соединений
Энергетическая диаграмма нитрования бензола
Слайд 85
Реакционная способность органических соединений
Слайд 86
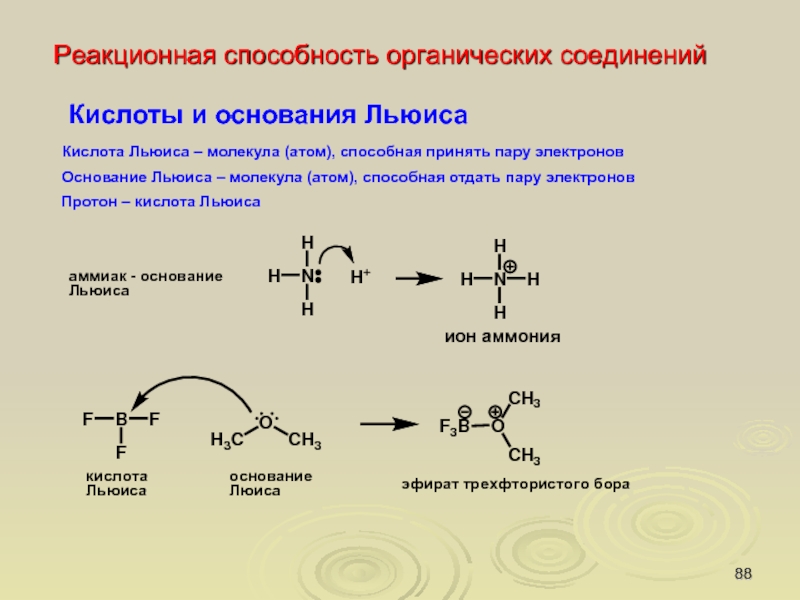
Реакционная способность органических соединений
Протолитическая концепция кислот и
оснований (Бренстед, Лоури,1923г.)
Кислоты это соединения, способные отщеплять (генерировать) протон.
Основания - соединения, способные
присоединять протон.
Процесс ионизации кислоты R−H в растворителе Sol:
Слайд 87
Реакционная способность органических соединений
Протолитическая концепция кислот и
оснований (Бренстед, Лоури,1923г.)
Процесс ионизации основания в растворителе Sol:
Кислоты характеризуются
константой кислотности (K)
или
показателем кислотности (pKa):
Слайд 88
Реакционная способность органических соединений
Слайд 89Классификация органических реакций
Субстратом называют основное органическое вещество, участвующее в реакции,
реагентом – вещество, с которым оно взаимодействует.
Обычно под реагентом
подразумевается
наиболее простое по строению вещество.
Часто органическую реакцию записывают не в виде уравнения, а в виде схемы. Это связано с тем, что в ходе реакции образуется не только основное вещество, но и несколько побочных. В схеме указываются исходные вещества, главный продукт и условия ее проведения. Вместо знака равенства используют стрелку ( ), указывающую направление превращения веществ. Над стрелкой указывают условия проведения реакции (катализатор, давление, температуру, иногда реагенты), а под стрелкой со знаком минус – побочные вещества, выделяющиеся при реакции.
Слайд 90Классификация органических реакций
За основу классификации принимают способ разрыва старых химических
связей и образования новых. В этом случае органические реакции классифицируют
по характеру химических превращений или по механизму их протекания.
Слайд 91Классификация органических реакций
I. По характеру химических превращений органические реакции делят
на следующие типы:
1. Реакции замещения (обозначается буквой S, от англ.
substitution – «замещение» ). Один атом (или группа атомов) замещается на другой атом (или группу атомов) с образованием новой молекулы
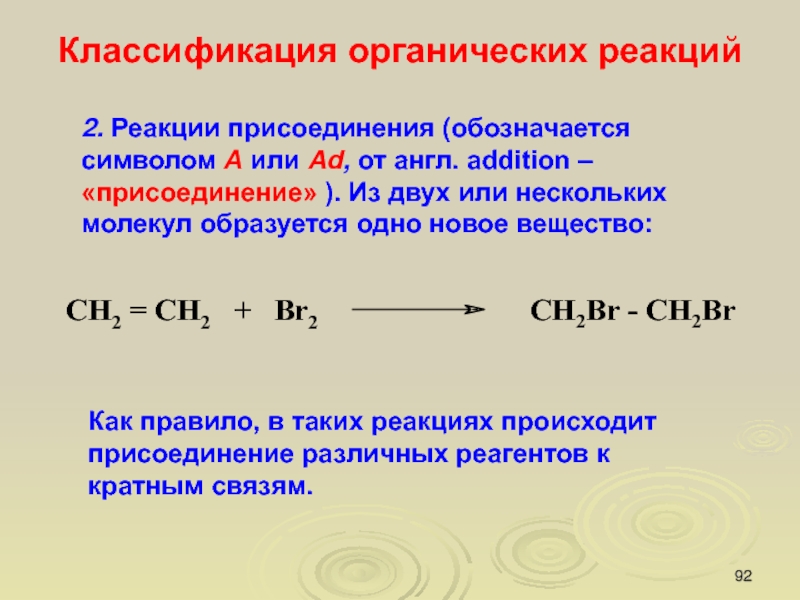
Слайд 922. Реакции присоединения (обозначается символом А или Ad, от англ.
аddition – «присоединение» ). Из двух или нескольких молекул образуется
одно новое вещество:
Классификация органических реакций
Как правило, в таких реакциях происходит присоединение различных реагентов к кратным связям.
Слайд 93Классификация органических реакций
3. Реакции отщепления, или элиминирования (обозначается символом Е,
от англ. еlimination – «отщепление» ). В результате этой реакции
образуется новое вещество, молекулы которого часто содержат кратную связь:
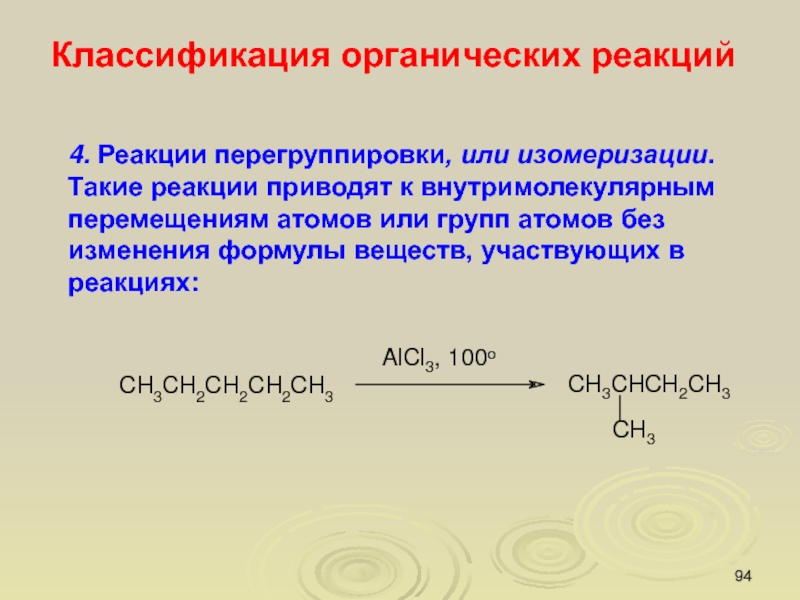
Слайд 944. Реакции перегруппировки, или изомеризации. Такие реакции приводят к внутримолекулярным
перемещениям атомов или групп атомов без изменения формулы веществ, участвующих
в реакциях:
Классификация органических реакций
Слайд 955. Реакции окисления и обратные им реакции восстановления. В результате
этих реакций меняется степень окисления атома углерода, являющегося реакционным центром.
Степень
окисления атома углерода соответствует числу его свзей с элементами более электроотрицательными, чем водород. Так, степень окисления атома углерода в метане СН4 нулевая, в метиловом спирте СН3ОН – первая, в формальдегиде СН2=О – вторая, в муравьиной кислоте НСООН – третья, в оксиде углерода СО2 – четвертая.
В окислительно-восстановительном процессе всегда участвуют два типа веществ: окислитель (соединение, принимающее электроны) и восстановитель (соединение отдающее электроны).
Классификация органических реакций
Слайд 96Классификация органических реакций
1. Гомолитические, или радикальные, реакции идут с участием
свободных радикалов – частиц с неспаренным электроном. Индекс R. Пример
радикального замещения SR:
II. По механизму протекания органические реакции делят на следующие типы
Слайд 97Классификация органических реакций
2. Гетеролитические, или ионные, реакции идут с участием
ионов, а также частиц с неподеленной парой электронов или вакантной
орбиталью, то есть нуклеофилов и электрофилов.
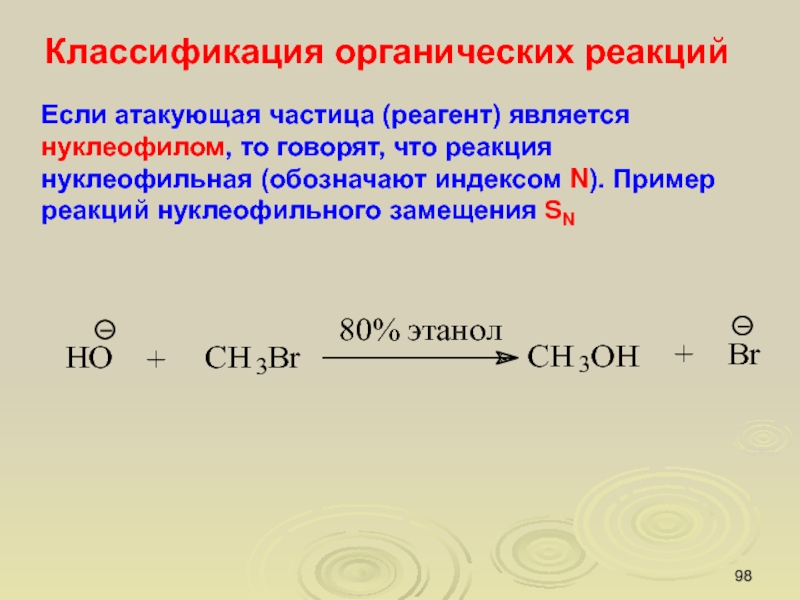
Слайд 98Классификация органических реакций
Если атакующая частица (реагент) является нуклеофилом, то говорят,
что реакция нуклеофильная (обозначают индексом N). Пример реакций нуклеофильного замещения
SN
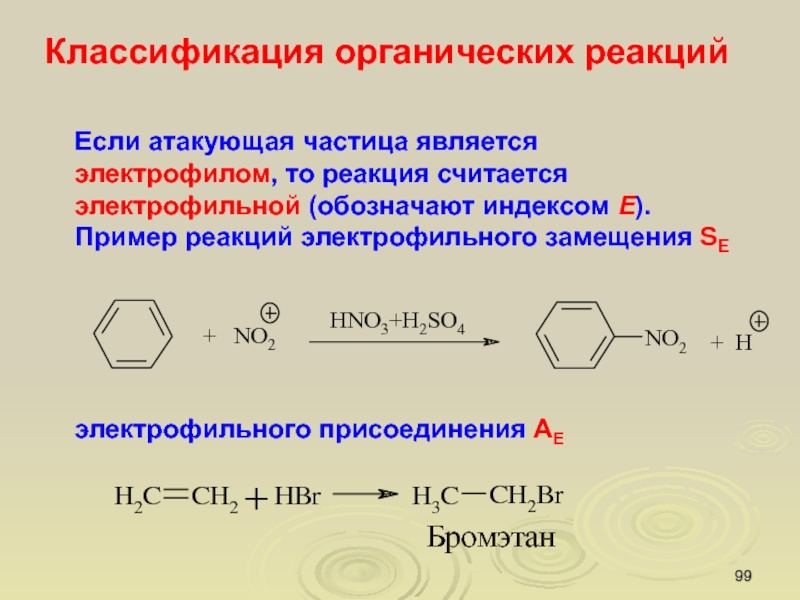
Слайд 99Если атакующая частица является электрофилом, то реакция считается электрофильной (обозначают
индексом E).
Пример реакций электрофильного замещения SE
электрофильного присоединения АЕ
Классификация
органических реакций
Слайд 100Реагирующие органические частицы
Нуклеофил – химическое соединение, способное быть донором электронной
пары (дословно – «любящий, стремящийся к ядру», т. е. к
положительному заряду). К нуклеофилам относятся все анионы и органические соединения с атомами, несущими неподеленные пары электронов.
Слайд 101Электрофил – химическое соединение, способное принимать на себя электронные пары
(дословно – «любящий, стремящийся к электрону», т. е. к отрицательному
заряду). К электрофилам относятся все катионы и кислоты Льюиса – галогениды алюминия, железа, олова, цинка и сурьмы
Реагирующие органические частицы
H+, Li+, BF3, AlCl3, NO2+ и др.
Слайд 102Радикал – нейтральная частица, содержащая один или несколько неспаренных электронов
Реагирующие
органические частицы
Слайд 103Взаимное влияние атомов в молекуле
Индуктивный эффект
Смещение электронной плотности
по цепи σ-связей называется индуктивным эффектом и обозначается буквой I.
Слайд 104Взаимное влияние атомов в молекуле
Индуктивный эффект
Электроноакцепторные заместители,
т.е.
атом или группа атомов, смещающие электронную плотность σ-связи от атома
углерода, проявляют отрицательный индуктивный эффект (-I-эффект).
Электронодонорные заместители, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект
(+I-эффект).
Слайд 105Взаимное влияние атомов в молекуле
Индуктивный эффект
+I-Эффект проявляют алифатические
углеводородные радикалы, т.е. алкильные радикалы (–CH3, –C2H5 и т. д.).
Большинство
функциональных групп проявляют -I-эффект: –Hal, –NH2, –OH, >С=O, –COOH.
пропен
Слайд 106Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Мезомерный
эффект (эффект сопряжения, резонансный эффект) является результатом перераспределения электронной плотности
в сопряженных системах с участием π и n - орбиталей.
Этот эффект возникает за счет смещения π-электронного облака вдоль системы с образованием на противоположных концах такой системы, равных по величине, но различных по знаку частичных зарядов. Мезомерный может передаваться по цепи сопряжения на более дальние расстояния.
Слайд 107Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Мезомерный
эффект (±M) – это электронные смещения в сопряженных системах с
участием π-электронов кратных связей, неподеленных пар
электронов, вакантных орбиталей.
эффект сопряжения (±C), резонансный эффект (±R).
Слайд 108Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Мезомерные
эффекты изображают при помощи изогнутых
стрелок, которые обозначают направление смещения электронов
в
результате сопряжения
Слайд 109Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Вследствие
сопряжения π - орбитали двойной связи с
nр-орбиталями фтора распределение
электронной плотности в реальной молекуле винилфторида не такое, как показывает формула
СН2= СН - F. Делокализация электронов (резонанс) показана на схеме
Эта запись означает, что истинное распределение электронов является промежуточным между двумя граничными (резонансными, мезомерными, предельными) структурами. Граничные структуры являются лишь условными способами изображения, не отвечая действительному состоянию молекулы. Действительное состояние молекулы лежит где-то между изображенными с помощью предельных структур фиктивными крайними положениями. Именно это и выражает термин "мезомерия" (между частями). Смысл граничных структур подчеркивается с помощью двусторонней стрелки (↔), которую ни в коем случае нельзя путать со стрелками ( ), обозначающими равновесие.
Слайд 110Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Таким
образом, альтернативными способами изображения мезомерного эффекта следует считать:
С помощью
Резонансные (предельные) Резонансный
изогнутых стрелок структуры гибрид
Слайд 111Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Положительным
мезомерным эффектом (+ М) обладают электронодонорные группы, способные к частичной
или полной передаче пары электронов в общую сопряженную систему
Слайд 112Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Электроноакцепторные
группы, поляризующие сопряженную систему в противоположном направлении, характеризуются отрицательным мезомерным
эффектом (—М)
Слайд 113Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Функциональные
заместители, вызывающие мезомерный эффект
Слайд 114Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
При
этом М- и I-эффекты могут иметь как одинаковое, так и
противоположное направление. При оценке влияния заместителей на распределение электронной плотности надо учитывать результирующее действие индуктивного и мезомерного эффектов