Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
p - элементы 17 группы периодической системы: галогены
Содержание
- 1. p - элементы 17 группы периодической системы: галогены
- 2. План лекцииВведение1. Общая характеристика галогенов, их физические
- 3. Периодическая система Д. И. Менделеева Неметаллы. Галогеныhttp://www.chemtable.com/indexr.htm
- 4. ВведениеКакие элементы относят к p-элементам?17-я группа (VIIA
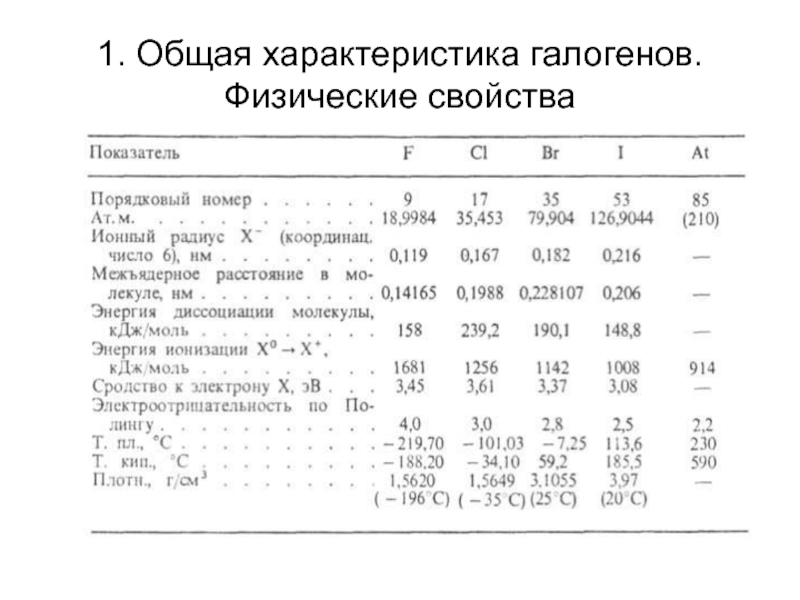
- 5. 1. Общая характеристика галогенов. Физические свойства
- 6. Степени окисления галогенов– 1 (наиболее характерна для
- 7. Слайд 7
- 8. Хлор (200C), бром (200C), иод (400C)
- 9. 2. Нахождение в природе Минералы, содержащие фторФлюорит (плавиковый шпат) CaF2«1С Химия для всех – XXI»
- 10. Минералы, содержащие фторАпатит Ca5(PO4)3F
- 11. Минералы, содержащие фторФосфорит Ca5(PO4)3F
- 12. Минералы, содержащие фторКриолит Na3[AlF6]
- 13. Минералы – хлоридыГалит (каменная соль) NaCl
- 14. Минералы – хлоридыСильвин KCl
- 15. Минералы – хлоридыСильвинит NaCl·KCl
- 16. Минералы – хлоридыКарналлит KCl·MgCl2·6H2O
- 17. Минералы – хлоридыКаинит KCl·MgSO4·3H2O
- 18. Минералы – хлоридыБишофит MgCl2·6H2O
- 19. 3. Получение галогенов Получение фтораВ промышленности –
- 20. Получение хлораВ промышленности – электролиз концентрированного раствора
- 21. Получение брома, иода, астатаПолучение брома и иода
- 22. 4. Химические свойства простых веществНевысокие энергии диссоциации
- 23. Химические свойства фтораРеагирует непосредственно со всеми элементами,
- 24. Химические свойства хлораНепосредственно не реагирует с кислородом,
- 25. Химические свойства бромаСоединения брома с галогенами -
- 26. Растворы брома и иодаИод в воде (слева) и вчетыреххлористом углеродеБромная вода (уравнение)
- 27. Химические свойства иодаВозгоняется при слабом нагреванииПлохо растворим
- 28. Иодная проба в пробирках и на картофеле (C6H10O5)n · Im
- 29. 5. Соединения галогенов в отрицательной степени окисленияНаиболее
- 30. Сравнение свойств галогеноводородов Почему HF проявляет аномальные свойства?
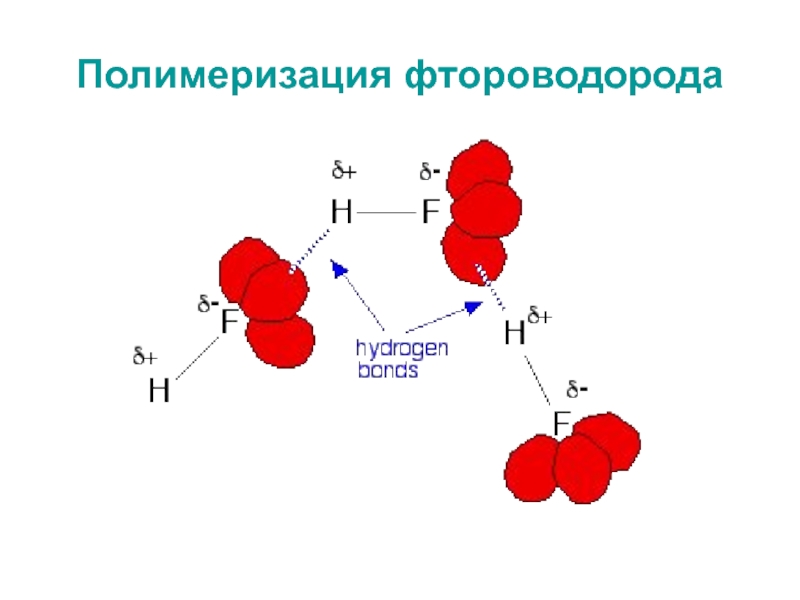
- 31. Полимеризация фтороводорода
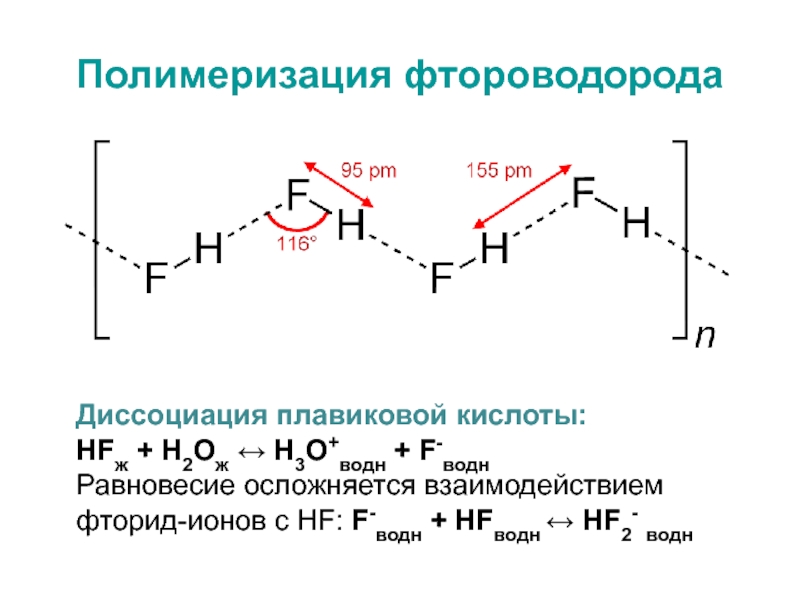
- 32. Полимеризация фтороводородаДиссоциация плавиковой кислоты:НFж + H2Ож ↔
- 33. Получение галогеноводородов1. Действие конц. серной кислоты на
- 34. Химические свойства галогеноводородов1. Все галогеноводороды – восстановители
- 35. Химические свойства галогеноводородов5. Концентрированный HF (плавиковая кислота)
- 36. Галогениды металловГалогениды щелочных и щелочно-земельных металлов, а
- 37. Фториды кислорода Дифторид кислорода OF2 (FOF –
- 38. 6. Соединения галогенов в положительной степени окисления
- 39. Оксиды галогеновДиоксид хлора ClO2 желтo-бурый газ с
- 40. Оксиды галогеновОксид хлора Cl2O6 (димер оксида хлора
- 41. Оксиды галогеновХлорный ангидрид Cl2O7 – бесцветная маслянистая
- 42. Оксиды галогеновОксид брома(I) Br2O – красно-коричневая жидкость,
- 43. Кислородсодержащие кислоты Галогены образуют:- галогеноватистые кислоты HOX
- 44. Галогеноватистые кислоты HOXСлабые кислоты, не выделены в
- 45. Хлорноватистая кислота HOCl и гипохлориты 2. Растворение
- 46. Галогеноватистые кислоты и их солиБромноватистая кислота HOBr
- 47. Галогенистые кислоты HOXO и их солиHClO2 и
- 48. Хлорноватая кислота HClO3 и хлораты HClO3 в
- 49. Бромноватая HBrO3 кислота и броматыБромноватая кислота существует
- 50. Иодноватая кислота HIO3 Иодноватая кислота HIO3 –
- 51. Хлорная кислота HClO4 и перхлораты Хлорная кислота
- 52. Хлорная и бромная HBrO4 кислотыСвойства:1. Окислительная способность:2HClO4
- 53. Иодная кислотаИодная кислота – гигроскопичное кристаллическое вещество
- 54. Иодная кислота и периодаты Получение:Получают по реакции
- 55. 7. История открытия галогенов Карл Вильгельм Шееле
- 56. Бернар Куртуа 8 февраля 1777 г. -
- 57. Антуан Жером Балар 30 сентября 1802 г.
- 58. Анри Муассан 28 сентября 1852 г. -
- 59. Получение астата (эко-иода)Дэйл Раймонд КорсонКеннет Росс МакКензи1912
- 60. Открытие 117-го элемента117-й элемент был открыт последним
- 61. 8. Биологическая роль и применение Биологическая роль
- 62. Биологическая роль фтораКариес зубов: под действием кислот,
- 63. Хлорсодержащие ОВ в первую мировую войну. Атака на зараженной местностиФотоархив "Химвойска" в 1-ю мировую войнуhttp://www.himvoiska.narod.ru/archivmain.html
- 64. Очистка воды от хлора
- 65. Применение галогенов
- 66. Применение галогенов Галогенные лампы(30000C) (400 – 10000C)W + 2I2 = WI4
- 67. Благодарю за внимание!
- 68. Скачать презентанцию
План лекцииВведение1. Общая характеристика галогенов, их физические свойства2. Нахождение в природе3. Получение4. Химические свойства простых веществ5. Соединения галогенов в отрицательной степени окисления6. Соединения галогенов в положительной степени окисления7. История открытия галогенов8.
Слайды и текст этой презентации
Слайд 1
p-элементы 17 группы периодической системы: галогены
Береснева Е. В.
к.п.н., профессор кафедры
фундаментальной химии и методики обучения химии ВятГУ
Слайд 2План лекции
Введение
1. Общая характеристика галогенов, их физические свойства
2. Нахождение в
природе
3. Получение
4. Химические свойства простых веществ
5. Соединения галогенов в отрицательной
степени окисления6. Соединения галогенов в положительной степени окисления
7. История открытия галогенов
8. Биологическая роль и применение (самостоятельная работа)
Слайд 3Периодическая система Д. И. Менделеева Неметаллы. Галогены
http://www.chemtable.com/indexr.htm
Слайд 4Введение
Какие элементы относят к p-элементам?
17-я группа (VIIA группа) периодической системы
объединяет p-элементы, носящие общее название галогены (от греч. halos –
соль и genes – рождающий, рождённый – рождающие соли) (галоиды): фтор F, хлор Сl, бром Вг, иод I, астат At, теннессин Ts (элемент № 117). Первые четыре элемента встречаются в природе в виде различных соединений. Астат и теннессин получены искусственным путем, радиоактивныВнешняя электронная оболочка атомов имеет конфигурацию s2p5
Слайд 6Степени окисления галогенов
– 1 (наиболее характерна для всех - НГ)
+
1 у Сl, Вr, I (НГО и др.)
+ 3 у
Сl и Вr (НГО2, ГF3), у I редко+ 4 у Сl, Вr, I (ГO2)
+ 5 у Сl, Вr, I (НГO3, XF5 и др.)
+ 6 у Сl (Сl2О6)
+ 7 у Сl, Вr и I (HClO4, Cl2O7, НВrO4, IF7 и др.)
Слайд 92. Нахождение в природе
Минералы, содержащие фтор
Флюорит (плавиковый шпат) CaF2
«1С Химия
для всех – XXI»
Слайд 193. Получение галогенов
Получение фтора
В промышленности – электролиз расплавов фторидов щелочных
металлов (напишите уравнение реакции)
В лаборатории – термолиз высших фторидов некоторых
металлов, например: 2CeF4 = 2CeF3 + F2Слайд 20Получение хлора
В промышленности – электролиз концентрированного раствора NaCl с диафрагмой,
разделяющей катодное и анодное пространства:
2NaCl + 2H2O
В лаборатории –
реакция конц. HCl с такими окислителями, как КMnO4, MnO2, K2Cr2O7 и др.16HCl + 2KMnO4=5Cl2 + 2KCl +2MnCl2 + 8H2O
Слайд 21Получение брома, иода, астата
Получение брома и иода в лаборатории –
взаимодействие галогенидов с окислителем (MnO2) в кислой среде, например: MnO2
+ 2H2SO4 + 2KI = I2 + MnSO4 + 2H2O + K2SO4Получение астата: облучение висмута или тория α-частицами
радиоактивный распад франция:
22387Fr → 21985At + 42He
обстреливание золота ядрами углерода: 19779Au + 126C → 20985At
Слайд 224. Химические свойства простых веществ
Невысокие энергии диссоциации молекул галогенов (существенно
меньшие, чем у О2, Н2 и N2)
Большое сродство атомов к
электронуПлохие доноры электронов
Хорошие акцепторы электронов
Высокая реакционная способность
Сильные окислители и кислотообразователи
Самые активные неметаллы
Слайд 23Химические свойства фтора
Реагирует непосредственно со всеми элементами, кроме He, Ne,
Ar, N2, C (алмаз)
В атмосфере фтора сгорают вода и стеклянная
вата:2H2O + 2F2 = 4HF + O2
SiO2 + 2F2 = SiF4 + O2
Фтор реагирует со взрывом при простом контакте с водородом (уравнение)
Соединения фтора с другими элементами: SiF4, BF3, CFx, BrF3, IF7, ClF, ClF3
Слайд 24Химические свойства хлора
Непосредственно не реагирует с кислородом, углеродом (алмаз), азотом,
благородными газами
Оксиды хлора: Cl2O, ClO2, Cl2O6 и Cl2O7. Все они
неустойчивы, могут быть получены только косвенным путем и являются сильными окислителями, как и сам хлорРеагирует с некоторыми Ме и неМе (уравнения с натрием, водородом и фосфором)
Со сложными веществами: Cl2 + H2O ↔ НCl + НClO
Cl2 + 2NaOH = NaClO + NaCl + H2O
3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O
Слайд 25Химические свойства брома
Соединения брома с галогенами - BrF3, BrF5, BrCl
и IBr
С кислородом, углеродом, азотом, благородными газами непосредственно не реагирует.
Косвенно получены оксиды - Вr2О, ВгО2, Br3O8С S, Se, Те, Р, As и Sb - S2Br2, РВr3, РВr5, неустойчивые SeBr4 и Se2Br2, TeBr4, AsBr3, SbBr3
С бором и кремнием при t - ВВг3 и SiBr4
С водородом при t (уравнение)
Слайд 26Растворы брома и иода
Иод в воде (слева) и в
четыреххлористом углероде
Бромная
вода (уравнение)
Слайд 27Химические свойства иода
Возгоняется при слабом нагревании
Плохо растворим в воде, лучше
в органических растворителях и в водных растворах иодидов
С кислородом, углеродом,
азотом, серой, селеном и благородными газами непосредственно не реагируетС металлами образует иодиды: Hg + I2 = HgI2
В горячих растворах щелочей дает соли иодид и иодат (уравнение)
H2S, Na2S2O3 и другие восстановители восстанавливают его до I-: I2 + H2S = S + 2НI
Иод – единственный галоген, который реагирует с конц. азотной кислотой:
3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O
Слайд 295. Соединения галогенов в отрицательной степени окисления
Наиболее важные соединения галогенов
в отрицательной степени окисления – галогеноводороды
Это соединения с полярной ковалентной
связью, в которой общая электронная пара сильно сдвинута в сторону галогенаСлайд 32Полимеризация фтороводорода
Диссоциация плавиковой кислоты:
НFж + H2Ож ↔ H3О+водн + F-водн
Равновесие
осложняется взаимодействием фторид-ионов с НF: F-водн + НFводн ↔ НF2-
воднСлайд 33Получение галогеноводородов
1. Действие конц. серной кислоты на твердые галогениды (HF,
HCl, редко HBr) (уравнения)
2. Синтез из простых веществ (HF, HCl)
(уравнения)3. Действие фосфорной кислоты на твердые галогениды (HBr, HI): KX + H3PO4 = KH2PO4 + HX
4. Реакция галогена с водой с участием красного фосфора (HBr, HI): 3Х2 + 2Р + 6Н2О = 6НХ + 2Н3РО3
5. Гидролиз бромида и иодида фосфора (HBr, HI):
PI3 + 3H2O = H3PO3 + 3HI
Слайд 34Химические свойства галогеноводородов
1. Все галогеноводороды – восстановители за счет галогенид-иона:
4HI + O2 = 2H2O + 2I2
2. Хлороводород окисляет некоторые
металлы: 2HClгаз + Mgтв →ᵗ MgCl2 тв + Н2 газ3. Реагируют с более активным галогеном:
2I- + Br2 = 2Br- + I2
4. В растворах проявляют общие свойства кислот – реагируют с металлами, их оксидами, гидроксидами, солями (уравнения)
Слайд 35Химические свойства галогеноводородов
5. Концентрированный HF (плавиковая кислота) реагирует с оксидом
кремния. Эта реакция применяется для травления стекла:
SiO2 + 6HF =
H2SiF6 + 2H2O – матовое травлениеSiO2 + 4HF = SiF4 + 2H2O – прозрачное травление
6. Качественные реакции на галогенид-ионы – реакции с ионами серебра: Г- + Ag+ = AgГ↓
Фторид серебра растворим, хлорид серебра – белый, бромид серебра – желтоватый, иодид серебра – ярко-желтый
Слайд 36Галогениды металлов
Галогениды щелочных и щелочно-земельных металлов, а также многие моно-
и дигалогениды других металлов – типичные соли, в которых преобладает
ионный характер связиГалогениды металлов V-VIII групп, кроме Сr и Мn, восстанавливаются Н2 до металлов:
WF6 + 3Н2 = W + 6HF
Более легкие галогены могут вытеснять более тяжелые из галогенидов
Галогениды получают непосредственно из элементов, реакцией галогеноводородов или галогеноводородных кислот с металлами, оксидами, гидроксидами или солями, а также другими обменными реакциями (уравнения)
Слайд 37Фториды кислорода
Дифторид кислорода OF2 (FOF – угловая молекула). Бесцветный
газ с резким неприятным запахом. tпл. = –224°С, tкип. =
–145°С. Получение:2F2 + 2NaOH = OF2 + 2NaF + H2O (0° C)
Сравнительно легко вступает в реакции с различными соединениями, что используется для синтеза фторидов благородных газов:
Xe + OF2 = XeF2 + 1/2O2 (400° C, 3 атм)
Не является кислотным ангидридом и при взаимодействии с водой не образует фторноватистую кислоту HOF, а разлагается
Диоксидифторид O2F2 (FOOF) (tпл. = –154°С, tкип. = –57°С) неустойчив и быстро разлагается
Слайд 386. Соединения галогенов в положительной степени окисления
Оксиды галогенов
Оксиды галогенов:
X2O (Cl2O, Br2O), XO2 (ClO2, BrO2), X2O6 (Cl2O6), X2O5 (I2O5),
X2O7 (Cl2O7)Оксид хлора Cl2O (хлорноватистый ангидрид) - темно-желтый газ с резким запахом (tпл. = –116°С, tкип. = 2°С). Синтезируют, пропуская ток хлора через оксид ртути: 2Cl2 + 2HgO = HgO·HgCl2 + Cl2O
Он хорошо растворяется в воде с образованием хлорноватистой кислоты HClO: Cl2O + H2O = 2HClO
С растворами щелочей дает соли хлорноватистой кислоты – гипохлориты: Cl2O + 2KOH = 2KClO + H2O
Ядовит и взрывоопасен. При комнатной температуре медленно диспропорционирует: 4Cl2O = 2ClO2 + 3Cl2
Слайд 39Оксиды галогенов
Диоксид хлора ClO2 желтo-бурый газ с резким запахом (tпл.
= –59°С, tкип. = 10°С), при t ниже 10°С –
бурая жидкость. Взрывоопасен при нагревании и соприкосновении с горючими веществамиПолучают из хлората калия:
KClO3 + H2SO4 = HClO3 + KHSO4
3HClO3 = 2ClO2 + HClO4 + H2O
В лабораторных условиях:
2KClO3 + H2C2O4 + H2SO4 = K2SO4 + 2ClO2 + 2CO2 + 2H2O
При взаимодействии с водой в щелочных растворах ClO2 диспропорционирует, т.е. ангидрид двух кислот
2ClO2 + H2O = HClO3 + HClO2 – хорошо с холодной водой
2ClO2 + 2KOH = KClO3 + KClO2 + H2O – с холодным раствором быстро
Слайд 40Оксиды галогенов
Оксид хлора Cl2O6 (димер оксида хлора VI) – вязкая
темно-красная маслянистая жидкость (tпл. = 3,5°С, tкип. = 203°С). Образуется
при окислении ClO2 озоном:2ClO2 + 2O3 = Cl2O6 + 2O2 (–10°C)
Смешанный ангидрид хлорноватой и хлорной кислот, которые образуются при реакции с водой:
Cl2O6 + H2O = HClO4 + HClO3
Реагирует со щелочами в растворе, при этом происходит реакция диспропорционирования:
2KOH + Cl2O6 = KClO3 + KСlO4 + H2O
В жидком состоянии уже при температуре плавления постепенно разлагается на ClO2 и кислород:
Cl2O6 = 2ClO2 + O2
В газовой фазе происходит распад димера:
Cl2O6 ↔ 2ClO3
Слайд 41Оксиды галогенов
Хлорный ангидрид Cl2O7 – бесцветная маслянистая жидкость (tпл. =
–90°С, tкип. = 82°С). Взрывается при нагревании до 120°C, но
более стабилен, чем другие оксиды хлора:2Cl2O7 = 2Сl2 + 7O2
Получают действием водоотнимающих средств (P4O10, олеум) на концентрированную хлорную кислоту с последующей перегонкой при –35°С и пониженном (1 мм рт. ст.) давлении:
4HClO4 + P4O10 = 2Cl2O7 + 4HPO3
При попадании в воду медленно образует хлорную кислоту HClO4, а со щелочами дает перхлораты:
Cl2O7 + H2O = 2HClO4
Cl2O7 + 2KOH = 2KСlO4 + H2O
Слайд 42Оксиды галогенов
Оксид брома(I) Br2O – красно-коричневая жидкость, выдерживает температуру ниже
-40°С. Получают аналогично Cl2O (уравнение)
При реакции с водой дает
бромноватистую кислоту: Br2O + H2O = 2HBrOОксид брома(IV) BrO2 – желтые кристаллы. Очень неустойчив, разлагается чуть выше 0°С, быстро диспропорционирует
Оксид брома(VI) BrO3 – бесцветные игольчатые кристаллы. Разлагается уже при температуре ниже -80°С. Образуется при действии озона на бром
Оксид иода(V) I2O5 (иодноватый ангидирид) – бесцветное кристаллическое соединение. Получают I2O5 дегидратацией HIO3 (уравнение)
Оксид иода(VII) I2O7 (иодный ангидрид) – оранжевое твердое вещество. Получают обезвоживанием иодной кислоты серной кислотой (уравнение)
Слайд 43Кислородсодержащие кислоты
Галогены образуют:
- галогеноватистые кислоты HOX (все слабые), соли
гипогалогениты
- галогенистые кислоты HOXO (НХО2) (первая средней силы, по другим
данных нет), соли галогениты- галогеноватые кислоты HOXO2 (НХО3) (первые 2 сильные, последняя средней силы), соли галогенаты
- галогеновые кислоты HOXO3 (НХО4) (первые 2 сильные, последняя слабая), соли пергалогенаты
Слайд 44Галогеноватистые кислоты HOX
Слабые кислоты, не выделены в чистом виде, а
встречаются только в виде водных растворов
Хлорноватистая кислота HOCl существует в
растворе зеленовато-желтого цвета, максимальная массовая доля 20-25%, неустойчива, уже при 5-10°С быстро разлагаетсяПолучение:
1. Хлорноватистая кислота настолько слабая, что даже угольная кислота вытесняет ее из растворов гипохлоритов:
NaOCl + H2O + CO2 = NaHCO3 + HOCl
Слайд 45Хлорноватистая кислота HOCl и гипохлориты
2. Растворение оксида хлора(I) в
воде (уравнение)
3. Растворение хлора в воде (уравнение). Гипохлориты получают аналогичной
реакцией хлора с раствором щелочи (уравнение)Свойства:
1. HOCl - очень сильный окислитель, нестойкая, даже в водном растворе распадается под действием света: HOCl → HCl + [О] 2О → О2 Аналогичная реакция протекает при разложение гипохлоритов в растворе: 2CaOCl2 = 2CaCl2 + O2 (катализатор – Со2+)
2. Гипохлориты – сильные окислители:
CaOCl2 + 2HCl = CaCl2 + Cl2 + H2O
NaClO + 2KI + H2SO4 = NaCl + I2 + K2SO4 + H2O
Слайд 46Галогеноватистые кислоты и их соли
Бромноватистая кислота HOBr существует только в
растворе желтоватого цвета, максимальная массовая доля 30%. Сильный окислитель. Получение
и свойства аналогичны хлорноватистой кислотеИодноватистая кислота HOI существует в разбавленном растворе, окрашена в зеленоватый цвет, неустойчива. Соединение амфотерное, причем основные свойства выражены сильнее, чем кислотные:
HOI + HNO3 = INO3 + H2O
Слайд 47Галогенистые кислоты HOXO и их соли
HClO2 и HВrO2 очень неустойчивы
и в растворе быстро диспропорционируют. Иодистая кислота HIO2 только недавно
была обнаружена в водных растворах в качестве переходной частицыПолучение HClO2 и хлоритов:
кислоты: Ba(ClO2)2 + H2SO4 = BaSO4↓ + 2HClO2
хлоритов: 2ClO2 + 2KOH = KClO2 + KClO3 + H2O
Свойства:
разложение в разбавленном водном растворе:
4HClO2 = HCl + HClO3 + 2ClO2 + H2O
Разложение солей (более устойчивы):
NaClO2 = NaCl + O2
3NaClO2 = NaCl + 2NaClO3
Слайд 48Хлорноватая кислота HClO3 и хлораты
HClO3 в свободном виде не
выделена, существует в растворе с массовой долей 40%, сильная, при
температуре 40-90°C разлагаетсяПолучение:
кислоты: аналогично хлористой (уравнение)
соли: 6Ba(OH)2 + 6Cl2 = 5BaCl2 + Ba(ClO3)2 + 6H2O
Свойства:
Разложение при нагревании:
4KClO3 = KCl + 3KClO4 без катализатора, t < 370°C
2KClO3 = 2KCl + 3O2 катализатор MnO2, t = 370°C
Реакция с кислотами:
3KClO3 + H2SO4 = K2SO4 + 2ClO2↑ + KClO4 + H2O
KClO3 + 6HCl = 3Cl2 + KCl + 3H2O
Слайд 49Бромноватая HBrO3 кислота и броматы
Бромноватая кислота существует в растворе с
массовой долей до 50%, сильная, сильный окислитель, нестабильна, разлагается на
воду, бром и кислородПолучение:
1. Аналогично хлорноватой (уравнение)
2. Окисление бромной воды хлором:
5Cl2 + Br2 + 6H2O = 2HBrO3 + 10HCl
Соли получают по реакции галогена с растворами щелочей (уравнение)
Слайд 50Иодноватая кислота HIO3
Иодноватая кислота HIO3 – белые кристаллы, устойчива
при комнатной температуре, при нагревании разлагается с образованием иодноватого ангидрида
и воды. Кислота средней силы, окислительПолучение:
1. Реакция ангидрида с водой (уравнение)
2. Окисление иодной воды хлором (уравнение аналогично окислению бромной воды)
3. Окисление иода конц. азотной кислотой (уравнение)
Соли получают по реакции галогена с растворами щелочей (уравнение)
Слайд 51Хлорная кислота HClO4 и перхлораты
Хлорная кислота HClO4 известна в
свободном виде, подвижная, бесцветная, дымящая на воздухе, гигроскопичная жидкость с
tпл. = -101°C, tк. = +110°CПолучение:
KClO4 + H2SO4 конц. = HClO4 + KНSO4 в вакууме
Электрохимическое окисление хлоратов или хлоридов на платиновом аноде
Перхлораты щелочных металлов обычно получают при диспропорционировании соответствующих хлоратов (уравнение)
Слайд 52Хлорная и бромная HBrO4 кислоты
Свойства:
1. Окислительная способность:
2HClO4 + I2 +
4H2O = 2H5IO6 + Cl2
2. Реакция нейтрализации (уравнение)
3. Разложение
при нагревании:4HClO4 = 4ClO2↑ + 3O2 + 2H2O
4. Обезвоживание оксидом фосфора:
2HClO4 + P4O10 + 5H2O = Cl2O7 + 4H3PO4
Бромная кислота HBrO4 нестойкая, стабильна только в водных растворах с концентрацией менее 55%, при более высокой концентрации разлагается. Перброматы – чрезвычайно сильные окислители
Слайд 53Иодная кислота
Иодная кислота – гигроскопичное кристаллическое вещество с tпл. =
130°C, хорошо растворимое в воде, слабая, может образовывать средние и
кислые солиВ растворах существует в трех формах: HIO4 – метаиодная кислота, H3IO5 – мезоиодная кислота и H5IO6 – ортоиодная кислота
Средние соли этих кислот – NaIO4, Na3IO5, Na5IO6
Слайд 54Иодная кислота и периодаты
Получение:
Получают по реакции диспропорционирования иодата и
обработки ортопериодата кислотой:
5Ba(IO3)2 = Ba5(IO6)2 + 4I2 + 9O2
Ba5(IO6)2 +
5H2SO4 = 5BaSO4↓ + 2H5IO6Соли получают окислением иодатов электрохимически или действием хлора
Свойства:
Метапериодаты чувствительны к нагреванию и даже могут при этом взрываться:
5NaIO4 = Na5IO6 + 2I2 + 7O2
Ортопериодаты более устойчивы при нагревании
Слайд 557. История открытия галогенов
Карл Вильгельм Шееле (9.12.1742 – 21.05.1786)
Первым
из семейства галогенов был открыт хлор в 1774 году шведским
аптекарем Карлом Шееле. Он так описал свой опыт: «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, окрасившим его в желтый цвет. Газ имел желто-зеленый цвет, пронзительный запах». В 1812 году французский химик Гей-Люссак дал этому газу современное название – хлор, что в переводе с греческого означает желто-зеленыйСлайд 56Бернар Куртуа 8 февраля 1777 г. - 27 сентября 1838 г.
В 1811 году французский химик-технолог и фармацевт Бернар Куртуа открыл
иод«Иодэс» в переводе с греч. Фиолетовый
Слайд 57Антуан Жером Балар 30 сентября 1802 г. – 30 марта 1876
г.
Бром был открыт в 1826 году лаборантом Антуаном Жеромом
Баларом в возрасте 24 лет. Через несколько лет напряженной работы он выделил необходимое количество темно-бурой жидкости, названной им муридом. В Парижской Академии наук Гей-Люссак и Тенар подтвердили открытие нового простого вещества, но нашли название неудачным и предложили свое – "бром", что в переводе с греческого означало зловонный Слайд 58Анри Муассан 28 сентября 1852 г. - 20 февраля 1907 г.
Только в 1886 г. франц. химику Анри Муассану сравнительно безболезненно
удалось получить фтор. Муассан случайно обнаружил, что при электролизе смеси жидкого безводного HF и гидродифторида калия (KHF2) в платиновом сосуде на аноде выделяется светло-желтый газ со специфическим резким запахом. Нобелевская премия по химии была присуждена Муассану в 1906 г. «в признание большого объема исследований – получения элемента фтора и введения в лабораторную и промышленную практику электрической печи, названной его именем». Этот элемент так и назвали «Фторос» – разрушающий Слайд 59Получение астата (эко-иода)
Дэйл Раймонд Корсон
Кеннет Росс МакКензи
1912 - 2002
05.04.1914 –
31.03.2012
Эмилио Джино Сегре
01.02.1905 – 22.04.1989
Один из изотопов элемента 85 (астат-211)
был получен в 1940 г. Корсоном, Маккензи и Сегре в циклотроне. Элемент 85 получил свое название астат (Astatium) в 1947 г. в статье авторов открытия. Название произведено от греч. Астатос, означающего «неустойчивый, шаткий», так как все изотопы астата оказались короткоживущими Слайд 60Открытие 117-го элемента
117-й элемент был открыт последним в 7-м периоде
Впервые
его удалось создать в 2009 году российско-американской группе. Для синтеза
117-го мишень из 97-го элемента берклия-249 обстреливали ионами кальция-48 на ускорителе У-400 Лаборатории ядерных реакций ОИЯИ30 декабря 2015 г. ИЮПАК официально признал открытие 117-го элемента и приоритет в этом ученых из Объединенного института ядерных исследований (ОИЯИ, г. Дубна, Россия) и Ливерморской национальной лаборатории
28 ноября 2016 года ИЮПАК утвердил название 117-го элемента теннессин (Ts) в честь штата Теннесси, где находится Окриджская лаборатория
Слайд 618. Биологическая роль и применение
Биологическая роль фтора
Минеральную основу зубных тканей
– дентина составляют гидроксилапатит Ca5(PO4)3(OH), хлорапатит Ca5(PO4)3Cl и фторапатит Ca5(PO4)3F.
Фторид-ион легко замещает гидроксид-ион в гидроксилапатите, образуя защитный эмалевый слой более твёрдого фторапатита:Ca5(PO4)3OH + F- ↔ Ca5(PO4)3F + OH-
Фторид-ионы способствуют осаждению фосфата кальция, тем самым ускоряя процесс реминерализации (образования кристаллов):
10Ca2+ + 6PO43- +2F- = 3Ca3(PO4)2 ∙ CaF2
Слайд 62Биологическая роль фтора
Кариес зубов: под действием кислот, вырабатываемых бактериями, происходит
растворение гидроксилапатитной компоненты эмали:
Ca5(PO4)3OH + 7H+ = 5Ca2+ + 3H2PO4-
+ H2OПрименение NaF в медицинской практике в качестве местно действующего наружного средства основано на образовании фторапатита:
NaF + Ca5(PO4)3OH ↔ NaOH + Ca5(PO4)3F
паста зубная ткань









![p - элементы 17 группы периодической системы: галогены Минералы, содержащие фторКриолит Na3[AlF6] Минералы, содержащие фторКриолит Na3[AlF6]](/img/thumbs/5eb8f655305a8475f4e52f56be1771d0-800x.jpg)