Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Пептиды. белки
Содержание
- 1. Пептиды. белки
- 2. П Л А Н 16.1 Пептиды, образование,
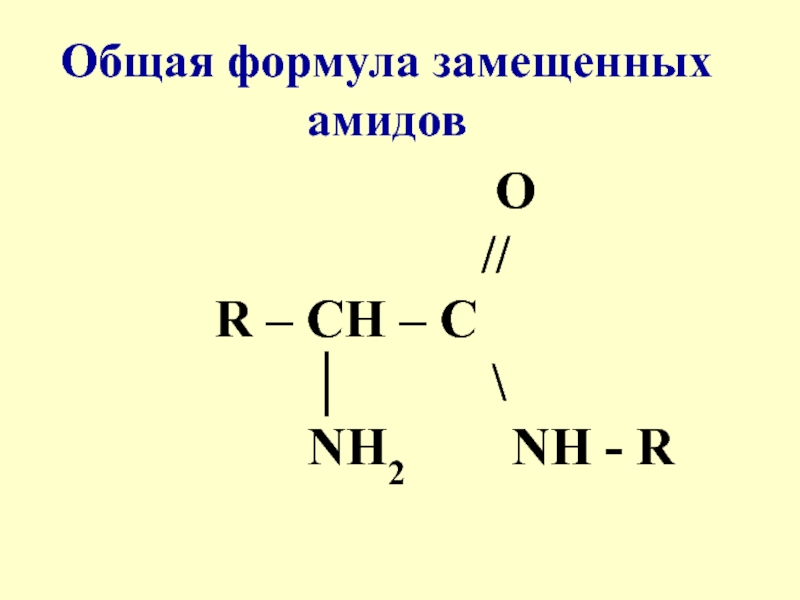
- 3. 16.1 ПЕПТИДЫСреди производных α-аминокислот важнейшими являются амиды,где
- 4. Слайд 4
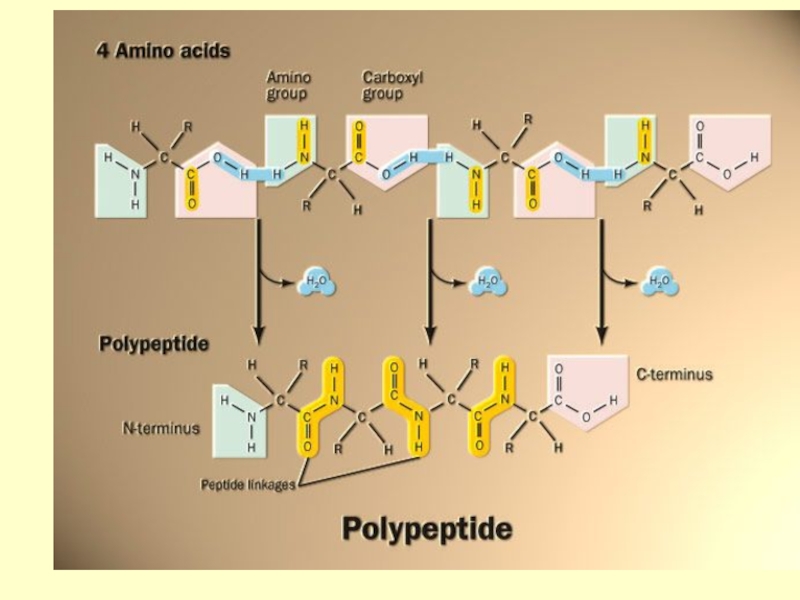
- 5. Пептиды - природные или синтетические вещества, построенные из остатков α-аминокислот, соединенных амидными (пептидными) связями
- 6. Амидная связь была названна пептидной связью Э.
- 7. Функции пептидов
- 8. Пептидную природу имеют некоторые антибиотики (циклоспорин А,
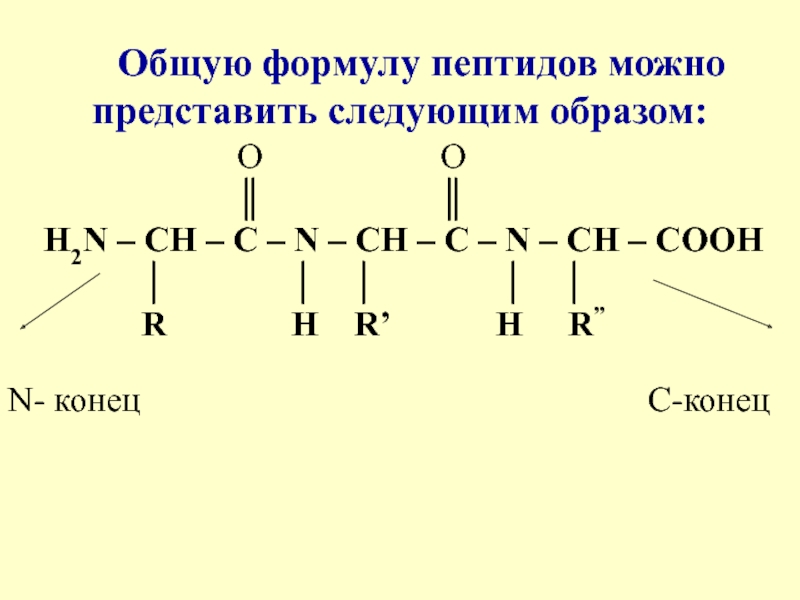
- 9. Общую формулу пептидов можно представить следующим образом:
- 10. Слайд 10
- 11. При построении названий пептидов в названии аминокислот
- 12. При построении белковых молекул с диамино- или
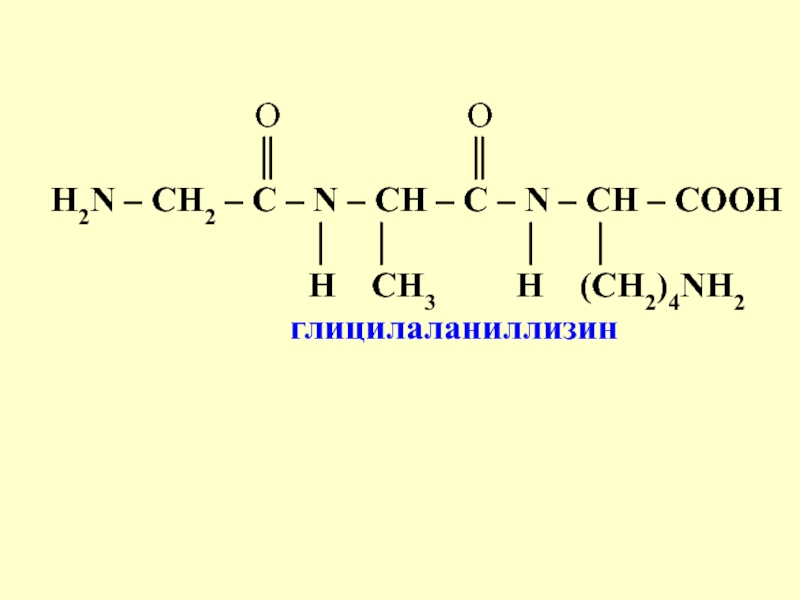
- 13. Слайд 13
- 14. В проявлении биологических функций пептидов и белков
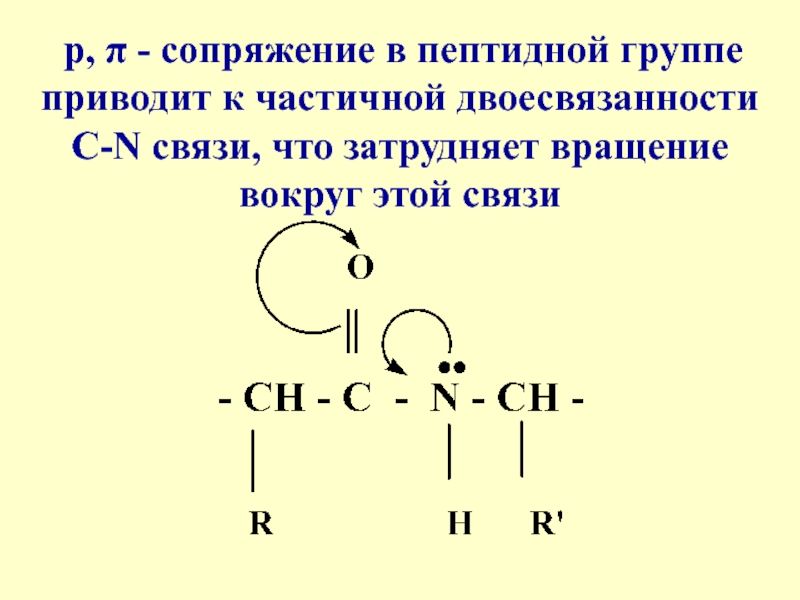
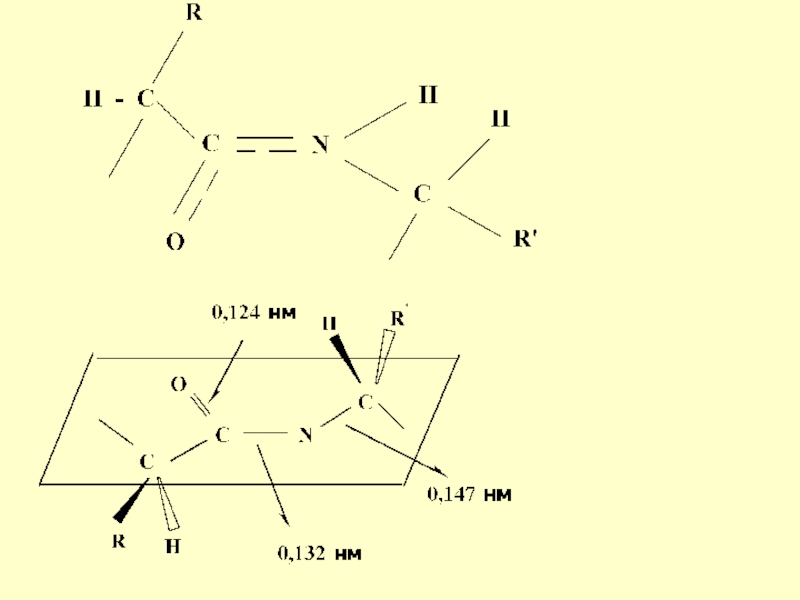
- 15. p, π - сопряжение в пептидной
- 16. Такая частичная двоесвязанность C-N связи означает, что
- 17.
- 18. Слайд 18
- 19. Химические свойства пептидов вытекают из их амидной
- 20. Первичная структура пептидов и белков- последовательность остатков α-аминокислот
- 21. Слайд 21
- 22. Вторичная структура пептидов - пространственное расположение цепи
- 23. Слайд 23
- 24. В одном витке спирали умещаются 3,6 аминокислотных
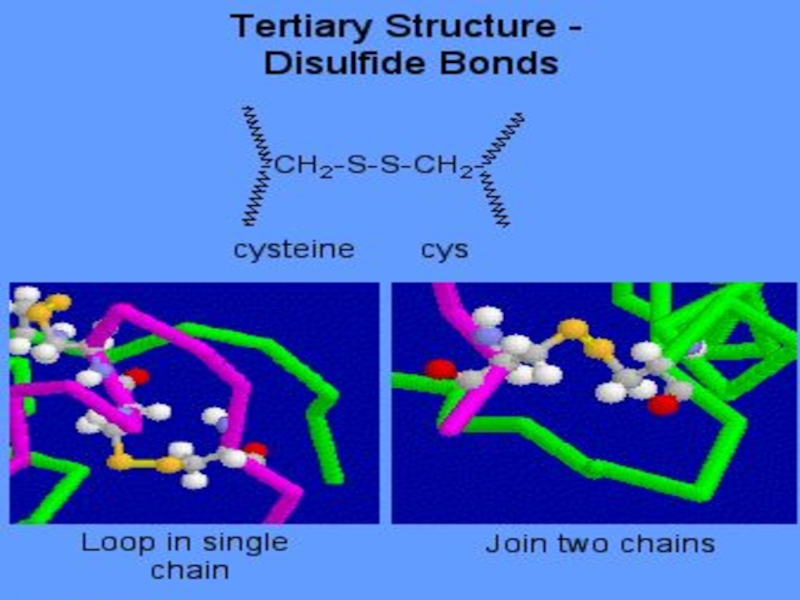
- 25. В пептидах возможны другие виды взаимодействий, приводящие
- 26. 16.2 Установление первичной структуры пептидовПервичная структура пептидов
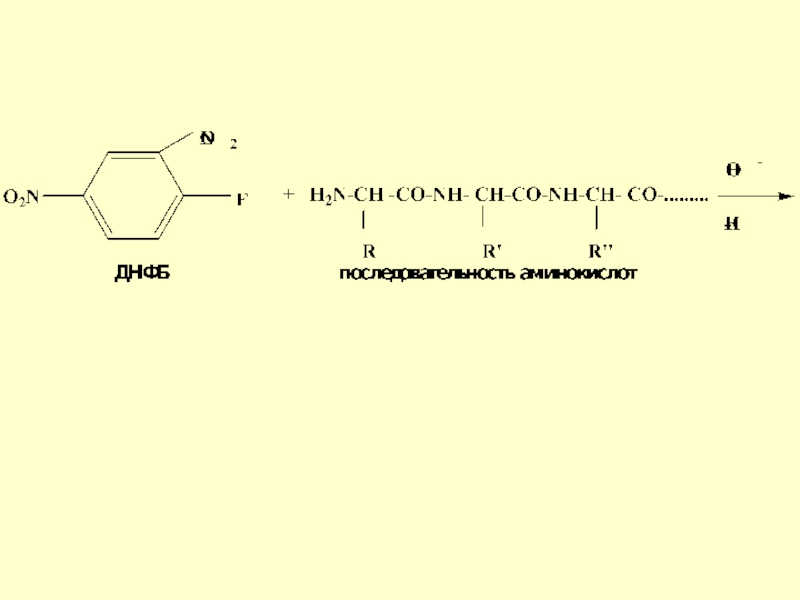
- 27. Метод Сенгера -
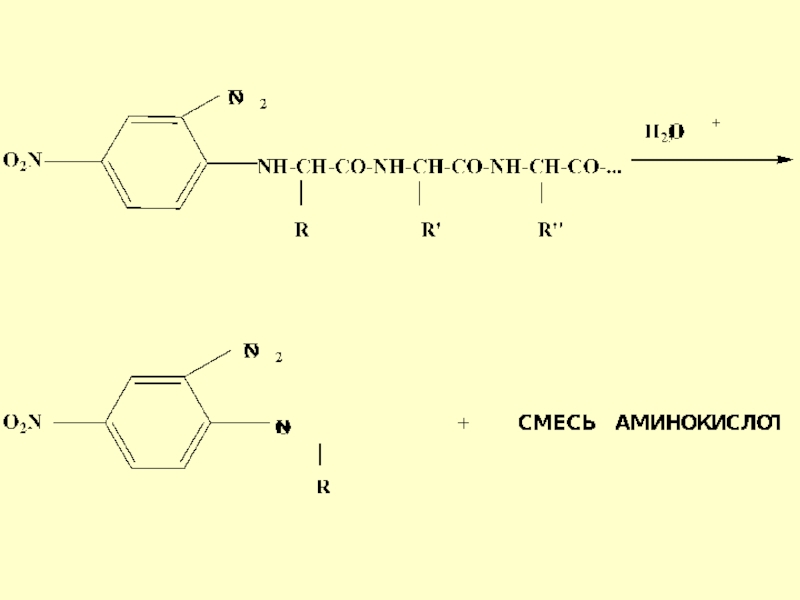
- 28. Слайд 28
- 29. Слайд 29
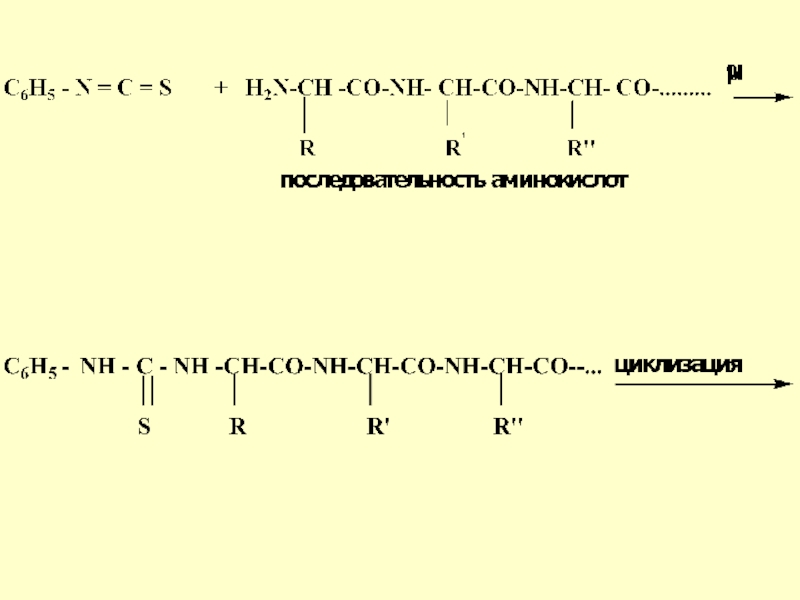
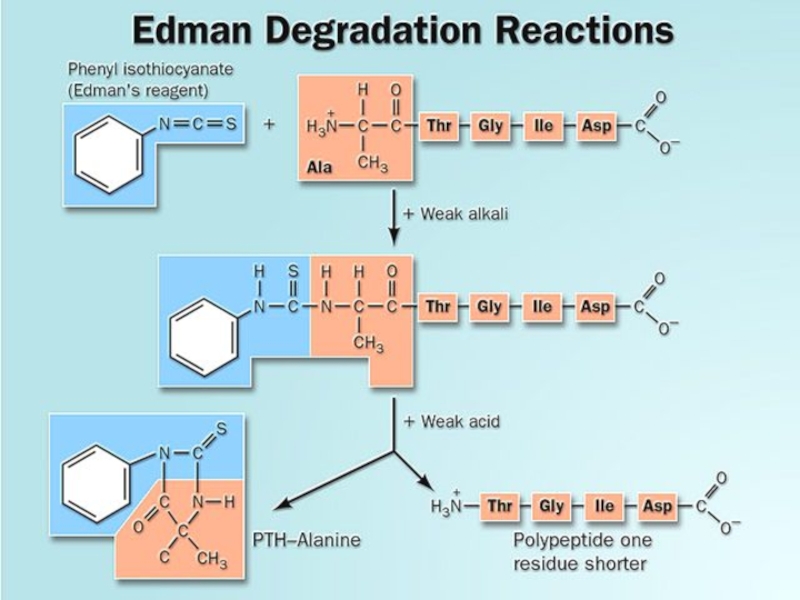
- 30. Метод Эдмана
- 31. Преимуществом этого метода является то, что при
- 32. Слайд 32
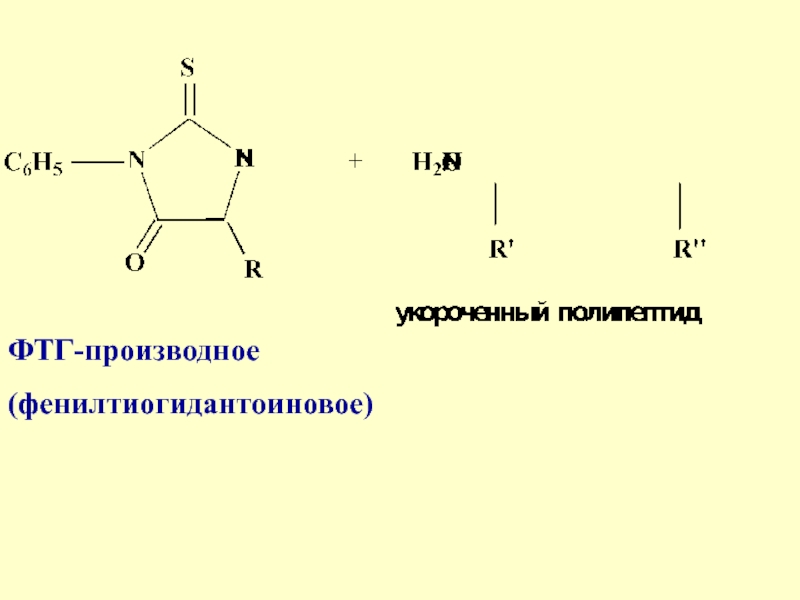
- 33. ФТГ-производное(фенилтиогидантоиновое)
- 34. Метод Эдмана лежит в основе автоматического прибора
- 35. Слайд 35
- 36. 16.3 Стратегия пептидного синтезаСхематично рассмотрим синтез дипептида
- 37. Первый этап синтеза - защита амино группы
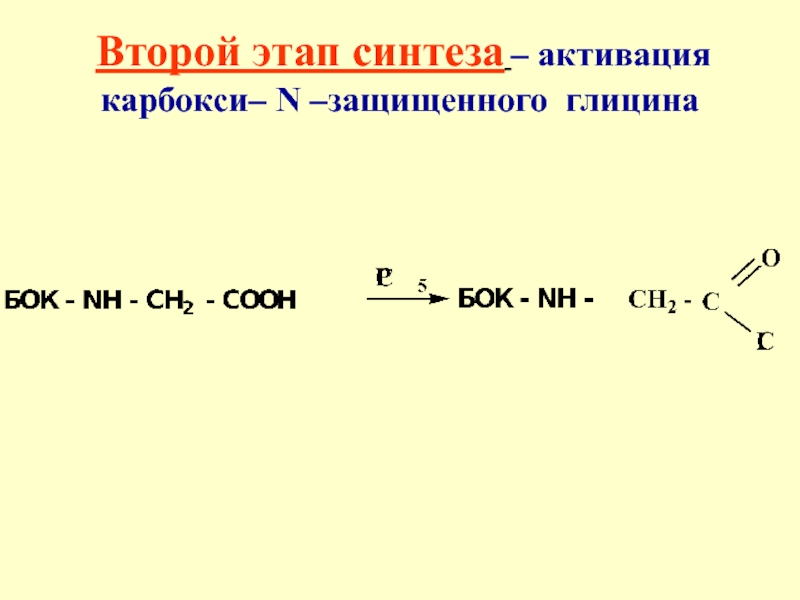
- 38. Второй этап синтеза – активация карбокси– N –защищенного глицина
- 39. Третий этап синтеза - защита карбоксильной
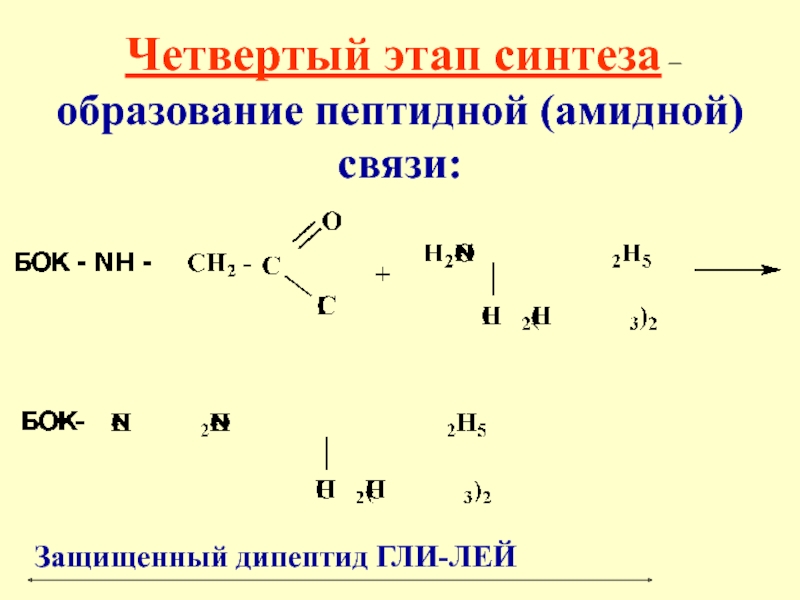
- 40. Четвертый этап синтеза – образование пептидной (амидной) связи: Защищенный дипептид ГЛИ-ЛЕЙ
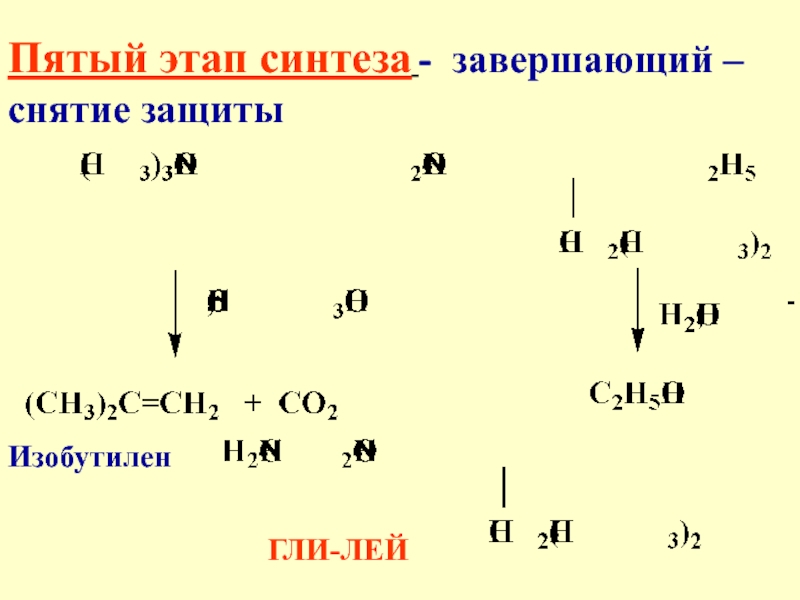
- 41. Пятый этап синтеза - завершающий – снятие
- 42. Пептиды и белки - полиэлектролиты
- 43. Слайд 43
- 44. ГЛИ - ЛИЗH2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾
- 45. 16.4 БЕЛКИ Белки - высокомолекулярные азотсодержащие биологические макромолекулы,
- 46. Простейший белок – полипептид, содержащий в своей структуре не менее 70 аминокислотных остатков
- 47. Белки – важнейшие компоненты клетки, на их
- 48. Биологическая роль белков1. Каталитическая функция2. Питательная (резервная)
- 49. Пищевую ценность белка определяют содержанием незаменимых аминокислот
- 50. Гистидин и аргинин частично заменимые аминокислоты
- 51. Слайд 51
- 52. Первичная структура – линейная последовательность биогенных аминокислот,
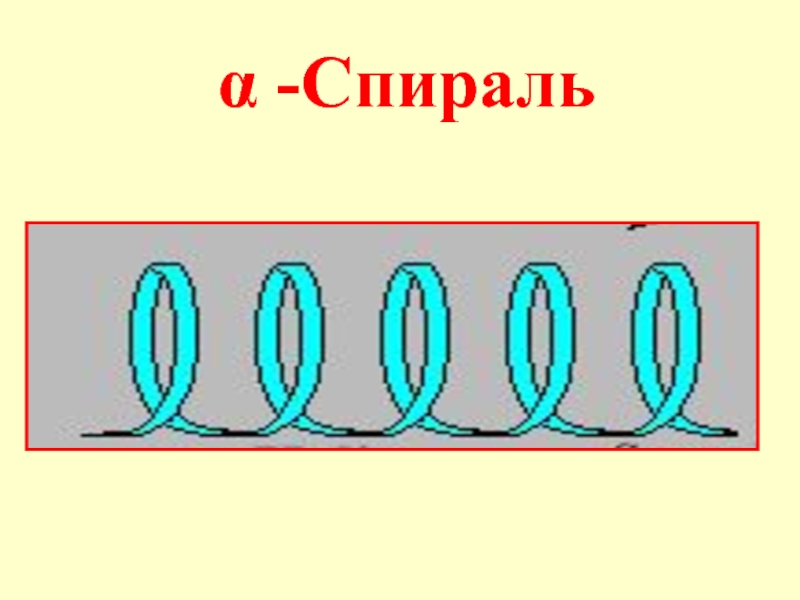
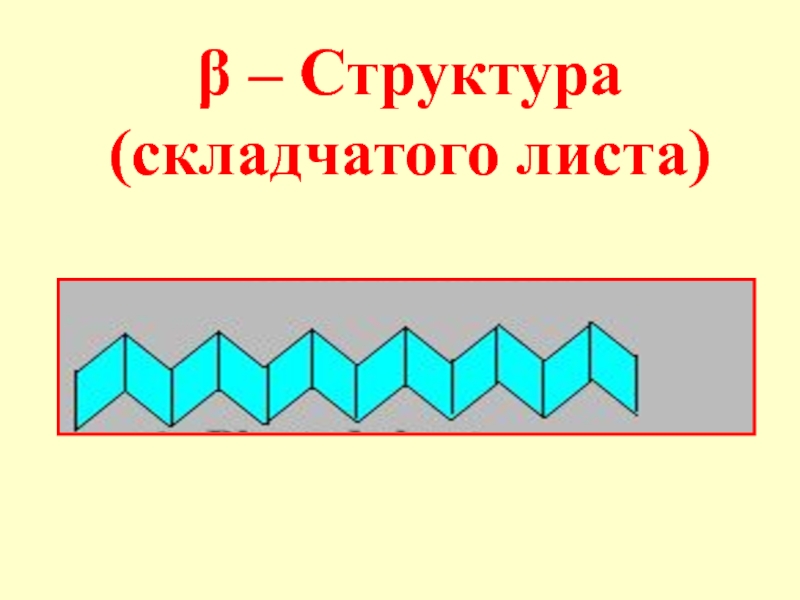
- 53. Вторичная структура – локальная конформация полипептидной цепи,
- 54. α -Спираль
- 55. β – Структура (складчатого листа)
- 56. Слайд 56
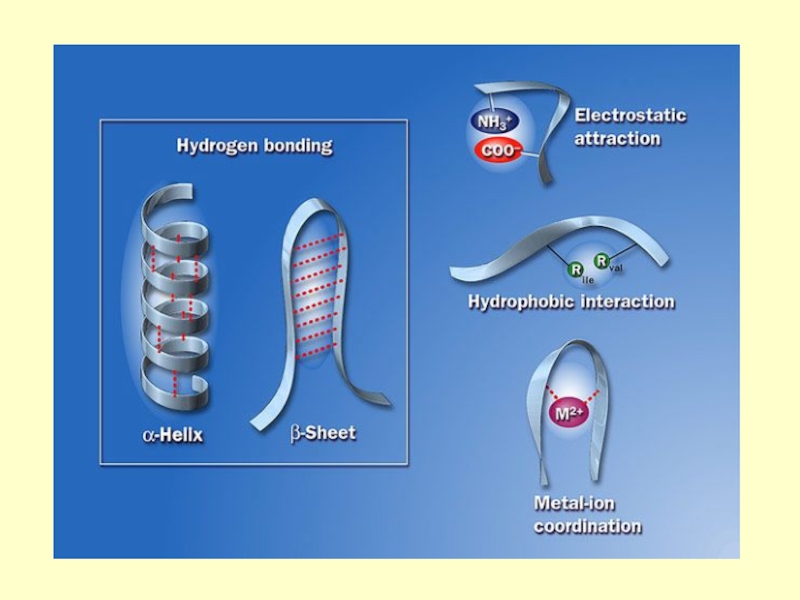
- 57. Третичная структура - конформация (расположение в пространстве)
- 58. Слайд 58
- 59. Слайд 59
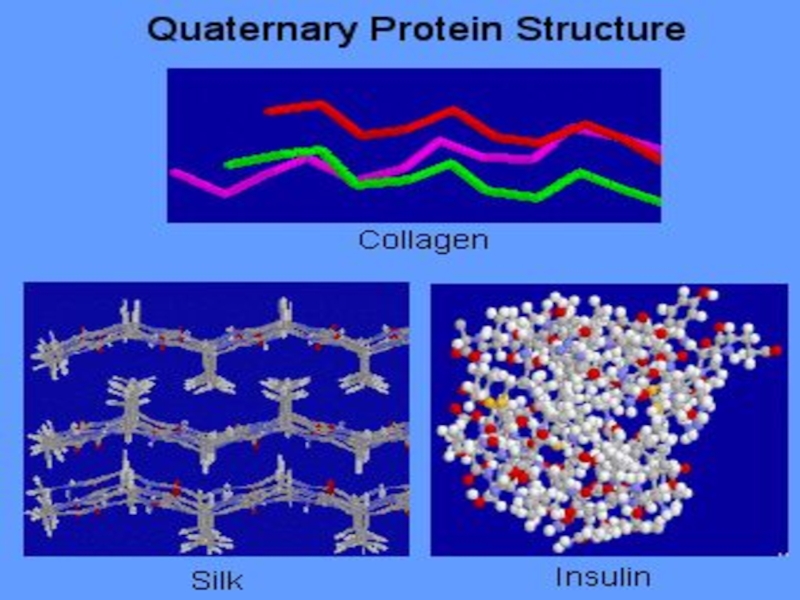
- 60. Четвертичная структура белка- способ укладки в пространстве
- 61. Слайд 61
- 62. Каждая отдельная полипептидная цепь в структуре мультимера
- 63. Гемоглобин – белок эритроцитов, относится к группе
- 64. Молекула гемоглобина в отличие от миоглобина обнаруживает
- 65. Физико-химические свойства белковБелки образуют коллоидные растворы, рассеивают
- 66. Денатурация – процесс разрушения природной макроструктуры белков
- 67. Цветные реакции белков
- 68. НИНГИДРИНОВАЯ РЕАКЦИЯ -
- 69. КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ -
- 70. РЕАКЦИЯ МИЛОНА -
- 71. РЕАКЦИЯ АДАМКЕВИЧА -
- 72. РЕАКЦИЯ ФОЛЯ -
- 73. Благодарим за внимание !
- 74. Скачать презентанцию
П Л А Н 16.1 Пептиды, образование, элект-ронное и пространственное строение пептидной связи16.2 Установление первичной структуры пептидов16.3 Стратегия пептидного синтеза16.4 Белки
Слайды и текст этой презентации
Слайд 2П Л А Н
16.1 Пептиды, образование, элект-ронное и пространственное
строение пептидной связи
БелкиСлайд 316.1 ПЕПТИДЫ
Среди производных α-аминокислот важнейшими являются амиды,
где замещенная аминогруппа представляет
собой остаток 2-й аминокислоты
Амиды такого типа называют пептидами
Слайд 5Пептиды - природные или синтетические вещества, построенные из остатков
α-аминокислот, соединенных амидными (пептидными) связями
Слайд 6Амидная связь была названна пептидной связью Э. Фишером, он первым
предположил первичную структуру для белков
Э. Фишер
(1852-1919)
Слайд 7Функции пептидов
1. Выполняют
функции биорегуляторов раз-личных биологических и физиологических процессов: регулируют тонус сосудов (вазопрессин, ангиотензин), моторику и секрецию ЖКТ (гастрин, холецистокинин), сон, бодрствование, эмоциональное пове-дение, память, обучение, синаптическую передачу 2. Стимулируют секрецию гормонов гипо-физа (АКТГ, соматотропный гормон) 3. Регулируют иммунитет (гормоны тиму-са,тафтсин) Слайд 8Пептидную природу имеют некоторые антибиотики (циклоспорин А, грамицидины), алкалоиды, токсины
пчел и ос, змей, ядовитых грибов (фалоидин и аманитин бледной
поганки), холерный и ботулинический токсиныСлайд 9Общую формулу пептидов можно представить следующим образом:
O
O║ ║
Н2N – СН – С – N – CH – C – N – CH – COOH
│ │ │ │ │
R H R’ H R”
N- конец С-конец
Слайд 11При построении названий пептидов в названии аминокислот окончание ин заменяется
на ил, а название аминокислоты, содержащей свободную карбоксильную группу остается
без изменения (для остатка аспарагиновой кислоты – аспартил)Слайд 12При построении белковых молекул с диамино- или дикарбоновыми аминокислотами в
образовании пептидной связи участвуют α-NH2 или α-СООН
Слайд 13
O
O║ ║
Н2N – СН2 – С – N – CH – C – N – CH – COOH
│ │ │ │
Н СН3 H (СН2)4NH2
глицилаланиллизин
Слайд 14В проявлении биологических функций пептидов и белков важно их пространственное
строение. Оно определяется электронным строением пептидной группы
Слайд 15 p, π - сопряжение в пептидной группе приводит к
частичной двоесвязанности С-N связи, что затрудняет вращение вокруг этой
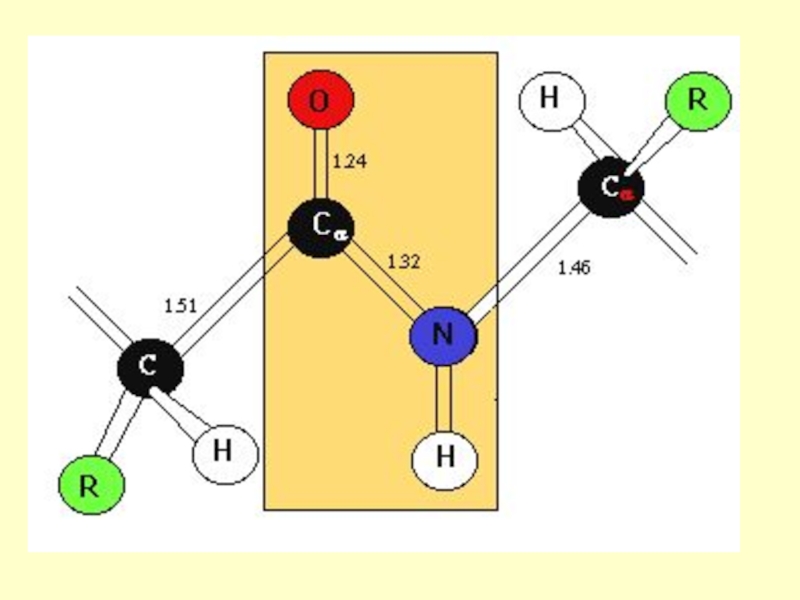
связиСлайд 16Такая частичная двоесвязанность C-N связи означает, что пептидная группа представляет
собой плоский участок пептидной цепи, рядом с которым находятся атомы
С своеобразные шарниры где возможно вращение вокруг связей С - С и N - CСлайд 19Химические свойства пептидов вытекают из их амидной природы, они способны
гидролизоваться в кислой и щелочной средах, в организме гидролиз осуществляется
при участии ферментов - протеиназСлайд 22Вторичная структура пептидов - пространственное расположение цепи (конформация), фиксируемое водородными
связями. Отдельные участки цепи образуют α-спираль, что впервые было показано
ПолингомСлайд 24В одном витке спирали умещаются 3,6 аминокислотных остатка, т.е. каждая
аминокислота связывается с 5-ой по счету в первичной последовательности. Например,
в последовательности Гли - Ала - Фен - Глу - Сер - Ала остаток глицина образует водородную связь с остатком серинаСлайд 25В пептидах возможны другие виды взаимодействий, приводящие к стабилизации цепи
в пространстве: ионные между заряженными группами СОО- и NН3+ ковалентные
связи S - S за счет окисления групп SH остатков цистеинаСлайд 26
16.2 Установление первичной структуры пептидов
Первичная структура пептидов и белков определяется
путем последовательного отщепления α-аминокислот с какого-либо конца макромолекулярной цепи и
их идентификацииСлайд 31Преимуществом этого метода является то, что при отщеплении каждой
N-концевой α-аминокислоты, остальная часть
пептидной молекулы не разрушается. Такие же операции можно повторять дальше до полного определения первичной структуры. Этот метод получил название «деградация по Эдману» (1950 год)Слайд 34Метод Эдмана лежит в основе автоматического прибора - секвенатора (sequence
от английского - последовательность), аминокислотный анализатор. Полученное на каждой стадии
производное идентифицируется либо ГЖХ либо ТСХ или жидкостной хроматографиейСлайд 3616.3 Стратегия пептидного синтеза
Схематично рассмотрим синтез дипептида ГЛИ –ЛЕЙ
Для осуществления
синтеза пептида с заданной последовательностью α-аминокислот
необходимо выполнить ряд последовательных операцийСлайд 37Первый этап синтеза - защита амино группы одной аминокислоты. С
помощью реакций ацилирования в аминогруппу вводят электроноакцепторный заместитель. По окончанию
синтеза эту защиту снимаюттрет-бутокси-карбонилхлорид
Глицин
Слайд 39 Третий этап синтеза - защита карбоксильной группы второй аминокислоты
-можно осуществить с помощью реакции этерификации
Лейцин
Слайд 40 Четвертый этап синтеза – образование пептидной (амидной) связи:
Защищенный дипептид
ГЛИ-ЛЕЙ
Слайд 42 Пептиды и белки - полиэлектролиты
ГЛИ - АЛА
H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾
│ │
CH3 СН3
ИЭТ находится в области рН≈7
Слайд 43
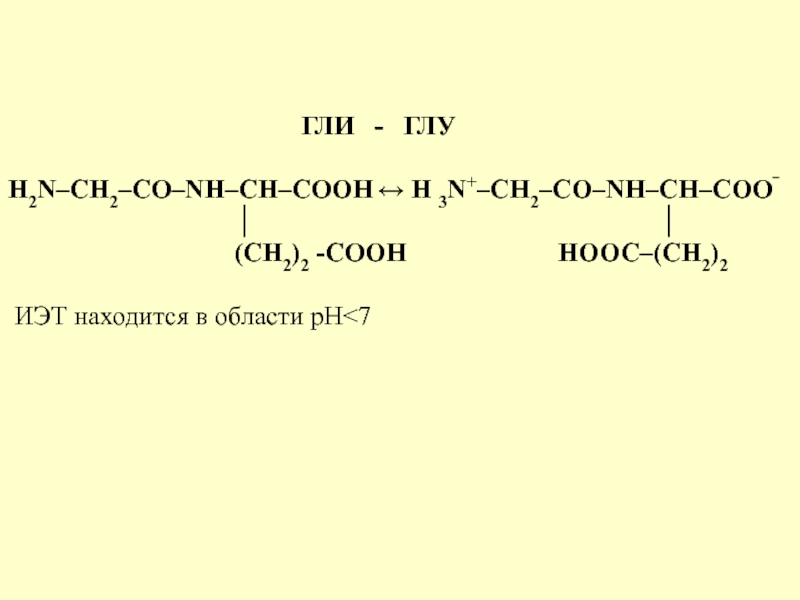
ГЛИ - ГЛУ
H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾
│ │
(CH2)2 -СООН НООС–(СН2)2
ИЭТ находится в области рН<7
Слайд 44ГЛИ - ЛИЗ
H2N–CH2–CО–NH–CH–COOH ↔ H 3N+–CH2–CО–NH–CH–COO‾
│ │
(CH2)4 –NН2 NН2 –(СН2)4
ИЭТ находится в области рН>7
Слайд 4516.4 БЕЛКИ
Белки - высокомолекулярные азотсодержащие биологические макромолекулы, состоящие из биогенных
α, L-аминокислот, связанных в линейную последовательность пептидными (амидными) связями
Слайд 46Простейший белок – полипептид, содержащий в своей структуре не менее
70 аминокислотных остатков
Слайд 47Белки – важнейшие компоненты клетки, на их долю приходится не
менее 50% сухого веса. Они осуществляют реализацию генетической информации, построение
структур клетки и организма, протекание метаболических процессов, иммунную защиту организмаСлайд 48Биологическая роль белков
1. Каталитическая функция
2. Питательная (резервная)
3. Транспортная
4.
Защитная функция
5. Сократительная
6. Структурная
7. Энергетическая
8. Гормональная
Слайд 49Пищевую ценность белка определяют содержанием незаменимых аминокислот -
не синтезируются в организме
ВАЛИН, ЛЕЙЦИН, ИЗОЛЕЙЦИН, ТРЕОНИН, МЕТИОНИН, ФЕНИЛАЛАНИН, ТРИПТОФАН, ЛИЗИНСлайд 52Первичная структура – линейная последовательность биогенных аминокислот, связанных пептидными связями.
Первичная структура определяет и более высокие уровни организации белковых молекул.
Зная первичную структуру можно последовательно получить белок синтетически (впервые был синтезирован инсулин, впоследствии многие другие белки, так широкое распространение получили синтетические полипептиды для лечения СПИДА, многих других заболеваний)Слайд 53Вторичная структура – локальная конформация полипептидной цепи, возникающая в результате
вращения отдельных ее участков, приводящая к скручиванию, складыванию или изгибу
этого участка цепи. Вторичная структура может быть представлена α-спиралью, β-структурой (структура складчатого листа)Слайд 57Третичная структура - конформация (расположение в пространстве) всей полипептидной цепи.
В ее формировании и стабилизации принимают участие все виды взаимодействий:
гидрофобное, вандервальсово, электростатическое (ионное), дисульфидные ковалентные связи. Наиболее значимыми являются гидрофобное взаимодействие и дисульфидные связиСлайд 60Четвертичная структура белка- способ укладки в пространстве отдельных полипептидных цепей
(одинаковых или разных) с третичной структурой, приводящей к формированию единого
в структурном и функциональном отношениях макромолекулярного образования (мультимера)Слайд 62Каждая отдельная полипептидная цепь в структуре мультимера называется протомером. Протомеры
стерически комплементарны и связывают структуру нековалентными связями. Гемоглобин состоит из
нескольких симметрично построенных частиц (одинаковых полипептидных цепей), обладающих одинаковой первичной, вторичной и третичной структуройСлайд 63Гемоглобин – белок эритроцитов, относится к группе гемопротеинов, участвует в
транспорте газов в организме. В качестве простетической группы содержит гем
(железопротопорфин). Представляет собой гетерогенный тетрамер, состоящий из двух идентичных α-цепей и двух идентичных β-цепей, соединенных солевыми мостиками. Каждая цепь, образующая комплекс с группой гема очень сходна с молекулой миоглобина – белка мышечной ткани, переносящего кислород и состоящего из одной полипептидной цепиСлайд 64Молекула гемоглобина в отличие от миоглобина обнаруживает ряд существенных особенностей:
1
Кислород связывается молекулой гемоглобина кооперативно, т.е. связывание одной молекулы О2
облегчает связывание трех последующих молекул О2;Молекула гемоглобина способна воспринимать информацию из окружающей среды, и как следствие, изменять сродство к кислороду, т.е. белки это не жесткие, а конформационно подвижные динамические структуры
Слайд 65
Физико-химические свойства белков
Белки образуют коллоидные растворы, рассеивают проходящий свет, обладают
гидрофильными свойствами, способны связывать воду, что приводит к набуханию и
образованию гелей. В животных тканях белки могут связывать до 80 - 90 % воды. Белки обладают амфотерными свойствами. Белки из-за больших размеров не могут проникать через полупроницаемые мембраны, на этом свойстве основан метод очистки белков - диализСлайд 66Денатурация – процесс разрушения природной макроструктуры белков под влиянием ряда
факторов: химических веществ (фенол, мочевина), повышенной температуры, изменения рН среды,
облучения УФО или рентгеновскими лучами и т.д. При денатурации разрушаются нековалентные связи, что проводит к изменению биологических свойств белков.Слайд 67Цветные реакции белков
обусловлены наличием в растворе белка аминокислоты отдельных групп или определенных связей
БИУРЕТОВАЯ РЕАКЦИЯ - появление синего окрашивания при действии на белок щелочи и разбавленного раствора сульфата меди (II). Окраска обусловлена наличием пептидной связи CO -NH