Слайд 2Поверхностные явления – те эффекты и особенности поведения веществ, которые
наблюдаются на поверхности раздела фаз.
К классу поверхностных явлений относятся:
поверхностное
натяжение;
сорбция: адсорбция, абсорбция, капиллярная конденсация;
адгезия и когезия;
смачивание и растекание;
образование двойного электрического слоя;
коррозия;
многие важнейшие биологические процессы,
например наше дыхание;
моющее действие стиральных порошков и т.п.
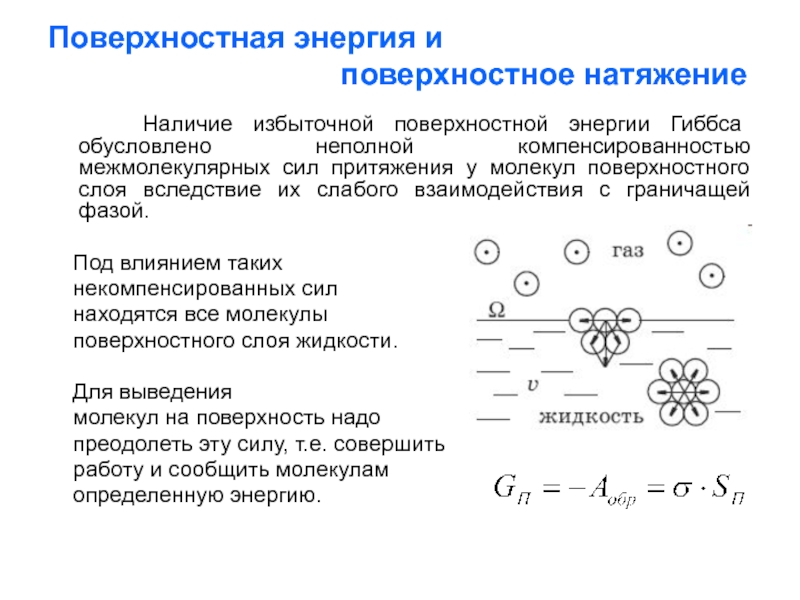
Слайд 3Поверхностная энергия и
поверхностное натяжение
Наличие избыточной поверхностной энергии Гиббса обусловлено неполной компенсированностью межмолекулярных сил притяжения у молекул поверхностного слоя вследствие их слабого взаимодействия с граничащей фазой.
Под влиянием таких
некомпенсированных сил
находятся все молекулы
поверхностного слоя жидкости.
Для выведения
молекул на поверхность надо
преодолеть эту силу, т.е. совершить
работу и сообщить молекулам
определенную энергию.
Слайд 4Физический смысл поверхностного натяжения
Энергетическая трактовка: поверхностное натяжение равно работе,
затраченной на образование единицы поверхности:
, (Дж/м2).
Силовое определение: поверхностное натяжение – это сила, действующая на поверхности по касательной к ней и стремящаяся сократить ее площадь до min (Н/м).
При 298 К воды = 71,9610-3 Дж/м2 = 71,9610-3 Н/м.
Дж/м2 = Нм/ м2 = Н/м.
Слайд 5Благодаря поверхностному натяжению капля жидкости в свободном падении принимает сферическую
форму.
Слайд 6Факторы, влияющие
на поверхностное натяжение
1) Температура
С увеличением температуры уменьшается.
Температура, при которой поверхностное натяжение обращается в ноль называется
критической температурой.
2) Природа фазообразующих веществ
Правило Ребиндера: чем больше разность полярностей (П) фаз, тем сильнее поверхностное натяжение на границе их раздела.
П.А. Ребиндер
1898 – 1972
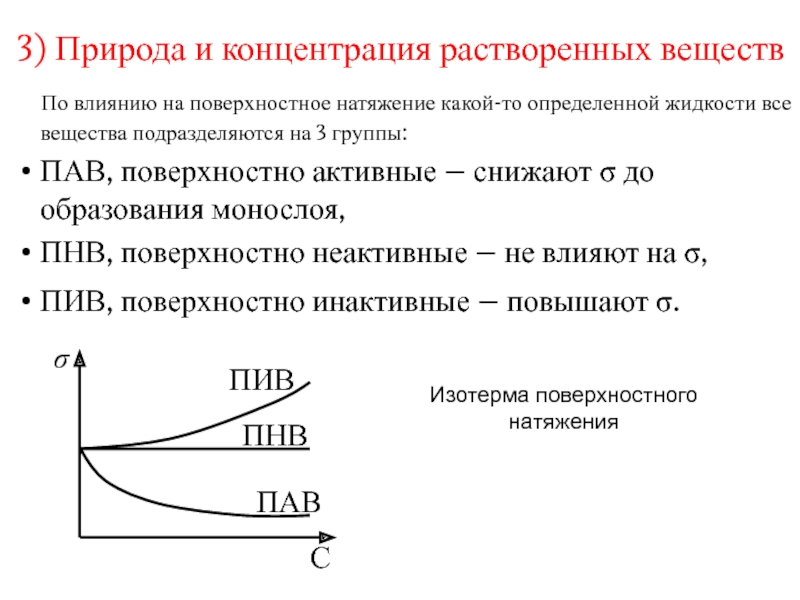
Слайд 73) Природа и концентрация растворенных веществ
По влиянию на
поверхностное натяжение какой-то определенной жидкости все вещества подразделяются на 3
группы:
ПАВ, поверхностно активные – снижают до образования монослоя,
ПНВ, поверхностно неактивные – не влияют на ,
ПИВ, поверхностно инактивные – повышают .
Изотерма поверхностного натяжения
Слайд 8 ПИВ являются неорганические вещества (электролиты).
Ионы хорошо гидратируются (взаимодействуют
с молекулами воды), поэтому они интенсивно втягиваются в глубину раствора
и усиливают полярные свойства системы.
В результате возрастает ΔП для соседних фаз, что, по правилу Ребиндера, приводит к увеличению .
ПИВ являются неорганические вещества (электролиты).
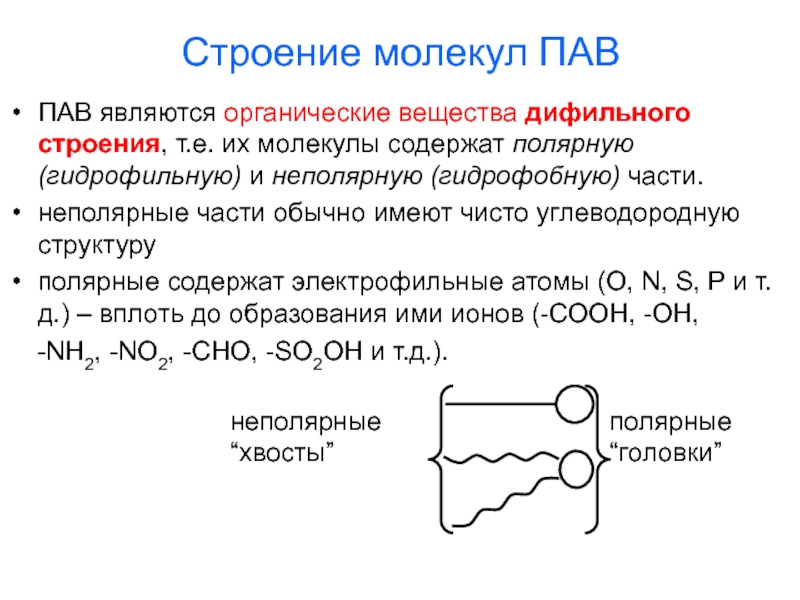
Слайд 9Строение молекул ПАВ
ПАВ являются органические вещества дифильного строения, т.е. их
молекулы содержат полярную (гидрофильную) и неполярную (гидрофобную) части.
неполярные части
обычно имеют чисто углеводородную структуру
полярные содержат электрофильные атомы (O, N, S, P и т.д.) – вплоть до образования ими ионов (-СООН, -ОН,
-NH2, -NO2, -CHO, -SO2OH и т.д.).
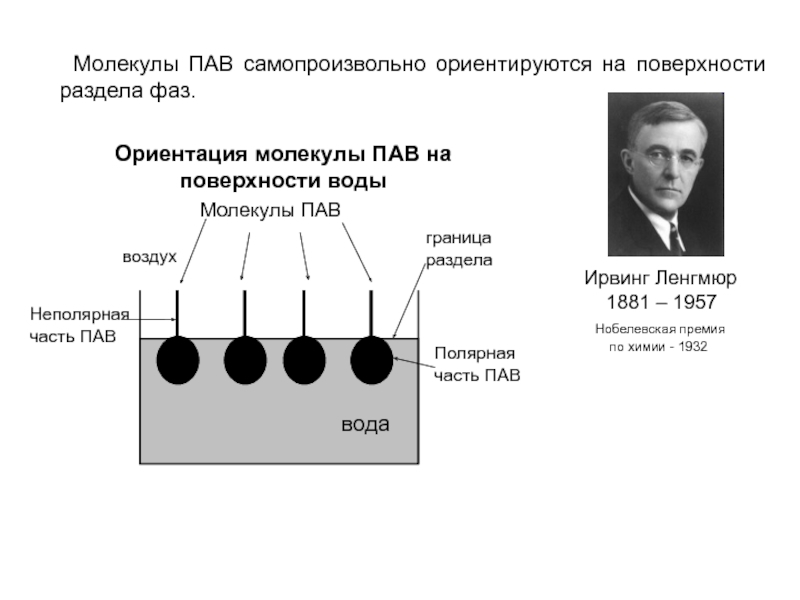
Слайд 10 Молекулы ПАВ самопроизвольно ориентируются на поверхности раздела фаз.
Ирвинг Ленгмюр
1881 – 1957
Нобелевская премия
по химии - 1932
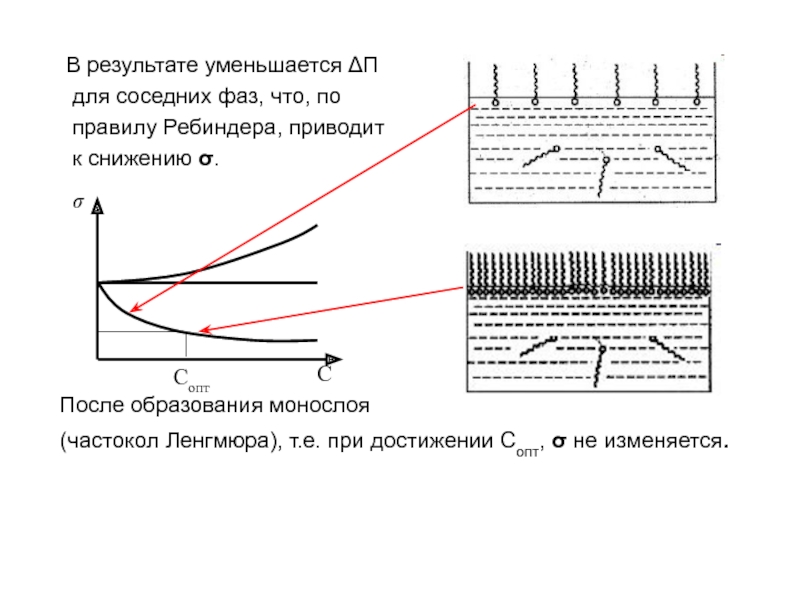
Слайд 11 В результате уменьшается ΔП
для соседних
фаз, что, по
правилу Ребиндера, приводит
к снижению .
После образования монослоя
(частокол Ленгмюра), т.е. при достижении Сопт, не изменяется.
Сопт
Слайд 13Поверхностная активность
Количественной мерой способности ПАВ понижать поверхностное натяжение на границе
раздела фаз служит поверхностная активность (g):
, (Джм/моль)
g – понижение поверхностного натяжения раствора при изменении концентрации ПАВ на единицу.
Поверхностная активность зависит от хим. структуры веществ: природы полярной и строения неполярной частей молекулы.
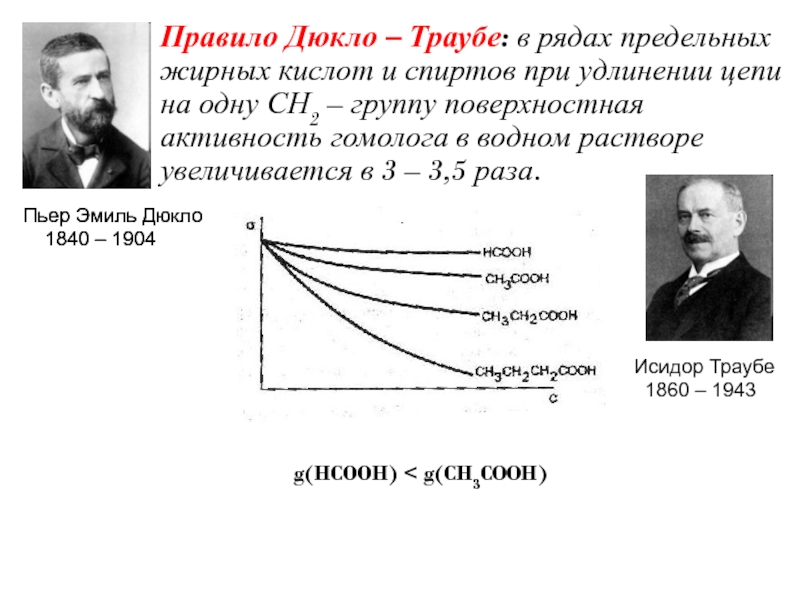
Слайд 14Правило Дюкло – Траубе: в рядах предельных жирных кислот и
спиртов при удлинении цепи на одну СН2 – группу поверхностная
активность гомолога в водном растворе увеличивается в 3 – 3,5 раза.
g(HCOOH) < g(CH3COOH)
Исидор Траубе
1860 – 1943
Пьер Эмиль Дюкло
1840 – 1904
Пьер Эмиль Дюкло
1840 – 1904
Слайд 15Адсорбция на подвижных границах
(жидкость – газ; жидкость – жидкость)
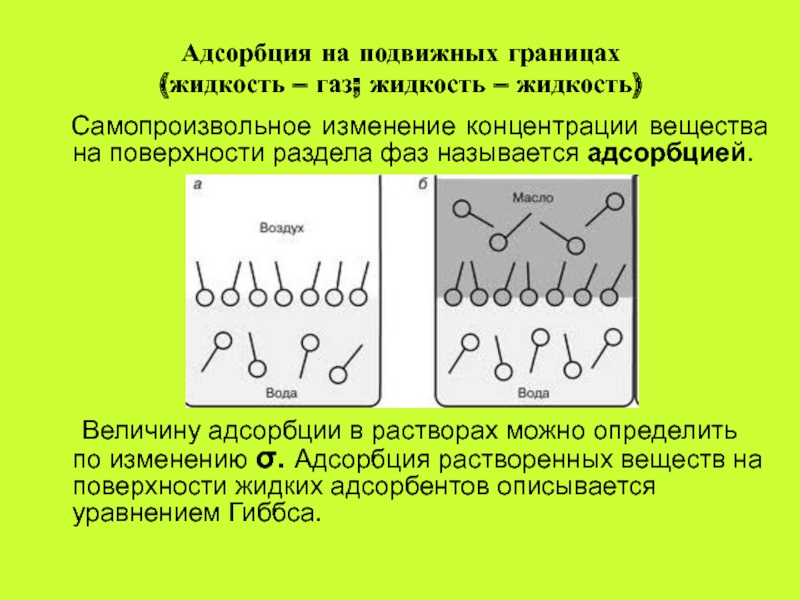
Самопроизвольное изменение концентрации вещества на поверхности раздела фаз называется адсорбцией.
Величину
адсорбции в растворах можно определить по изменению . Адсорбция растворенных веществ на поверхности жидких адсорбентов описывается уравнением Гиббса.
Слайд 16Изотерма адсорбции Гиббса
Уравнение, описывающее зависимость между адсорбцией и концентрацией вещества
называется изотермой адсорбции.
Уравнение адсорбции Гиббса:
отражает зависимость между Св-ва на
единице
S раздела фаз и Св-ва в объеме раствора
Для ПАВ: < 0; g >0; Г > 0 – адсорбция положительна.
Для ПИВ: > 0; g < 0; Г < 0 – адсорбция отрицательна.
Слайд 17Адсорбция на неподвижных границах
(твердое тело – газ; твердое тело
– раствор)
Причиной адсорбции на твердых телах является нескомпенсированность
силовых полей молекул, в зонах деформации (активных центрах).
Адсорбцию, проходящую на них, разделяют на физическую и химическую (хемосорбция).
Слайд 18 Физическая адсорбция (ФАд) возникает за счет ван-дер-ваальсовых взаимодействий и происходит
на активных центрах (во впадинах поверхности).
Химическая адсорбция (хемосорбция) (ХАд)
осуществляется путем химического взаимодействия молекул адсорбента и адсорбата и приходится на выступы рельефа поверхности.
Различия:
1. ФАд – обратима, а ХАд – необратима;
2. ХАд локализована, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента.
3. С увеличением t величина ФАд уменьшается, а ХАд увеличивается.
Активные центры физической (а) и химической (б) адсорбции
Слайд 19Твердое тело, на котором происходит адсорбция, называют адсорбентом;
Адсорбированное вещество,
находящееся на поверхности или в объеме пор адсорбента называют адсорбатом;
Вещество, способное адсорбироваться, но еще не адсорбированное называют адсорбтивом.
Процесс поглощения веществ поверхностным слоем часто дополняется поглощением адсорбтива всем объемом твердого тела – абсорбцией, суммарный процесс (адсорбция + абсорбция) называют сорбцией.
Сорбция – обратимый процесс (десорбция).
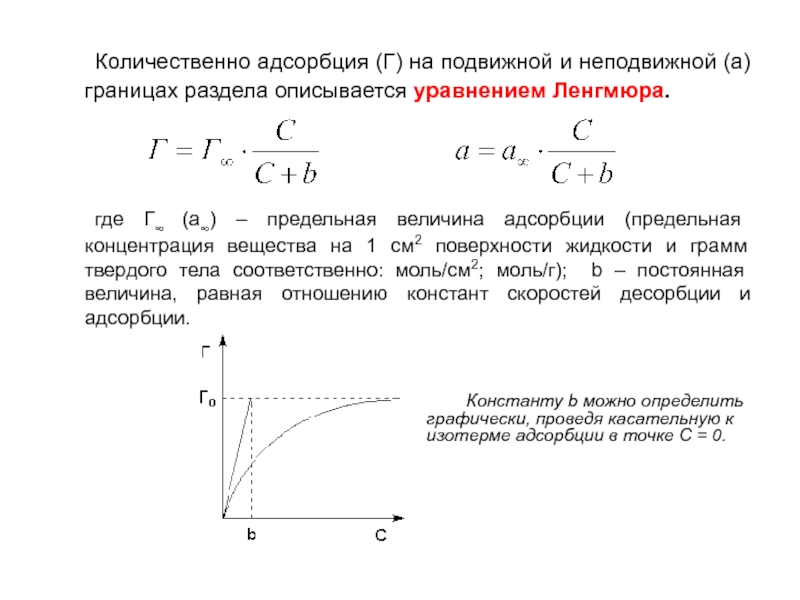
Слайд 20 Количественно адсорбция (Г) на подвижной и неподвижной (а) границах раздела
описывается уравнением Ленгмюра.
где Г∞ (а∞) – предельная величина адсорбции (предельная
концентрация вещества на 1 см2 поверхности жидкости и грамм твердого тела соответственно: моль/см2; моль/г); b – постоянная величина, равная отношению констант скоростей десорбции и адсорбции.
Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
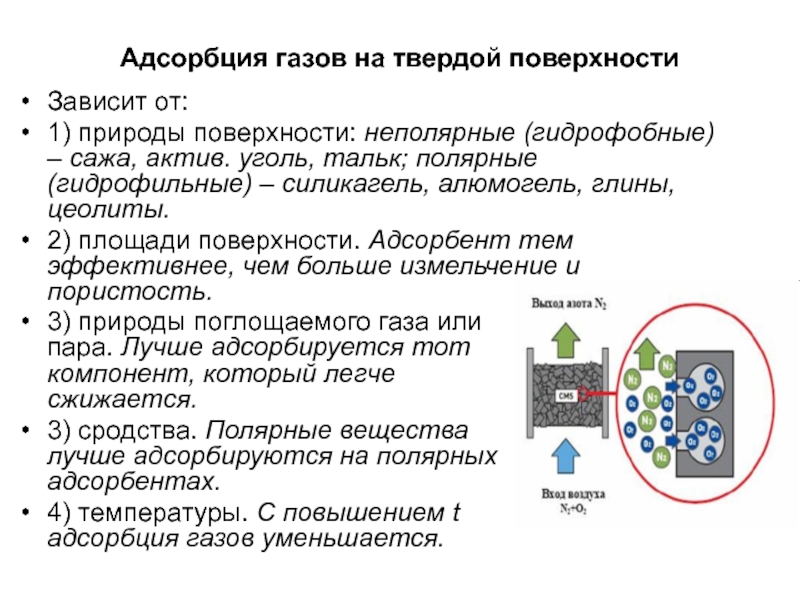
Слайд 21Адсорбция газов на твердой поверхности
Зависит от:
1) природы поверхности: неполярные (гидрофобные)
– сажа, актив. уголь, тальк; полярные (гидрофильные) – силикагель, алюмогель,
глины, цеолиты.
2) площади поверхности. Адсорбент тем эффективнее, чем больше измельчение и пористость.
3) природы поглощаемого газа или пара. Лучше адсорбируется тот компонент, который легче сжижается.
3) сродства. Полярные вещества лучше адсорбируются на полярных адсорбентах.
4) температуры. С повышением t адсорбция газов уменьшается.
Слайд 22Молекулярная адсорбция на границе
твердое тело – раствор
Отличие от адсорбции
газов заключается в конкуренции между растворителем и растворенным веществом за
адсорбционные центры на твердой поверхности адсорбента.
Зависит от:
1) природы адсорбента. Полярные адсорбенты поглощают полярные вещества.
2) природы растворителя. Чем хуже растворитель смачивает поверхность и чем хуже растворяет вещество, тем лучше адсорбция растворенного вещества.
3) концентрации раствора. Описывается уравнением Ленгмюра.
4) температуры. При повышении t адсорбция веществ из растворов уменьшается.
Слайд 235) природы поглощаемого вещества (адсорбата):
а) Правило Шилова: чем больше
растворимость вещества в растворителе, тем хуже оно адсорбируется на адсорбенте.
б)Правило
Ребиндера: на поверхности раздела фаз лучше адсорбируются те вещества, при адсорбции которых происходит выравнивание соприкасающихся фаз, причем с увеличением ∆П способность к адсорбции этих веществ возрастает.
Слайд 24Адсорбция ионов из растворов
в зависимости от природы адсорбента подразделяется на
ионную адсорбцию
и
ионнообменную адсорбцию
Слайд 25Ионная адсорбция
По сравнению с молекулярной адсорбцией более сложный процесс, т.к.
в растворе присутствует уже 3 вида частиц: катионы, анионы растворенного
вещества и растворитель.
Особенности:
1) адсорбируются заряженные частицы (ионы), а не молекулы.
2) адсорбция происходит только на полярных адсорбентах (полярная адсорбция).
3) адсорбция сопровождается образованием ДЭС.
4) Адсорбция является избирательной.
5) В основе адсорбции лежат химические силы, т.е. адсорбция необратима.
6) Характерно явление обменной адсорбции.
Слайд 26Зависит от:
1) природы адсорбента. Чем более полярный адсорбент, тем лучше
адсорбция ионов.
2) природы иона:
а) чем меньше rиона, тем больше
адсорбция;
Ионы одинакового заряда можно расположить в так называемые лиотропные ряды (или ряды Гитторфа):
Li+ > Na+ > K+ > Rb+ > Cs+
Cl- > Br- > NO3- > SCN- > OH-
уменьшение гидратации, усиление адсорбционных свойств
б)чем больше zиона, тем сильнее адсорбция
Слайд 27Избирательная адсорбция ионов подчиняется
правилу Панета – Фаянса
Например: на AgI
могут адсорбироваться Ag+ и I-, а также изоморфные ионы: Cl-,
Br-, CN-, CNS-. Обязательным является условие образования труднорастворимого соединения.
Фридрих Адольф
Панет
1887 – 1958
на кристаллической поверхности адсорбируются те ионы, которые способны достроить кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл.
Казимир Фаянс
1887 – 1975
Слайд 28Ионообменная адсорбция
Ионообменная адсорбция – это процесс, при котором твердый адсорбент
обменивает свои ионы на ионы того же знака из жидкого
раствора.
Сорбенты, способные к обмену ионов, называют ионообменниками или ионитами.
Ионообменные смолы – это высокомолекулярные нерастворимые соединения, способные набухать в водных растворах, поглощая значительное количество воды, и высвобождать ионы в процессе электролитической диссоциации.
Слайд 29 Иониты подразделяют на катиониты, анионита и амфотерные иониты
Катиониты (катионообменные сорбенты)
– представляют собой нерастворимые многоосновные кислоты; обменивают катионы.
R – SO3-H+
Аниониты (анионообменные сорбенты) представляют собой нерастворимые многоатомные основания; они обменивают анионы.
R – N(CH3)3+ – OH-
Амфортерные иониты содержат и катионные и анионные обмениваемые группы.
H+SO3-– R– N(CH3)3+ OH-.
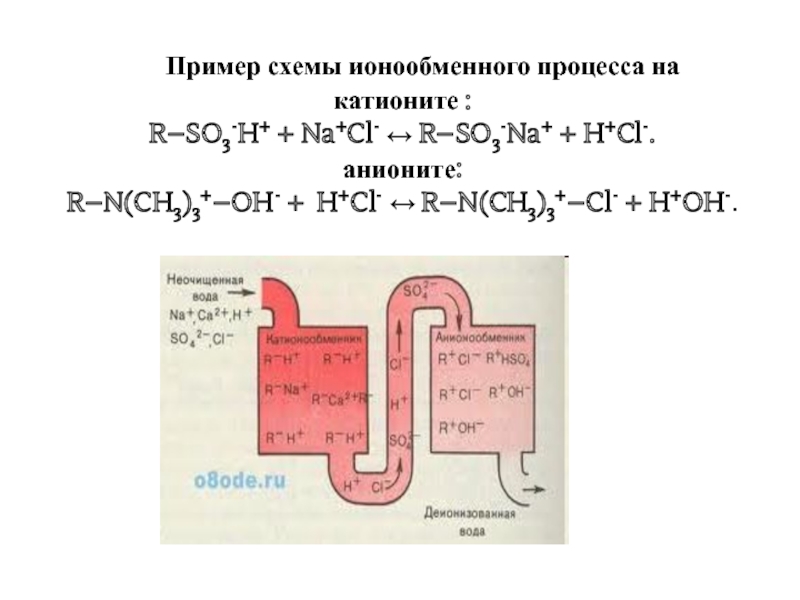
Слайд 30 Пример схемы ионообменного процесса на
катионите :
R–SO3-H+ + Na+Cl-
R–SO3-Na+ + H+Cl-.
анионите:
R–N(CH3)3+–OH- + H+Cl- R–N(CH3)3+–Cl- + H+OH-.
Слайд 31Адсорбционные процессы, используемые в медицине
Адсорбционная терапия применяется для удаления
токсинов и вредных веществ из ЖКТ (адсорбенты: Al(OH)3, МgO,AlPO4 входят
в состав алмагеля, фосфалюгеля и др.). Активированный уголь – адсорбент газов (при метеоризме), токсинов (при пищевых токсикоинфекциях), алкалоидов и солей тяжелых металлов (при отравлениях).
Гемосорбция используется для удаления из крови крупных молекул токсических веществ, вирусов, бактерий (углеродные сорбенты, иммуносорбенты, ионообменные смолы).