Слайд 2Какой металл самый – самый…
Самый легкий металл –
Самый тяжелый металл
–
Самый легкоплавкий металл –
Самый тугоплавкий металл –
Самый
мягкий металл -
Самый твердый металл –
Самый электропроводный металл –
Самый блестящий металл –
Самый пластичный металл –
Самый звонкий металл –
Слайд 3Какой металл самый – самый…
Самый легкий металл – литий
Самый тяжелый
металл – осмий
Самый легкоплавкий металл – ртуть
Самый тугоплавкий металл –
вольфрам
Самый мягкий металл - цезий
Самый твердый металл – хром
Самый электропроводный металл – серебро
Самый блестящий металл – серебро
Самый пластичный металл – золото
Самый звонкий металл – золото.
Слайд 4Верю – не верю
А) Литий, натрий, калий, медь являются щелочными
металлами.
Б) Металлы пропускают световые лучи.
В) Большинство металлов в
равной степени рассеивают все лучи видимой части спектра.
Г) Ртуть – легкий металл, поэтому используется в физических приборах.
Д) Общие физические свойства металлов обусловлены положением металлов в ПСХЭ.
Слайд 5Химические свойства металлов
Цель урока: обобщить и закрепить знания о химических
свойствах металлов, уметь составлять уравнения химических реакций на основании положения
металла в электрохимическом ряду напряжений.
Истинный химик должен быть теоретиком и практиком.
(М.В.Ломоносов)
Слайд 6Вопросы на размышление
Какую роль выполняют металлы в химических реакциях?
Как оценить активность металлов в реакциях с их участием?
Какую информацию
о свойствах металлов можно получить на основании их положения в электрохимическом ряду напряжений металлов?
Слайд 7Кратко из биографии
Николай Николаевич Бекетов (1827–1911) –
русский ученый, основатель отечественной школы
физической химии,
академик Петербургской
академии наук с 1886г.
Родился 1 (13) января 1827 года в селе Новая Бекетовка Пензенской губернии.
В 1844 году поступил в Петербургский университет, а на третьем курсе перешел в Казанский университет.
В 1847–1853 годах работал в Петербурге в Медико-химической лаборатории под руководством знаменитого химика Н.Н. Зинина. В 1855 году стал профессором Харьковского университета, читал лекции по физической химии и руководил проводившимися в университете практическими исследованиями.
В 1864 году по его предложению в Харьковском университете открылось первое в России физико-химическое отделение.
Бекетов открыл способ восстановления металлов из их оксидов, составил вытеснительный ряд металлов, который был назван его именем.
Слайд 8Ряд напряжений металлов
Металлы расположены в порядке убывания восстановительных свойств при
реакциях в водных растворах в стандартных условиях;
Металлы, стоящие левее, вытесняют
металлы, стоящие правее, из их солей в растворе;
Металлы, стоящие в этом ряду до водорода, вытесняют его из кислот в растворе (кроме HNO3 и концентрированной H2SO4 )
Ме до Al + H2O == щелочь + H2
Ме после Al + H2O =t= оксид + H2
Ме после H + H2O =/=
Слайд 9Взаимодействуют с кислородом
Na + О2 =
Li + О2 =
Cu + О2 =
Ag
+ О2 =
Слайд 10Взаимодействуют с кислородом
2Na + О2 = Na2О2
4Li + О2 =
2Li2 О
2Cu + О2 = 2Cu О
Ag + О2
=/=
Слайд 11Взаимодействуют с неметаллами
Fe + Br2 =
Al + S =
Li + N2 =
Na + H2 =
Слайд 12Взаимодействуют с неметаллами
2Fe + 3Br2 =t= 2FeBr3
2Al + 3S =t=
Al2S3
6Li + N2 = 2Li3N
2Na + H2 =t= 2NaH
Слайд 13Взаимодействуют с водой
Na + H2O =
Mg + H2O =
Fe +
H2O =
Ag + H2О =
Слайд 14Взаимодействуют с водой
2Na + 2H2O = 2NaОН + H2
Mg + 2H2O
=t= Mg(ОН)2 +H2
3Fe + 4H2O =t= Fe3O4 + 4H2
Ag +
H2О =/=
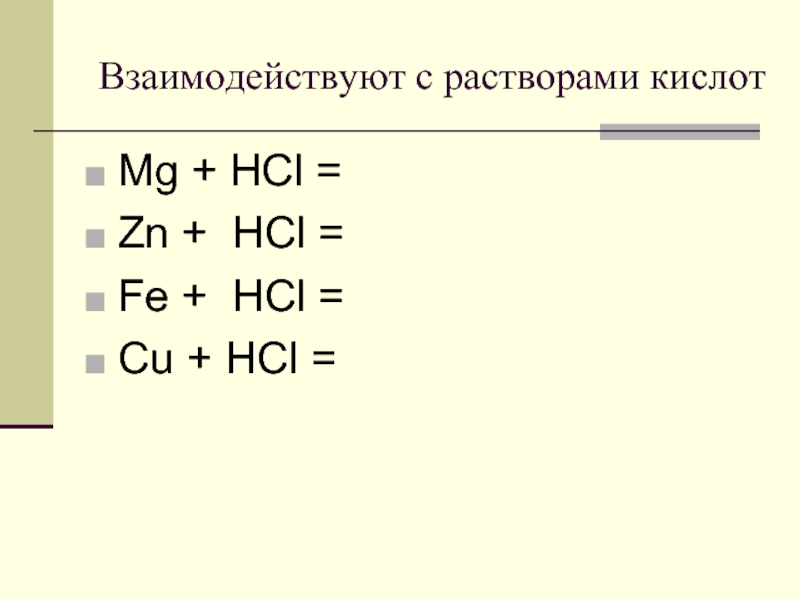
Слайд 15Взаимодействуют с растворами кислот
Mg + HCl =
Zn + HCl =
Fe
+ HCl =
Cu + HCl =
Слайд 16Взаимодействуют с растворами кислот
Mg + 2HCl = MgCl2 + H2
Zn
+ 2HCl = ZnCl2 + H2
Fe + 2HCl = FeCl2
+ H2
Cu + HCl =/=
Слайд 17Взаимодействуют с растворами солей
Fe + CuSO4 =
Cu
+ FeSO4 =
Слайд 18Взаимодействуют с растворами солей
Fe + CuSO4 = FeSO4 + Cu
Cu
+ FeSO4 =/=
Слайд 19Взаимодействуют с органическими веществами
А) реакция с одноатомными спиртами, многотомными спиртами,
фенолом:
СН2 - ОН
СН2 - ОNa
| +2Na = | + H2
СН2 - ОН СН2 - ОNa
Б) реакция Вюрца:
СН3 - Cl+ 2Na = СН3 - СН3 + 2NaCl
В) образование ацетиленидов
СH ≡ СН + 2Na =NH3= СNa ≡ СNa + H2
Г) образование металлоорганических соединений
СН3 – Cl + Mg = СН3MgCl
Слайд 20Домашнее задание
§ 18 , страница 201 -207 упр. 6,
9, 13
Слайд 21Закрепление
1. Кому не жаль «денег»?
Однажды
два приятеля – Алюминий и Калий – поздно возвращались домой.
И вдруг на них неожиданно напал грабитель Хлор, который потребовал выложить кошельки с электронами. Как вы считаете, какой из приятелей легче расстанется со своим кошельком? Объясните, почему?
2.Нигде нет покоя…
Когда Магний пришел в бар, там уже сидели: Кислород, Сера, Хлорид Натрия в растворе, разбавленная Серная Кислота и Гидроксид Меди (II). Присутствие каких веществ испортило ему настроение? Почему? Подтвердите свой ответ уравнениями реакций.
3. Задача.
Некий жилец второго подъезда пришел в гости в квартиру №8 поиграть в шахматы. Кто из них кому пешку не уступил или шах поставил – неизвестно. Но только они крупно повзаимодействовали, в результате чего жилец массой 0,8г исчез, а вместо него образовалось 1,12г его оксида. Определите, как звали пропавшего жильца, который любил ходить в гости?