Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сера. Строение атома, аллотропия, свойства и применение серы
Содержание
- 1. Сера. Строение атома, аллотропия, свойства и применение серы
- 2. Цель:Определить положение серы в периодической системе химических
- 3. «В древней магии присутствую при рождении огня, называют серой издавна меня»
- 4. Сера. Строение атома, аллотропия, свойства и применение серы.
- 5. Визитка химического элемента. Химический знак - SПорядковый
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
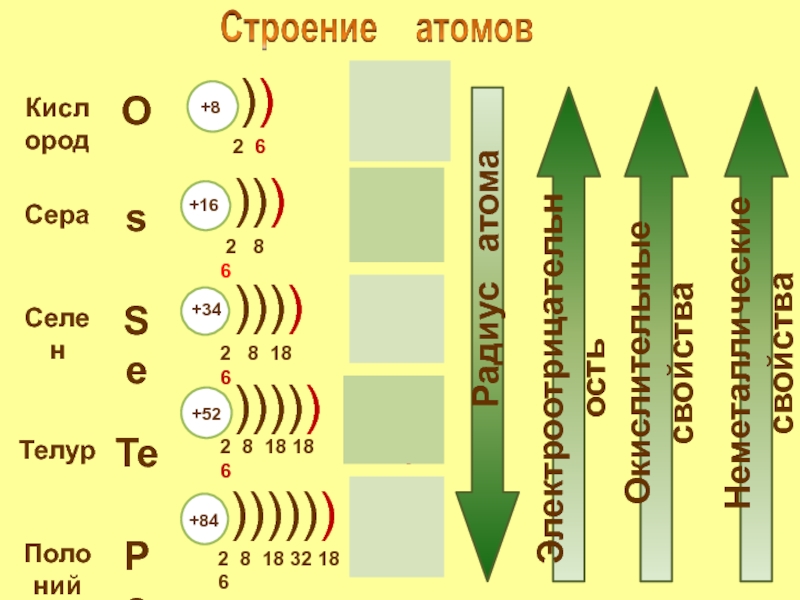
- 9. S+16322681s22s2
- 10. Валентные состояния атома серы
- 11. Распространенность серыСодержание в окружающей среде и в
- 12. Нахождение серы в природе.Сера в природеСамородная сера -SСульфидыПирит –FeS2СульфатыГипс-СаSO4*2H2OМирабилит –Na2SO4*10H2OГорькая соль-MgSO4*7H2OКиноварь HgSХалькопирит CuFeS2
- 13. Слайд 13
- 14. Ромбическая сера Ромбическая (α-сера) - S8, желтого цвета, t°пл. = 113°C; Наиболее устойчивая модификация.
- 15. Физические свойства серыТвердое кристаллическое вещество желтого цвета,
- 16. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые
- 17. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная)
- 18. Химические свойства серыS – окислительS + 2е-
- 19. Химические свойства серы. S – восстановитель S
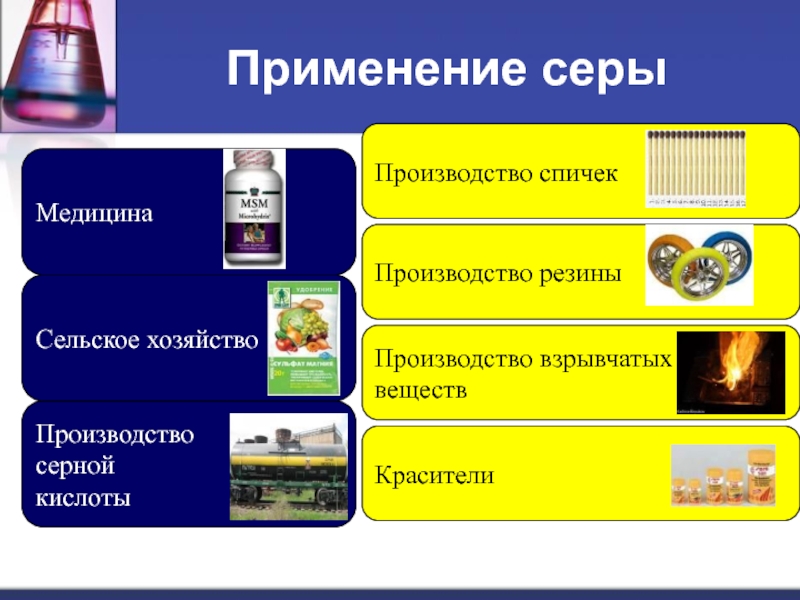
- 20. Применение серы МедицинаПроизводствосернойкислотыСельское хозяйство Производство спичекПроизводство резиныПроизводство взрывчатых веществ Красители
- 21. ОТВЕТЬТЕ НА ВОПРОСЫ:Охарактеризуйте положение серы в периодической системе химических элементов Д.И. Менделеева.
- 22. Выберите правильный ответ:В каком соединении сера проявляет степень окисления +4?А) H2SБ) H2SO3В) H2SO4
- 23. ОТВЕТЬТЕ НА ВОПРОСЫ:В каком виде сера находится в природе?
- 24. ОТВЕТЬТЕ НА ВОПРОСЫ:Охарактеризуйте физические свойства серы.
- 25. Выберите правильный ответ:С каким веществом реагирует сера образуя сульфид:А) водойБ) водородомВ) натрием
- 26. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель:
Определить положение серы в периодической системе химических элементов Д.И. Менделеева;
Рассмотреть
строение атома серы, физические и химические свойства, области применения серы.
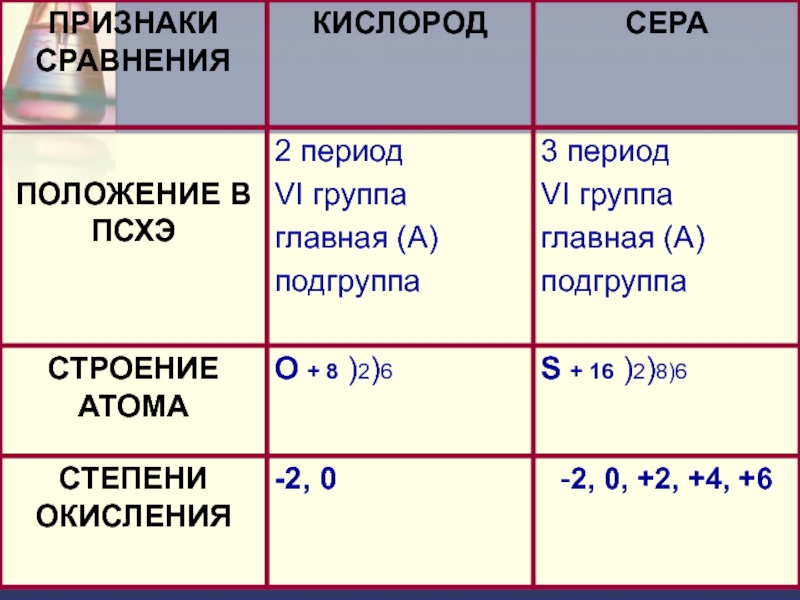
Слайд 5Визитка химического элемента.
Химический знак - S
Порядковый номер – 16
Аr -
32.066
Период - III
Группа – V I
Подгруппа – главная
Электронная формула атома –1s22s22p63s23p4
Радиус атома – 0.104 нм.
Электроотрицательность – 2.58
S 16
Sulfur 2
32.066 8
3s23p4 6
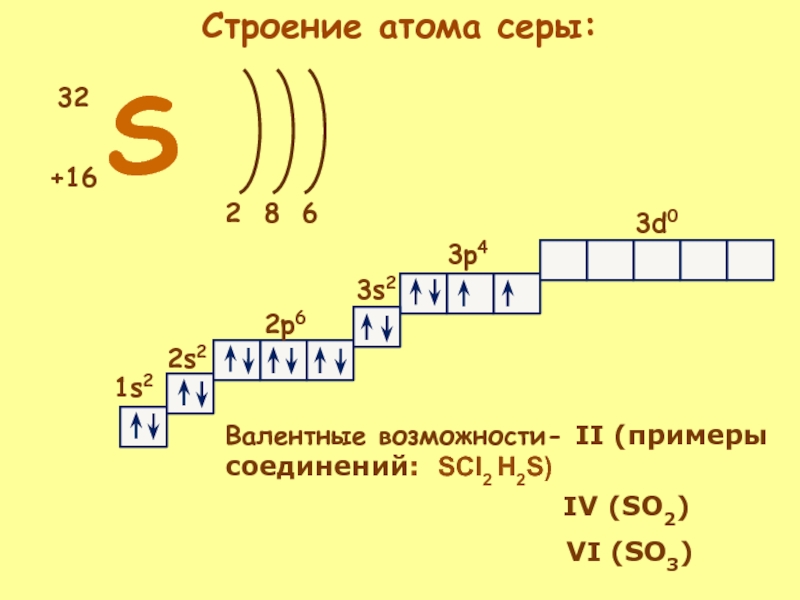
Слайд 9S
+16
32
2
6
8
1s2
2s2
2p6
3s2
3p4
3d0
Валентные возможности- II (примеры соединений:
SCl2 H2S)IV (SO2)
VI (SO3)
Строение атома серы:
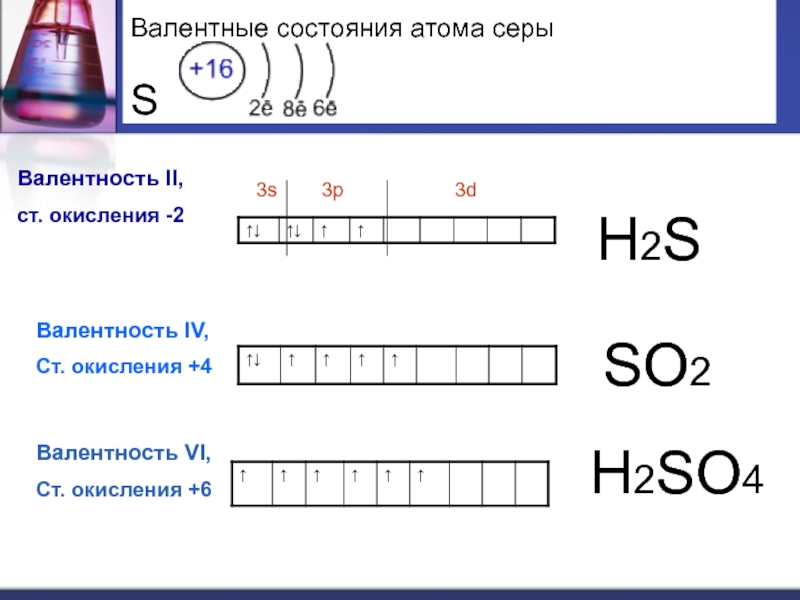
Слайд 10 Валентные состояния атома серы S
Валентность II,
ст. окисления -2
3s
3p 3dВалентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
Н2S
SО2
Н2SО4
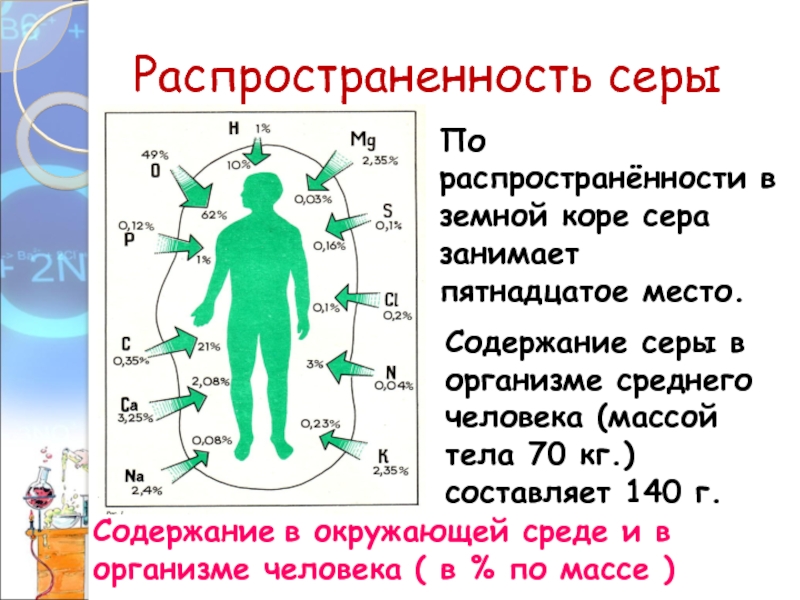
Слайд 11Распространенность серы
Содержание в окружающей среде и в организме человека (
в % по массе )
По распространённости в земной коре сера
занимает пятнадцатое место.
Содержание серы в организме среднего человека (массой тела 70 кг.) составляет 140 г.
Слайд 12Нахождение серы в природе.
Сера в природе
Самородная сера -S
Сульфиды
Пирит –FeS2
Сульфаты
Гипс-СаSO4*2H2O
Мирабилит –Na2SO4*10H2O
Горькая
соль-MgSO4*7H2O
Киноварь HgS
Халькопирит
CuFeS2
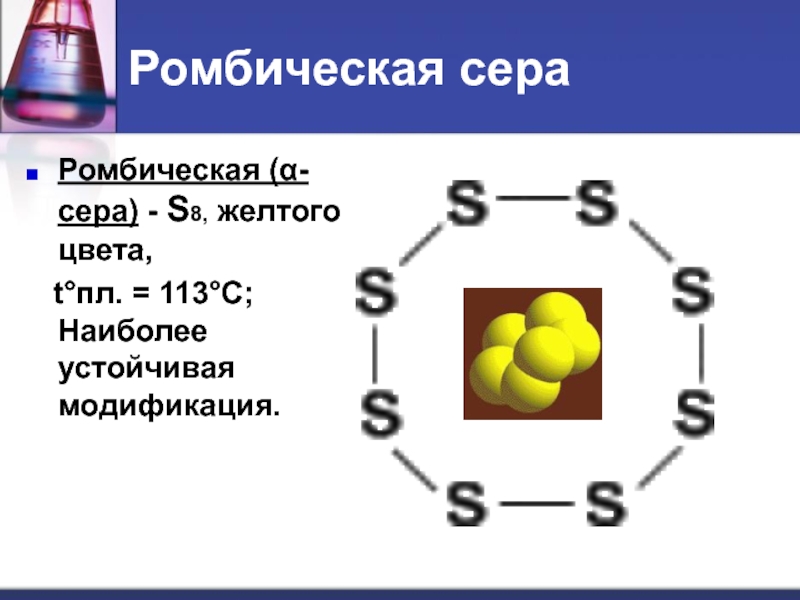
Слайд 14Ромбическая сера
Ромбическая (α-сера) - S8, желтого цвета,
t°пл.
= 113°C; Наиболее устойчивая модификация.
Слайд 15Физические свойства серы
Твердое кристаллическое вещество желтого цвета, нерастворима в воде,
водой не смачивается (порошок серы в воде не тонет и
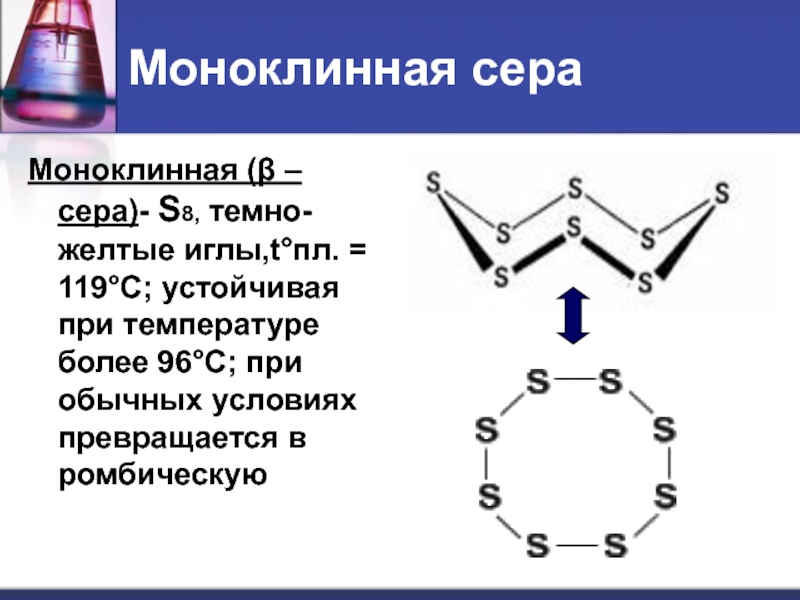
плавает на поверхности воды)Слайд 16Моноклинная сера
Моноклинная (β –сера)- S8, темно-желтые иглы,t°пл. = 119°C;
устойчивая при температуре более 96°С; при обычных условиях превращается в
ромбическуюСлайд 17Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива
и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу.
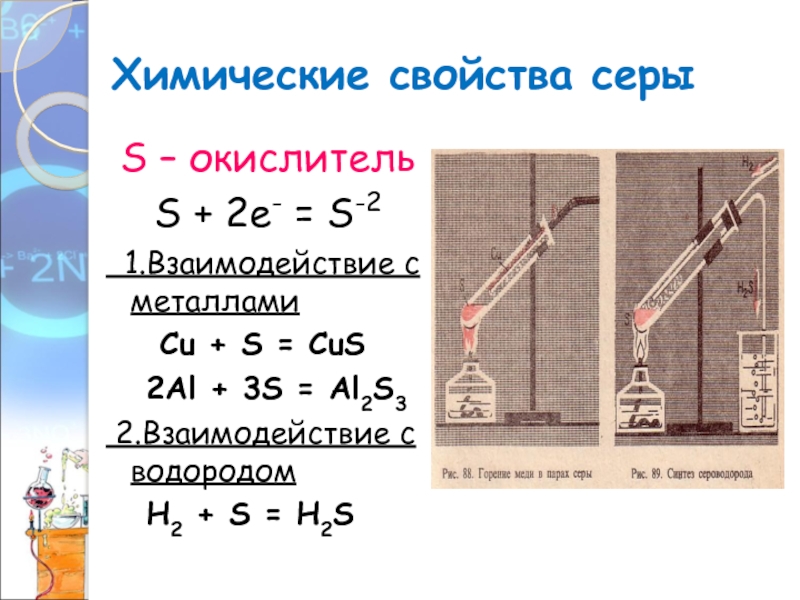
Слайд 18Химические свойства серы
S – окислитель
S + 2е- = S-2
1.Взаимодействие
с металлами
Сu + S = CuS
2Al
+ 3S = Al2S32.Взаимодействие с водородом
H2 + S = H2S
Слайд 19Химические свойства серы.
S – восстановитель
S – 2e- =
S+2 S - 4e- = S+4
S - 6e- = S+61.Взаимодействие с кислородом
S + O2= SO2
2.Взаимодействие с галогенами
S+ Cl2= SCl2
S + 3F2= SF6
3.Взаимодействие с кислотами – окислителями
S+ 2Н2SО4=3SO2+2H2O
Концентрированная.



















![ДИФФЕРЕНЦИАЦИЯ ЗВУКОВ [Л] - [Р]
В СЛОГАХ, СЛОВАХ](/img/thumbs/8747bbe13d20063553fa1f12a186718b-800x.jpg)