Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома. и периодический закон Менделеева
Содержание
- 1. Строение атома. и периодический закон Менделеева
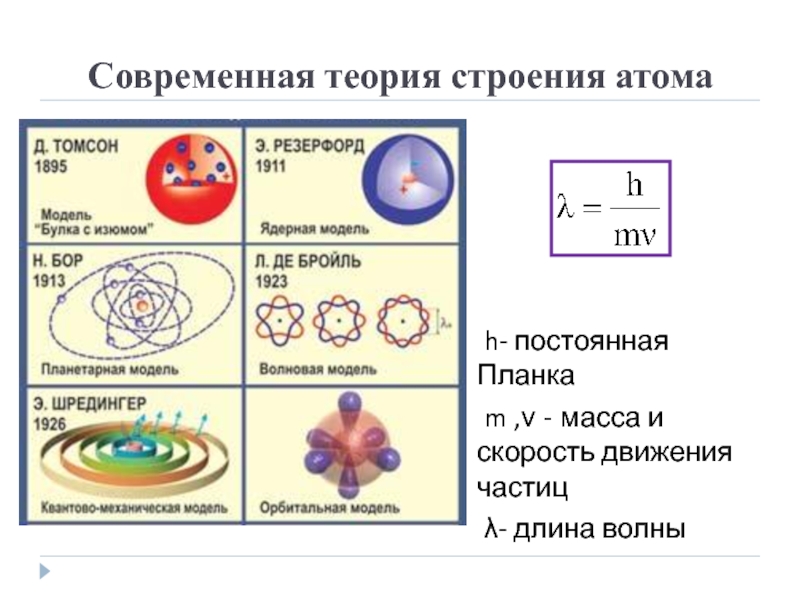
- 2. Современная теория строения атомаh- постоянная Планкаm ,ν - масса и скорость движения частицλ- длина волны
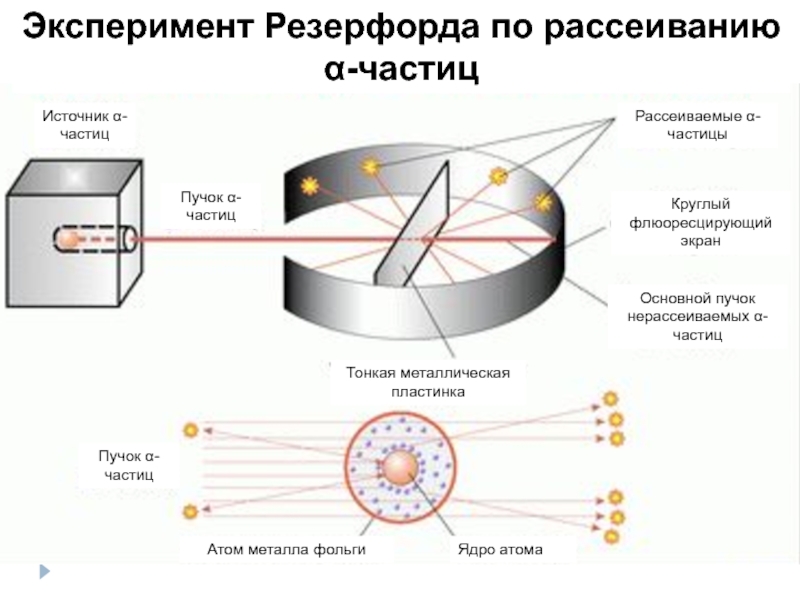
- 3. Эксперимент Резерфорда по рассеиванию α-частиц
- 4. Орбиталь – ……пространство вокруг ядра, в котором
- 5. Квантовые числаГлавное квантовое число n характеризует энергию
- 6. Квантовые числаПобочное (орбиальное) квантовое число - величина,
- 7. Орбитальное квантовое числоКроме того, побочное квантовое число
- 8. Примеры энергетических уровнейn = 1, ℓ =
- 9. Обозначение свободных орбиталейs орбитальp орбитальd орбитальf орбиталь
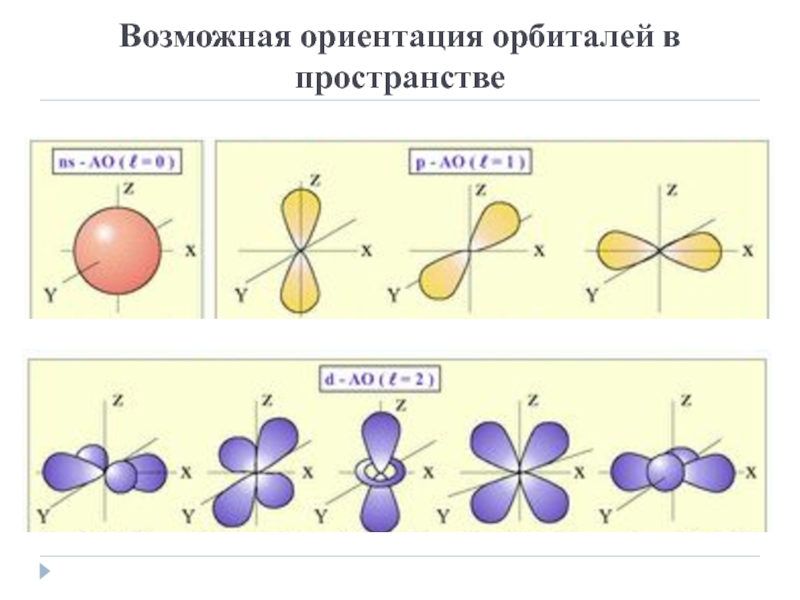
- 10. Возможная ориентация орбиталей в пространстве
- 11. Магнитное квантовое числоОриентация орбиталей в пространстве характеризуется
- 12. Значения квантовых чиселn = 1, ℓ =
- 13. Спиновое квантовое число msЧисло ms характеризует собственный
- 14. Принцип минимума энергииē в невозбужденном атоме распределяются
- 15. Порядок заполнения атомных орбиталей электронамиТаким образом, при
- 16. Принцип ПаулиВ атоме не может быть двух
- 17. Принцип ПаулиОбщее число электронов на заполненных уровнях
- 18. Правило ГундаЭлектронно-графические формулы
- 19. Электронно-графические формулы33As ) ) ) ) 2 8 18 5
- 20. Спасибо за внимание!
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Орбиталь – …
…пространство вокруг ядра, в котором заключено примерно 90%
электронного облака.
Электроны, которые движутся в орбиталях близкого размера образуют электронный
уровень.Слайд 5Квантовые числа
Главное квантовое число n характеризует энергию электронов определенного уровня
и принимает значение положительных чисел (1,2,3,4 и т.д.), совпадающих с
номером уровня.Чем больше величина n, тем дальше находится электрон от ядра и тем больше его энергия
E1< E2 < E3 …….. En; r1 < r2 < r3…. rn
орбитальный радиус
Слайд 6Квантовые числа
Побочное (орбиальное) квантовое число - величина, отражающая различия в
энергетическом состоянии электронов различных подуровней.
Численные значения l принято обозначать буквенными
символами:0 1 2 3
s p d f
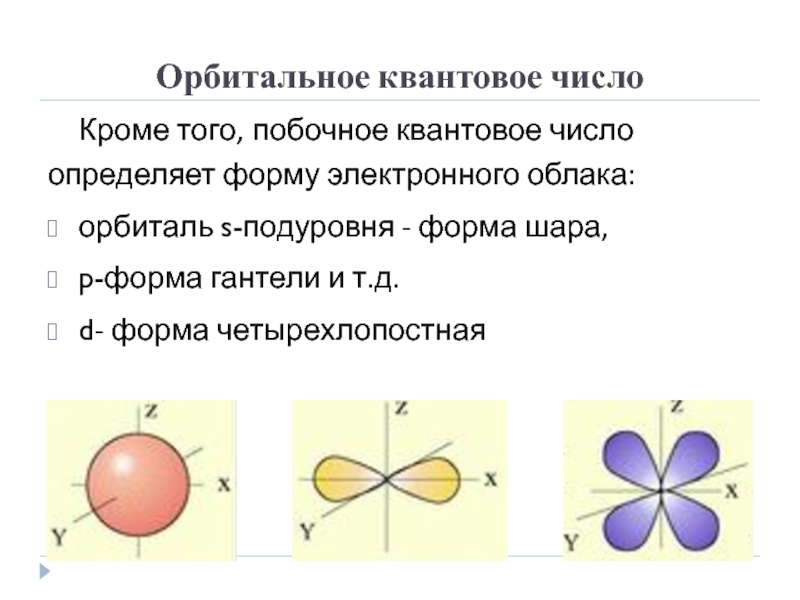
Слайд 7Орбитальное квантовое число
Кроме того, побочное квантовое число определяет форму электронного
облака:
орбиталь s-подуровня - форма шара,
p-форма гантели и т.д.
d- форма четырехлопостная
Слайд 8Примеры энергетических уровней
n = 1, ℓ = 0 – s
орбиталь;
n = 2, ℓ = 0 – s орбиталь,
ℓ = 1 – р орбиталь;n = 3, ℓ = 0 – s орбиталь,
ℓ = 1 – р орбиталь,
ℓ = 2 – d орбиталь;
n = 4, ℓ = 0 – s орбиталь,
ℓ = 1 – р орбиталь,
ℓ = 2 – d орбиталь;
ℓ = 3 – f орбиталь,
2 энергетический уровень
3 энергетический уровень
4 энергетический уровень
1 энергетический уровень
Слайд 11Магнитное квантовое число
Ориентация орбиталей в пространстве характеризуется магнитным квантовым числом
ml, поэтому количество орбиталей одного вида можно определить по числу
его значений. Магнитное квантовое число принимает все целочисленные значения от –l до +l.Для s-орбитали ml =0 (одно значение);
для p-орбитали ml =-1, 0, +1 (три значения);
для d-орбитали ml =-2, -1, 0, +1, +2 (пять значений);
для f-орбитали ml =-3, -2, -1, 0, +1, +2, +3 (семь значений).
Слайд 12Значения квантовых чисел
n = 1, ℓ = 0 – s
орбиталь
n = 2, ℓ = 0 – s орбиталь
ℓ = 1 – р орбитальn = 3, ℓ = 0 – s орбиталь
ℓ = 1 – р орбиталь
ℓ = 2 – d орбиталь
n = 4, ℓ = 0 – s орбиталь
ℓ = 1 – р орбиталь
ℓ = 2 – d орбиталь
ℓ = 3 – f орбиталь
mℓ = 0
mℓ = 0
mℓ = –1,0,+1
mℓ = 0
mℓ = –1,0,+1
mℓ = –2,–1,0,+1,+2
mℓ = 0
mℓ = –1,0,+1
mℓ = –2,–1,0,+1,+2
mℓ = –3,–2,–1,0,+1,+2,+3
Слайд 13Спиновое квантовое число ms
Число ms характеризует собственный момент количества движения
электрона, получивший название спин, и принимает 2 значения: +½ и
-½.Два противоположных направления обозначают: ↑ или ↓.
Слайд 14Принцип минимума энергии
ē в невозбужденном атоме распределяются по энергетическим уровням
и подуровням так, чтобы их сумма была минимальной.
Согласно первому правилу
Клечковского, раньше заполняются те орбитали и уровни, у которых сумма главного и орбитальных квантовых чисел меньше (n+ℓ).В случае равных сумм (второе правило Клечковского) сначала заполняется та орбиталь, у которой меньше значение n.
Слайд 15Порядок заполнения атомных орбиталей электронами
Таким образом, при записи электронной конфигурации
необходимо учитывать последовательность заполнения электронами орбиталей:
26Fe
1s2 2s2 2p6 3s6
4s2 3d6Слайд 16Принцип Паули
В атоме не может быть двух электронов с одинаковым
набором значений всех четырех квантовых чисел.
Максимальное число электронов на всех
орбиталях данного энергетического подуровня равно:Xℓ =2(2 ℓ+1)
ℓ=0, s подуровень Xℓ =2
ℓ=1, p подуровень Xℓ =6
ℓ=2, d подуровень Xℓ =10
ℓ=3, f подуровень Xℓ =14
Слайд 17Принцип Паули
Общее число электронов на заполненных уровнях (1,2,3,4)соответствует формуле:
Xn=2n2
n- номер рассматриваемого уровня
16S ) ) )
26Fe ) ) ) )2 8 6 2 8 14 2
1s22s22p63s23p4 1s22s22p63s23p64s23d6
Слайд 18Правило Гунда
Электронно-графические формулы
Не 1s
В невозбужденных атомах электроны в пределах данного подуровня занимают максимальное число свободных орбиталей, при этом суммарное спиновое число максимально.