Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение и свойства кальциевых каналов
Содержание
- 1. Строение и свойства кальциевых каналов
- 2. Эукариотические клетки содержат системы транспорта кальция:В плазматической
- 3. Осуществляется вход Сa2+по градиенту концентрации.Повышение концентрации кальция
- 4. Типы кальциевых каналов,классифицированныена основе их регуляторного механизмаПотенциал-управляемые (VOC или VGCC)Рецептор-управляемые (ROC)Управляемые опустошением ретикулярных кальциевых депо (SOC)
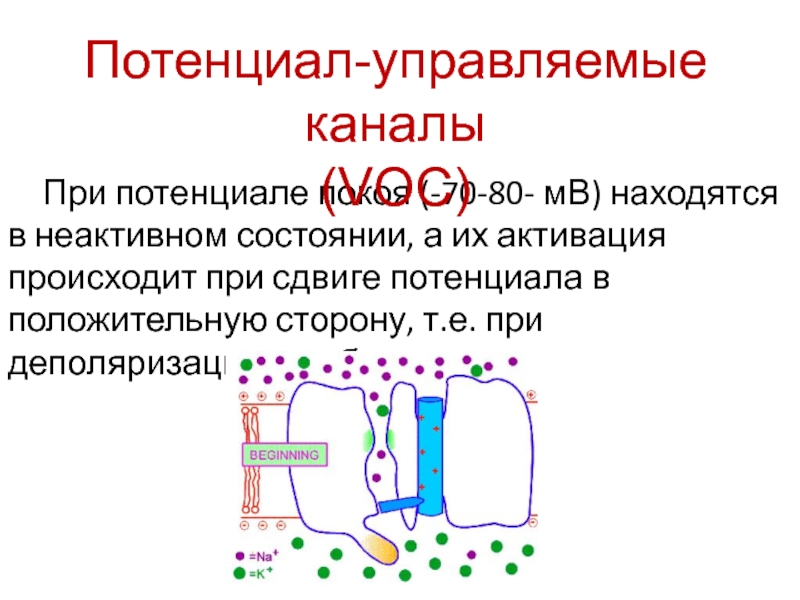
- 5. При потенциале покоя (-70-80- мВ) находятся в
- 6. Типа VOC, различающиеся по чувствительности к мембр.
- 7. Каналы L-типа, будучи активированы, сохраняют это
- 8. Каналы Т-типа открываются при существенно более
- 9. N-каналы (найдены в нейронах) активируются при
- 10. Каналы P-типа выявленные первоначально в нейронах Пуркинье
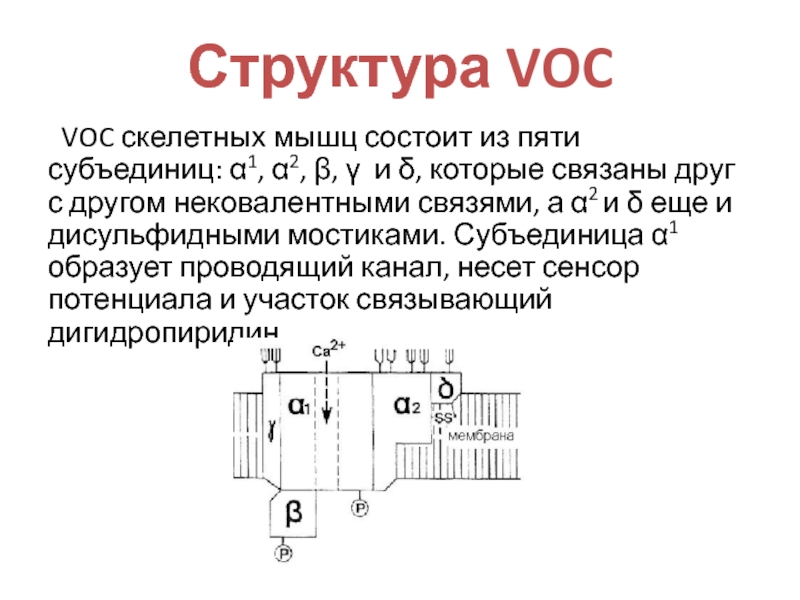
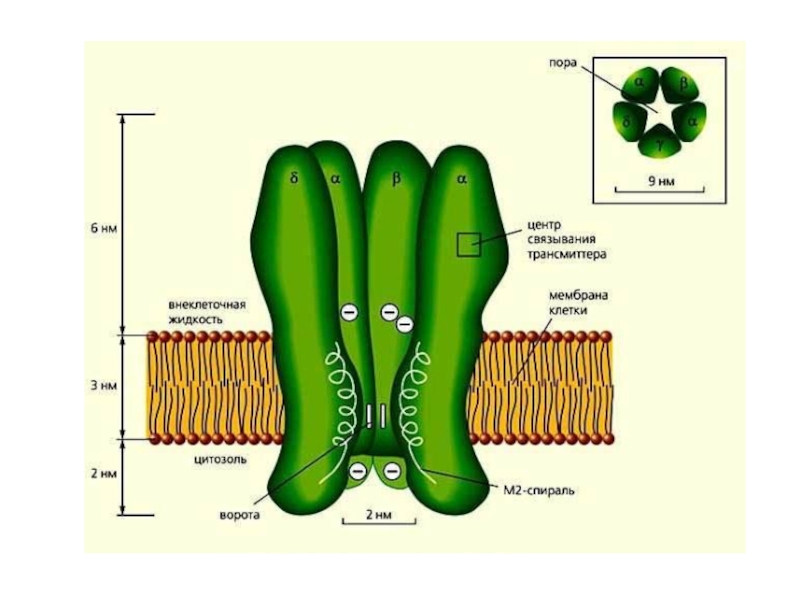
- 11. Структура VOC VOC скелетных мышц состоит из
- 12. Механизм перехода Ca2+ через канал Катион связывается
- 13. Блокаторы VOCПроизводные 1,4-дигидропиридинов ФенилалкиламиныКальцисептонинЛантаноиды Эффективность блокирования
- 14. Регуляция VOCG-белки, сопряженные с пуринорецепторами (каналы N-
- 15. Различают три подгруппы рецептор-управляемых ионных каналов,
- 16. Истинные рецептор-управляемые каналы Каналы,
- 17. Слайд 17
- 18. К числу истинных рецептор-управляемых каналов относятся:Каналы,
- 19. Са2+-каналы, активируемые вторичными посредниками. Са2+ каналы,
- 20. cGMP/cAMP-чувствительные каналы Представляют собой низкоселективные катионные каналы,
- 21. Са2+-каналы, регулируемые высвобождением Са2+ из внутренних депо
- 22. Поддерживает разницу концентраций цитоплазматического и внеклеточного
- 23. Ca-АТФаза саркоплазматического ретикулума ПП мышц. ЭНЕРГЕТИКА
- 24. Изменение свободной энергии при переносе двух
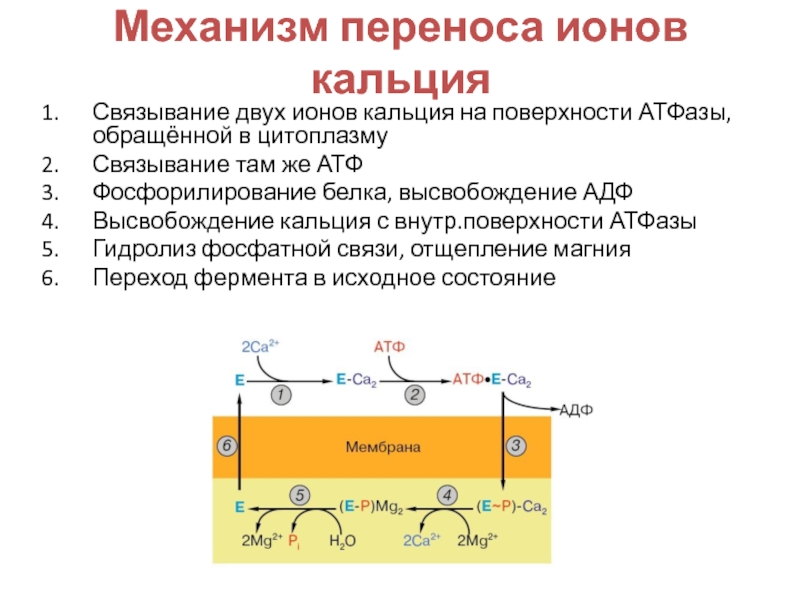
- 25. Механизм переноса ионов кальцияСвязывание двух ионов кальция
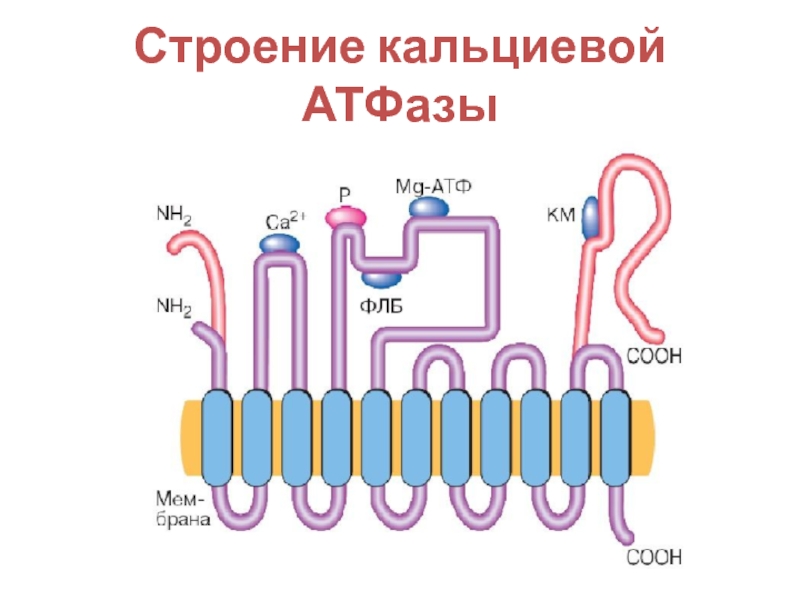
- 26. Строение кальциевой АТФазы
- 27. Различают АТФазы цитоплазматических мембран и эндоплазматического
- 28. Менее 1% ионов кальция, проникшего
- 29. Скачать презентанцию
Эукариотические клетки содержат системы транспорта кальция:В плазматической мембранеВ митохондрияхВ эндоплазматическом ретикулумеПлазматическая мембрана содержит три системы:Са2+-каналы. Специфичная АТФ-азаNa+-Сa2+ обменник.
Слайды и текст этой презентации
Слайд 2Эукариотические клетки содержат системы транспорта кальция:
В плазматической мембране
В митохондриях
В эндоплазматическом
ретикулуме
Слайд 3Осуществляется вход Сa2+по градиенту концентрации.
Повышение концентрации кальция в цитоплазме происходит
при открывании кальциевых каналов и входе Сa2+ в клетку.
При активации
каналы образуют мгновенные ионоселективные поры, через которые ионы кальция проникают внутрь клетки.Кальциевые каналы
Слайд 4Типы кальциевых каналов,классифицированные
на основе их регуляторного механизма
Потенциал-управляемые (VOC или VGCC)
Рецептор-управляемые
(ROC)
Управляемые опустошением ретикулярных кальциевых депо (SOC)
Слайд 5При потенциале покоя (-70-80- мВ) находятся в неактивном состоянии, а
их активация происходит при сдвиге потенциала в положительную сторону, т.е.
при деполяризации мембраны.Потенциал-управляемые каналы
(VOC)
Слайд 6Типа VOC, различающиеся по чувствительности к мембр. потенциалу и фармак.
веществам, а также по проводимости
L – тип (long-lasting)
T – тип
(transient)N – тип (neuron)
P – тип (нейроны Пуркинье)
Слайд 7 Каналы L-типа, будучи активированы, сохраняют это состояние довольно долго.
Их повторяющиеся открывание обеспечивают длительный кальциевый ток через мембрану.
Характерным
признаком кальциевых каналов L-типа является их чувствительность к дигидропиридинам и другим кальциевым антагонистам.Слайд 8 Каналы Т-типа открываются при существенно более отрицательном по сравнению
с каналами L-типа мембранном потенциале и быстро инактивируются. Для активации
каналов Т-типа также требуется кратковременная гиперполяризация, необходимая для того, чтобы снять эффект инактивации.Через каналы Т-типа в клетки поступает быстрая составляющая кальциевого тока. Эти два типа кальциевых каналов осуществляют вход Са2+ в клетки сердца.
Слайд 9 N-каналы (найдены в нейронах) активируются при переходе от очень
отрицательных значений мембранного потенциала к сильной деполяризации и регулируют секрецию
нейромедиаторов.Ток кальция через такие каналы в пресинаптических окончаниях ингибируется норадреналином через альфа-адренорецепторы.
Слайд 10Каналы P-типа выявленные первоначально в нейронах Пуркинье (от чего и
происходит их название), присутствуют в гранулярных клетках и в гигантских
аксонах кальмара. По-видимому, эти каналы также регулируют секрецию нейромедиаторов.Слайд 11Структура VOC
VOC скелетных мышц состоит из пяти субъединиц: α1,
α2, β, γ и δ, которые связаны друг с другом
нековалентными связями, а α2 и δ еще и дисульфидными мостиками. Субъединица α1 образует проводящий канал, несет сенсор потенциала и участок связывающий дигидропиридин.Слайд 12Механизм перехода Ca2+ через канал
Катион связывается с отрицательно заряженными
остатками Glu в устье канала.
Катион проходит по порообразующей структуре канала.
При деполяризации мембраны происходит сдвиг чувствительного сенсора, вызывающий конформационное изменение и открывание канала. Слайд 13Блокаторы VOC
Производные 1,4-дигидропиридинов
Фенилалкиламины
Кальцисептонин
Лантаноиды
Эффективность блокирования зависит от радиуса
катиона: чем меньше радиус, тем эффективнее блокирование.
Слайд 14Регуляция VOC
G-белки, сопряженные с пуринорецепторами (каналы N- и P-типа)
Жирорастворимые вторичные
мессенджеры (липоксигеназные метаболиты арахидоновой кислоты).
Протеинкиназы (каналы L-типа)
Слайд 15 Различают три подгруппы рецептор-управляемых ионных каналов, участвующих в транспорте
Са2+:
Истинные рецептор-управляемые каналы.
Каналы, активируемые вторичными посредниками.
Каналы, регулируемые высвобождением Са2+ из
внутренних депо.Рецептор-управляемые каналы
(ROC)
Слайд 16
Истинные рецептор-управляемые каналы
Каналы, в которых рецептор либо сам
выполняет функцию канала, либо непосредственно взаимодействует с канальной структурой.
Примером
такого канала является никотиновый холинорецептор, который представляет собой неселективный катионный канал. Канал проницаем для Са2+, однако в физиологических условиях он транспортирует преимущественно Na+ и K+.Слайд 18 К числу истинных рецептор-управляемых каналов относятся:
Каналы, активируемые глютаминовой кислотой
(NMDA-рецепторы). Условия открытия канала - связывание глутамата с рецептором и
деполяризация мембраны, приводящая к удалению Mg2+Каналы, активируемые адениновыми нуклеотидами (Р2-пуринорецепторы).
Слайд 19Са2+-каналы, активируемые вторичными посредниками.
Са2+ каналы, сопряжение которых
с рецепторами происходит при участии вторичных посредников.
В качестве активаторов
Са2+-транспортирующих каналов плазматической мембраны могут выступать инозитол-1,4,5-трисфосфат, инозитол-1,3,4,5-тетракисфосфат, ионы Са2+ и циклические нуклеотиды (cGMP и cAMP).Слайд 20cGMP/cAMP-чувствительные каналы
Представляют собой низкоселективные катионные каналы, активируемые циклическими нуклеотидами
с внутренней стороны мембраны.
Относятся к типу лиганд-активируемых каналов. Они
открываются при непосредственном связывании с ними циклических нуклеотидов - cGMP и cAMP/cGMP без участия протеинкиназ.Слайд 21Са2+-каналы, регулируемые высвобождением Са2+ из внутренних депо
Кальций входит
сначала в цитозоль, а потом закачивается во внутриклеточный пул, повышение
концентрации Ca2+ в котором приводит к прекращению входа.Каким образом может осуществляться сопряжение между входом Са2+ и внутриклеточными резервуарами, совершенно неясно. Неизвестен также механизм транспорта Са2+ через плазматическую мембрану.
Слайд 22 Поддерживает разницу концентраций цитоплазматического и внеклеточного кальция. Удаляют из
клетки кальций после «исполнения приказа».
Это группа кальциевых АТФаз, различающихся
по локализации, строению, способу регуляции. Все они переносят Са2+ за счёт энергии гидролиза АТФ.Мономерные белки, различающиеся по молекул. массе.
Ca-АТФаза
Слайд 23Ca-АТФаза саркоплазматического ретикулума ПП мышц.
ЭНЕРГЕТИКА
При гидролизе
одной молекулы АТФ Ca-АТФаза переносит 2 иона кальция из окружающей
среды внутрь везикул.Перенос ионов сопровождается переносом электрических зарядов, но разность потенциала на мембране не удерживается, потому что мембрана СР хорошо проницаема для других ионов.
Слайд 24 Изменение свободной энергии при переносе двух молей Са2+ равно
при 37 градусах 47,5 кДж/моль, что приблизительно равно энергии гидролиза
макроэргической связи АТФ при физиологических концентрациях АТФ, АДФ и ортофосфата.Следовательно, транспорт кальция осуществляется с высоким КПД, почти без потерь энергии.
Слайд 25Механизм переноса ионов кальция
Связывание двух ионов кальция на поверхности АТФазы,
обращённой в цитоплазму
Связывание там же АТФ
Фосфорилирование белка, высвобождение АДФ
Высвобождение кальция
с внутр.поверхности АТФазыГидролиз фосфатной связи, отщепление магния
Переход фермента в исходное состояние
Слайд 27 Различают АТФазы цитоплазматических мембран и эндоплазматического ретикулума.
Активность АТФазы
саркоплазматического ретикулума регулируется особым белком –фосфоламбаном.
Активность АТФазы цитоплазматической мембраны
регулируется белком кальмодулином. Слайд 28 Менее 1% ионов кальция, проникшего в цитозоль, остаётся
в несвязанном состоянии.
Кальций связывают:
Кальмодулин
Парвальбумин
Кальретенин
Буферы способствуют диффузии
ионов кальция в ЦП и распространению сигнала по клетке.Кальциевые буферы