Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение, свойства и функции аминокислот и белков
Содержание
- 1. Строение, свойства и функции аминокислот и белков
- 2. План лекцииСтруктура, свойства и функции аминокислотКлассификация аминокислотПриродные
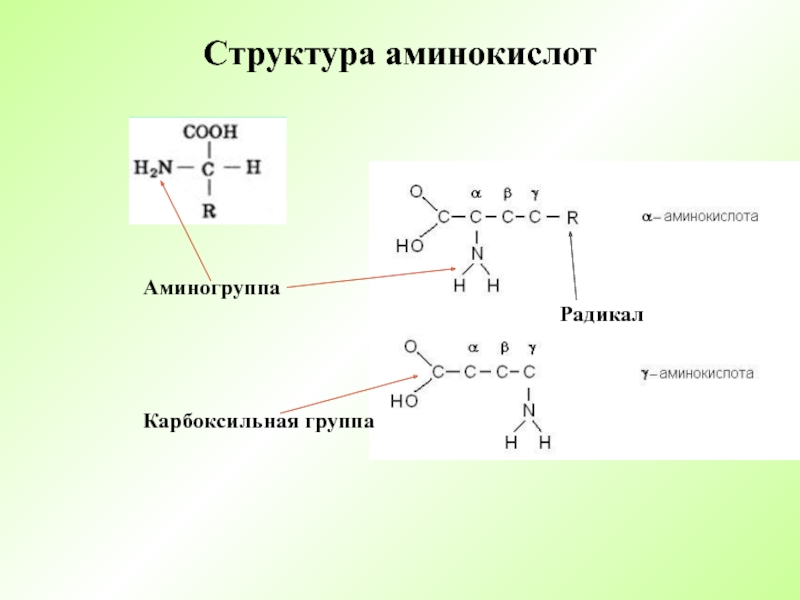
- 3. Структура аминокислотАминогруппа
- 4. Физические свойства аминокислотСтереоизомерия: L и D формы
- 5. Химические свойства: - образование пептидной связи;
- 6. Биологические функции аминокислотМономеры белковВходят в состав природных
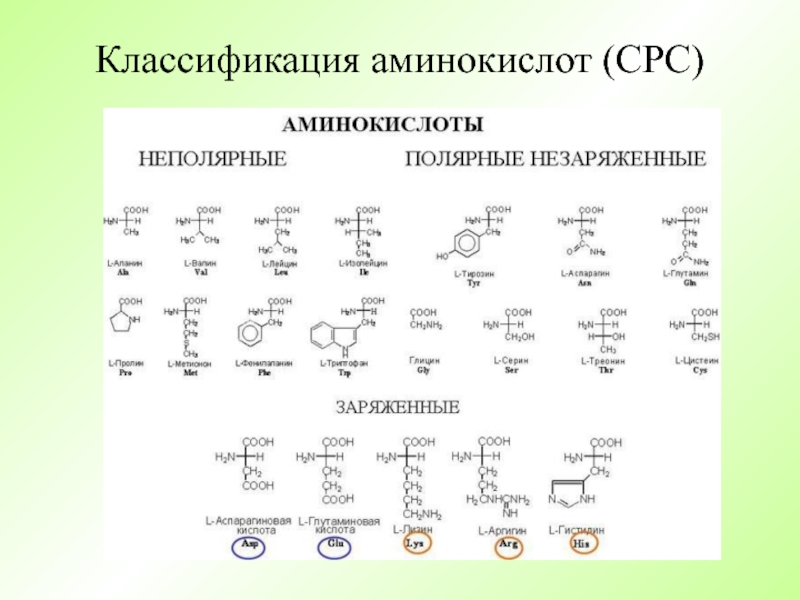
- 7. Классификация аминокислот (СРС)
- 8. Классификация аминокислот по биологическому и физиологическому значению
- 9. Классификация по структуре радикала (СРС)Алифатические монокарбоновые кислоты:
- 10. Природные пептидыДве аминокислоты образуют дипептид: карнозин, ансерин
- 11. Белки – высокомолекулярные азотосодержащие органические полимеры. Это
- 12. Размеры белков IgG, гемоглобин, инсулин, аденилаткиназа, глутаминсинтаза150 kD, 16 kD, 5,5 kD,
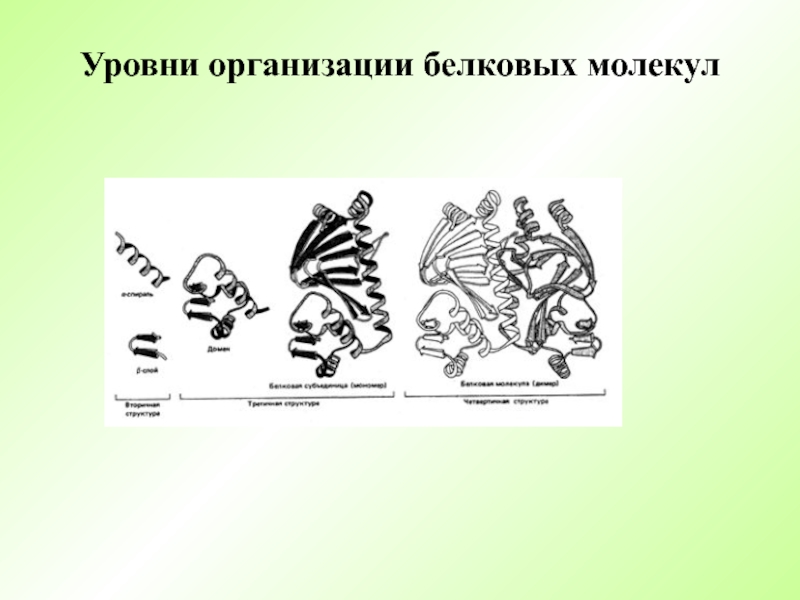
- 13. Уровни организации белковых молекул
- 14. Структурная организация белков Первичная Вторичная Третичная Четвертичная
- 15. Вторичная структура α-спираль и β - складчатый
- 16. Конформация белка («сворачивание» белка – образование глобулы)
- 17. Биологическая роль белковПластическая: миозин, актин, коллагенКаталитическая: ферментыРегуляторная:
- 18. Классификация белков
- 19. Сложные белки имеют простетические группы Гликопротеины (содержат
- 20. Классификация белков по функциямСтруктурные – входят в
- 21. Физико-химические свойства белков Высокий молекулярный вес: 16
- 22. Методы выделения и очистки белковгомогенизация - клетки
- 23. Методы выделения белковВысаливание белков: (NH4)SO4 - снимается
- 24. Денатурация Денатурация – это нарушение пространственной структуры белка
- 25. РенатурацияРенатурация – восстановление нативной пространственной структуры и
- 26. Методы выделения и очистки белков экстракция белков
- 27. Белковые препараты в медицинеγ-глобулинИммуномодулятор – интерферонГормоны –
- 28. Скачать презентанцию
План лекцииСтруктура, свойства и функции аминокислотКлассификация аминокислотПриродные пептидыСтроение, свойства и функции белковКлассификация белковМетоды разделения белковБелковые препараты в медицине
Слайды и текст этой презентации
Слайд 2План лекции
Структура, свойства и функции аминокислот
Классификация аминокислот
Природные пептиды
Строение, свойства и
функции белков
Слайд 4Физические свойства аминокислот
Стереоизомерия: L и D формы –
энантиомеры (хиральный центр)
Изоэлектрическая точка рI – значение рН, при
котором суммарный заряд аминокислоты равен нулю (цвиттер-ион).рIАЛА=6,02
Растворимость – растворяются в полярных растворителях (вода)
Температура плавления выше 200оС
Ионные: катионная и анионная формы (в зависимости от рН):
в кислой: –СООН, -NH3+;
в нейтральной: –СОО-, -NH3+ ;
в щелочной: –СООН, -NH2
Слайд 5Химические свойства: - образование пептидной связи; - цветные реакции; - реакции, свойственные
функциональным группам
Связь называется пептидной (1902г. – Г.Э.Фишер) от греческого пепсис
– пищеварение, т.к. эта связь гидролизуется пищеварительным ферментом желудочного сока пепсином. По природе пептидная связь является ковалентной. Слайд 6Биологические функции аминокислот
Мономеры белков
Входят в состав природных соединений (кофермента КоА
– β-аланин; желчных кислот - глицин и др.)
Переносчики сигналов:
ГЛУ, АСП, ГЛИ Метаболиты: ГЛН донор азота при синтезе нуклеиновых кислот
Являются предшественниками биологически активных веществ: ГИС – предшественник гистамина
Слайд 8Классификация аминокислот по биологическому и физиологическому значению (СРС)
Заменимые: ГЛИ, АЛА,
ПРО, АСП, АСН, ГЛУ, ГЛН, СЕР, ТИР, ЦИС
Незаменимые: ВАЛ,
ЛЕЙ, ИЛЕ, ЛИЗ, ФЕН, ТРП, МЕТ, ТРЕ Частично заменимые: АРГ, ГИС - незаменимые для детей; ТИР – незаменимая при фенилкетонурии у детей
Слайд 9Классификация по структуре радикала (СРС)
Алифатические монокарбоновые кислоты: гли, ала, вал,
лей, илей.
Оксиаминокислоты (алифатические) : сер, тре.
Серосодержащие: цис, мет.
Основные (диаминомонокарбоновые): лиз,
арг, гис.Кислые (моноаминодикарбоновые): аспарагиновая, глутаминовая, у них есть амиды (асн, глн).
Ароматические: фен, тир.
Гетероциклические: гис, три.
Иминокислота: про.
Слайд 10Природные пептиды
Две аминокислоты образуют дипептид: карнозин, ансерин – в мышечной
ткани
три аминокислоты – трипептид: глутатион
Пептиды, содержащие до 10
аминокислот, называют олигопептидами: окситоцин, вазопрессин (9), энкефалины, эндорфины, а до 50 — полипептидами: глюкагон (29), Полипептиды, содержащие более 50 аминокислот, уже называют белками: инсулин (51).
Слайд 11Белки – высокомолекулярные азотосодержащие органические полимеры. Это гетерополимеры (нерегулярные полимеры),
состоящие из 20 мономеров – природных альфа-аминокислот.
С ними связаны
следующие свойства живого: Способность к воспроизведению.
Сократимость и движение.
Обмен веществ (распад и обновление составных частей живого организма) с участием белков-ферментов.
Слайд 12Размеры белков
IgG, гемоглобин, инсулин, аденилаткиназа, глутаминсинтаза
150 kD, 16 kD,
5,5 kD,
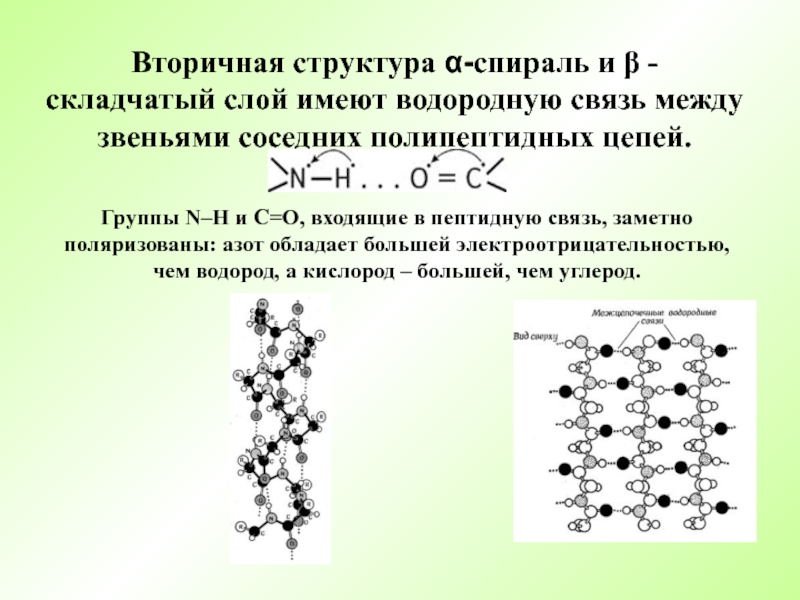
Слайд 15Вторичная структура α-спираль и β - складчатый слой имеют водородную
связь между звеньями соседних полипептидных цепей.
Группы N–H и С=О, входящие
в пептидную связь, заметно поляризованы: азот обладает большей электроотрицательностью, чем водород, а кислород – большей, чем углерод. Слайд 17Биологическая роль белков
Пластическая: миозин, актин, коллаген
Каталитическая: ферменты
Регуляторная: инсулин
Защитная: иммуноглобулины
Транспортная: ферритин
Пищевая
и запасная (резервная): Яичный альбумин, казеин молока, глиадин пшеницы
Рецепторная: белки
биомембранПоддерживают рН крови: белковый и гемоглобулиновый буфер
Поддерживают онкотическое давление крови
Когенетическая: участвуют в хранении и передачи генетической информации
Слайд 19Сложные белки имеют простетические группы
Гликопротеины (содержат углеводы).
Липопротеины (содержат
липиды).
Фосфопротеины (содержат фосфорную кислоту).
Хромопротеины (содержат окрашенную простетическую группу).
Металлопротеины (содержат ионы различных металлов).
Нуклеопротеины (содержат нуклеиновые кислоты).
Слайд 20Классификация белков по функциям
Структурные – входят в различные структуры клетки
и организма.
Ферменты – являются биологическими катализаторами.
Гормоны – являются регуляторами биологических
функций.Транспортные – переносят различные вещества.
Защитные – обеспечивают иммунные реакции организма.
Сократительные – участвуют в сокращении мышечных волокон.
Запасные – служат резервными веществами клетки и организма.
Токсины – являются ядами, используемыми живыми существами в целях защиты или нападения.
Слайд 21Физико-химические свойства белков
Высокий молекулярный вес: 16 000-1 000 000:
высокая вязкость, способность к набуханию, низкое осмотическое, высокое
онкотическое давлениеАмфотерность и подвижность в электромагнитном поле: заряд белковой молекулы обусловлен наличием гидрофильных группировок аминокислот (-СООН, -ОН,
-NH2, -SH) и может меняться в зависимости от РН. Белки бывают кислыми и основными.
Оптическая активность и способность к поглощению УФ
pI – значение рН, при котором суммарный заряд белка равен 0, у большинства варьирует от 5,5 до 7:
рI пепсина равен 1, сальмина – 12
Слайд 22Методы выделения и очистки белков
гомогенизация - клетки растираются до однородной
массы;
экстракция белков водными или водно-солевыми растворами;
диализ;
высаливание;
электрофорез;
хроматография: адсорбция, расщепление;
ультрацентрифугирование.
Слайд 23Методы выделения белков
Высаливание белков: (NH4)SO4 - снимается гидратная оболочка, белок
сохраняет свою структуру, все связи, нативные свойства.
Такие белки можно затем вновь растворить и использовать.Осаждения с потерей нативных свойств белка - процесс необратимый. С белка снимается гидратная оболочка и заряд, при этом нарушаются свойства.
Слайд 24Денатурация
Денатурация – это нарушение пространственной структуры белка и изменение нативных
свойств белка при воздействии на них определенных агентов.
При денатурации
белок перестает функционировать. нарушается четвертичная, третичная и вторичная структура, первичная структура не изменяется,
Факторы, вызывающие денатурацию:
Физические: термические (кипячение); радиоактивное излучение.
Химические: кислоты, - HNO3, H2SO4, HCl, щелочи - NaOH, соли тяжелый металлов - меди, ртути, мышьяка, органические соединения – токсины, алкалоиды – танины и др.