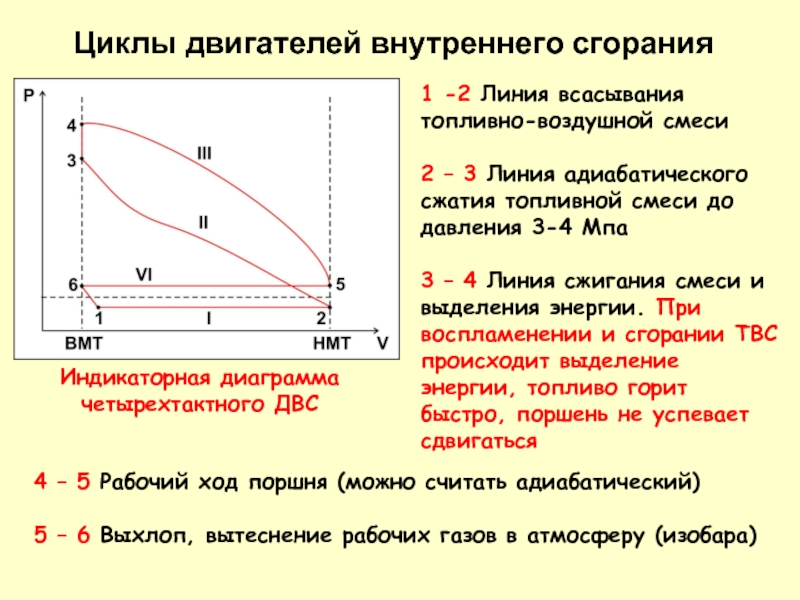
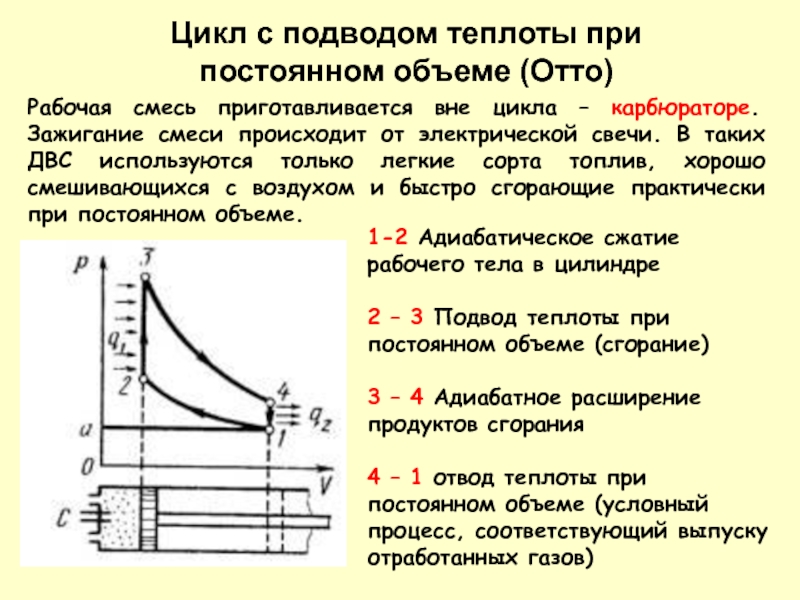
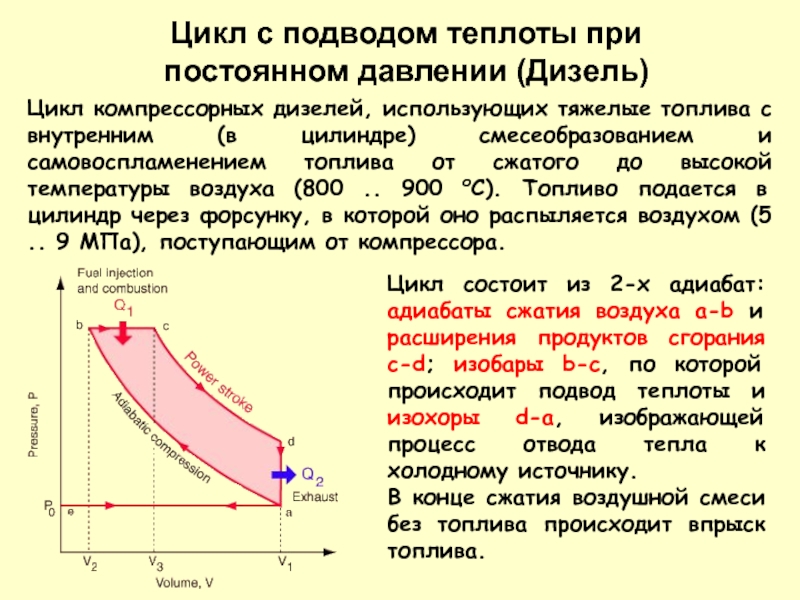
ней не затухают все необратимые процессы. В этом случае энтропия
достигает максимального значения. Следовательно, условие устойчивости состояния термодинамической системы можно сформулировать как: Если энтропия адиабатически изолированной термодинамической системы принимает максимальное значение, то ее состояние термодинамически устойчиво.Принцип Ле-Шателье - Брауна
При устойчивом термодинамическом равновесии энтропия адиабатически изолированной системы имеет экстремум: S = S, где S - энтропия системы в состоянии термодинамического равновесия. Следовательно, в состоянии устойчивого равновесия первая вариация энтропии изолированной термодинамической системы S = 0, а вторая ее вариация - S2 < 0. Условие равенства нулю первой вариации энтропии дает необходимое условие равновесия изолированной системы, а неравенство
S2 < 0 - достаточное условие устойчивости равновесного состояния