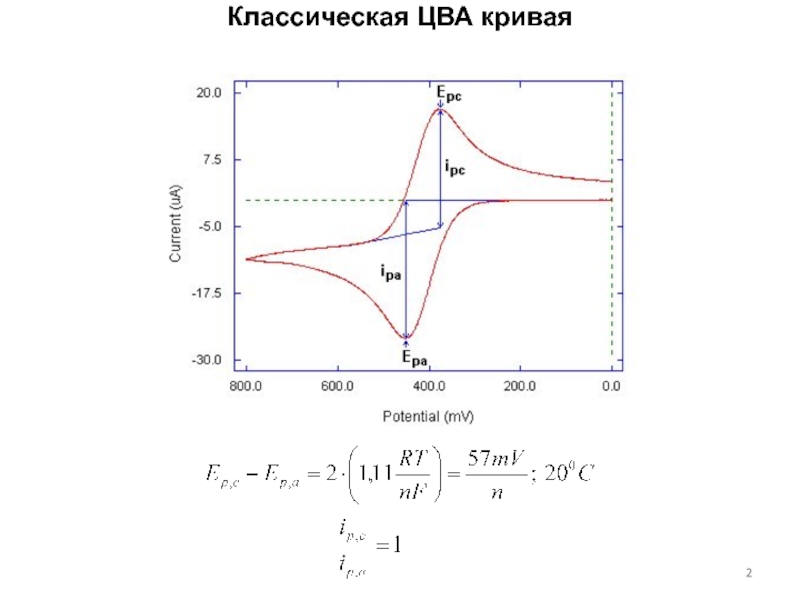
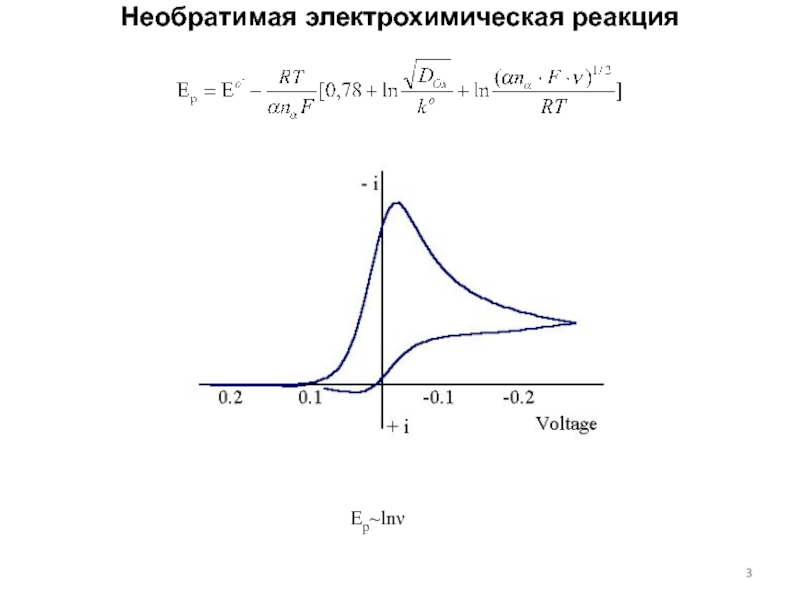
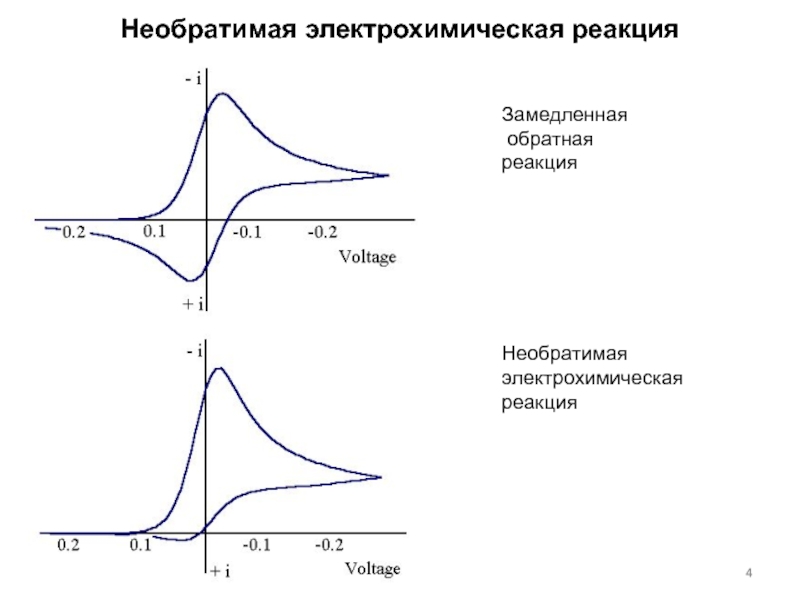
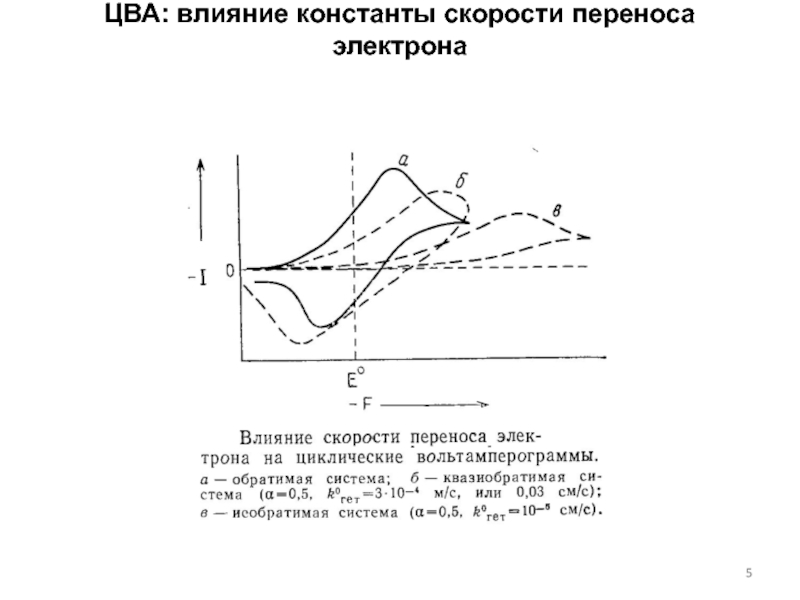
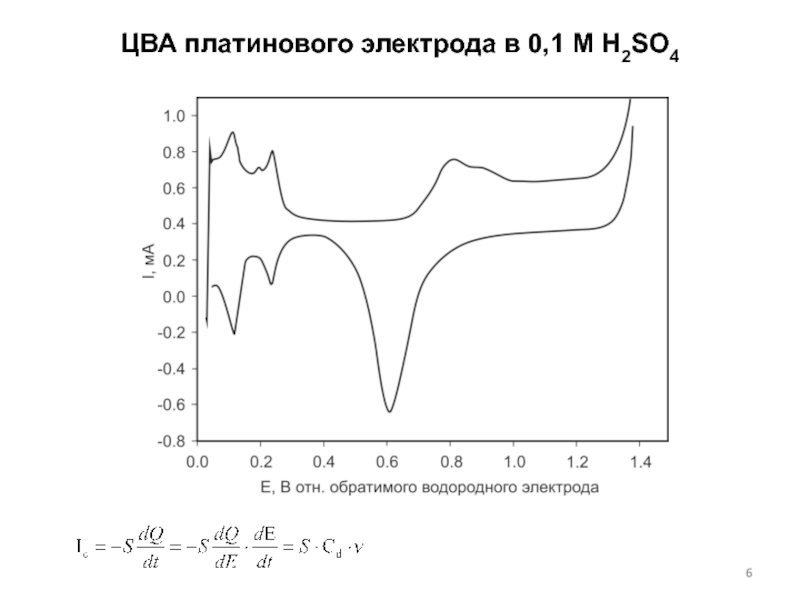
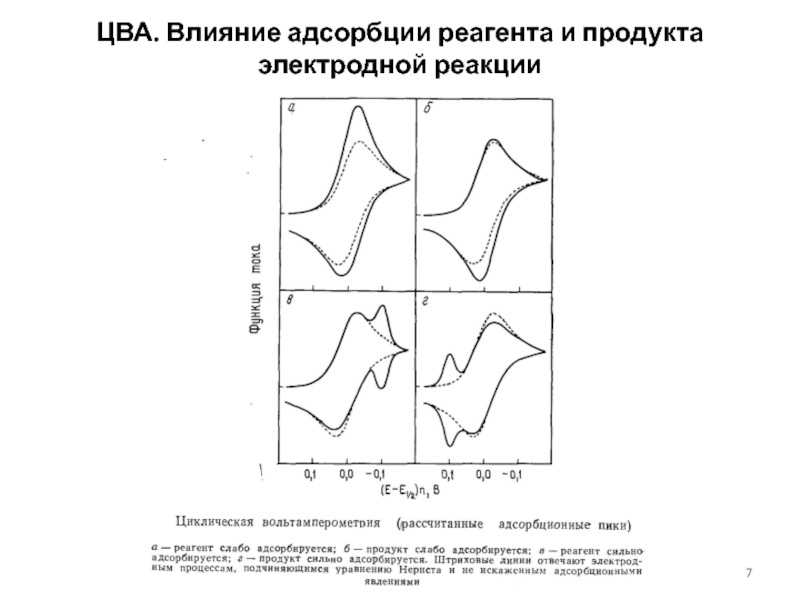
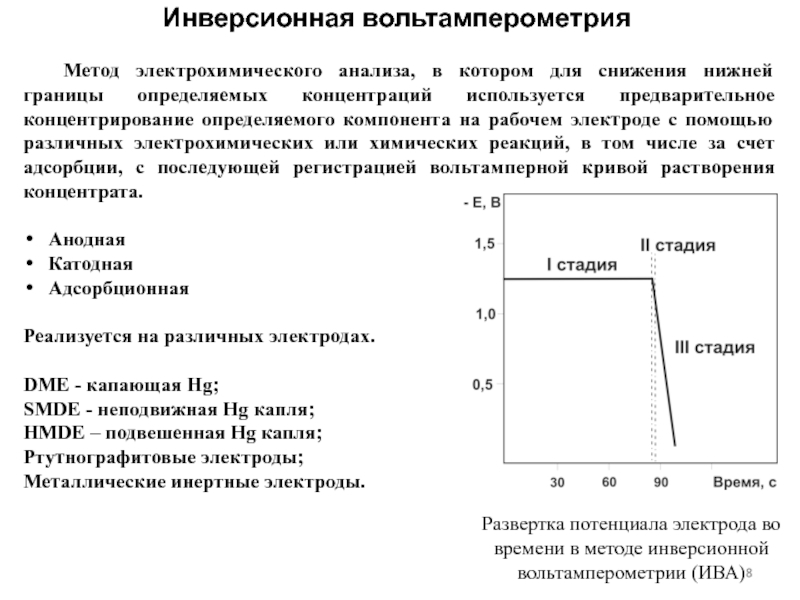
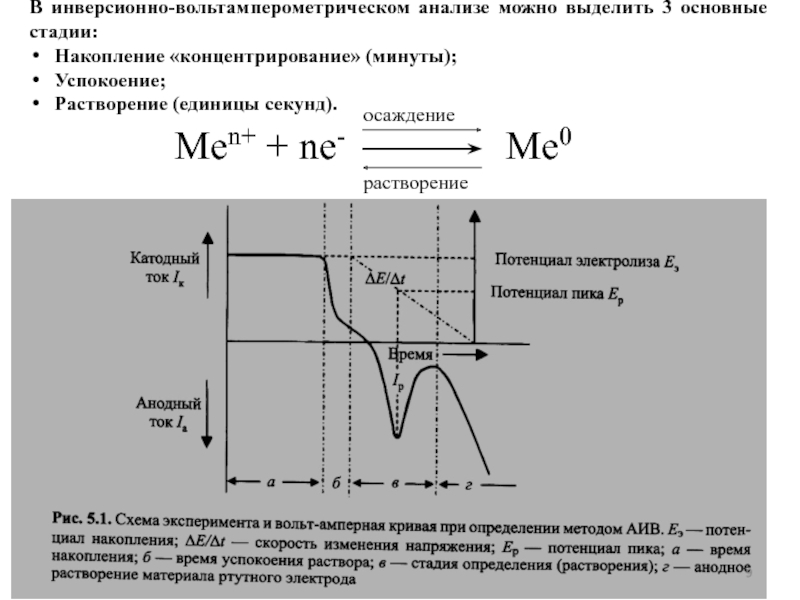
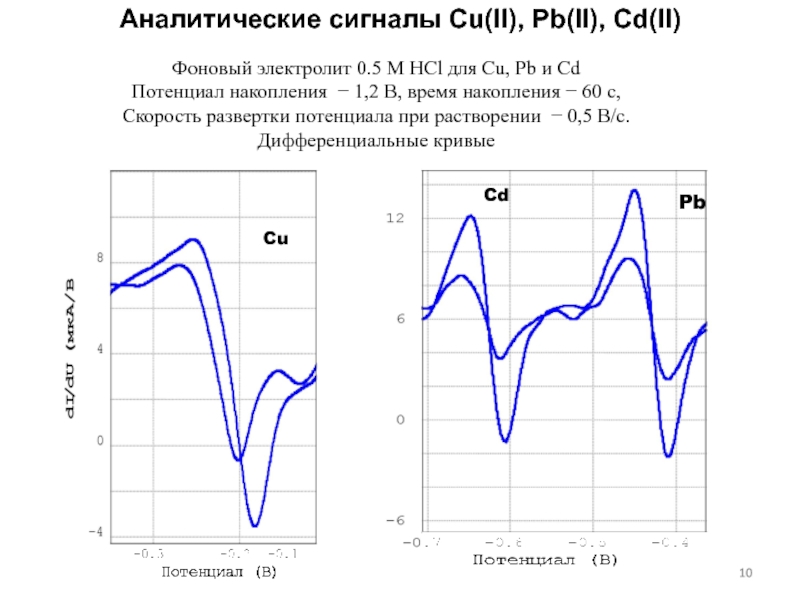
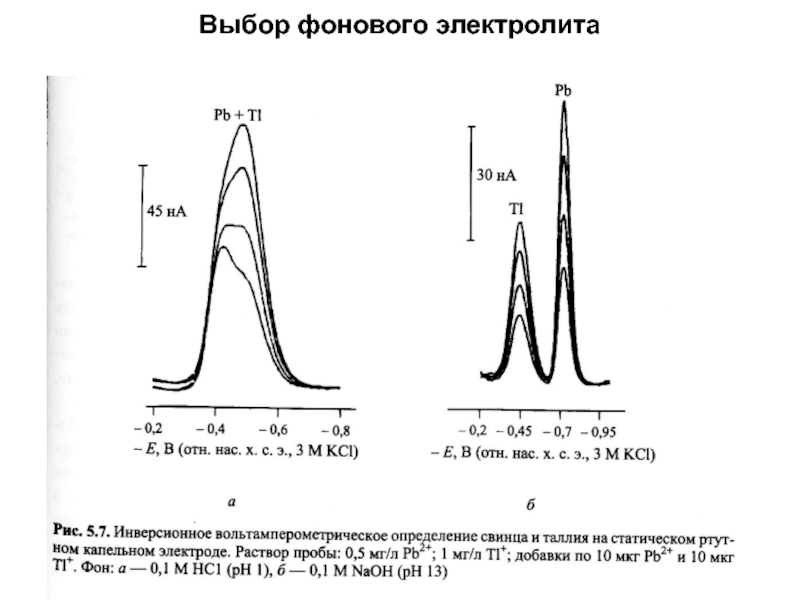
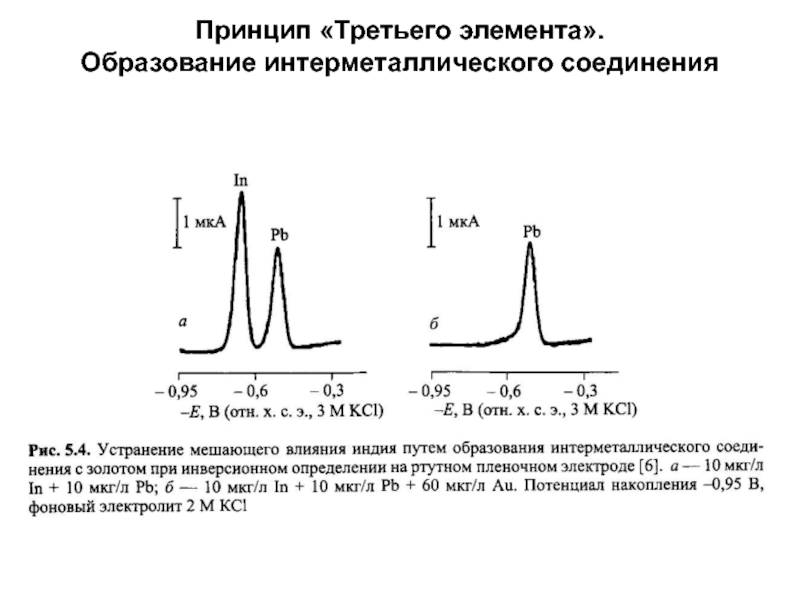
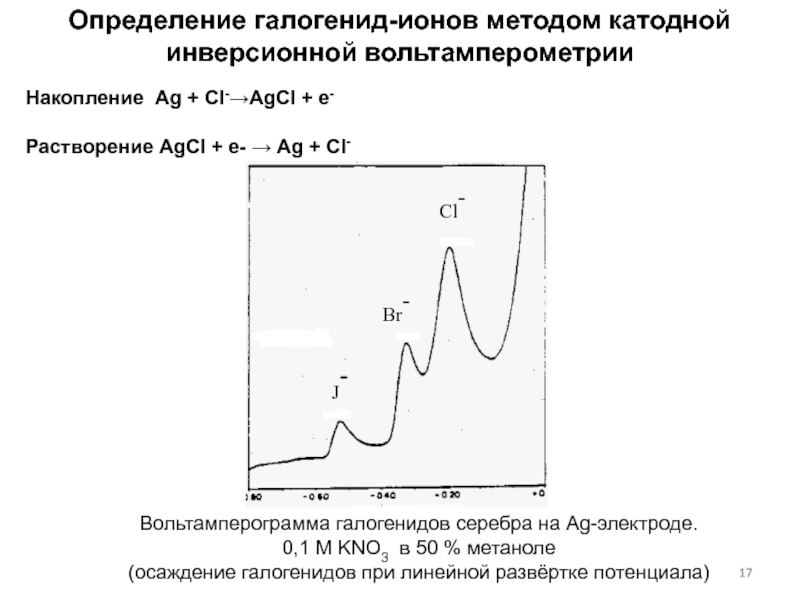
концентраций используется предварительное концентрирование определяемого компонента на рабочем электроде с
помощью различных электрохимических или химических реакций, в том числе за счет адсорбции, с последующей регистрацией вольтамперной кривой растворения концентрата.Анодная
Катодная
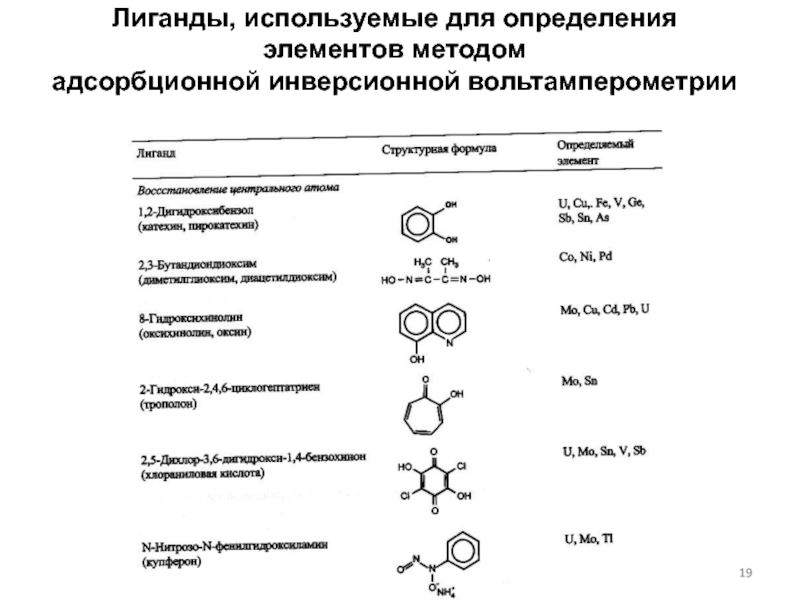
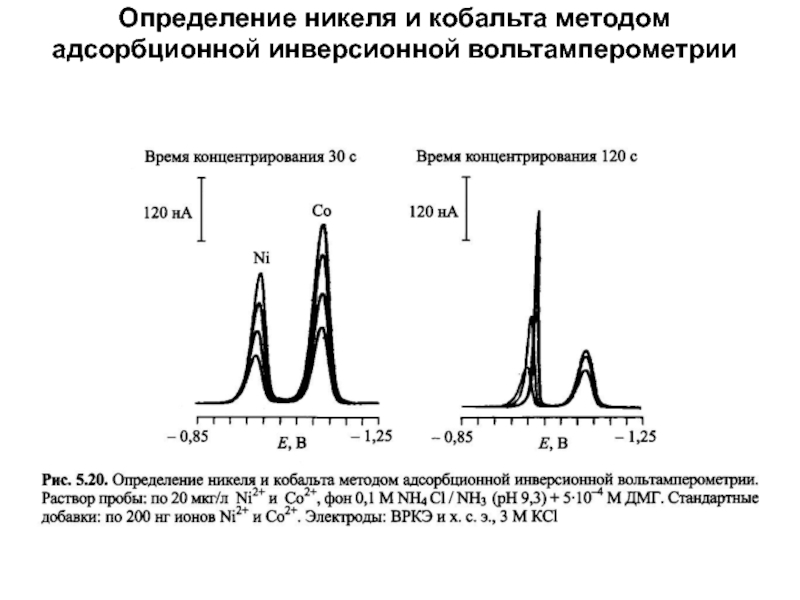
Адсорбционная
Реализуется на различных электродах.
DME - капающая Hg;
SMDE - неподвижная Hg капля;
HMDE – подвешенная Hg капля;
Ртутнографитовые электроды;
Металлические инертные электроды.
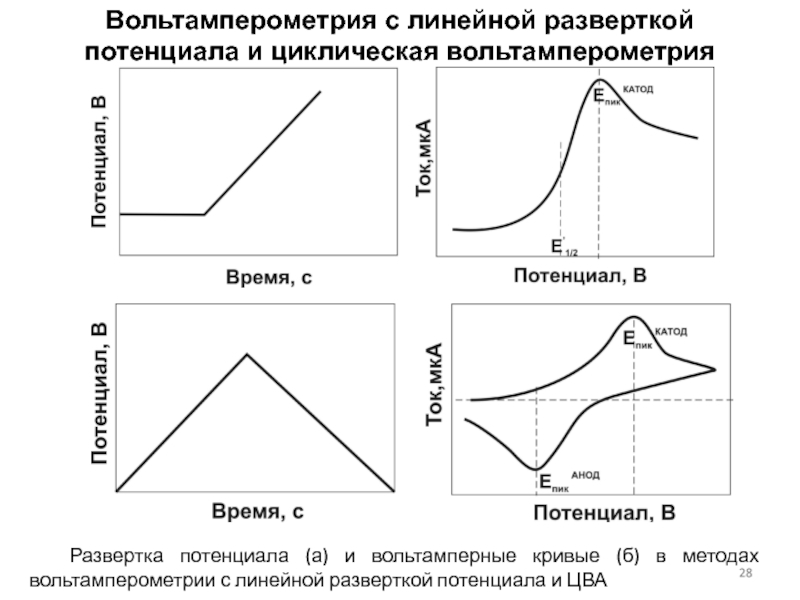
Инверсионная вольтамперометрия
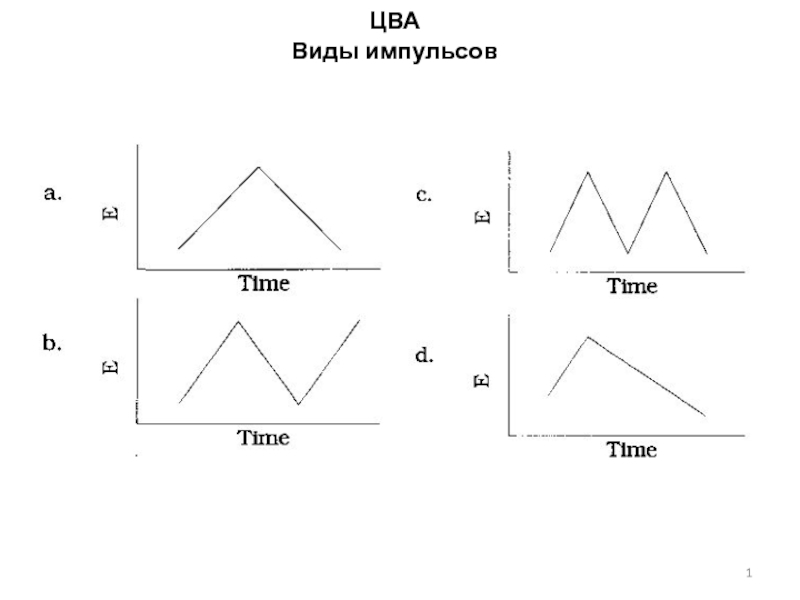
Развертка потенциала электрода во времени в методе инверсионной вольтамперометрии (ИВА)