Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углеводороды нефти
Содержание
- 1. Углеводороды нефти
- 2. Общая формула алканов СnH2n+2
- 3. Слайд 3
- 4. ГазыСH4 метанС2H6 этанС3H8 пропанС4H10 бутан
- 5. жидкостиС5H12 пентан…..С15H32 пентадекан
- 6. Твердые веществаНачиная с С16Н34
- 7. Газообразные парафиновые углеводороды входят в состав природных
- 8. природные газы газы газоконденсатных месторождений попутные газы
- 9. Примерный состав природного газа
- 10. Примерный состав попутного нефтяного газа
- 11. Примерный состав газов газоконденсатных месторождений
- 12. Газообразные парафины дают комплексы с водой, они
- 13. Молекулы газов включаются в полости, образующиеся в кристаллической решетке воды.
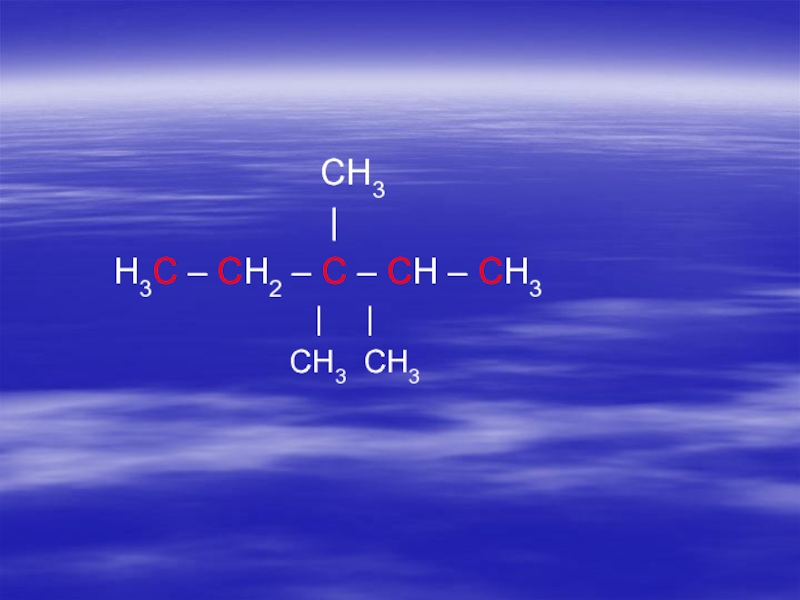
- 14. Систематическая номенклатура алканов (ИЮПАК; JUPAC;
- 15. Слайд 15
- 16. Слайд 16
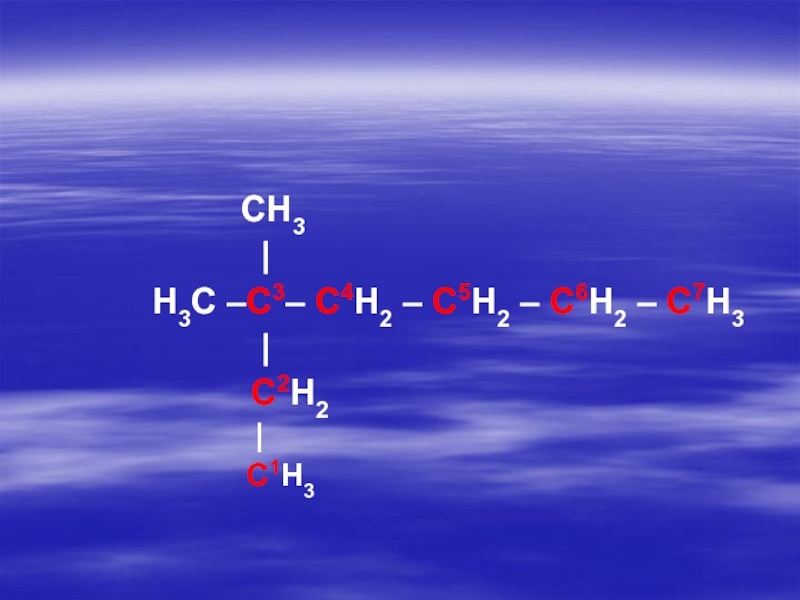
- 17. 2. Нумеруют атомы углерода в цепи,
- 18. Формулы и названия радикалов
- 19. Слайд 19
- 20. Слайд 20
- 21. 3. Перечисляют все радикалы (в порядке
- 22. Слайд 22
- 23. Слайд 23
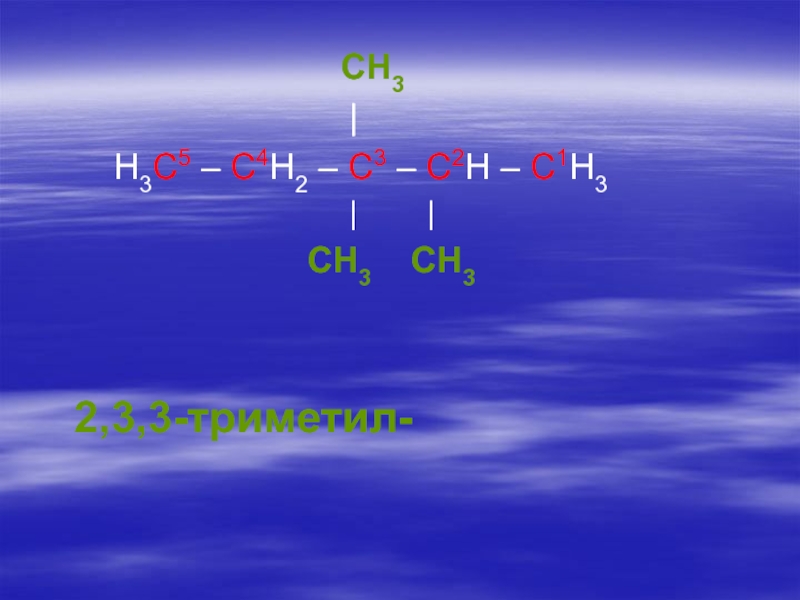
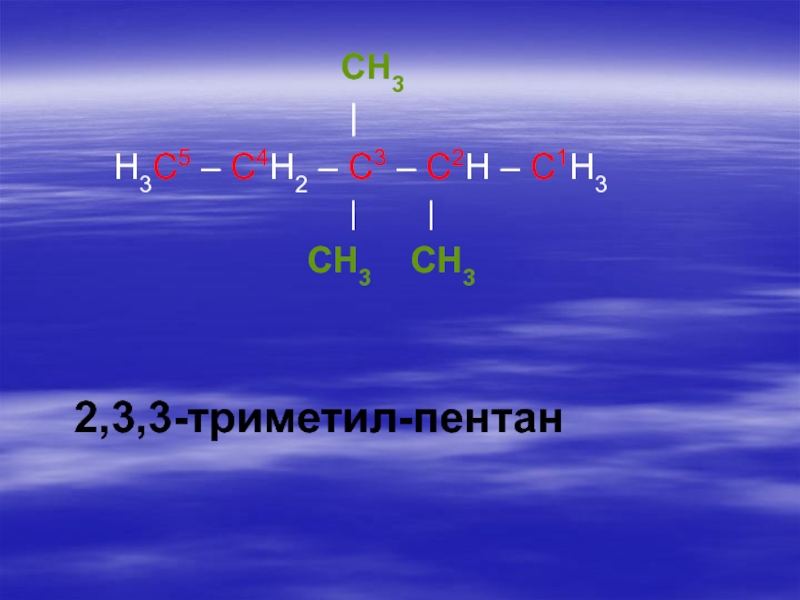
- 24. 4. Дают название пронумерованной цепи, которое соответствует
- 25. Слайд 25
- 26. Слайд 26
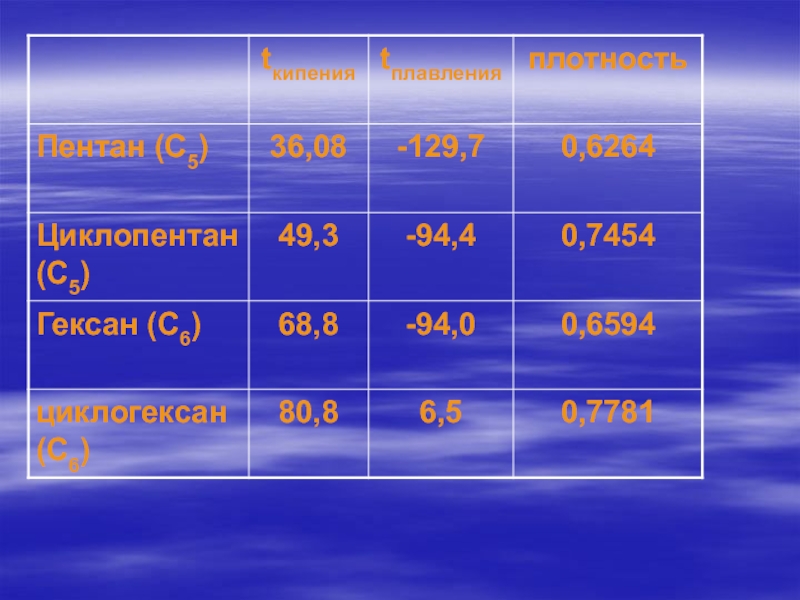
- 27. Физические свойства алканов
- 28. Вывод: Среди алканов нормального строения с ростом числа атомов углерода в молекуле растут:температура кипениятемпература плавленияплотность
- 29. Физические свойства алканов
- 30. Вывод: Среди алканов одинакового состава, но разного
- 31. Углеводороды нефтиЦиклоалканы. Нафтены.Содержание в нефтях в среднем 25-80%
- 32. ЦиклопропанЦиклобутанЦиклопентанЦиклогексанМоноциклические нафтены (СnH2n)
- 33. ИЗОМЕРИЯ
- 34. Слайд 34
- 35. Слайд 35
- 36. Слайд 36
- 37. Бициклические нафтены СnH2n-2Конденсированного типаСочлененного типаИзолированного типа(CH2)
- 38. Мостикового типа
- 39. Слайд 39
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Спироспиро [3,4] октан
- 44. Трициклические нафтены CnH2n-4ПергидроантраценПергидрофенантренадамантан
- 45. Моноциклические нафтены содержатся во фракциях выкипающих до
- 46. Физические свойства нафтенов Нафтены имеют более
- 47. Слайд 47
- 48. Введение метильной группы в молекулу нафтена резко
- 49. Химические свойства нафтеновРеакция дегидрогенизации.Реакция была открыта и
- 50. Циклогексан и его гомологи в присутствии Pt,
- 51. Образование комплексов с тиомочевинной Нафтеновые углеводороды образуют
- 52. Изомеризация Алкилпроизводные нафтенов с достаточно длинной
- 53. Слайд 53
- 54. В присутствии кислот Льюиса (AlCl3, AlBr3) происходит
- 55. Реакция окисления. Устойчивость к кислороду у нафтенового
- 56. Нафтены имеют более высокие октановые числа чем соответствующие им алканы
- 57. Автомобильные бензиныВ бензиновых фракциях содержатся моноциклические производные
- 58. Циклопентан содержится в очень небольших количествах (до
- 59. Углеводороды нефтиАроматические углеводороды. Арены.Содержание в нефтях в среднем 10-20%
- 60. Одноядерные арены СnH2n-6БензолРадикал бензола -ФЕНИЛ
- 61. Толуол Метил-бензол
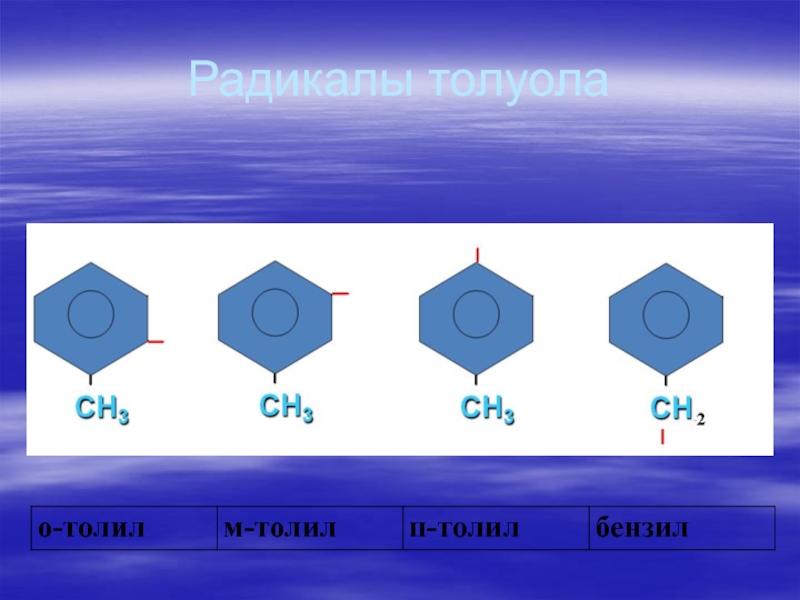
- 62. Радикалы толуола
- 63. СН3 1,2-диметилбензолПоложение 1,2-ортоО-диметилбензол о-ксилолСН3
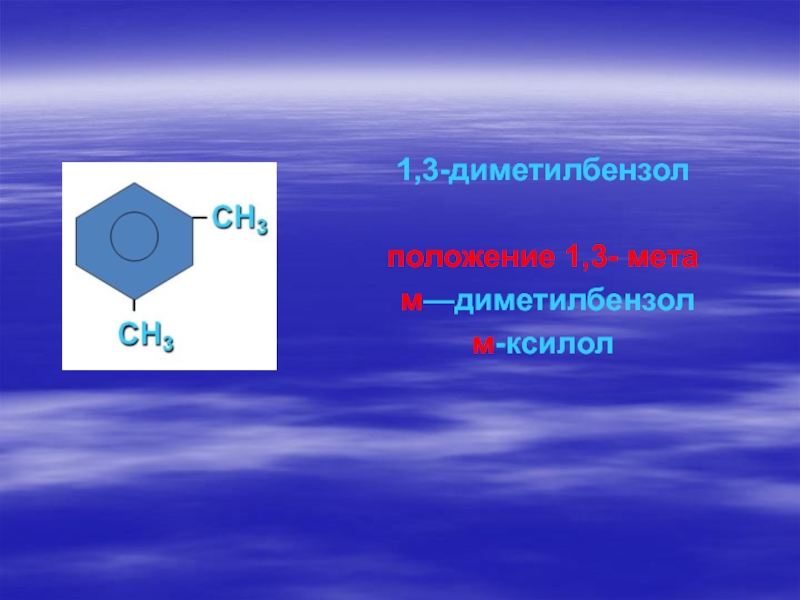
- 64. 1,3-диметилбензолположение 1,3- мета м—диметилбензолм-ксилол
- 65. 1,4-диметилбензол положение 1,4 –парап-диметилбензол п-ксилол
- 66. Многоядерные арены ДвухядерныеНафталин
- 67. дифенилметан
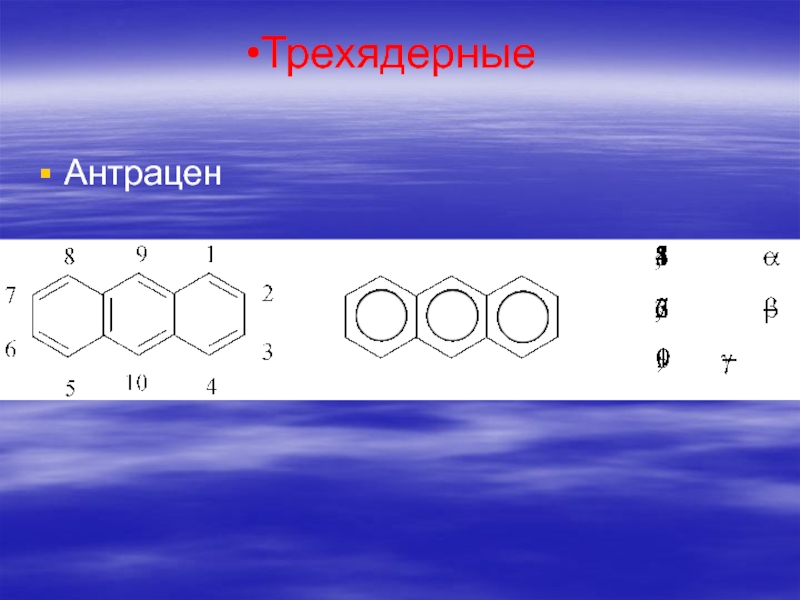
- 68. Трехядерные Антрацен
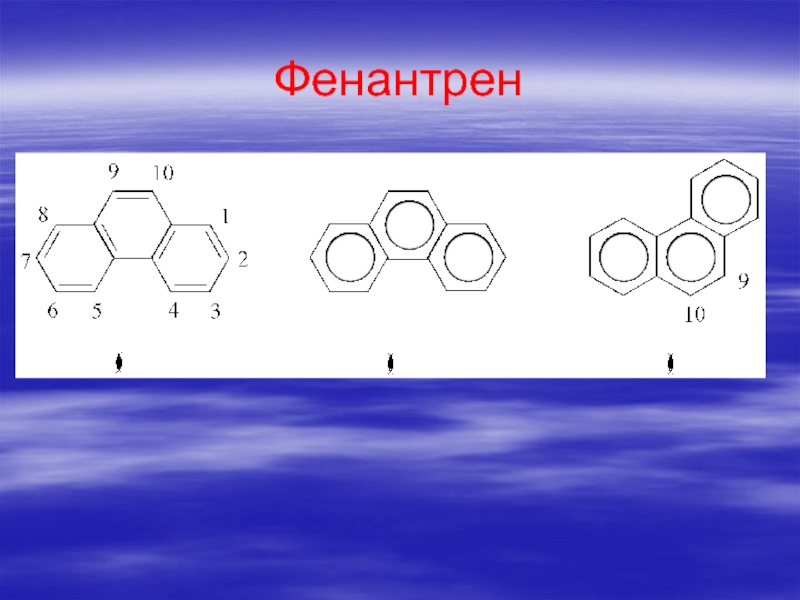
- 69. Фенантрен
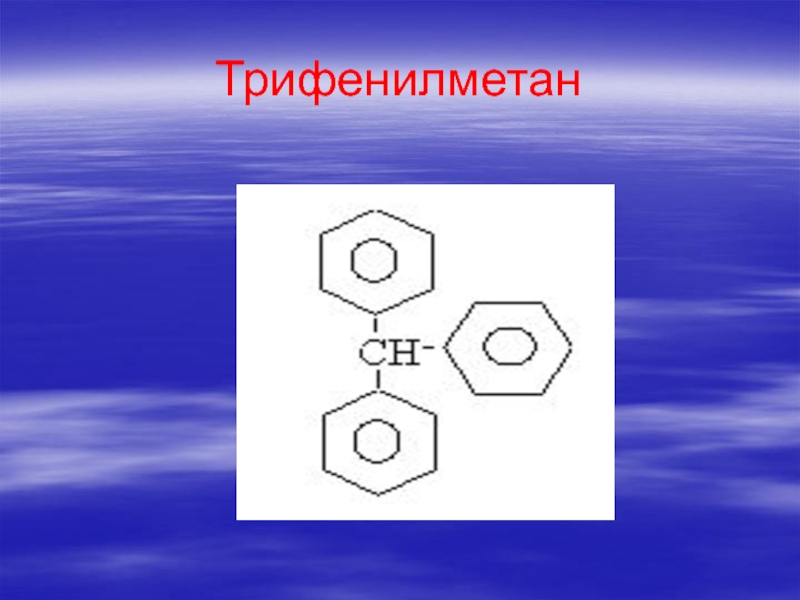
- 70. Трифенилметан
- 71. ЧетырехядерныеХРИЗЕН
- 72. ПИРЕН
- 73. Слайд 73
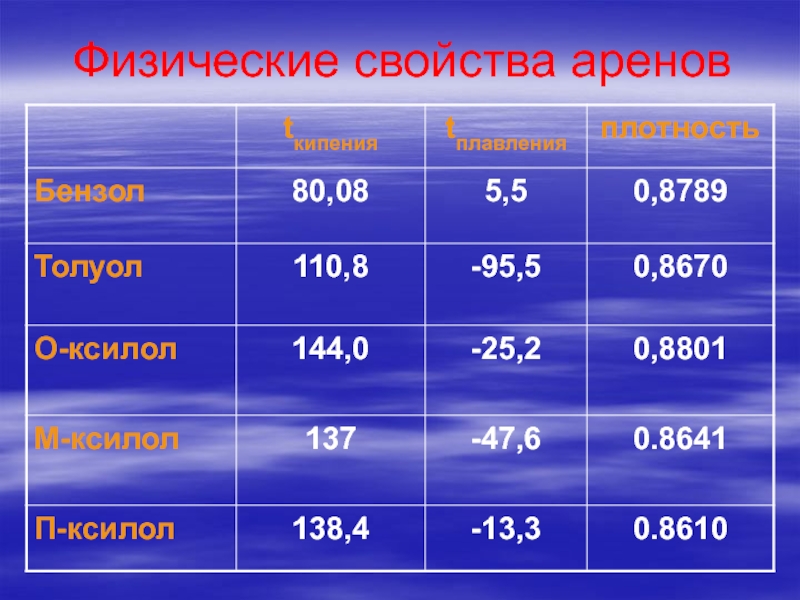
- 74. Физические свойства аренов
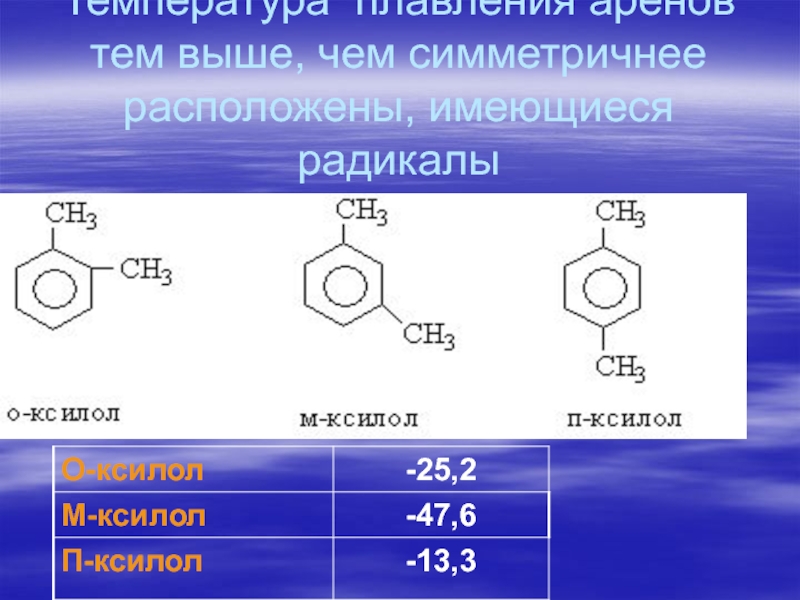
- 75. Температура плавления аренов тем выше, чем симметричнее расположены, имеющиеся радикалы
- 76. На температуру плавления в многоядерных конденсированных системах влияет взаимное расположение колец
- 77. Линейное расположение колец – антрацен (tплавления 2160С) Ангулярное расположение колец – фенантрен (tплавления990С)
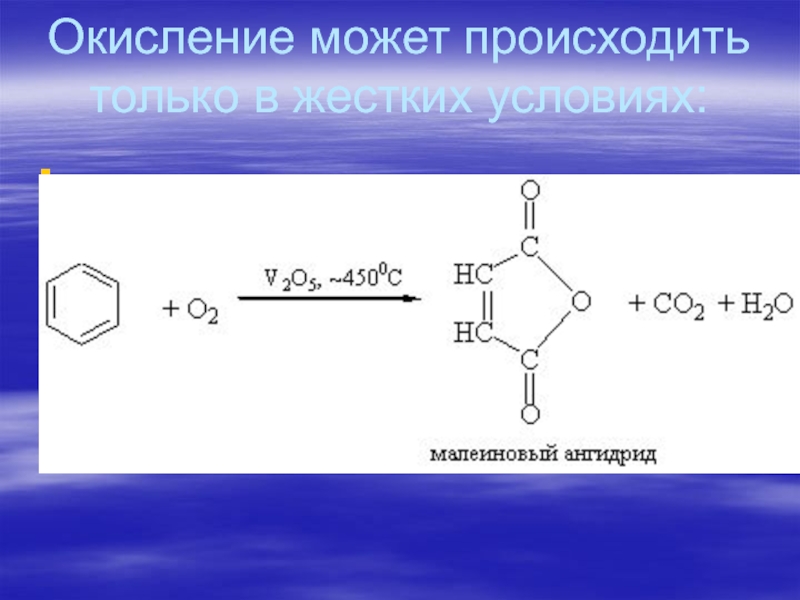
- 78. Окисление бензолаБензол не окисляется при нагревании такими сильными окислителями как концентрированные растворы KMnO4, K2Cr2O7, концентрированной HNO3.
- 79. Окисление может происходить только в жестких условиях:
- 80. Гомологи бензола окисляются значительно легче, чем бензол, по С–Н связям в α-положении радикала.
- 81. Александр Флавианович ДобрянскийВ зависимости от содержания и распределения аренов подразделил нефти на три класса
- 82. Первый класс – с плотностью 0,900Второй класс - с плотностью 0,850-0,900Третий класс- с плотностью менее 0,850
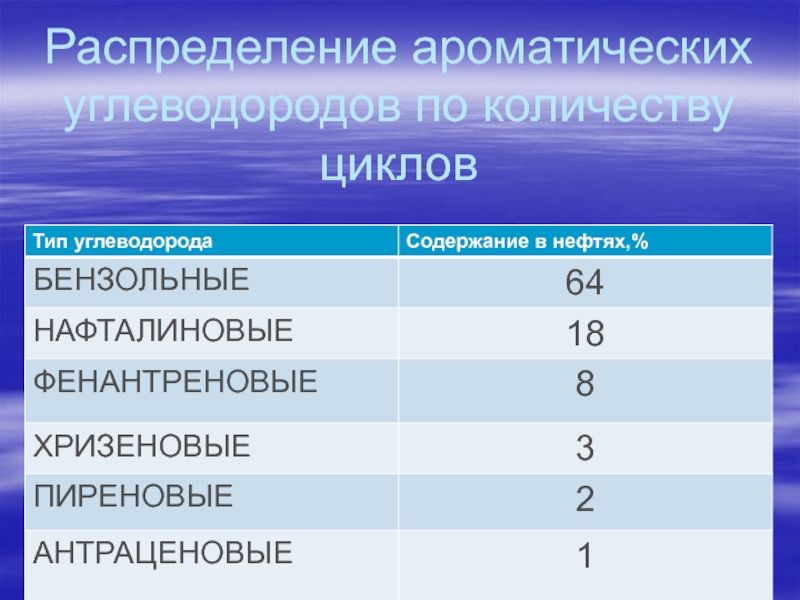
- 83. Распределение ароматических углеводородов по количеству циклов
- 84. В бензиновой фракции нефти Понка-Ситисоотношение аренов С6:С7:С8:С9
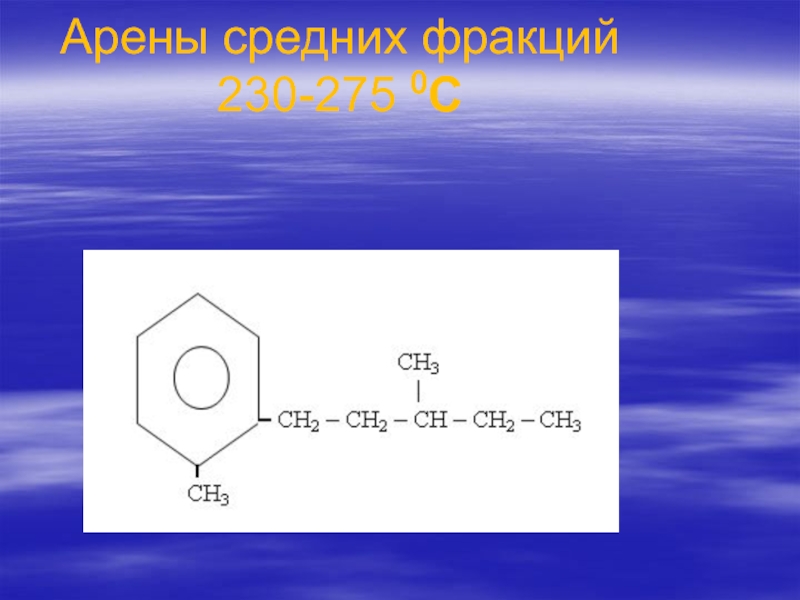
- 85. Арены средних фракций 230-275 0С
- 86. Алкильная цепь имеет изопреноидное строение
- 87. Слайд 87
- 88. Скачать презентанцию
Общая формула алканов СnH2n+2
Слайды и текст этой презентации
Слайд 1Углеводороды нефти
Алканы. Парафины
Содержание в нефтях в среднем 25-35%
(не считая растворенных
газов)
Слайд 7Газообразные парафиновые углеводороды входят в состав природных углеводородных газов, которые
в зависимости от условий нахождения в природе делятся на три
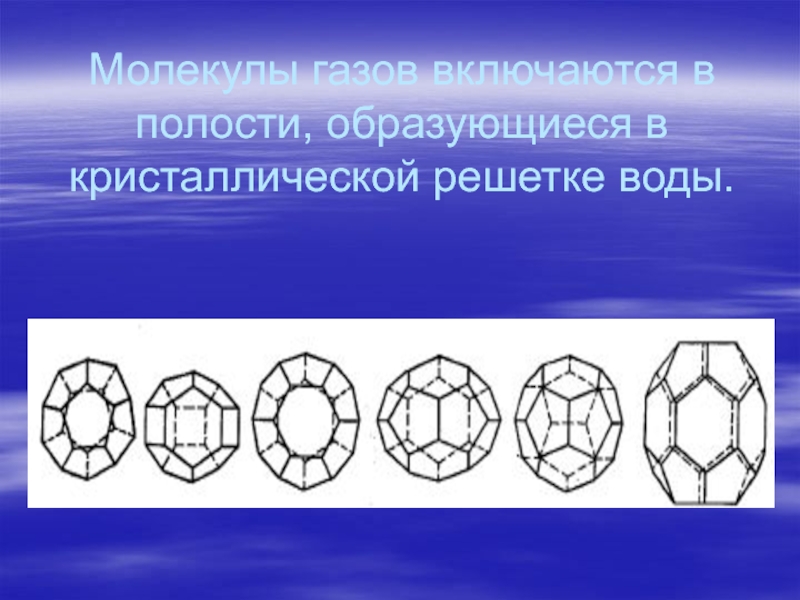
типа:Слайд 12Газообразные парафины дают комплексы с водой, они называются гидратами природных
газов, или соединениями включения, клатратными соединениями.
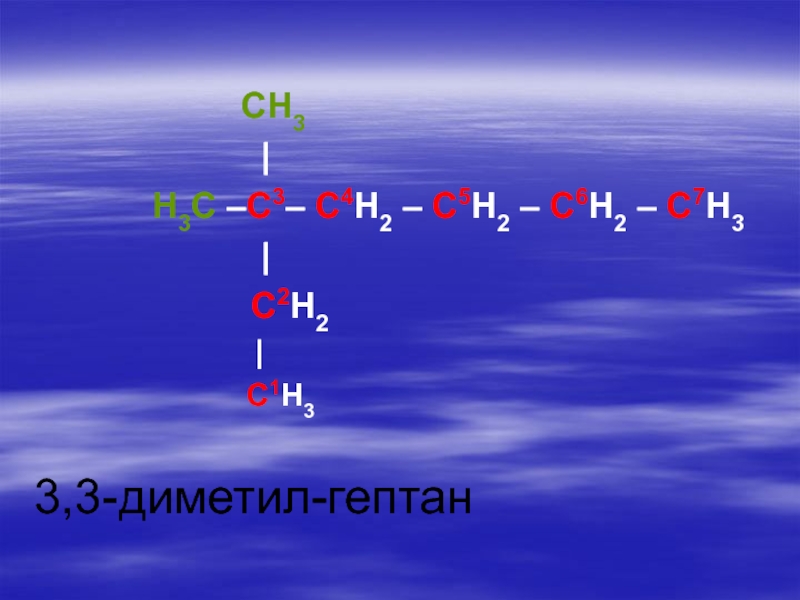
Слайд 14 Систематическая номенклатура алканов (ИЮПАК; JUPAC; Международный союз теоретической и прикладной химии)
1.
Выбирают самую длинную углеродную цепь
(при одинаковой длине выбирают наиболее
разветвленную)Слайд 172. Нумеруют атомы углерода в цепи, с того конца, к которому
ближе расположен радикал (одновалентный остаток, получаемый удалением атома водорода от какого-либо
атома углерода).Слайд 213. Перечисляют все радикалы (в порядке возрастания сложности) перед каждым радикалом
ставится цифра указывающая номер углерода у которого он расположен, при
наличии нескольких одинаковых радикалов их число обозначают греческими числительными (ди-, три-, тетра- и т.д.).Слайд 244. Дают название пронумерованной цепи, которое соответствует названию нормального алкана, состоящего
из такого же числа атомов углерода.
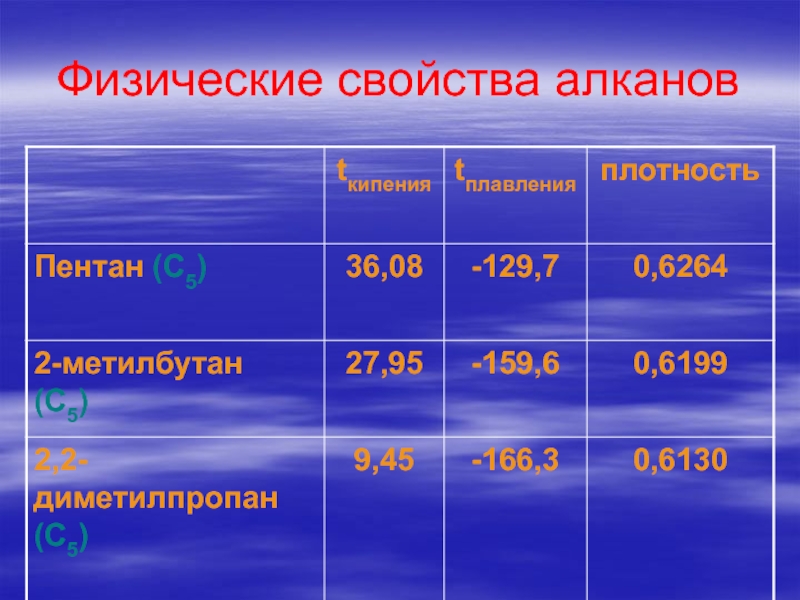
Слайд 28Вывод:
Среди алканов нормального строения с ростом числа атомов
углерода в молекуле растут:
температура кипения
температура плавления
плотность
Слайд 30Вывод:
Среди алканов одинакового состава, но разного строения минимальными показателями:
температура
кипения
температура плавления
плотность
обладают наиболее разветвленные из них
Слайд 37Бициклические нафтены СnH2n-2
Конденсированного типа
Сочлененного типа
Изолированного типа
(CH2)
Слайд 45Моноциклические нафтены содержатся во фракциях выкипающих до 3000С и содержатся
они в основном в бензиновых, керосиновых, дизельных фракциях. Бициклические встречаются во
фракциях 150 -5000С , но выше 4000С их количество заметно убывает Трициклические найдены во фракциях выкипающих выше 3500ССлайд 46Физические свойства нафтенов
Нафтены имеют более высокие температуры кипения
и плавления и показатели преломления, чем соответствующие по числу атомов
углерода алканы.Это объясняется тем, что вследствие более правильной, более жесткой структуры - молекулы нафтенов плотнее упаковываются в жидком или твердом состоянии, что увеличивает силы межмолекулярного взаимодействия.
Слайд 48Введение метильной группы в молекулу нафтена резко нарушает симметрию молекулы
, что приводит к уменьшению температуры плавления
Слайд 49Химические свойства нафтенов
Реакция дегидрогенизации.
Реакция была открыта и изучена Н. Д.
Зеленским
Никола́й Дми́триевич Зели́нский
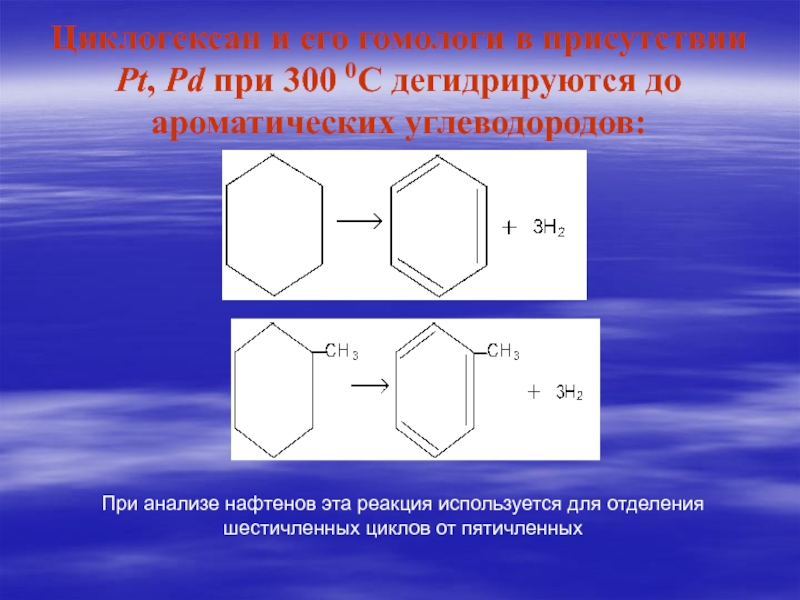
(1861- 1953) — выдающийся русский и советский химик-органик, создатель научной школы, один из основоположников органического катализа и нефтехимии, академик АН СССР (1929), Герой Социалистического Труда (1945), лауреат Ленинской и Сталинской премий.Слайд 50Циклогексан и его гомологи в присутствии Pt, Pd при 300
0С дегидрируются до ароматических углеводородов:
При анализе нафтенов эта реакция используется для отделения шестичленных циклов от пятичленных
Слайд 51Образование комплексов с тиомочевинной
Нафтеновые углеводороды образуют соединения включения (клатраты) с
тиомочевиной NH2CSNH2.
Молекулы тиомочевины за счет водородных связей образуют спирали
внутрь, которых помещаются молекулы нафтенов.Прочность образующихся соединений зависит от величины и строения молекул циклоалканов. С помощью тиомочевины можно разделить моно- и полициклические нафтены (последние образуют более прочные комплексы с тиомочевиной).
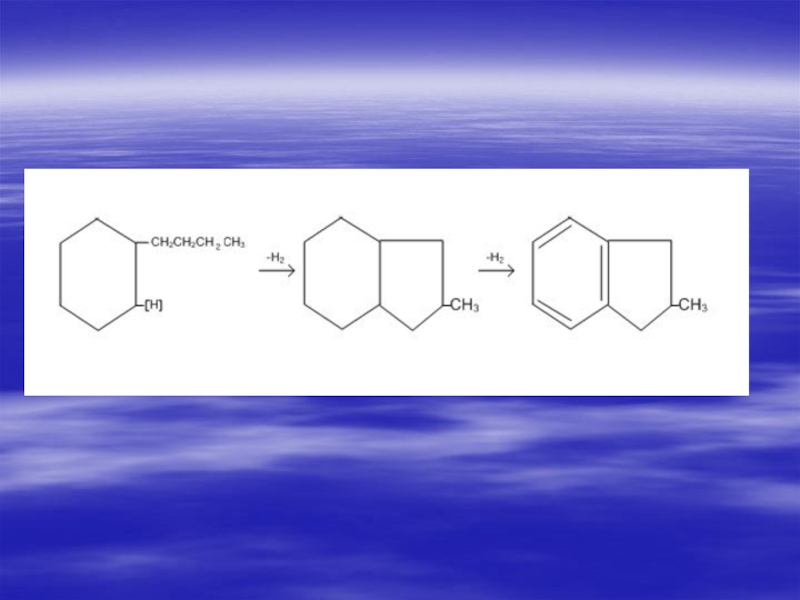
Слайд 52Изомеризация
Алкилпроизводные нафтенов с
достаточно длинной углеродной цепью
(С3 и более)
над платиной при 300 0С
образуют бициклические
углеводороды:
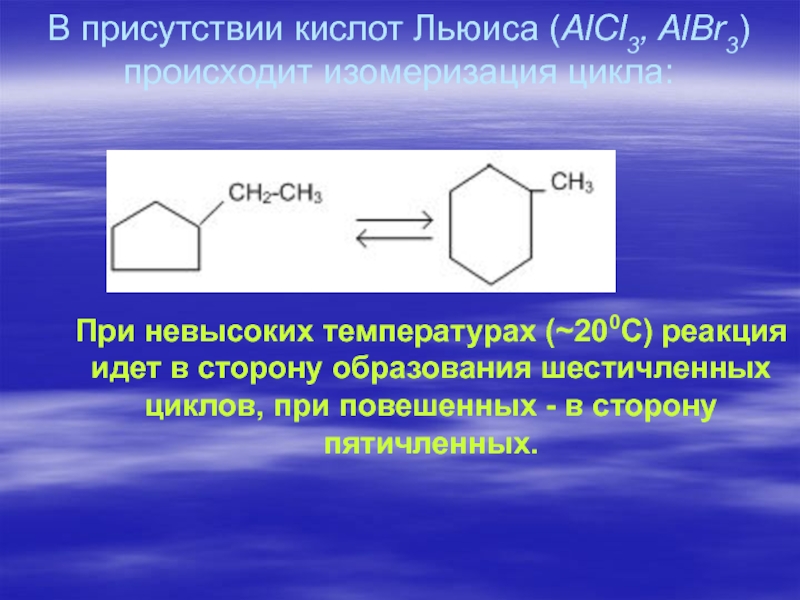
Слайд 54В присутствии кислот Льюиса (AlCl3, AlBr3) происходит изомеризация цикла:
При невысоких
температурах (~200С) реакция идет в сторону образования шестичленных циклов, при
повешенных - в сторону пятичленных.Слайд 55Реакция окисления.
Устойчивость к кислороду у нафтенового цикла ниже, чем у
ароматического.
При окислении нафтеновых углеводородов получаются спирты, двухосновные кислоты, кетокислоты.
Образующиеся кислоты
окисляются в оксикислоты, которые при дальнейшей конденсации дают смолы. Пятичленный цикл более устойчив к окислению, чем шестичленный






























![Углеводороды нефти Спироспиро [3,4] октан Спироспиро [3,4] октан](/img/thumbs/8a276add0a1d9498b85cdad219fda95d-800x.jpg)