Слайд 2Что такое водородная связь?
Водородная связь — то связь, образуемая протонированным
атомом водорода с сильноэлектроотцательным атомом той же или другой молекулы.
В обычных условиях валентность водорода равна 1, и он способен обобществлять с другими атомами одну электронную пару, образуя ковалентную связь: атом водорода может присоединять электрон, образуя гидрид-ион Н + .
Слайд 3История
Определение «водородная связь» появилось в 1920 году. Его применили учёные
Латимер и Родебуш для объяснения сущности аномалий, наблюдавшихся при кипении
воды, предельных одноатомных спиртов и жидкого фтороводорода. При сопоставлении точек кипения в ряду водородсодержащих родственных соединений Н2O (вода), Н2S (сероводород), Н2Se (селеноводород) и Н2Te (теллуроводород) обнаружилось, что первый участник этого списка (H2O) переходит из жидкости в пар гораздо раньше, чем можно было бы ожидать, следуя закономерности, которой подчиняются остальные члены. Истинное значение точки кипения воды оказалось на 200° C выше ожидаемого.
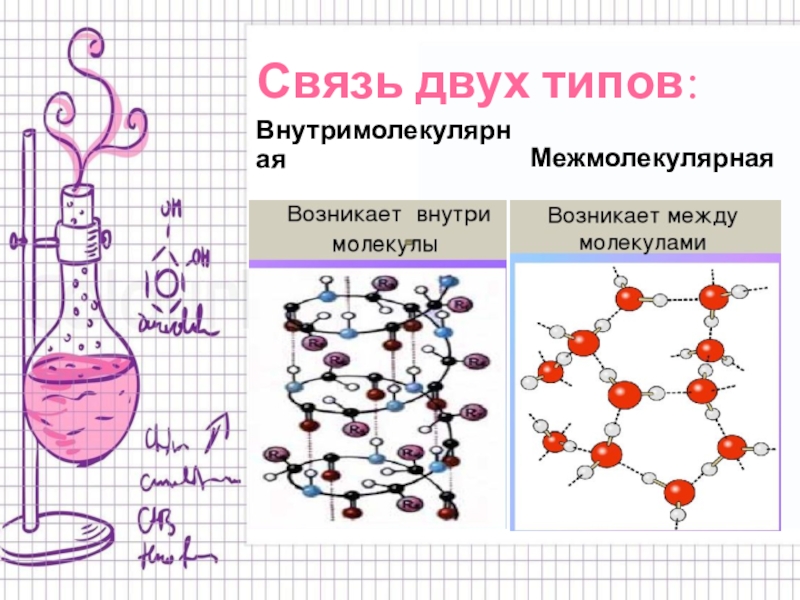
Слайд 4Связь двух типов:
Внутримолекулярная
Межмолекулярная
Слайд 5Где возникают?
фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
вода H2O
(пар, лед, жидкая вода):
раствор аммиака и органических аминов — между молекулами аммиака и воды;
органические соединения,
в которых есть связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Слайд 6Как обнаружить?
В настоящее время надежный способ обнаружить Н-связи дают спектральные
методы (чаще всего инфракрасная спектроскопия). Спектральные характеристики групп АН, связанных
водородными связями, заметно отличаются от тех случаев, когда такая связь отсутствует. Кроме того, если структурные исследования показывают, что расстояние между атомами Б – Н меньше суммы Ван-дер-Ваальсовых радиусов, то считают, что присутствие Н-связи установлено.
Слайд 7Механизм Гротгуса
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов
обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до
четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5—6). Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Слайд 8Высокая температура
Помимо повышенной температуры кипения водородные связи проявляются себя также
при формировании кристаллической структуры вещества, повышая его температуру плавления. В
кристаллической структуре льда Н-связи образуют объемную сетку, при этом молекулы воды располагаются таким образом, чтобы атомы водорода одной молекулы были направлены к атомам кислорода соседних молекул:
Слайд 9Водородная связь окружает нас
Земля — чемпион по содержанию воды среди
других планет Солнечной системы. Моря и океаны, реки и озёра,
средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов. Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете.
Слайд 10Роль
Велика роль Н-связи в биохимических системах. Свойства белков и нуклеиновых
кислот в значительной степени обусловлены наличием водородной связи. Н-связь играет
большую роль в процессах растворения. Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, поэтому эти связи играют важную роль в химии процессов жизнедеятельности.