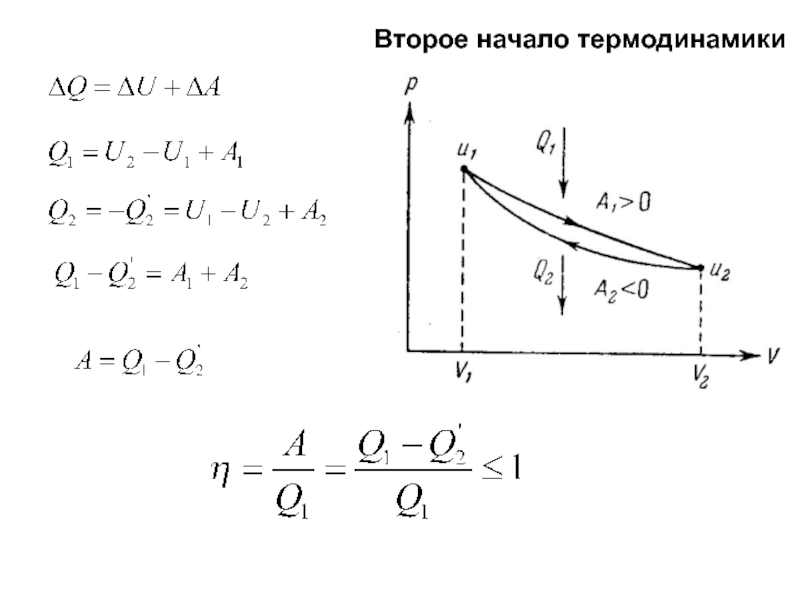
тепловых процессов. Энергия теплового движения молекул качественно отличается от всех
других видов энергии – механической, электрической, химической и т. д. Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, т. е. он не может быть осуществлен полностью в обратном направлении.Первое начало термодинамики – это обобщение закона сохранения энергии на тепловые процессы.
Оказывается, однако, что не все процессы разрешённые первым началом термодинамики возможны. Второе начало термодинамики формулирует эти ограничения.