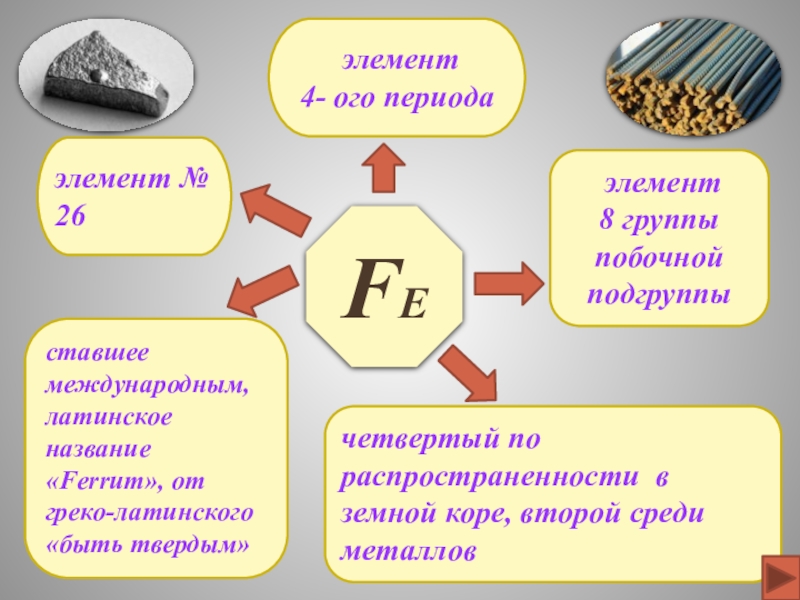
периодической системе
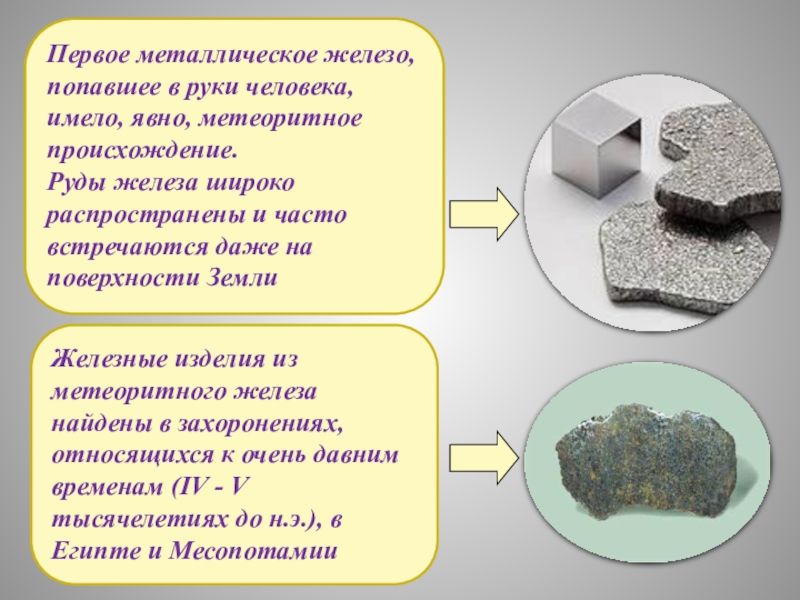
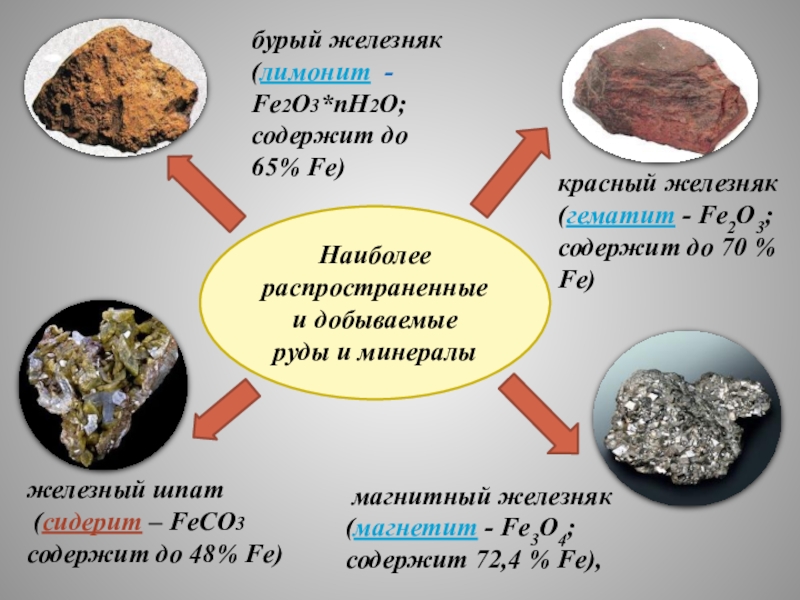
НАХОЖДЕНИЕ
В ПРИРОДЕ
ОТКРЫТИЕ И ПОЛУЧЕНИЕ
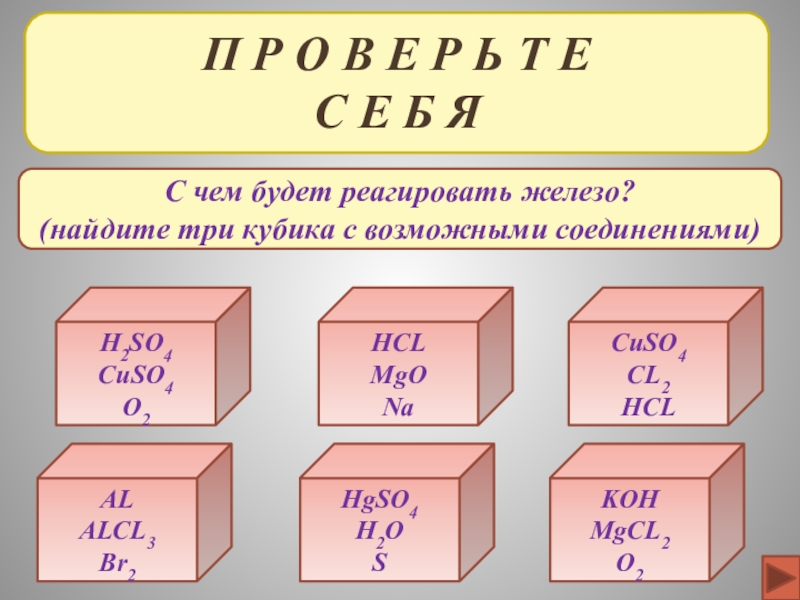
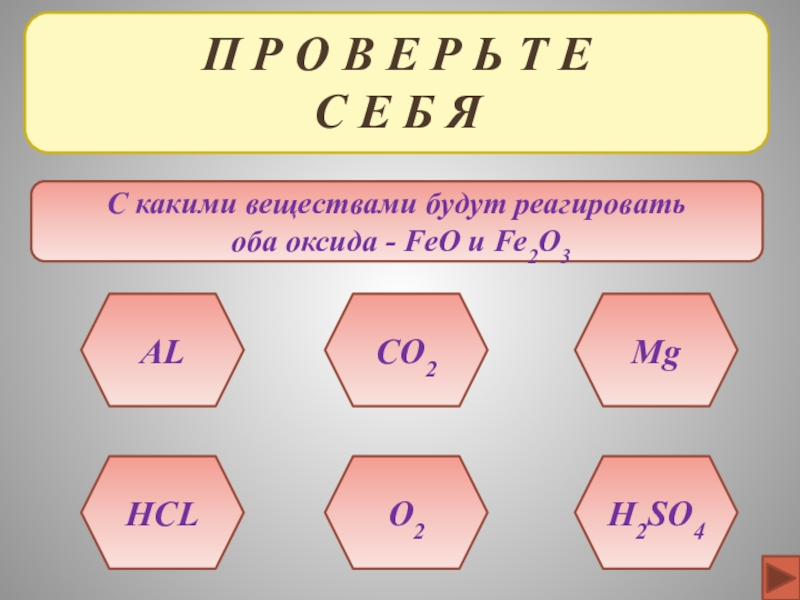
ХИМИЧЕСКИЕ СВОЙСТВА
ЖЕЛЕЗО В ОРГАНИЗМЕ И
ЕГО РОЛЬСОЕДИНЕНИЯ
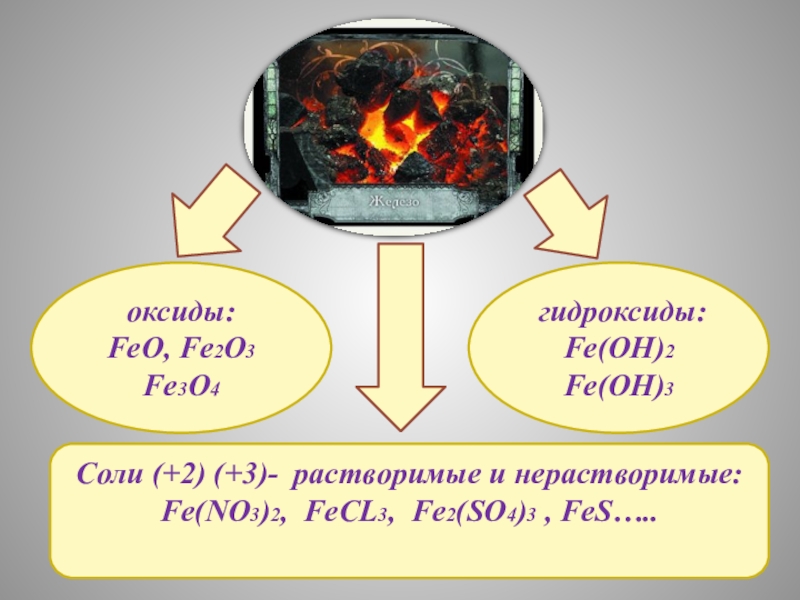
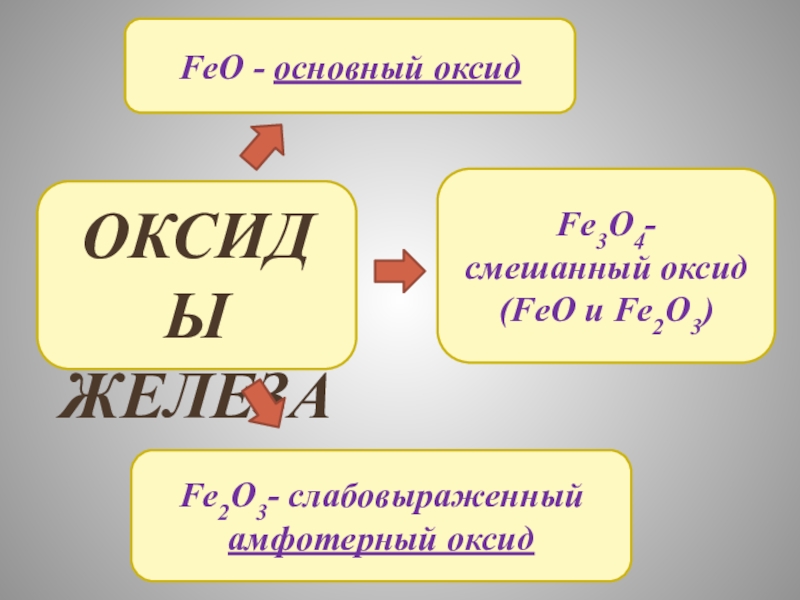
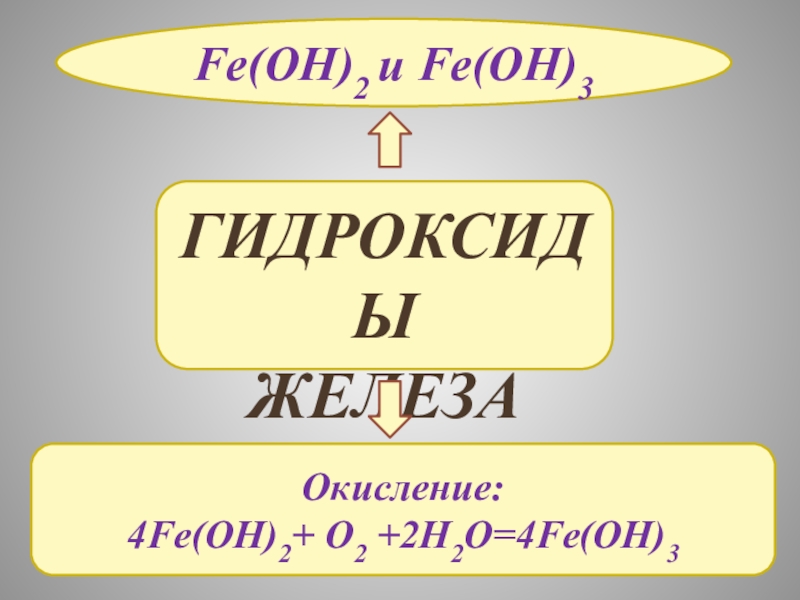
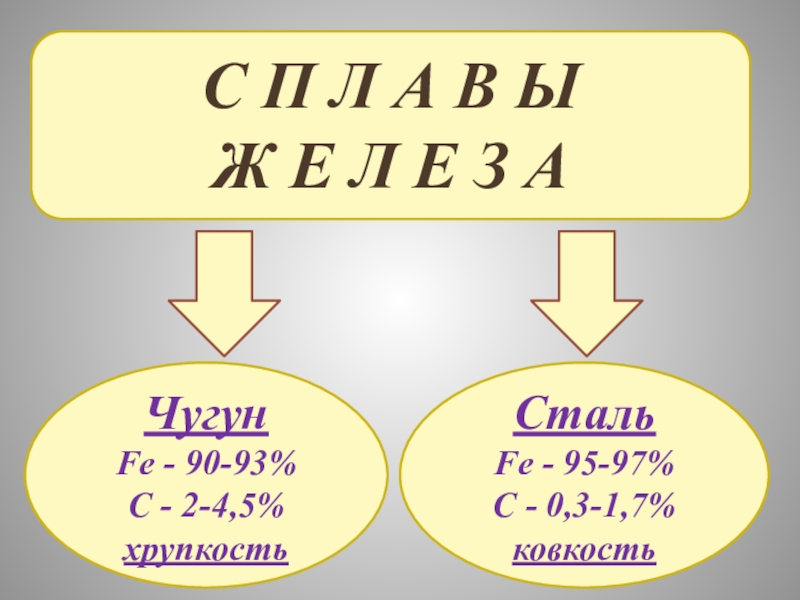
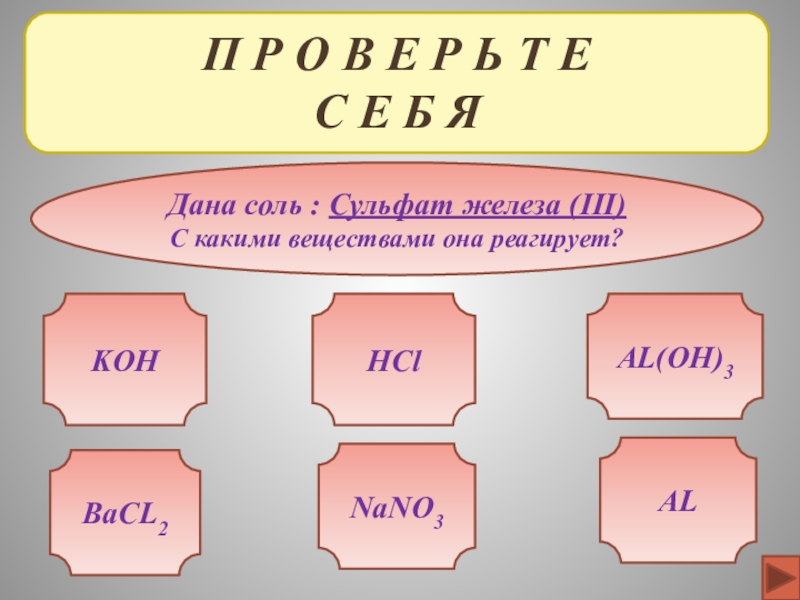
ЖЕЛЕЗА
И ИХ СВОЙСТВА
ПРИМЕНЕНИЕ ЖЕЛЕЗА И ЕГО СПЛАВОВ
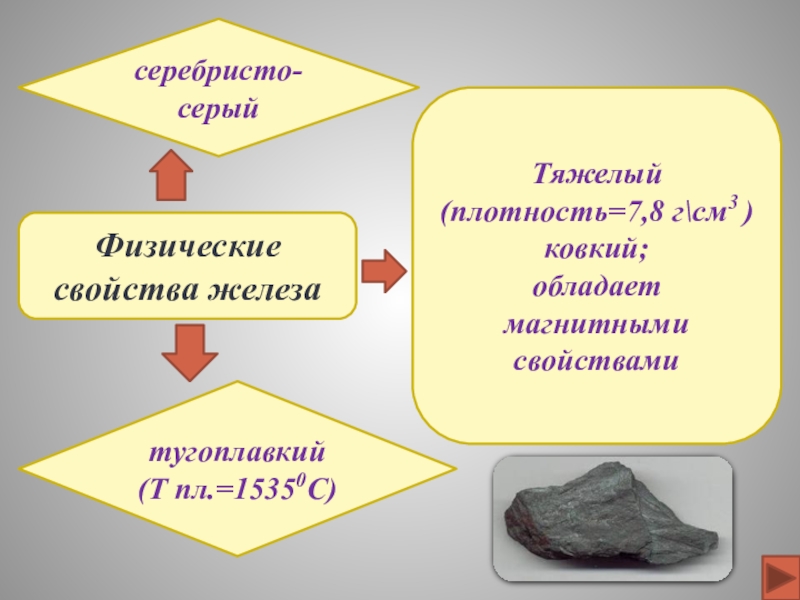
ФИЗИЧЕСКИЕ
СВОЙСТВА
П
Р
О
В
Е
Р
К
А
ф
о
л
ь
к
л
о
р