Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алканы (10 класс)
Содержание
- 1. Алканы (10 класс)
- 2. Цель: эффективно повторить и обобщить знания, устранить
- 3. Содержание теорияконтрольсоставстроениеполучение1 уровень2 уровень3 уровеньответысвойства
- 4. АЛКАНЫСОСТАВСТРОЕНИЕСВОЙСТВАПРИМЕНЕНИЕЭКОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯСИНТЕЗЫХИМИЧЕСКИЕПРЕВРАЩЕНИЯГЕНЕТИЧЕСКАЯСВЯЗЬ
- 5. СоставCH4C2H6C3H8 CnH2n+2Гомологический ряд: CH4,C2H6,…..C8H18….C10H22Метан, этан, ……..октан ……декан - ЭТО ВЕЩЕСТВА- ГОМОЛОГИ
- 6. Гомологи - вещества, сходные по строению и
- 7. Гомологами являются :а) C2H6 и C2H4
- 8. Определите формулы алканов: а) C5H10
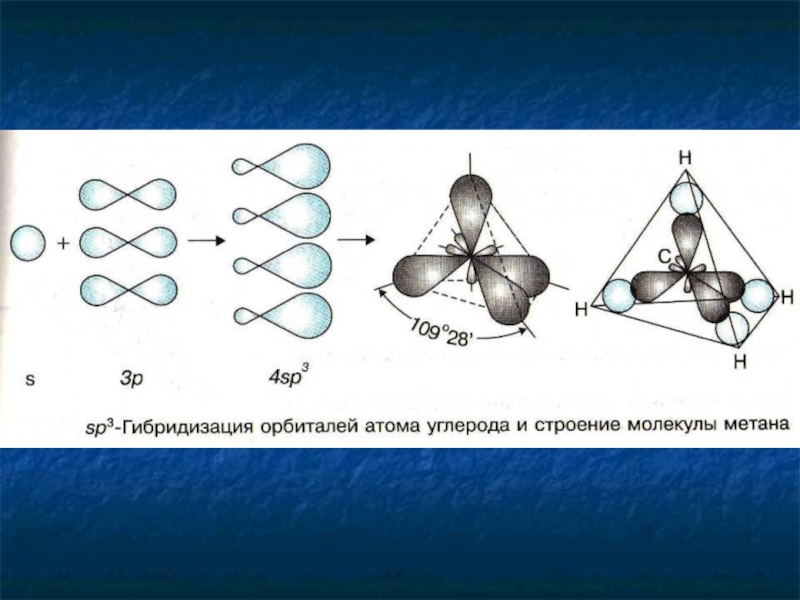
- 9. Строение алкановПервое валентное состояние атома углерода Невозбужденный атом углеродаВозбужденный атом углерода
- 10. Гибридизация - «перемешивание» электронных облаков
- 11. Форма углеродных цепей зигзагообразна
- 12. Слайд 12
- 13. Изображение молекул алканов на плоскости- формулы строенияДлина связи С-С равна 0,15 нм
- 14. ИЗОМЕРЫ ЭТО ВЕЩЕСТВА, ИМЕЮЩИЕ ОДИНАКОВЫЙ КАЧЕСТВЕННЫЙ СОСТАВ,СХОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА, НОРАЗНОЕ СТРОЕНИЕ И РАЗЛИЧАЮЩИЕСЯ ПО ФИЗИЧЕСКИМ СВОЙСТВАМ
- 15. Сколько углеводородов изображено формулами?Ответ :а)один б)два в) три г) четыреОдин ; это бутан
- 16. Номенклатура алкановНазовем алкан - 1.Выбираем самую длинную
- 17. 2.В начале названия перечисляют радикалы и другие
- 18. CH3-CH - CH2 -CH3
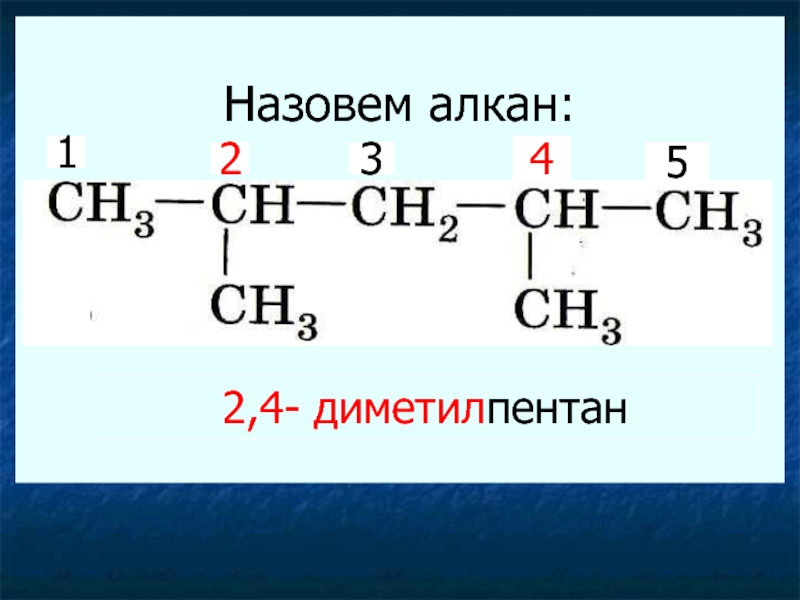
- 19. Назовем алкан: 123452,4- диметилпентан
- 20. Название углеводорода с формулой: А)2,2,4-триметилгексанБ)5,5-диметил-3этилгексанВ)2-диметил-4 этилгексанГ)2,2-диметил-4 этилгексан
- 21. Свойства алкановФизические химическиеС1- С4 - газыС5- С17
- 22. Химические превращения алканов обусловлены: 1.
- 23. Галогенирование -радикальное замещение водорода на галоген (хлорирование
- 24. 2. Нитрование - замещение водорода на нитрогруппу
- 25. 3. Изомеризация Использование хлорида алюминия при нагревании
- 26. 4.Крекинг - разрыв связей С - С
- 27. 5. Дегидрирование - отщепление водорода; происходит при
- 28. 6. Риформинг (ароматизация)Если алкан содержит шесть или
- 29. 7. Горение Cn H2n +2
- 30. 8.Конверсия метанаCH4 + H2O катализатор, температура→CO+3H2
- 31. 9.Каталитическое окисление бутана, метана
- 32. Синтезы алкановПриродными источниками алканов (предельных углеводородов) являются:нефть, газ и горный воск.Химики открыли способы синтеза алканов →
- 33. 1. Гидрирование непредельных углеводородов (промышленный способ) (гидрированием
- 34. 2. Реакция Фишера -Тропша (промышленный способ)Смесь предельных
- 35. 3. Реакция Вюрца (лабораторный способ)В 1855 г
- 36. 4. Реакция Дюма - декарбоксилирование солей карбоновых
- 37. 5. Реакция Кольбе- электролиз расплавов солей карбоновых
- 38. 6.Синтез метана из простых веществПри нагревании углерода
- 39. 7.Гидролиз карбида алюминияAl4 C3 + 12 H2O
- 40. Слайд 40
- 41. Контроль1 Уровень. Воспроизведение знаний1).Для вещества, имеющего строениеCH3-CH
- 42. 2). Напишите уравнения реакций: а) изомеризации
- 43. 3). Решите задачу: Какая масса сажи образуется
- 44. 4). Решите задачу: Найдите молекулярную формулу
- 45. 2 уровень. Применение знаний по образцу, в
- 46. 2) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CH4→CH3 Cl→C2H6→C2H5Br
- 47. 3) Решите задачу: При термическом разложении метана
- 48. 4). Решите задачу: Найдите молекулярную формулу углеводорода,
- 49. 3 уровень. Умение применять полученные знания в
- 50. 2) Хлорэтан - газ, легко превращающийся в
- 51. 3) В качестве хладагента в холодильниках наиболее
- 52. 4) Решите задачу: При сгорании вещества массой
- 53. Ответы I уровень№ 3 -17,28 г№ 4
- 54. Вы можете узнать больше об органических веществах на сайтахhttp:cnit.ssau.ru/organics/index.htmwww.chemiistry.ruДо свидания!
- 55. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель: эффективно повторить и обобщить знания, устранить отставание учащихся по
теме «Алканы»
разноуровневые заданияСлайд 4АЛКАНЫ
СОСТАВ
СТРОЕНИЕ
СВОЙСТВА
ПРИМЕНЕНИЕ
ЭКОЛОГИЧЕСКИЕ
ПОСЛЕДСТВИЯ
СИНТЕЗЫ
ХИМИЧЕСКИЕ
ПРЕВРАЩЕНИЯ
ГЕНЕТИЧЕСКАЯ
СВЯЗЬ
Слайд 5Состав
CH4
C2H6
C3H8
CnH2n+2
Гомологический ряд:
CH4,C2H6,…..C8H18….C10H22
Метан, этан, ……..октан ……декан - ЭТО ВЕЩЕСТВА-
ГОМОЛОГИ
Слайд 6Гомологи - вещества, сходные по строению и свойствам, состав которых отличается на одну
или более групп CH2
Слайд 9Строение алканов
Первое валентное состояние атома углерода
Невозбужденный атом
углерода
Возбужденный атом
углерода
Слайд 14ИЗОМЕРЫ
ЭТО ВЕЩЕСТВА, ИМЕЮЩИЕ
ОДИНАКОВЫЙ КАЧЕСТВЕННЫЙ СОСТАВ,
СХОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА,
НО
РАЗНОЕ СТРОЕНИЕ И
РАЗЛИЧАЮЩИЕСЯ ПО ФИЗИЧЕСКИМ СВОЙСТВАМ
Слайд 15Сколько углеводородов изображено формулами?
Ответ :а)один б)два в) три
г) четыре
Один ; это бутан
Слайд 16Номенклатура алканов
Назовем алкан -
1.Выбираем самую длинную цепь атомов углерода
и
нумеруем ,начиная с того конца, к которому ближе
разветвление :Слайд 172.В начале названия перечисляют радикалы и другие заместители с указанием
номеров атомов углерода, с которыми они связаны
CH3-метил,
C2H5- этил,
Cl - хлор;
Если
их несколько, то цифрой указывают место каждого в главной цепи и перед названием ставят частицы : ди- (2),три - (3), тетра -(4).3. Основа названия - наименование алкана в главной цепи
Слайд 20Название углеводорода с формулой:
А)2,2,4-триметилгексан
Б)5,5-диметил-3этилгексан
В)2-диметил-4 этилгексан
Г)2,2-диметил-4 этилгексан
Слайд 21Свойства алканов
Физические
химические
С1- С4 - газы
С5- С17 - жидкости
с
запахом бензина
начиная с С 18 -
твердые вещества
(парафины)
У алканов сигма-связи
прочны, насыщенны, поэтому при н.у.
предельные углеводороды
пассивны
2. Поэтому для них нехарактерны
реакции присоединения,
а характерны реакции
свободно-радикального
замещения
Слайд 22
Химические
превращения алканов обусловлены:
1. Разрывом цепи углеродных атомов.
2. Отрывом атомов
водорода с последующим замещением их в соединении другими атомами или
группами атомовСлайд 23Галогенирование -радикальное замещение водорода на галоген (хлорирование и бромирование происходит под
действием солнечного света, УФ-излучения, при нагревании до 300-500градусов; фторирование и
йодирование не призводят: фтор реагирует со взрывом, йод- слишком медленно)Эти реакции протекают по механизму
цепных радикальных реакции.
Николай Николаевич Семенов (Россия)
в 1956 получил Нобелевскую премию
за изучение механизма протекания таких реакций
Слайд 242. Нитрование - замещение водорода на нитрогруппу
(реакция Коновалова)
CH4 +
HNO3→CH3 - NO2 + H2O
Коновалов «оживил химических мертвецов»,
действуя раствором азотной кислоты на алканы при температуре +140 градусовЗамещение атома водорода у гомологов метана ,
так же как и при бромировании,
в первую очередь замещается атом водорода у
третичного атома углерода, затем - у вторичного, и в
последнюю очередь - у первичного
Слайд 253. Изомеризация
Использование хлорида алюминия при нагревании
вызывает превращение алканов
с нормальной
цепью в их изомеры с разветвленной цепью.
Этот процесс
называют изомеризациейБутан
2-метилпропан, или изобутан
Слайд 264.Крекинг - разрыв связей С - С , происходит при температуре
свыше 400 градусов без доступа воздуха, в присутствии катализаторов C8H18→ C4H8
+ C4H10 алкен алканСлайд 275. Дегидрирование - отщепление водорода; происходит при разных температурах (от300 до
600град.),на разных катализаторах: Ni, Pd, Pt, Cr2O3 В зависимости от этого
образуются разные продуктыСлайд 286. Риформинг (ароматизация)
Если алкан содержит шесть или более атомов углерода,
то
дегидрирование может сопровождаться замыканием
цикла с образованием бензола или его
гомологовСлайд 32Синтезы алканов
Природными источниками
алканов (предельных
углеводородов) являются:
нефть, газ и
горный воск.
Химики открыли способы синтеза
алканов →
Слайд 331. Гидрирование непредельных углеводородов
(промышленный способ)
(гидрированием называют реакции присоединения водорода
по кратным связям); происходит в присутствии катализаторов (Ni, Pd), повышенного
давления и при нагреванииCH2 = CH2 + H2→ CH3 - CH3
Слайд 342. Реакция Фишера -Тропша
(промышленный способ)
Смесь предельных углеводородов
от С6 до С12
под названием синтетический бензин
получают
из синтез-газа при использовании катализаторов Co,Fe,Ni в интервале температур от170 до 330 градусов:CO + H2 → Cn H2n + 2 + H2O
Слайд 353. Реакция Вюрца
(лабораторный способ)
В 1855 г французский химик Ш.А.Вюрц разработал
способ синтеза алканов путем нагревания галогеналканов с металлами (натрием, цинковой
пылью):2CH3CH2Br +2Na →
CH3CH2CH2CH3 + 2NaBr
Слайд 364. Реакция Дюма -
декарбоксилирование солей карбоновых кислот
Эта реакция протекает при
нагревании смеси порошков соли карбоновой кислоты и гидроксида натрия и
сопровождается отщеплением группы -COONa от молекулы соли. в молекуле образовавшегося алкана остается на один атом углерода меньше, чем в молекуле исходной соли:CH3CH2COONa + NaOH t→
CH3CH3 + Na2CO3
Слайд 375. Реакция Кольбе-
электролиз расплавов солей карбоновых кислот
В ходе электролиза на
аноде анионы CH3COO- окисляются до радикалов CH3COO• , которые распадаются
с образованием радикалов СН3∙ и углекислого газа СО2. Радикалы СН3∙ соединяются попарно, и образуется молекула симметричного алкана:2СН3СOONa +2H2O→эл-из
CH3CH3 + 2CO2 + 2NaOH + H2
Слайд 386.Синтез метана из простых веществ
При нагревании углерода в атмосфере водорода
при температуре 400-500 градусов и повышенном давлении в присутствии катализатора
образуется метан:C + 2 H2 → CH4
Слайд 397.Гидролиз карбида алюминия
Al4 C3 + 12 H2O →4Al(OH)3+3CH4
На карбид можно
действовать не только водой, но и раствором кислоты
Al4 C3
+ 12 HCl→4AlCl3+3CH4Другие алканы получить этим способом нельзя
Слайд 41Контроль
1 Уровень. Воспроизведение знаний
1).Для вещества, имеющего строение
CH3-CH - CH -
CH3
⏐
⏐ CH3 CH3
составьте формулы одного гомолога и двух изомеров. Дайте им названия по систематической номенклатуре.
Слайд 422). Напишите уравнения реакций: а) изомеризации бутана; б) горения пропана
в кислороде; в) первой, второй и третьей стадий хлорирования метана.
Дайте названия всем продуктам реакцииСлайд 433). Решите задачу: Какая масса сажи образуется при разложении метана массой 24
?
Массовая доля выхода продукта составляет 96%.
Слайд 444). Решите задачу: Найдите молекулярную формулу углеводорода, если массовая доля
углерода в нем равна 80%, плотность вещества по водороду равна
15.Слайд 452 уровень. Применение знаний по образцу, в знакомой ситуации
1) Дано
вещество - 2 метилбутан. Составьте формулу по названию, приведите по
одному примеру гомолога и изомера и дайте им названия по систематической номенклатуреСлайд 462) Напишите уравнения реакций, с помощью которых можно осуществить следующие
превращения:
CH4→CH3 Cl→C2H6→C2H5Br
Слайд 473) Решите задачу: При термическом разложении метана количеством вещества 14 моль
получен ацетилен (С2Н2) ,объем которого при н.у. составляет 120,96 л.
Вычислите объемную долю(%) выхода ацетилена.Слайд 484). Решите задачу: Найдите молекулярную формулу углеводорода, содержащего по массе 85,7%
углерода и 14,3% водорода. Плотность вещества по водороду равна 28.
относится ли этот углеводород к предельным?Слайд 493 уровень. Умение применять полученные знания в новой ситуации
1) Напишите
уравнения реакций, с помощью которых можно осуществить следующие цепочки превращений:
Al4C3→+HOH
X1→ +Cl2,светX2 →+2K →X3CH3COONa(безводн) +NaOH,тв,сплав→X1 →CH3Cl →C2H6
CH3COONa → CH4 → t=1500 X4
Назовите продукты Х1 - Х4.
Слайд 502) Хлорэтан - газ, легко превращающийся в жидкость, которая при
быстром испарении охлаждает кожу,что используют для местной анестезии при легких
операциях. Составьте уравнение реакции получения хлорэтана из этана.Слайд 513) В качестве хладагента в холодильниках наиболее широко используется дифтордихлорметан
(фреон-1)- газ, легко переходящий в жидкое состояние. Составьте структурную и
электронную формулы дифтордихлорметанаСлайд 524) Решите задачу: При сгорании вещества массой 1,5 г образовались оксид
углерода (IV) массой 4,4 г и вода массой 2,7 г.
Относительная плотность паров вещества по воздуху равна 1,03. Установите молекулярную формулу данного вещества.Слайд 53Ответы
I уровень
№ 3 -17,28 г
№ 4 - C2H6
II уровень
№
3 - 77,14%
№ 4 - C4H8
III уровень
№ 1 - X1
- CH4 , X2- CH3Cl , X3 -CH4 ,X4-C2H2№ 2 - CH3Cl , №3 - CF2-CCl2 №4 -C2H6