Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлы IА-группы щелочные металлы
Содержание
- 1. Металлы IА-группы щелочные металлы
- 2. Что узнаем…Положение щелочных металлов в Периодической системеИзменение свойств в группеИстория названияНахождение в природеФизические свойстваХимические свойстваОкраска пламениЗакреплениеЛитература
- 3. Щелочные металлы находятся в IA-группеМаксимальная степень окисления+1Строение внешнего энергетического уровня ns1 Первой группы элементыодинаково валентны
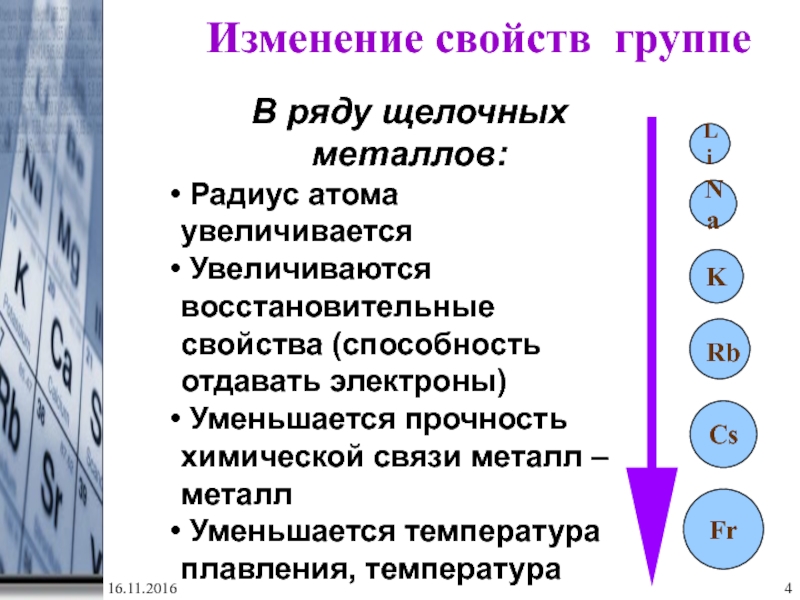
- 4. FrKNaLiИзменение свойств группеВ ряду щелочных металлов: Радиус
- 5. «Если не знать имен - умрет
- 6. ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВЛитий был открыт шведским химиком
- 7. Нахождение в природе Натрий и калий
- 8. Кислородные соединения щелочных металлов
- 9. Щелочные металлы легкоплавки и мягки, серебристы, как
- 10. Эти металлы получили название щелочных, потому что
- 11. Химические свойстваЩелочные металлы активно взаимодействуют почти со
- 12. Химические свойстваКусочек металлического натрия реагирует с водой
- 13. Окраска пламени ионами щелочных металловLi+K+Na+Cs+
- 14. Закрепление С помощью уравнений реакций осуществите превращения:1)
- 15. Домашнее задание § 11, упр. 4, 5
- 16. Литература http://ru.wikipedia.org/wiki/%D0%9B%D0%B5%D0%BF%D0%B8%D0%B4%D0%BE%D0%BB%D0%B8%D1%82http://ru.wikipedia.org/wiki/%D0%A9%D0%B5%D0%BB%D0%BE%D1%87%D0%BD%D1%8B%D0%B5_%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D1%8BХимия. 9 класс; учеб.для общеобразоват. учреждений/
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Металлы IА-группы ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Аблямитова Татьяна Алексеевна
Учитель первой кв. категории
г. Казань,
Республика Татарстан
Слайд 2Что узнаем…
Положение щелочных металлов в Периодической системе
Изменение свойств в группе
История
названия
Нахождение в природе
Физические свойства
Химические свойства
Окраска пламени
Закрепление
Литература
Слайд 3Щелочные металлы находятся в IA-группе
Максимальная степень окисления
+1
Строение внешнего энергетического уровня
ns1
Первой группы элементы
одинаково валентны
Слайд 4Fr
K
Na
Li
Изменение свойств группе
В ряду щелочных металлов:
Радиус атома увеличивается
Увеличиваются
восстановительные свойства (способность отдавать электроны)
Уменьшается прочность химической связи металл
– металлУменьшается температура плавления, температура кипения
Слайд 6ОТКРЫТИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Литий был открыт шведским химиком Й. Арведсоном в
1817 г. по предложению Й.Берцелиуса назван литием (от греч. литос
– камень)Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей
Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент по предложению Гильберта назван калием (от араб. алкали – щелочь)
Гемфри Дэви
(1778 – 1829)
Йенс-Якоб Берцелиус (1779–1848)
Слайд 7 Нахождение в природе
Натрий и калий широко распространены в
природе в виде солей
Соединения других щелочных металлов встречаются редко
Кристаллы
хлорида натрия – минерал галитКак очень активные металлы, они встречаются в природе только в виде соединений
поташ
Лепидолит- один из основных источников редких щелочных металлов, рубидия и цезия
Слайд 9Щелочные металлы легкоплавки и мягки, серебристы, как снежки…
Металлический цезий в
ампуле
Физические свойства
Металлический рубидий в ампуле
Натрий – мягкий металл, его
можно резать ножомЛитий - мягкий и пластичный, твёрже натрия, но мягче свинца
Слайд 10Эти металлы получили название щелочных, потому что большинство их соединений
растворимы в воде.
По-славянски «выщелачивать» означает «растворять», это и определило
название данной группы металлов Слайд 11Химические свойства
Щелочные металлы активно взаимодействуют почти со всеми неметаллами:
2Ме0 +
Н20 = 2Ме+1Н-1 (гидрид)
2Na + H2 = 2NaH
2Ме0 + Cl20
= 2Mе+1Cl-1 (хлорид)2Ме0 + S0 = Mе+12S (сульфид)опыт
С кислородом натрий образует
пероксиды:
2Ме0 + О20 = Ме+12О2-1 пероксид
2Na + O2 = Na2O2
Слайд 12Химические свойства
Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина
Все
щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая
воду до водорода:2Ме0 + 2Н2О = 2Ме+1ОН + Н2
2Na + 2Н2О = 2NaOH + H2
Скорость взаимодействия щелочного металла с водой увеличивается от лития к цезию опыт
Слайд 14Закрепление
С помощью уравнений реакций осуществите превращения:
1) Na
→ Na2O2 → Na2O
NaOH → Na2CO3Li → Li2O → LiOH → LiCl
LiOH