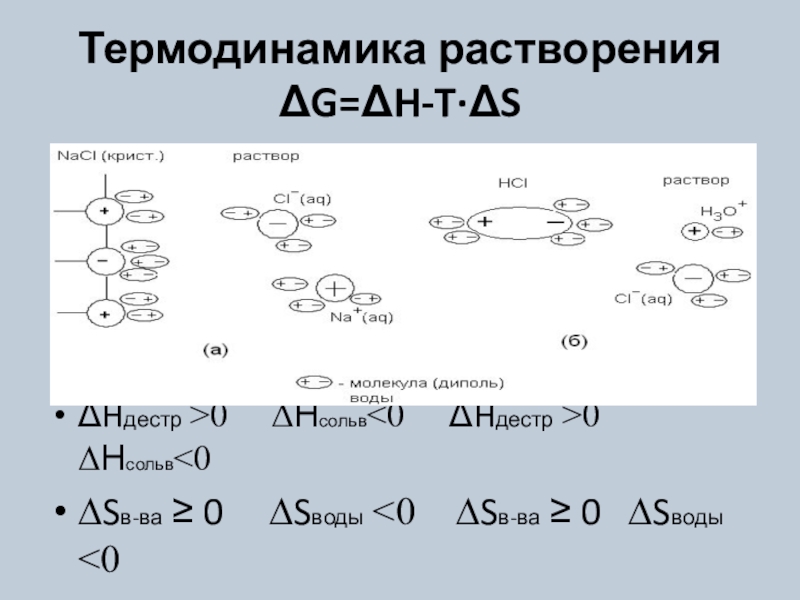
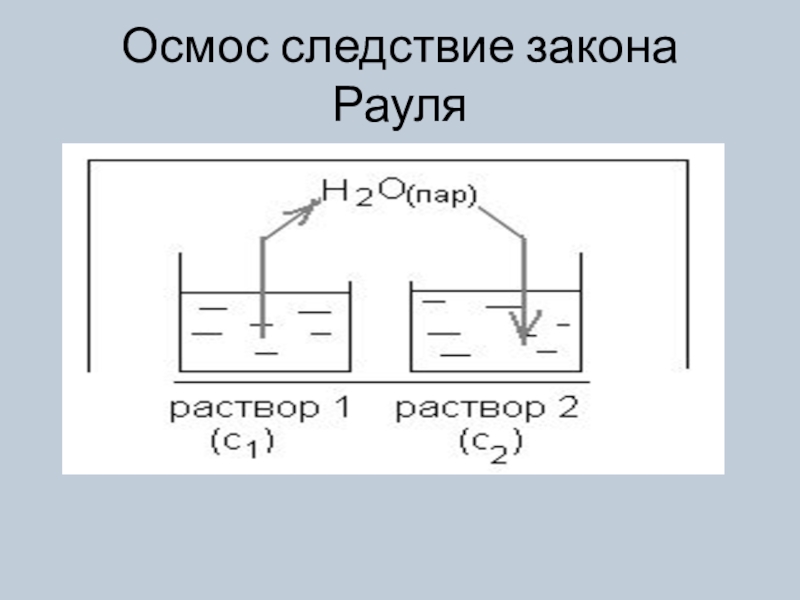
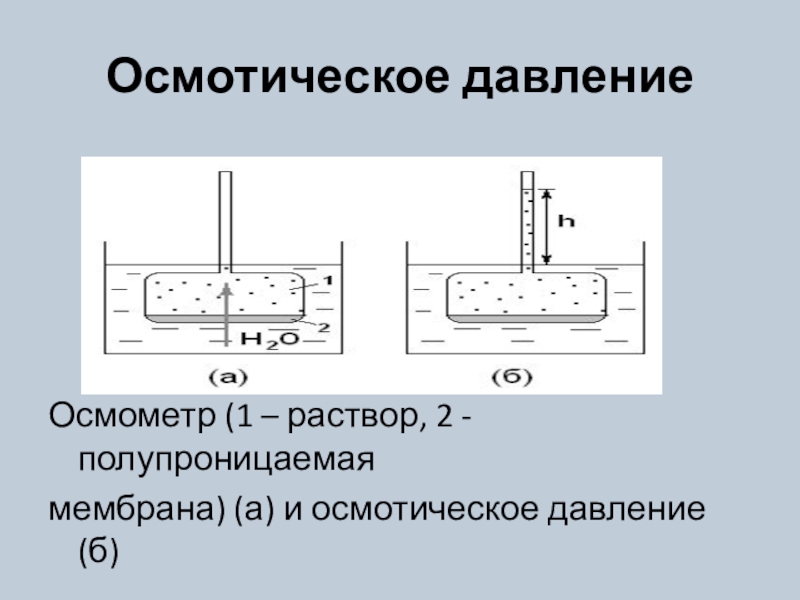
изменять в определенных пределах, и в которой имеется взаимодействие между
частицами веществ.При теоретическом рассмотрении растворов вводится понятие идеальных растворов – это такие растворы, в которых энергии взаимодействия между всеми видами частиц одинаковы: Е(А–А) = Е(В–В) = Е(А–В).