Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Серная кислота
Содержание
- 1. Серная кислота
- 2. Строение молекулы H2SO4H2SO4 Связь О-Н в H2SO4
- 3. Производство серной кислоты 1-я стадия.
- 4. Физические свойства Тяжелая маслянистая жидкость ("купоросное масло");p
- 5. Химические свойства H2SO4 - сильная двухосновная кислота H2SO4
- 6. 3) с основаниями:H2SO4 + 2NaOH => Na2SO4
- 7. ВАСИЛИЙ КАДЕВИЧ 20085) концентрированная H2+6SO4 – сильный
- 8. 6) концентрированная H2S+6O4 реагирует при нагревании с
- 9. 6) Гигроскопичность серной кислотыКонцентрированная серная кислота жадно
- 10. Концентрированная серная кислота энергично обугливает сахарозу
- 11. Слайд 11
- 12. Помните! При приготовлении раствора кислоту вливать малыми порциями в воду, а не наоборот!
- 13. В природе встречается 180 минералов сульфатов, и
- 14. Серная кислота в природеКислые озёра
- 15. Существуют предположения, что кислотное озеро возникло
- 16. Серная кислота – очень активная жидкость, особенноконцентрированная,
- 17. ВАСИЛИЙ КАДЕВИЧ 2008Применение H2SO4В производстве пластмассыВ производстве
- 18. Применение серной кислоты.
- 19. Сульфат меди
- 20. Сульфат натрия.
- 21. Сульфат натрия.
- 22. СОЛИ СЕРНОЙ КИСЛОТЫCaSO4• 2H2O - гипс
- 23. Домашнее заданиеСоставьте инструкцию по правилам обращения с
- 24. Лабораторный опыт № 7 Исследование
- 25. В пробирках в виде растворов представлены вещества:NaCl,
- 26. Если эти утверждения верны на Ваш
- 27. СПАСИБО ЗА СОТРУДНИЧЕСТВОВАСИЛИЙ КАДЕВИЧ 2008
- 28. Скачать презентанцию
Слайды и текст этой презентации
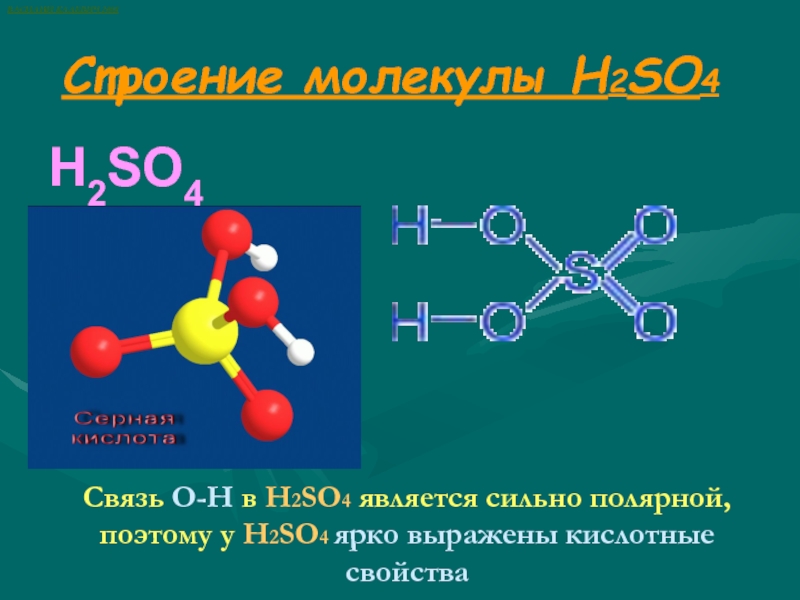
Слайд 2Строение молекулы H2SO4
H2SO4
Связь О-Н в H2SO4 является сильно полярной,
поэтому у H2SO4 ярко выражены кислотные свойства
Слайд 3Производство серной кислоты
1-я стадия. Печь для обжига колчедана.
4FeS2
+ 11O2 => 2Fe2O3 + 8SO2 + Q
2-я стадия.
Окисление сернистого газа до серного ангидрида (450°С – 500°С; катализатор V2O5):2SO2 + O2 ⬄ 2SO3
3-я стадия. Поглощение серного ангидрида
nSO3 + H2SO4(конц)=>(H2SO4 • nSO3)(олеум)
ВАСИЛИЙ КАДЕВИЧ 2008
Слайд 4Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло");
p = 1,84 г/см3;
Нелетучая,
хорошо растворима в воде – с сильным нагревом;
t°пл. =
10,3°C, t°кип. = 296°С,Очень гигроскопична, обладает водоотнимающими свойствами
ВАСИЛИЙ КАДЕВИЧ 2008
Слайд 5Химические свойства
H2SO4 - сильная двухосновная кислота
H2SO4 ⬄ H+ +
HSO4- ⬄2H+ + SO42-
1) Взаимодействие с металлами:
разбавленная серная кислота
растворяет только металлы, стоящие в ряду напряжений левее водорода:Zn0 + H2+1SO4(разб) => Zn+2SO4 + H2
2) с основными оксидами:
CuO + H2SO4 => CuSO4 + H2O
CuO + 2H+ => Cu2+ + H2O
ВАСИЛИЙ КАДЕВИЧ 2008
Слайд 63) с основаниями:
H2SO4 + 2NaOH => Na2SO4 + 2H2O
H+ +
OH- => H2O
H2SO4 + Cu(OH)2 => CuSO4 + 2H2O
2H+ +
Cu(OH)2 => Cu2+ + 2H2O4) обменные реакции с солями:
MgCO3 + H2SO4 => MgSO4 +H2O + CO2
MgCO3 + 2H+ => Mg2+ + H2O + CO2
BaCl2 + H2SO4 => BaSO4↓ + 2HCl
Ba2+ + SO42- => BaSO4↓
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
ВАСИЛИЙ КАДЕВИЧ 2008
Слайд 7
ВАСИЛИЙ КАДЕВИЧ 2008
5) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии
с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0
или H2S-2 (без нагревания не реагируют с Fe; Al, Cr - пассивируются):2Ag0 + 2H2 +6SO4 => Ag2+1SO4 + S+4O2 + 2H2O
8Na0 + 5H2 +6SO4 => 4Na2+1SO4 + H2S-2 + 4H2O
Чем более активен металл, тем более полно восстанавливается сера
Слайд 86) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за
счет своих сильных окислительных свойств, превращаясь в соединения серы более
низкой степени окисления, (например, S+4O2):С0 + 2H2S+6O4(конц) => C+4O2 + 2S+4O2 + 2H2O
S0 + 2H2S+6O4(конц) => 3S+4O2 + 2H2O
2P0 + 5H2S+6O4(конц) => 5S+4O2 + 2H3P+5O4 + 2H2O
ВАСИЛИЙ КАДЕВИЧ 2008
Слайд 96) Гигроскопичность серной кислоты
Концентрированная серная кислота жадно набирает воду отовсюду,
образуя гидраты, и способна для этого даже разрушать молекулы. Древесина
состоит из множества органических веществ, среди которых – целлюлоза (C6H7O2(OH)3)n . Концентрированная серная кислота разрушает органические молекулы, отнимая водород и кислород – составляющие воды. Разрушение органических молекул сопровождается выделением свободного углерода. Поэтому лучинка при соприкосновении с концентрированной серной кислотой чернеет, обугливается. Кислота ведет себя, как обезвоживающий агент.ВАСИЛИЙ КАДЕВИЧ 2008
Слайд 13В природе встречается 180 минералов сульфатов, и на их долю
приходится ~0,5 % массы земной коры.
Их даже много и в
морской воде, особенно в лагунах по берегам морей. Много сульфатов и в горячих водных растворах, просачивающихся из глубин Земли.
Слайд 15
Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате
извержения, произошедшего незаметно для людей.
Тот, кто сумел достичь его
подножия, просто обязан подняться на кромку кратера. Зрелище, которое открывается глазам, незабываемо: двухсотметровый провал кратера, дымящееся зеленое озеро, буйство красок на внутренних стенках.
В ясную ветреную погоду можно спуститься в кратер.
Это обитель «подземных духов»
Это одно из чудес камчатской природы
Слайд 16Серная кислота –
очень активная жидкость, особенно
концентрированная,
которая реагирует со
многими
неорганическими веществами,
также она легко действует на
органические соединения:
обугливает
бумагу,сахар, древесину, т.е. соединения,
которые содержат в себе углерод.
Хранят ее в стеклянной таре,
а перевозят в стальных цистернах
Слайд 17ВАСИЛИЙ КАДЕВИЧ 2008
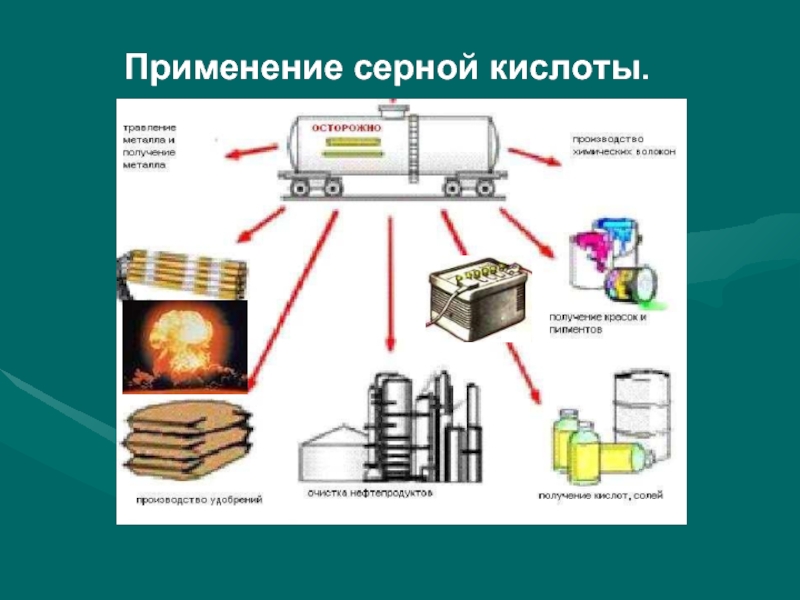
Применение H2SO4
В производстве пластмассы
В производстве синтетического волокна
В средствах
защиты растений
В моющих средствах
В лекарствах
В красителях и пигментах
В производстве
взрывчатых веществЭлектролит в аккумуляторах
В очистке нефтепродуктов
В получении солей и кислот
В металлургии
В минеральных удобрениях
Слайд 22СОЛИ СЕРНОЙ КИСЛОТЫ
CaSO4• 2H2O - гипс
CaSO4• 0,5H2O - алебастр
CuSO4• 5H2O – медный купорос
Na2SO4• 10H2O –
мирабилит (глауберова соль)MgSO4• 7H2O – горькая соль
К2SO4• Al2(SO4)3 • 24H2O – алюмокалиевые квасцы
Слайд 23Домашнее задание
Составьте инструкцию по правилам обращения с серной кислотой
• для
лаборанта кабинета химии;
• для автолюбителя, который собирается приготовить раствор серной
кислоты в качестве электролита для аккумулятора своего авто;• для хозяйки, которая в магазине «Хозтовары» покупает концентрированную серную кислоту для и планирует почистить ею ванну, чайник от известкового налета.
Изучить § 34, упражнения 3,8,10 стр. 223
.
Слайд 24
Лабораторный опыт № 7
Исследование химических свойств раствора серной кислоты
ВНИМАНИЕ
! При работе с кислотой будьте осторожны. При попадании на руки тщательно
вымойте их водой, при необходимости - нейтрализуйте раствором соды.Слайд 25В пробирках в виде растворов представлены вещества:
NaCl, NaBr,
NaI, NaF, H2SO4,
Na2CO3, Na2SO4, NaOH
Предложите план
идентификации данных веществ.Укажите качественную реакцию на серную кислоту и ее соли
Слайд 26 Если эти утверждения верны на Ваш взгляд, то напротив них
поставьте знак «+», а если нет, то знак «-»
1.
Свойства концентрированной серной кислоты обусловлены тем, чтостепень окисления серы в ней равна +6
2. Концентрированная серная кислота является восстановителем.
3. Концентрированную серную кислоту нельзя перевозить в стальных
цистернах, т.к. в состав стали входит железо
4. Концентрированная серная кислота не взаимодействует с металлами,
стоящими после водорода.
5. Концентрированная серная кислота взаимодействует с неметаллами
6. Концентрированная серная кислота диссоциирует практически
полностью с образованием ионов водорода и сульфат-ионов.
7. Продукты восстановления серы в серной кислоте могут быть со
степенями окисления +4, -2.
8. Алюминий в концентрированной серной кислоте разрушается.
9. На органические вещества концентрированная серная кислота не
действует
10. Концентрированная серная кислота может вытеснять другие кислоты
из их солей