Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочноземельные металлы
Содержание
- 1. Щелочноземельные металлы
- 2. Девиз урока :Опыт – основа познанияЖизнь без
- 3. Цели:Обобщить и системати-зировать знания о ще-лочных и
- 4. РАЗМИНКА :№1. В состав ляписа входит серебро.
- 5. Щелочные металлы : Это Li литий, Na
- 6. Положение в периодической таблице. Строение атома В периодической
- 7. Физические свойства щелочных металловцвет пламени
- 8. Физические свойства щелочноземельных металлов
- 9. Химические свойства1.
- 10. Химические свойства щелочных и щелочноземельных металлов Щелочные
- 11. Горение магния
- 12. Взаимодействие натрия с водой
- 13. Проверка знаний2Mg + O2 = 2MgO
- 14. Проверка знанийЗадание 5. Вывод о свойствах металлов.
- 15. Проверка знаний Сравните атомы
- 16. Проверь себя (самостоятельная работа )
- 17. Рефлексия. Что запомнилось на уроке, что
- 18. 6. Домашнее задание.* Подготовить сообщение о практическом
- 19. Домашнее задание: Подготовить сообщение о практическом применении
- 20. Скачать презентанцию
Девиз урока :Опыт – основа познанияЖизнь без металлов невозможна, И эта аксиома непреложна: Твердые, блестящие, ток проводящие, Для человека металлы – друзья настоящие!
Слайды и текст этой презентации
Слайд 3Цели:
Обобщить и системати-зировать знания о ще-лочных и щелочнозе-мельных металлах
Научить характери-зовать
элементы по положению в периоди-ческой таблице
Рассмотреть физ. и хим. свойства,
применение соединений щелочных и щелочноземельных металлов Научить анализировать и обрабатывать услы-шанное на уроке
Развивать коммуника-тивные умения учащихся
Воспитывать экологическую культуру учащихся
Слайд 4РАЗМИНКА :
№1. В состав ляписа входит серебро. – эл.
Степень окисления
галлия +3. – эл.
Алюминий легкий металл. – пр.
Натрий «бегает» по
воде. – пр.Галлий плавится в ладони. – пр.
Электроотрицательность цезия меньше электроотрицательности кислорода.–эл.
Максимальная оценка 3 балла. ( 6 вопросов по 0,5 балла )
№2. Использование лития в электротехнике обуславливают свойства: металлический блеск, ковкость, электропроводность, серебристый цвет. Подчеркните правильные ответы.
Максимальная оценка 1 балл.
№ 3. Составьте формулы оксидов цезия и радия. Cs2O RaO
Максимальная оценка 2 балла.
Слайд 5Щелочные металлы : Это Li литий, Na натрий, K калий,
Rb рубидий, Cs цезий, Fr франций.
Щелочноземельные металлы : Это
Mg магний, Ca кальций, Sr стронций, Ba барий и Ra радий.Слайд 6Положение в периодической таблице. Строение атома
В периодической системе находятся в
главной подгруппе
I и II группы.
Являются сильными восстановителями, отдают 1ē,
2 ē, во всех соединениях проявляют степень окисления +1, +2.
Li +3 2ē, 1ē
Na +11 2ē, 8ē, 1ē
K +19 2ē, 8ē, 8 ē, 1ē
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
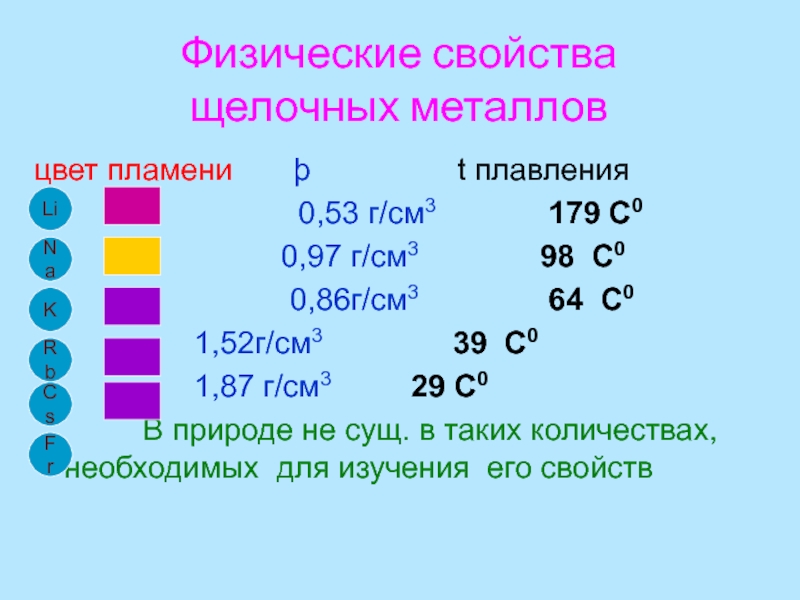
Слайд 7Физические свойства
щелочных металлов
цвет пламени þ
t плавления
0,53 г/см3 179 С0 0,97 г/см3 98 С0
0,86г/см3 64 С0
1,52г/см3 39 С0
1,87 г/см3 29 С0
В природе не сущ. в таких количествах, необходимых для изучения его свойств
Li
K
Fr
Na
Rb
Cs
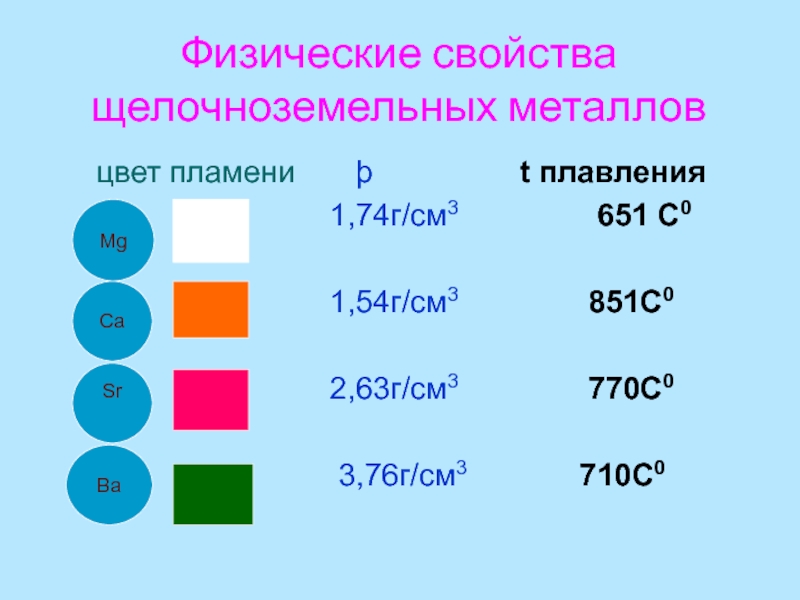
Слайд 8Физические свойства щелочноземельных металлов
цвет пламени
þ
t плавления1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 9 Химические свойства
1. Взаимодействуют с кислородом
с образованием оксидов ( основных )
4Me0 +O2 → 2Me2+1O-2
2Me0
+O2 → 2Me+2O-22. Взаимодействуют с водородом с образованием гидридов.
2Me0 +H2 → 2Me+1H
Me0 +H2 → Me+2H2
3. Взаимодействуют с неметаллами.
2Me0 +Cl02 → 2Me+1Cl
Me0 +Cl02 → Me+2Cl2
2Me0 +S0 → Me2+1S-2
Me0 +S0 → Me+2S-2
4. Взаимодействуют с кислотами с вытеснением водорода.
2Me +2HCl → 2MeCl + H2
Me +2HCl → MeCl2 + H2
5. Взаимодействуют с водой с вытеснением водорода.
2Me +2HOH → 2MeOH +Н2
Me +2HOH → Me(OH)2 +Н2
Слайд 10Химические свойства щелочных и щелочноземельных металлов
Щелочные металлы – _сильные восстановители,
взаимодействуют с простыми и сложными веществами.
С галогенами
2Li +
F2 =2 LiF Сa + Cl2 = СaCl2 C кислородом
4Li + O2 =2Li2O 2Сa + O2 = 2СaO
3) С водородом
2Na + Н2 = 2NaН Сa + Н2 = СaН2
4) С азотом
6 Li + N2 = 2Li 3N 3Сa + N 2 = Сa3N 2
5) С водой
2 Li + 2Н2О = 2LiОН + Н2 Сa + 2Н2О = Сa (ОН) 2 + Н2
6) С кислотами
2Na + Н2SО4 = Na2SО4 + Н2 Сa + Н2SО4 = СaSО4 + Н2
Слайд 14Проверка знаний
Задание 5. Вывод о свойствах металлов. Заполните пропуски нужными
словами.
Радиус атомов металлов больше радиуса атомов неметаллов. Во всех соединениях
ионы металлов имеют положительные степени окисления. При комнатной температуре металлы находятся в твердом агрегатном состоянии, за исключением ртути Металлы обладают характерным блеском. Они хорошо проводят эл. ток и тепло. Самый тяжёлый металл – осмий, самый легкий – литий, самый тугоплавкий – вольфрам, самый легкоплавкий – ртуть.
0,2 *12 = 2,4
Слайд 15Проверка знаний
Сравните атомы элементов, поставив знаки
или = вместо *:
а) заряд ядра: Mg *
Ca, Na *< Mg, Ca > * К;б) число электронных слоев: Mg *< Ca, Na * = Mg,
Ca * = К;
в) число электронов на внешнем уровне: Mg * = Ca,
Na *< Mg, Ca > * К;
г) радиус атома: Mg *< Ca, Na = * Mg, Ca = * K;
д) восстановительные свойства: Mg *< Ca, Na * > Mg,
Ca *< K.
Слайд 16 Проверь себя
(самостоятельная работа )
Дополните схемы взаимодействия щелочных ( 1 вар. ) и
щелочноземельных ( 2 вар. ) металлов с неметаллами общими формулами и названиями продуктов реакции.1. Запишите конкретные уравнения реакции:
а) Ме + S = ______ б) Ме + N2 = _______ ____________________________
в) Ме + Н 2 = _______ г) Ме + С12 = ______
Пример: ___________________
2. Допишите уравнения реакций:
1 вар. а) Са + H2O→ ……………2 вар. а) Mg + НСl→……………
б) Li + НСl→……………… б) Nа + H2O→ ………
в) Ва + О2→………………… в) K + О2→……………
3. Осуществить превращения по схеме:
1 вар. 2 вар.
Ме → МеО → Ме(ОН)2 → МеSО4 Ме → Ме2 О → МеОН → Ме2 SО4
Слайд 17Рефлексия.
Что запомнилось на уроке, что понравилось.
А) Что я узнал
о химических свойствах металлов?
Б) Для чего необходимо знать химические свойства
металлов?В) Что бы Вы могли предложить для лучшего усвоения материала по данной теме?