Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углерод
Содержание
- 1. Углерод
- 2. Строение атома В периодической таблице химических элементов углерод
- 3. Нахождение в природеСодержание углерода в земной коре
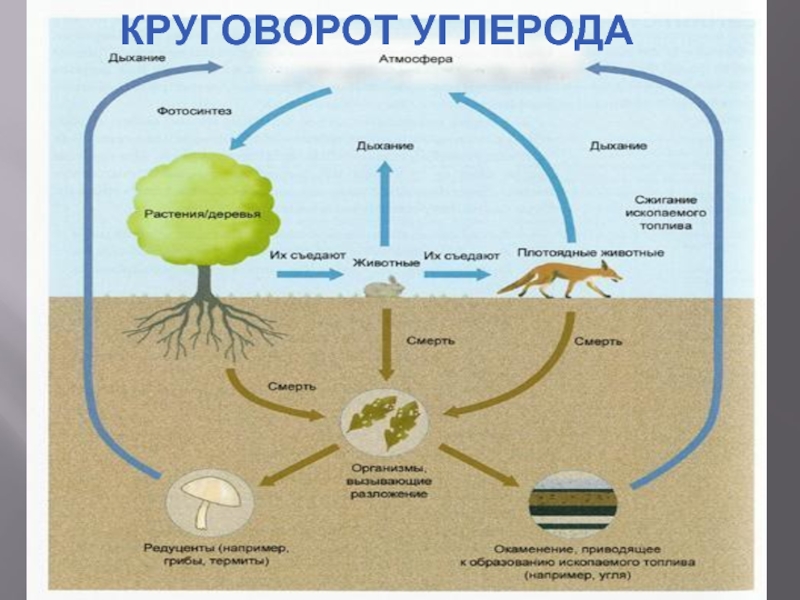
- 4. КРУГОВОРОТ УГЛЕРОДА
- 5. Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит.Графит (от др.-греч. γράφω —
- 6. Аллотропия углеродаАлма́з (от араб. ألماس, ’almās, тур. elmas, которое идёт через арабск. из др.-греч.
- 7. Химические свойстваПродукты горения углерода в кислороде являются
- 8. Применение Графит используется в карандашной промышленности. Также его
- 9. Углерод играет огромную роль в жизни человека.
- 10. Домашнее задание Параграф 29, упр. 5,6,8 (письменно)
- 11. Скачать презентанцию
Строение атома В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы.Углерод (С) — неметалл. Возможные степени окисления: -4; 0; +2; +4. Формулы высшего оксида и
Слайды и текст этой презентации
Слайд 1Углерод
Составил:
учитель химии
МОУ «Средняя общеобразовательная
школа №92 с углубленным
изучением
отдельных предметов»
Слайд 2Строение атома
В периодической таблице химических элементов углерод (С) расположен во
втором периоде, в IV группе главной подгруппы.
Углерод (С) — неметалл.
Возможные степени окисления: -4; 0; +2; +4. Формулы высшего оксида и гидроксида: СО2 и Н2СО3. Оба соединения проявляют кислотные свойства.Слайд 3Нахождение в природе
Содержание углерода в земной коре 0,1 % по массе.
Свободный углерод находится в природе в виде алмаза и графита.
Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).Слайд 5Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит.
Графит (от др.-греч. γράφω — пишу) — минерал из класса
самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Хорошо проводит электрический ток. В
отличие от алмаза обладает низкой твёрдостью. Плотность 2,08—2,23 г/см³. Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. В кислотах не растворяется. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).Аллотропия углерода
Слайд 6Аллотропия углерода
Алма́з (от араб. ألماس, ’almās, тур. elmas, которое идёт через арабск. из др.-греч. ἀδάμας — «несокрушимый») —минерал, кубическая аллотропная
форма углерода. Главные отличительные черты алмаза — высочайшая среди минералов твёрдость, наиболее высокая теплопроводность среди
всех твёрдых тел. Температура плавления алмаза составляет 3700—4000 °C. На воздухе алмаз сгорает при 850—1000 °C, а в струе чистого кислорода горит слабо-голубым пламенем при 720—800 °C, полностью превращаясь в конечном счёте в углекислый газ. При нагреве до 2000 °C без доступа воздуха алмаз переходит в графит за 15-30 минутСлайд 7Химические свойства
Продукты горения углерода в кислороде являются CO и CO2 (монооксид
углерода и диоксид углерода соответственно).
С + О2=СО2
При реакции углерода с серой получается сероуглерод CS2
С
большинством металлов, бором и кремнием углерод образует карбиды, например:4Al + 3C = Al4C3(карбид алюминия);
Ca + 2C = CaC2(карбид кальция).
Важна в промышленности реакция углерода с водяным паром:
C + H2O = CO + H2
Слайд 8Применение
Графит используется в карандашной промышленности. Также его используют в качестве смазки
при особо высоких или низких температурах.
Алмаз, благодаря исключительной твёрдости, незаменимый абразивный материал.
Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.Слайд 9Углерод играет огромную роль в жизни человека. Его применения столь
же разнообразны, как сам этот многоликий элемент. В частности углерод
является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человесества.