Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биохимия мышечной ткани
Содержание
- 1. Биохимия мышечной ткани
- 2. Слайд 2
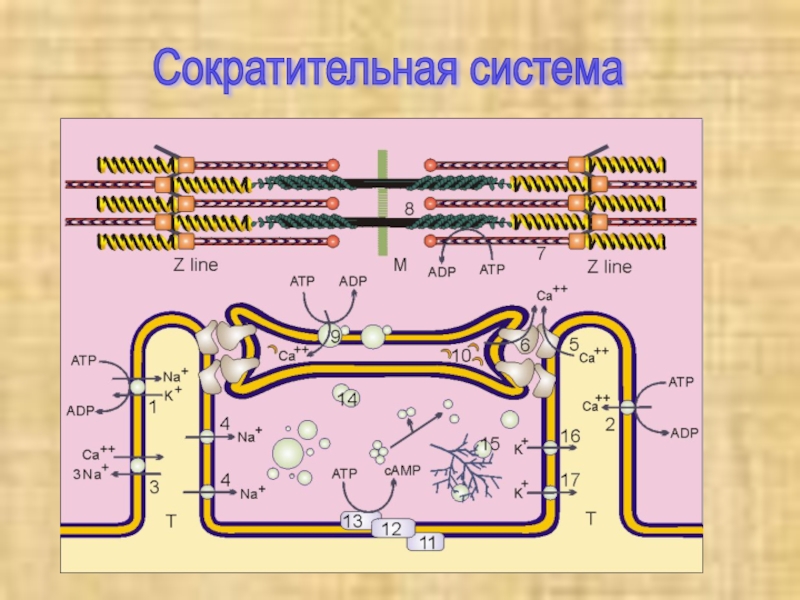
- 3. Сократительная система
- 4. Организация скелетных мышц позвоночныхСократительные элементы, саркомеры, состоят
- 5. Слайд 5
- 6. В количественном отношении наиболее важным белком миофибрилл
- 7. Главным белком тонких нитей является актин (42
- 8. Слайд 8
- 9. Механизм сокращения мышечных волокон
- 10. В отсутствие АТФ (АТР), т. е. в
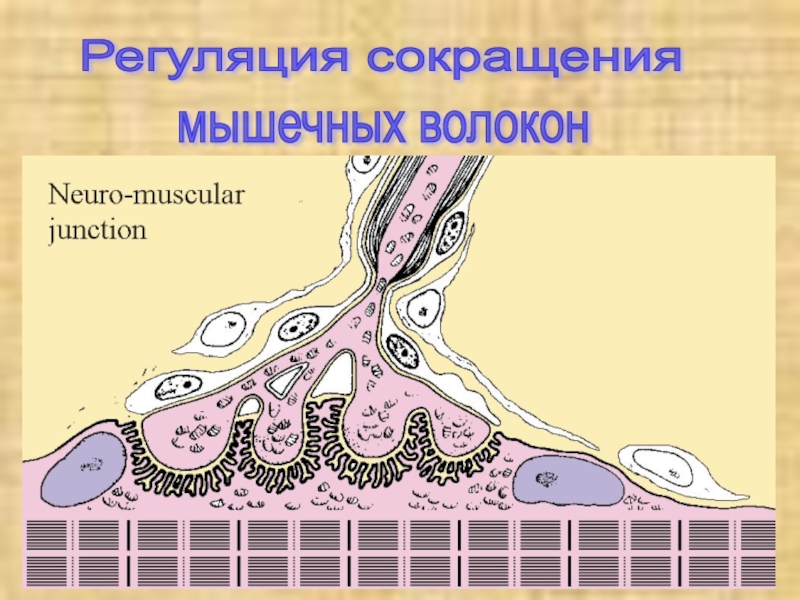
- 11. Регуляция сокращения мышечных волокон
- 12. Слайд 12
- 13. Электромеханическое
- 14. Слайд 14
- 15. Саркоплазматический
- 16. Переносу потенциала действия на СР индивидуальной миофибриллы
- 17. Слайд 17
- 18. В расслабленной скелетной мышце комплекс тропонина (субъединицы
- 19. Таким образом, при сокращении мышечного волокна скелетных
- 20. Источники энергии
- 21. Энергетический обмен в мышечной тканиВажнейшей функцией мышечного
- 22. Потребности работающей мышцы в АТФ удовлетворяются за
- 23. 2 Анаэробный гликолиз. В мышечной ткани наиболее
- 24. 4. Образование инозинмонофосфата [ИМФ (IMP)]. Другим источником
- 25. Метаболическая регуляция мышечного сокращения
- 26. Слайд 26
- 27. В клетках, не содержащих митохондрий (например, в
- 28. Обратная связь, подобная циклу Кори, существует в
- 29. Слайд 29
- 30. Метаболизм белков и аминокислотСкелетные мышцы активно участвуют
- 31. Синтез и расщепление мышечных белков контролируются гормонами.
- 32. Белки мышцБелки саркоплазмы миоглобин, белки–ферментыБелки миофибриллСократительные белки: миозин, актин, актомиозинРегуляторные белки: тропомиозин, тропонинБелки стромы эластин, коллаген
- 33. МиоглобинДыхательный белок мышцГемопротеинСодержит 153 аминокислотных остаткаОсновная функция
- 34. Слайд 34
- 35. МиозинСоставляет 50 – 55% от массы миофибриллФибриллярный
- 36. АктинСоставляет 20% от массы миофибриллНебольшой глобулярный белокСостоит
- 37. актиновая нить
- 38. Тропомиозинфибриллярный белоксостоит из 2 α-спиралейна 1 молекулу
- 39. ТропонинГлобулярный белокВ состав входят 3 субъединицы:Тн-Т –
- 40. В мышцах присутствует фетальная форма миозина, обладающая
- 41. Биосинтез и распад креатинаКреатин и креатининфосфат
- 42. Синтез креатинаПервая стадия синтеза креатина протекает в
- 43. Вторая стадия – метилирование-
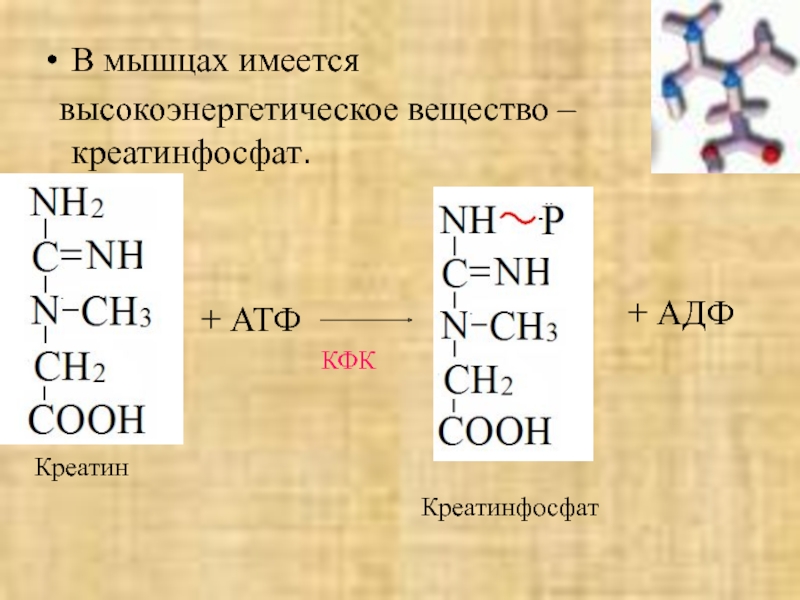
- 44. В мышцах имеется высокоэнергетическое вещество – креатинфосфат.КреатинКФК+ АТФ+ АДФКреатинфосфат
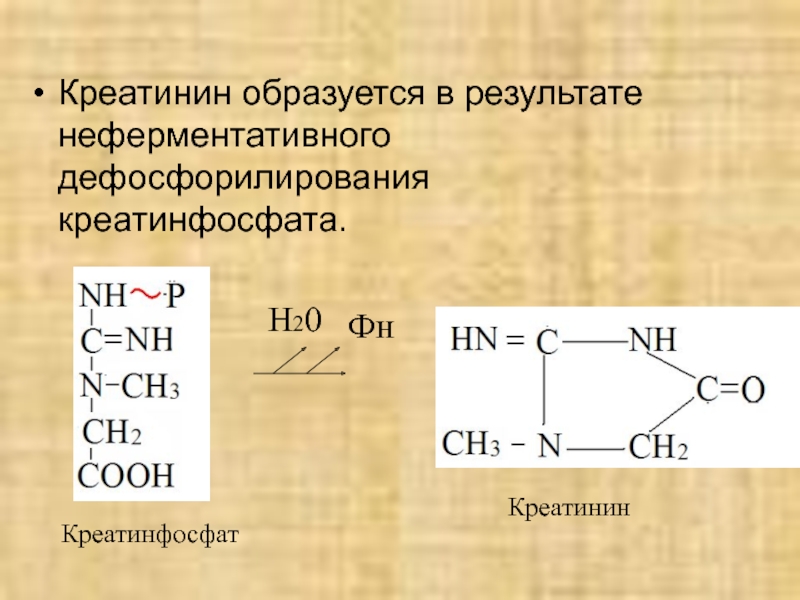
- 45. Креатинин образуется в результате неферментативного дефосфорилирования креатинфосфата.ФнН20Креатинфосфат Креатинин
- 46. Содержание в плазме кровиВ плазме крови в
- 47. Диагностическое значение уровень креатинина в сыворотке –
- 48. Физиологическая креатинурия наблюдается у новорожденных, так как
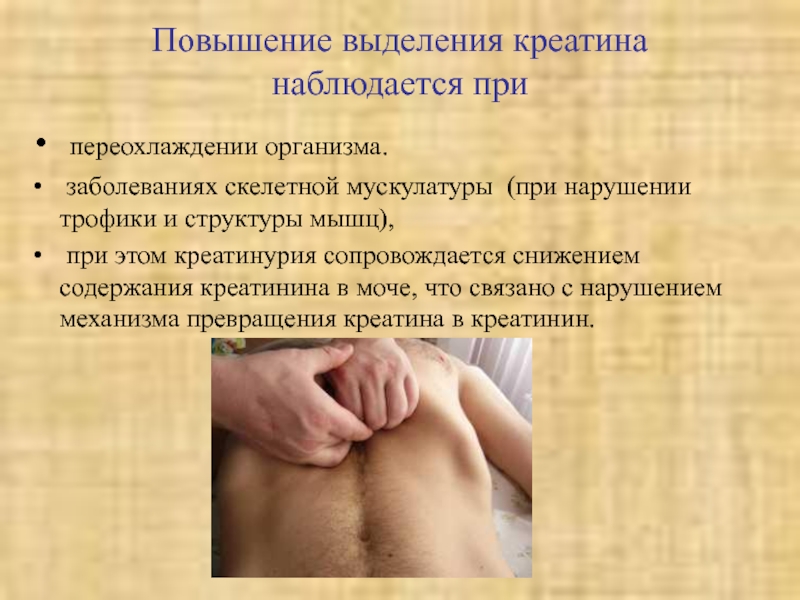
- 49. Повышение выделения креатина наблюдается при переохлаждении
- 50. Скачать презентанцию
Сократительная система
Слайды и текст этой презентации
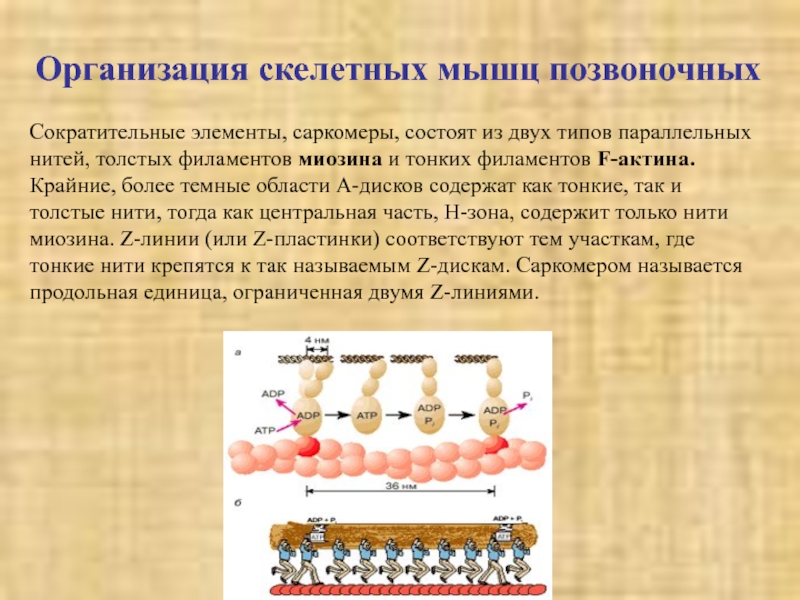
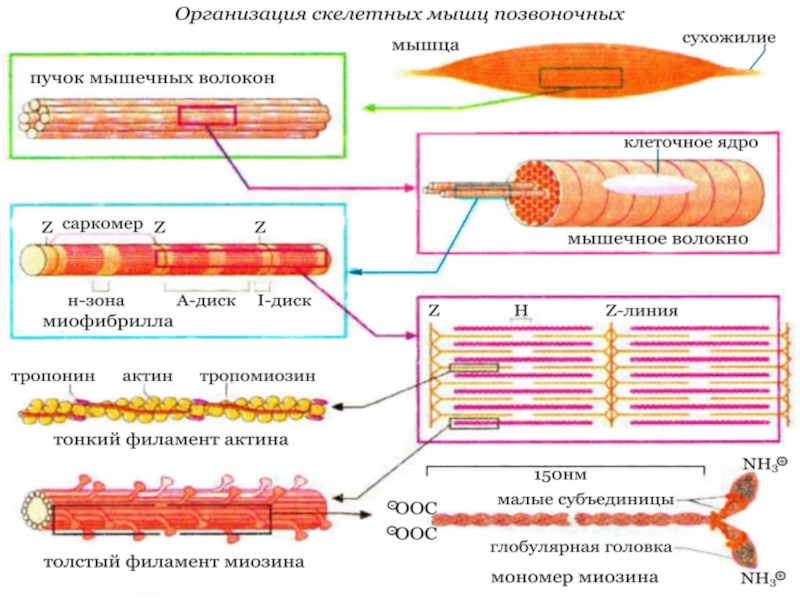
Слайд 4Организация скелетных мышц позвоночных
Сократительные элементы, саркомеры, состоят из двух типов
Слайд 6В количественном отношении наиболее важным белком миофибрилл является миозин (~65%
мышечного белка). Молекула миозина построена из шести субъединиц, двух идентичных
тяжелых цепей (2 х 223 кДа) и четырех легких цепей (~20 кДа), связанных нековалентно. Каждая тяжелая цепь миозина имеет форму длинного стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (на схеме внизу справа). α-Спиральные участки двух тяжелых цепей свернуты в двойную суперспираль, а четыре небольших субъединицы связаны с глобулярными головками. В мышечном волокне миозин образует толстые миозиновые филаменты, которые представляют собой пучки из сотен молекул миозина, расположенных параллельно. Головка молекулы миозина обладаетСа2+-зависимой АТФ-азной активностью
(КФ 3.6.1.32), которая регулируется
малыми субъединицами.
Слайд 7Главным белком тонких нитей является актин (42 кДа, ~20-25% мышечного
белка). Фибриллярный F-актин является важным структурным элементом цитоскелета; он находится
в равновесии с глобулярным G-актином.Кроме этих двух белков система включает тропомиозин и комплекс тропонина. Нитевидный тропомиозин (64 кДа) связан с F-актином, охватывая примерно семь актиновых субъединиц. Тропонин (78 кДа) - комплекс, состоящий из трех различных субъединиц (Т, С, I), способен связываться как с актином, так и с тропомиозином. Остальные белки, присутствующие в гораздо меньшем количестве, включают α- и β-актинин, десмин, коннектин (титин) и виментин.
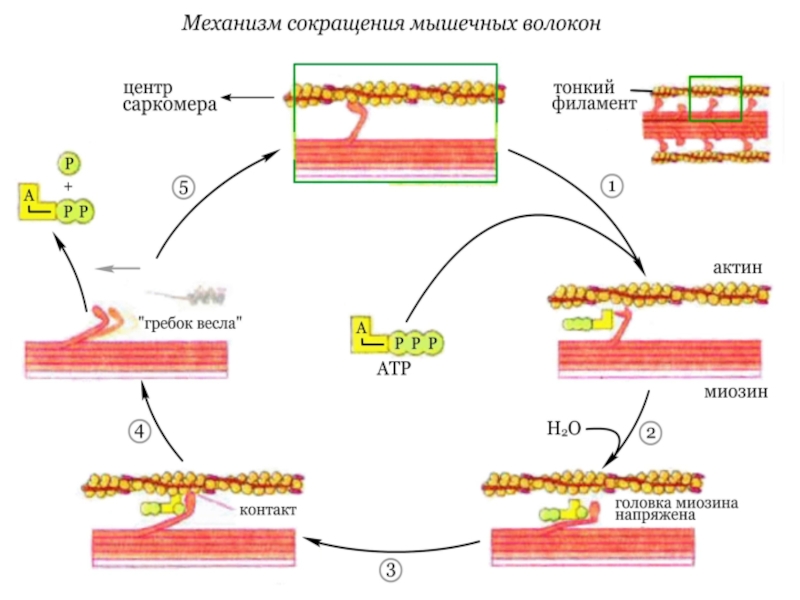
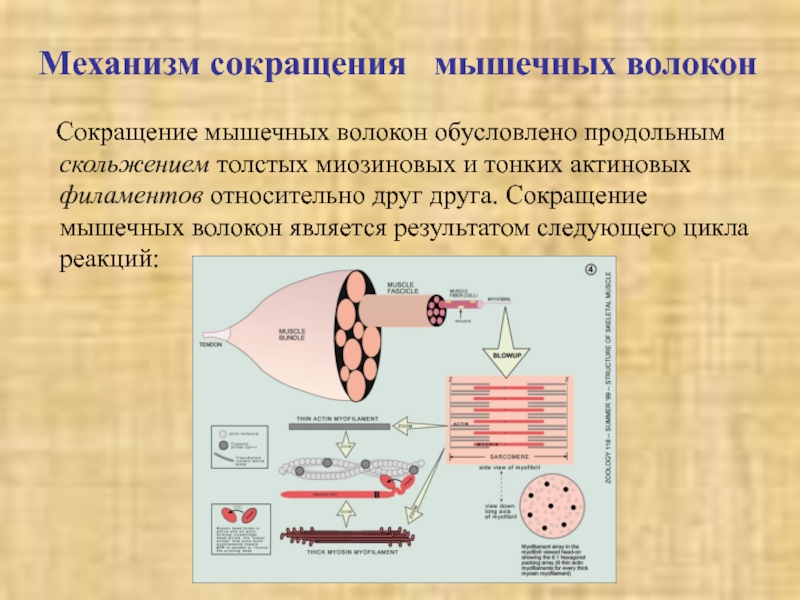
Слайд 9Механизм сокращения мышечных волокон
Сокращение мышечных
волокон обусловлено продольным скольжением толстых миозиновых и тонких актиновых филаментов
относительно друг друга. Сокращение мышечных волокон является результатом следующего цикла реакций:Слайд 10В отсутствие АТФ (АТР), т. е. в исходном состоянии, головки
молекул миозина прочно связаны с актиновыми нитями. При связывании АТФ
головки отделяются от актиновых нитей.АТФ-аза головок миозина гидролизует АТФ на АДФ и неорганический фосфат, но продолжает удерживать оба продукта реакции близко друг от друга. Гидролиз АТФ вызывает аллостерические изменения в миозиновой головке.
Теперь головка миозина образует новый мостик с соседней молекулой актина.
Актин ускоряет выброс продуктов АТФ-азной реакции из активного центра миозина. Это приводит к преобразованию аллостерического напряжения и изменению конформации головки миозина, которое действует подобно «удару весла» (модель весельной лодки). Во время этого «гребка» миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового филамента по направлению к Z-диску. Цикл повторяется до тех пор, пока имеется АТФ.
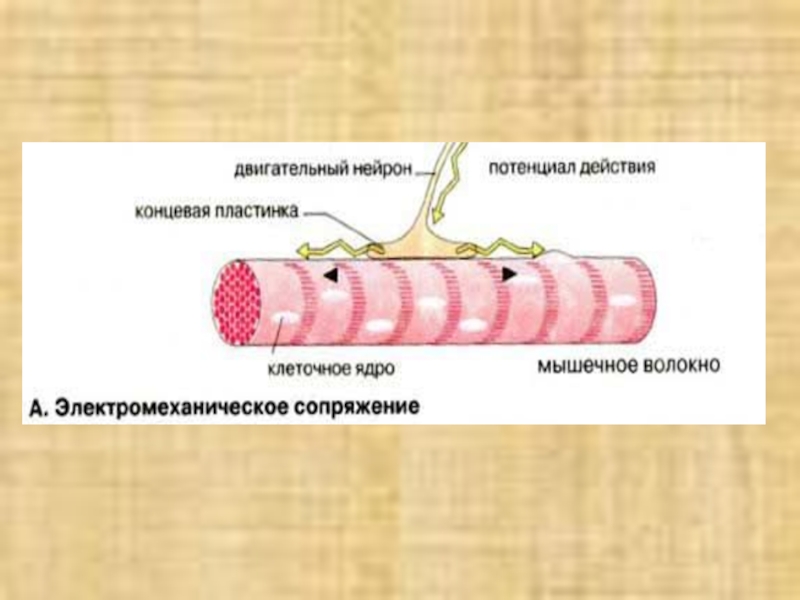
Слайд 13
Электромеханическое сопряжение
Сокращением мышечного волокна
управляют двигательные нейроны, которые выделяют нейромедиатор ацетилхолин в нервно-мышечные соединении
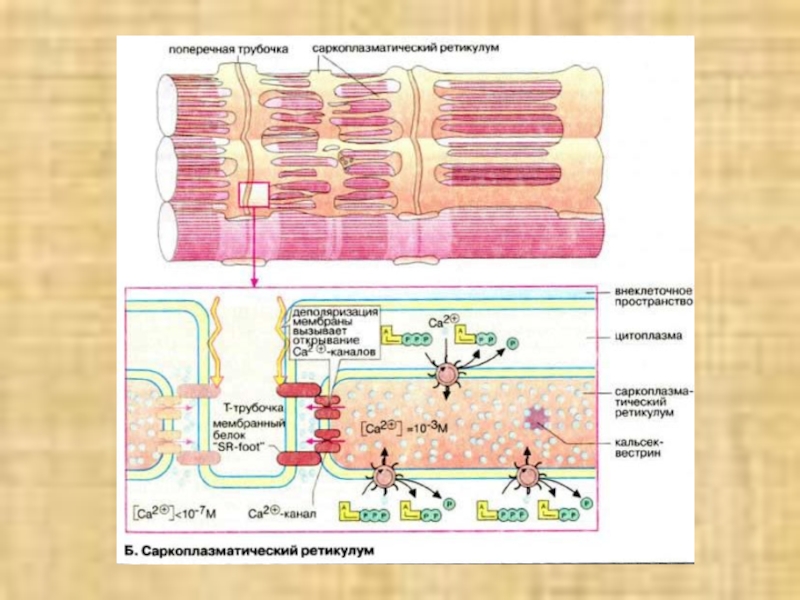
(синапсы). Ацетилхолин диффундирует через синаптическую щель и взаимодействуют с ацетилхолиновыми (холинэргическими) рецепторами плазматической мембраны мышечных клеток. Это вызывает открывание трансмембранных ионных каналов и деполяризацию клеточной мембраны (образование потенциала действия). Потенциал действия быстро распространяется по всем направлениям от нервно-мышечного соединения, возбуждая все мышечные клетки. В течение нескольких миллисекунд реализуется рассмотренный выше цикл сокращения мышечного волокна.Слайд 15 Саркоплазматический ретикулум
Саркоплазматический ретикулум [СР
(SR)] – разветвленная подобная эндоплазматическому ретикулуму органелла, окружающая индивидуальные миофибриллы
подобно сетке (в верхней части схемы в качестве примера приведен СР клетки сердечной мышцы). В покоящихся клетках концентрация Са2+ очень низка (менее 10-5 М). Однако в саркоплазматическом ретикулуме уровень ионов Са2+ существенно выше (около 10-3 М). Высокая концентрация Са2+ в СР поддерживается Са2+-АТФ-азами. Кроме того, в СР имеется специальный белоккальсеквестрин (55 кДа), который благодаря высокому
содержанию кислых
аминокислот способен прочно связывать ионы Са2+.
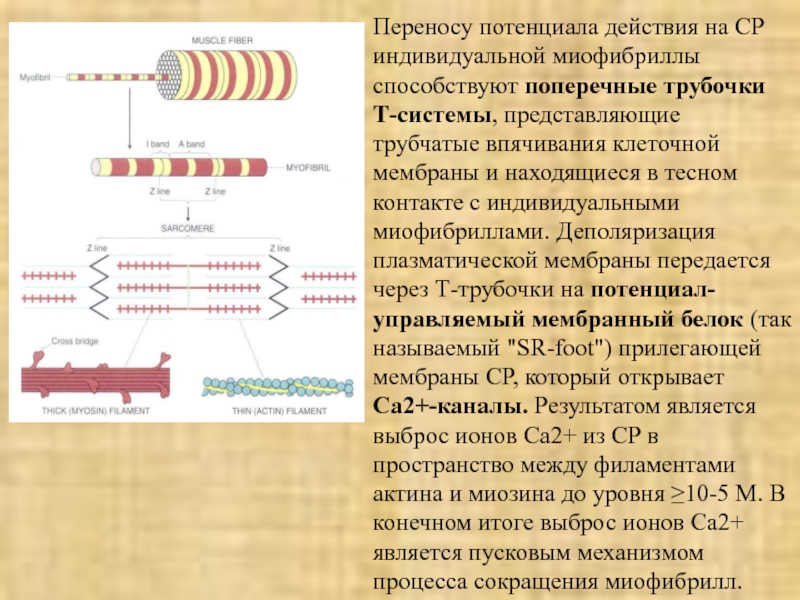
Слайд 16Переносу потенциала действия на СР индивидуальной миофибриллы способствуют поперечные трубочки
Т-системы, представляющие трубчатые впячивания клеточной мембраны и находящиеся в тесном
контакте с индивидуальными миофибриллами. Деполяризация плазматической мембраны передается через Т-трубочки на потенциал-управляемый мембранный белок (так называемый "SR-foot") прилегающей мембраны СР, который открывает Са2+-каналы. Результатом является выброс ионов Са2+ из СР в пространство между филаментами актина и миозина до уровня ≥10-5 M. В конечном итоге выброс ионов Са2+ является пусковым механизмом процесса сокращения миофибрилл.Слайд 18
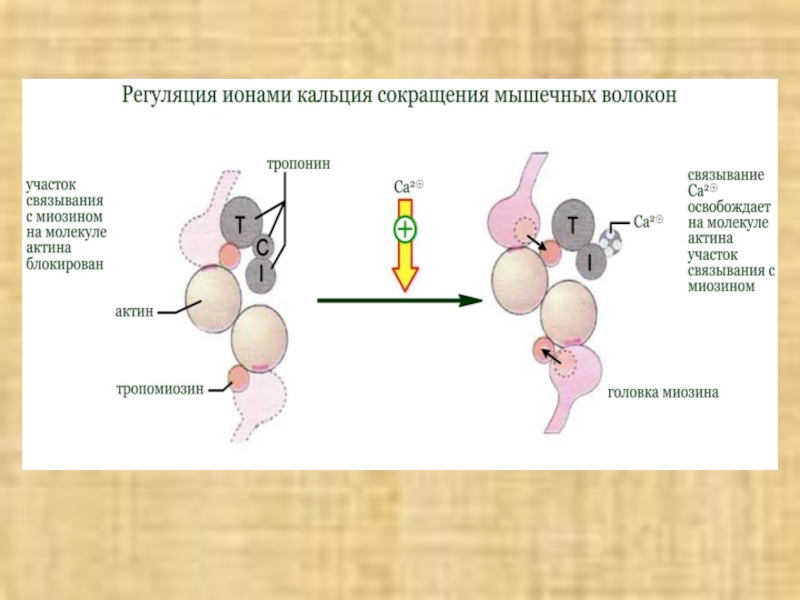
В расслабленной скелетной мышце комплекс
тропонина (субъединицы = Т, С,
I) с
тропомиозином препятствует взаимодействию
миозиновых головок с актином.
Быстрое увеличение
в цитоплазме концентрации ионов кальция в результате открывания каналов СР приводит к
связыванию Са2+ с С-субъединицей тропонина. Последняя по свойствам близка кальмодулину. Связывание ионов Са2+ вызывает конформационную перестройку в тропонине, тропонинтропомиозиновый комплекс разрушается и освобождает на молекуле актина участок связывания с миозином (на схеме выделен красным цветом). Это инициирует цикл мышечного сокращения.
В отсутствие последующего стимулирования АТФ-зависимые кальциевые насосы мембраны СР быстро снижают концентрацию ионов Ca2+ до исходного уровня. Как следствие, комплекс Са2+ с тропонином С диссоциирует, тропонин восстанавливает исходную конформацию, место связывания миозина на актине блокируется и мышца расслабляется.
Регуляция ионами кальция
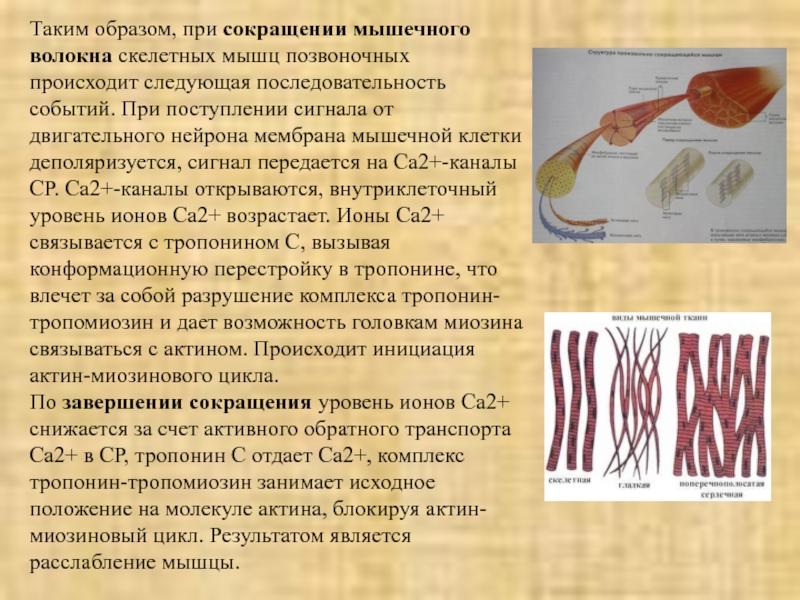
Слайд 19Таким образом, при сокращении мышечного волокна скелетных мышц позвоночных происходит
следующая последовательность событий. При поступлении сигнала от двигательного нейрона мембрана
мышечной клетки деполяризуется, сигнал передается на Сa2+-каналы СР. Са2+-каналы открываются, внутриклеточный уровень ионов Са2+ возрастает. Ионы Сa2+ связывается с тропонином С, вызывая конформационную перестройку в тропонине, что влечет за собой разрушение комплекса тропонин-тропомиозин и дает возможность головкам миозина связываться с актином. Происходит инициация актин-миозинового цикла.По завершении сокращения уровень ионов Са2+ снижается за счет активного обратного транспорта Са2+ в СР, тропонин С отдает Са2+, комплекс тропонин-тропомиозин занимает исходное положение на молекуле актина, блокируя актин-миозиновый цикл. Результатом является расслабление мышцы.
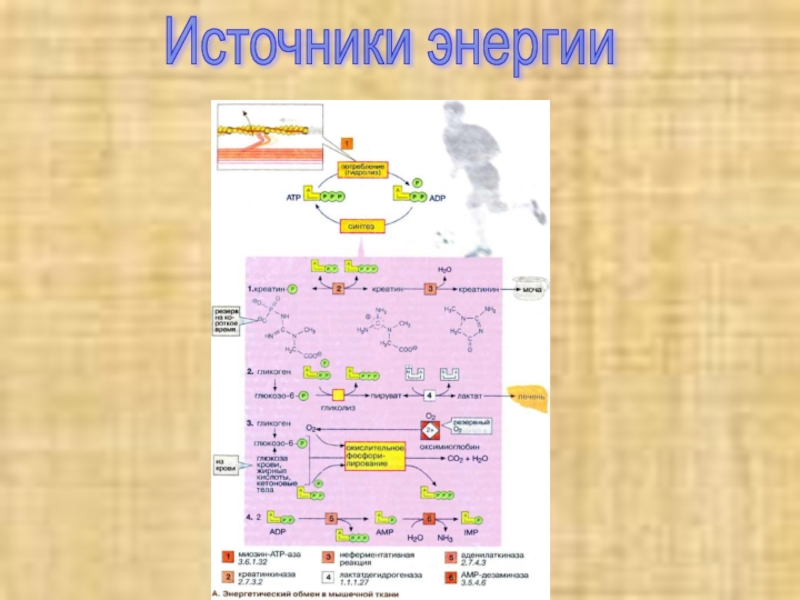
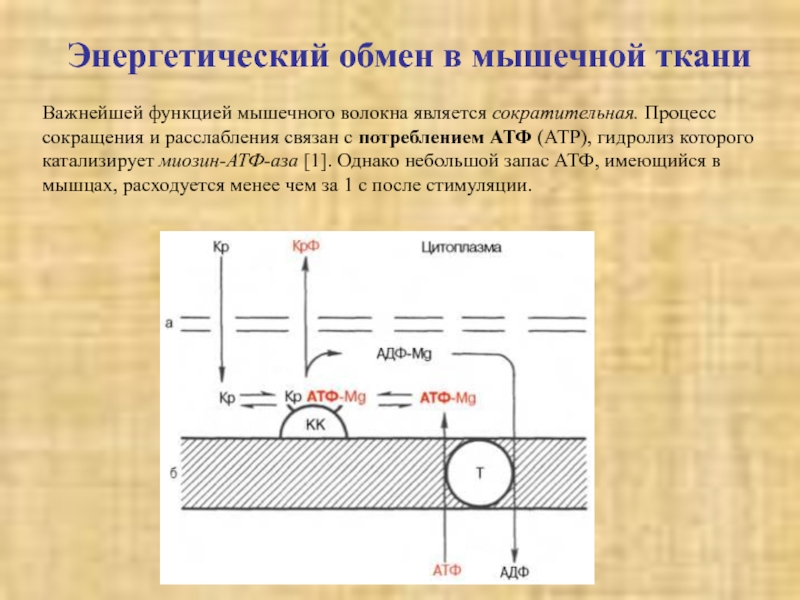
Слайд 21Энергетический обмен в мышечной ткани
Важнейшей функцией мышечного волокна является сократительная.
Процесс сокращения и расслабления связан с потреблением АТФ (АТР), гидролиз
которого катализирует миозин-АТФ-аза [1]. Однако небольшой запас АТФ, имеющийся в мышцах, расходуется менее чем за 1 с после стимуляции.Слайд 22Потребности работающей мышцы в АТФ удовлетворяются за счет следующих ферментативных
реакций:
1. Резерв в виде креатинфосфата. Быстрая регенерация АТФ может быть
достигнута за счет переноса фосфатной группы креатинфосфата на АДФ (ADP) в реакции, катализируемой креатинкиназой [2]. Однако и этот мышечный резерв «высокоэргического фосфата» расходуется в течение нескольких секунд. В спокойном состоянии креатинфосфат вновь синтезируется из креатина. При этом фосфатная группа присоединяется по гуанидиновой группе креатина (N-гуанидино-N-метилглицина). Креатин, который синтезируется в печени, поджелудочной железе и почках, в основном накапливается в мышцах. Здесь креатин медленно циклизуется за счет неферментативной реакции [3] с образованием креатинина, который поступает в почки и удаляется из организма.Слайд 232 Анаэробный гликолиз. В мышечной ткани наиболее важным долгосрочным энергетическим
резервом является гликоген. В покоящейся ткани содержание гликогена составляет до
2% от мышечной массы. При деградации под действием фосфорилазы гликоген легко расщепляется с образованием глюкозо-6-фосфата, который при последующем гликолизе превращается в пируват. При большой потребности в АТФ и недостаточном поступлении кислорода пируват за счет анаэробного гликолиза восстанавливается в молочную кислоту (лактат), которая диффундирует в кровь.3. Окислительное фосфорилирование. В аэробных условиях образующийся пируват поступает в митохондрии, где подвергается окислению. Окислительное фосфорилирование - наиболее эффективный и постоянно действующий путь синтеза АТФ. Однако этот путь реализуется при условии хорошего снабжения мышц кислородом. Наряду с глюкозой, образующейся при расщеплении мышечного гликогена, для синтеза АТФ используются и другие "энергоносители", присутствующие в крови: глюкоза крови, жирные кислоты и кетоновые тела.
Слайд 244. Образование инозинмонофосфата [ИМФ (IMP)]. Другим источником быстрого восстановления уровня
АТФ является конверсия АДФ в АТФ и АМФ (AMP), катализируемая
аденилаткиназой (миокиназой) [5]. Образовавшийся АМФ за счет дезаминирования частично превращается в ИМФ (инозинмонофосфат), что сдвигает реакцию в нужном направлении.Из всех способов синтеза АТФ наиболее продуктивным является окислительное фосфорилирование. За счет этого процесса обеспечиваются потребности в АТФ постоянно работающей сердечной мышцы (миокарда). Вот почему для успешной работы сердечной мышцы обязательным условием является достаточное снабжение кислородом (инфаркт миокарда — это следствие перебоев в поступлении кислорода).
В высокоактивных (красных) скелетных мышцах источником энергии для рефосфорилирования АДФ служит окислительное фосфорилирование в митохондриях. В обеспечении этих мышц кислородом принимает участие миоглобин (Mb) - близкий гемоглобину белок, обладающий свойством запасать кислород. В малоактивных скелетных мышцах, лишенных красного миоглобина и поэтому белых, главным источником энергии для восстановления уровня АТФ является анаэробный гликолиз. Такие мышцы сохраняют способность к быстрым сокращениям, однако они могут работать лишь короткое время, поскольку при гликолизе образование АТФ идет с низким выходом. Спустя некоторое время мышцы истощаются в результате изменения рН в мышечных клетках.
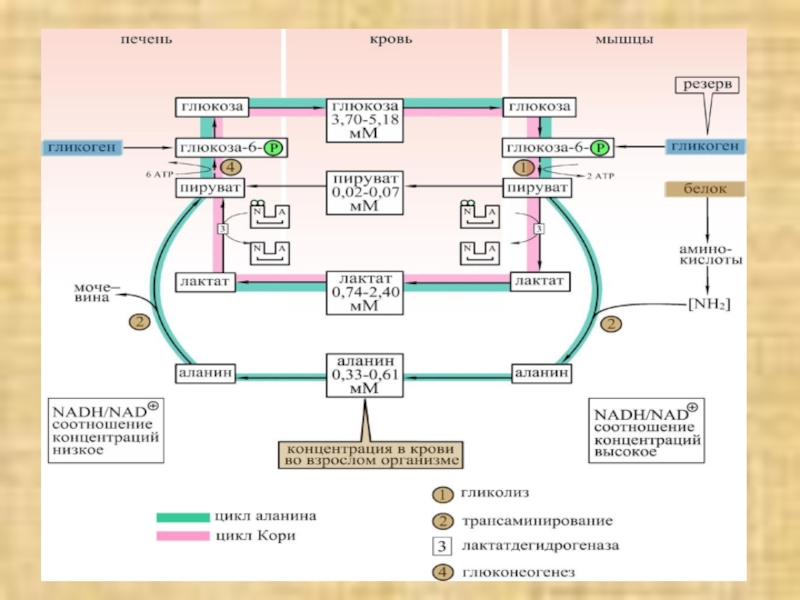
Слайд 27В клетках, не содержащих митохондрий (например, в эритроцитах), или в
тканях при недостаточном снабжении кислородом (например, в активно работающих мышцах)
АТФ (АТР) синтезируется за счет процесса превращений глюкозы в лактат, т. е. за счет процесса брожения. Лактат переносится кровью в печень, где в процессе глюконеогенеза с затратой АТФ вновь конвертируется в глюкозу (цикл Кори).При интенсивной работе мышцы максимально активируется гликолиз. Продукт гликолиза, пировиноградная кислота (пируват) накапливается в цитоплазме и недостаточно быстро поступает в митохондрии, если они из-за недостатка кислорода не готовы к окислению пирувата. В анаэробных условиях пируват в реакции, катализируемой лактатдегидрогеназой (заключительный этап гликолиза) восстанавливается до лактата. Одновременно НАДН (NADH), кофермент лактатдегидрогеназы, окисляется до НАД+ (NAD+), который вновь используется на окислительном этапе гликолитического пути. Этой реакции способствует относительно высокое отношение НАДН/НАД+ в мышечной ткани. Лактат диффундирует в кровь и поступает в печень, где конвертируется в глюкозу. Таким образом, образование лактата временно заменяет аэробный метаболизм глюкозы и частично переносит этот процесс из мышц в печень.
Слайд 28Обратная связь, подобная циклу Кори, существует в цикле аланина, в
котором также участвует пируват. Цикл аланина берет начало с протеолиза
белков. Образующиеся аминокислоты в результате трансаминирования в присутствии ферментов превращаются в α-кетокислоты, которые в основном включаются в цикл трикарбоновых кислот (цитратный цикл).Одновременно в реакции, катализируемой аланинтрансаминазой, аминогруппы из разных аминокислот переносятся на имеющийся субстрат, пируват. Образующийся аланин поступает в кровь и переносится в печень. Таким образом, цикл аланина служит каналом передачи азота и предшественников глюкозы в печень, которая является местом синтеза конечных продуктов азотистого обмена, например мочевины.Следует напомнить, что при анаэробном гликолизе образуются кислоты, которые, не принимая участие в последующем обмене, существуют в форме анионов. Поэтому при интенсивном анаэробном гликолизе рН мышечной клетки может понизиться настолько, что сокращение станет невозможным. Обычно этого не происходит благодаря быстрому выходу кислых метаболитов (лактата и пирувата) в кровь, которая также может оказаться закисленной (метаболический ацидоз).
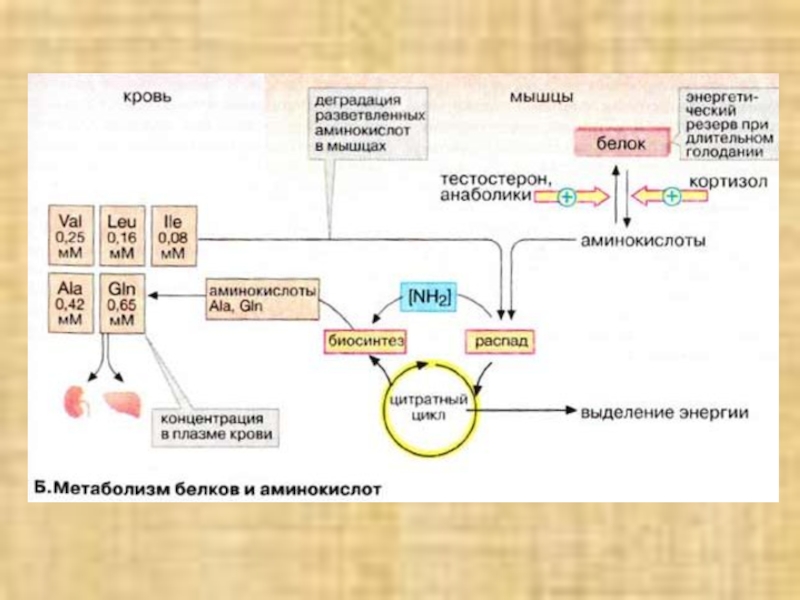
Слайд 30Метаболизм белков и аминокислот
Скелетные мышцы активно участвуют в метаболизме аминокислот.
Это наиболее важный участок деградации разветвленных аминокислот. Ряд других аминокислот
также деградируются преимущественно в мышцах. Одновременно идет ресинтез и высвобождение в кровь аланина и глутамина. Эти аминокислоты служат переносчиками азота, образующегося при расщеплении белков, в печень (цикл аланина) и почки.При голодании мышечные белки служат энергетическим резервом организма. Они гидролизуются до аминокислот, которые поступают в печень. Здесь углеродный скелет аминокислот конвертируется в промежуточные продукты цитратного цикла, в том числе в ацетоацетил-КоА и ацетил-КоА. Эти амфиболические соединения окисляются в цикле трикарбоновых кислот или включаются в процесс глюконеогенеза.
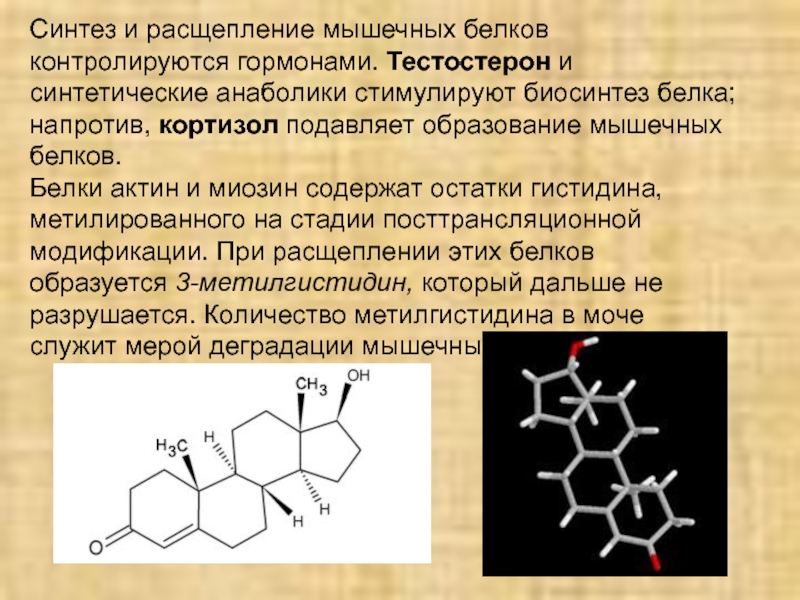
Слайд 31Синтез и расщепление мышечных белков контролируются гормонами. Тестостерон и синтетические
анаболики стимулируют биосинтез белка; напротив, кортизол подавляет образование мышечных белков.
Белки
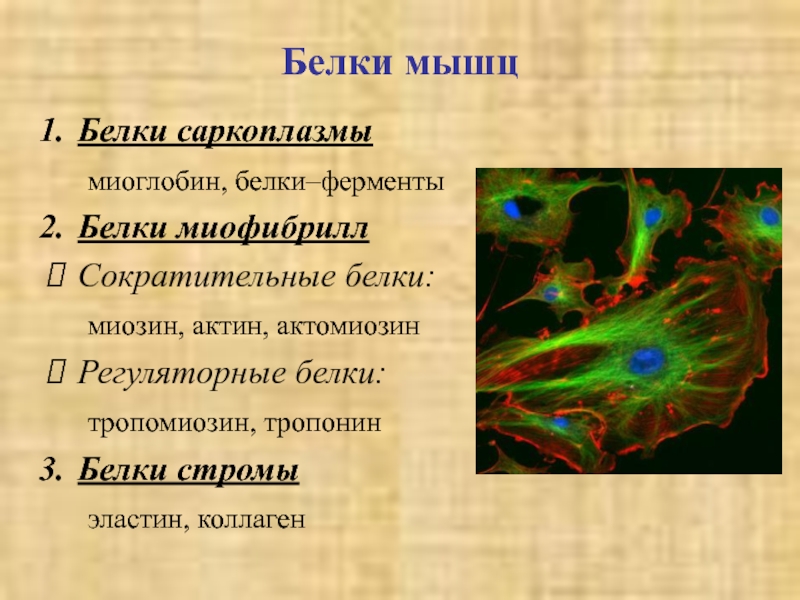
актин и миозин содержат остатки гистидина, метилированного на стадии посттрансляционной модификации. При расщеплении этих белков образуется 3-метилгистидин, который дальше не разрушается. Количество метилгистидина в моче служит мерой деградации мышечных белков.Слайд 32Белки мышц
Белки саркоплазмы
миоглобин, белки–ферменты
Белки миофибрилл
Сократительные белки:
миозин, актин, актомиозин
Регуляторные белки:
тропомиозин, тропонин
Белки
стромы
эластин, коллаген
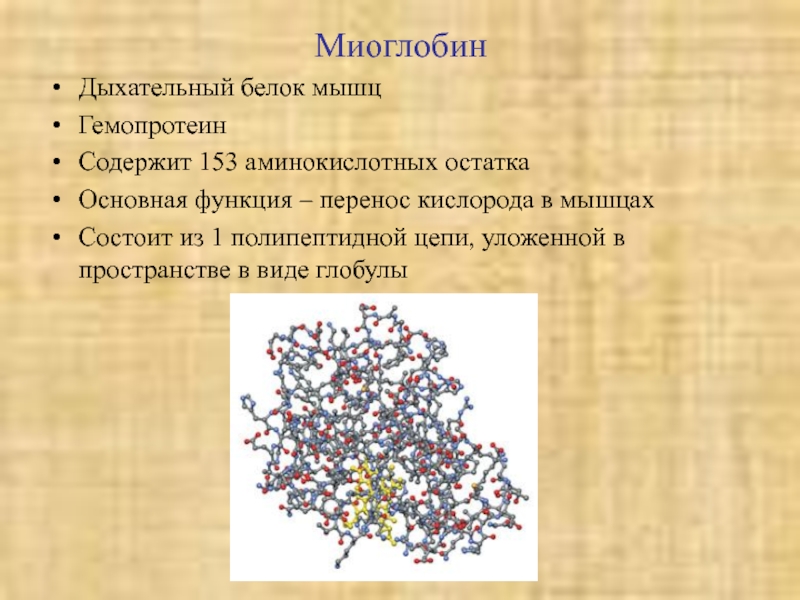
Слайд 33Миоглобин
Дыхательный белок мышц
Гемопротеин
Содержит 153 аминокислотных остатка
Основная функция – перенос кислорода
в мышцах
Состоит из 1 полипептидной цепи, уложенной в пространстве в
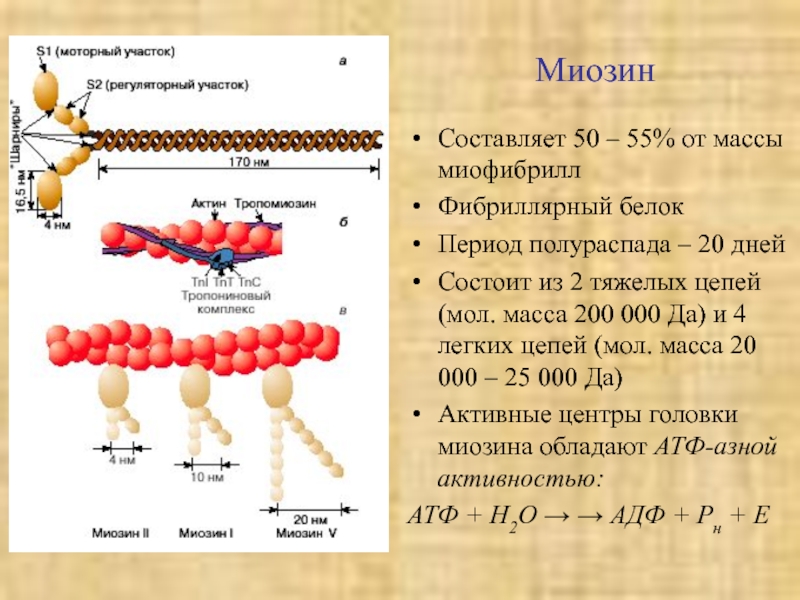
виде глобулыСлайд 35Миозин
Составляет 50 – 55% от массы миофибрилл
Фибриллярный белок
Период полураспада –
20 дней
Состоит из 2 тяжелых цепей (мол. масса 200 000
Да) и 4 легких цепей (мол. масса 20 000 – 25 000 Да) Активные центры головки миозина обладают АТФ-азной активностью:
АТФ + Н2О → → АДФ + Рн + Е
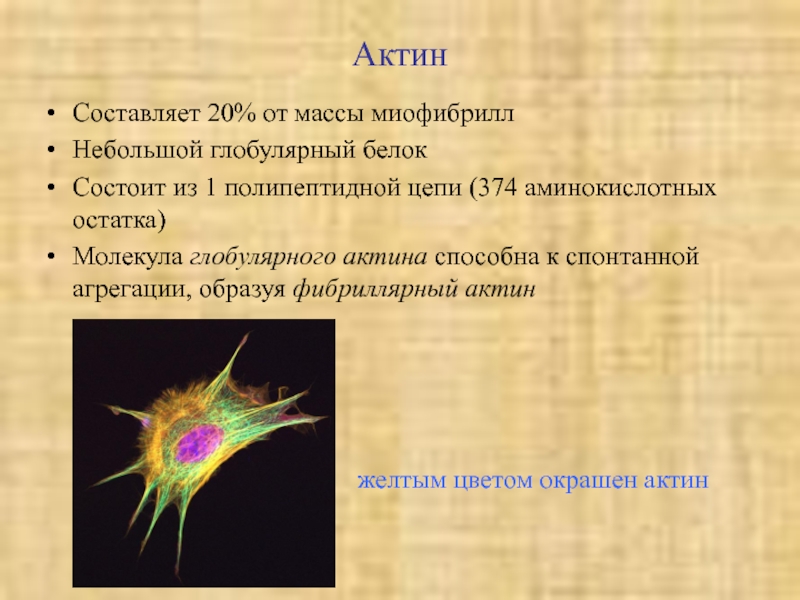
Слайд 36Актин
Составляет 20% от массы миофибрилл
Небольшой глобулярный белок
Состоит из 1 полипептидной
цепи (374 аминокислотных остатка)
Молекула глобулярного актина способна к спонтанной агрегации,
образуя фибриллярный актинжелтым цветом окрашен актин
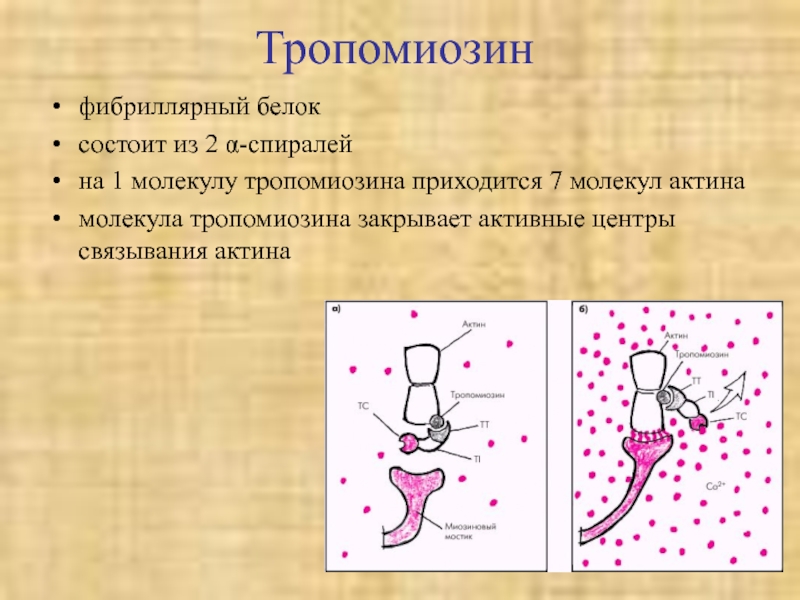
Слайд 38Тропомиозин
фибриллярный белок
состоит из 2 α-спиралей
на 1 молекулу тропомиозина приходится 7
молекул актина
молекула тропомиозина закрывает активные центры связывания актина
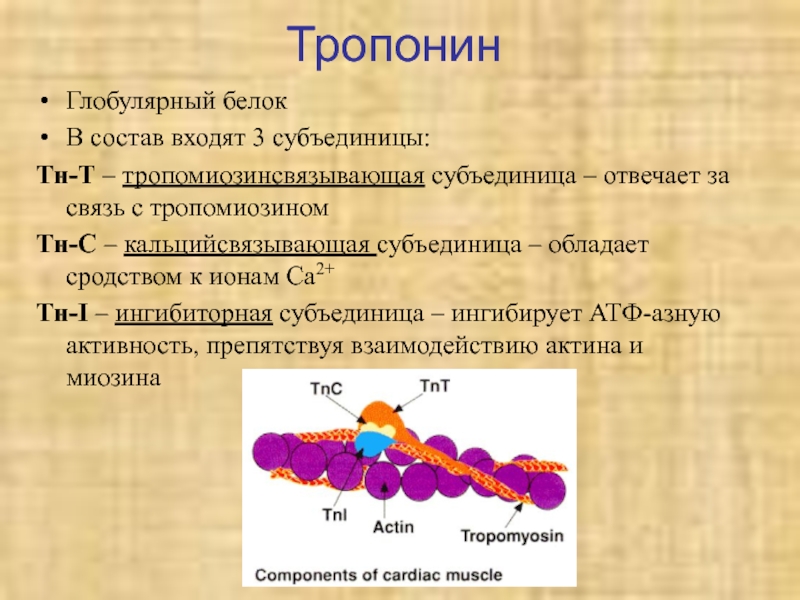
Слайд 39Тропонин
Глобулярный белок
В состав входят 3 субъединицы:
Тн-Т – тропомиозинсвязывающая субъединица –
отвечает за связь с тропомиозином
Тн-С – кальцийсвязывающая субъединица – обладает
сродством к ионам Са2+Тн-I – ингибиторная субъединица – ингибирует АТФ-азную активность, препятствуя взаимодействию актина и миозина
Слайд 40В мышцах присутствует фетальная форма миозина, обладающая измененной структурой, сниженной
АТФ-азной активностью
С возрастом в мышцах увеличивается содержание миоглобина и уменьшается
количество гликогена, лактата, нуклеиновых кислот и водыМышцы детей обладают повышенной чувствительностью к нейромедиаторам (ацетилхолин)
Во внутриутробном периоде мышца производит 3 – 4 сокращения в секунду, тогда как у детей младшего возраста число мышечных сокращений может быть до 60 – 80 в секунду, что способствует формированию тетануса мышц.
Слайд 41Биосинтез и распад
креатина
Креатин и креатининфосфат – важные азотистые вещества
мышцы.
Находится креатин в мышцах, ткани мозга, миокарде в свободном состоянии
и в форме фосфокреатина.При переходе от покоя к работе мышцы сначала используют АТФ, образующийся из креатинфосфата – это наиболее быстрый путь генерации АТФ.
Слайд 42Синтез креатина
Первая стадия синтеза креатина протекает в почках под действием
глицин-амидинотрансферазы.
Арг
Гли
Гуанидинуксусная
кислота
Орнитин
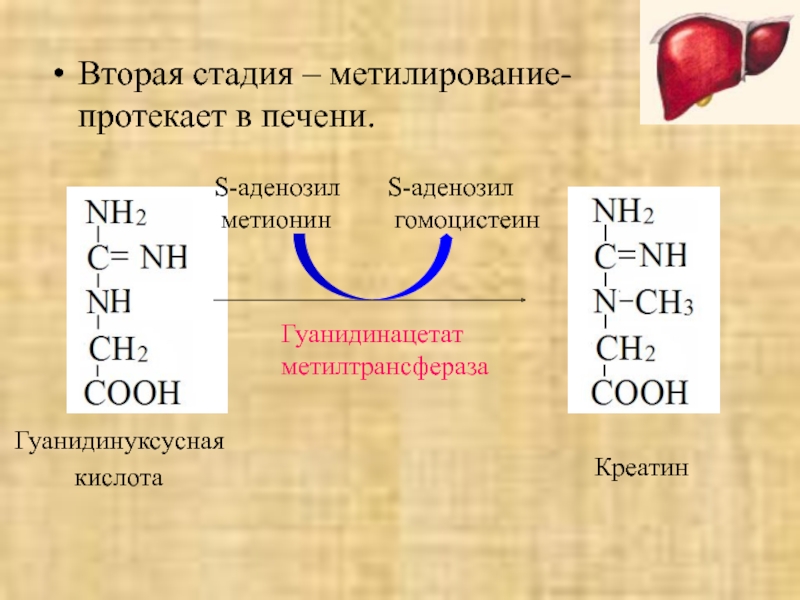
Слайд 43Вторая стадия – метилирование-
протекает в печени.
Гуанидинуксусная
кислота
S-аденозил
метионин
S-аденозил
гомоцистеин
Гуанидинацетат
метилтрансфераза
Креатин
Слайд 44В мышцах имеется
высокоэнергетическое вещество – креатинфосфат.
Креатин
КФК
+ АТФ
+ АДФ
Креатинфосфат
Слайд 45Креатинин образуется в результате неферментативного дефосфорилирования креатинфосфата.
Фн
Н20
Креатинфосфат
Креатинин
Слайд 46Содержание в плазме крови
В плазме крови в небольших количествах содержатся
креатин и креатинин. Содержание креатинина в плазме крови - 44-100
ммоль/л у мужчин, у женщин - чуть меньше.С мочой креатин выделяется только у детей, у взрослых – креатинин.
При болезнях почек с нарушением фильтрации выделение креатинина уменьшается, а его количество в крови увеличивается.
В норме суточное выделение креатинина с мочой пропорционально мышечной массе.
Слайд 47Диагностическое значение
уровень креатинина в сыворотке – чувствительный показатель состояния
функции почек,
снижение выделение креатинина с мочой наблюдается при гипертиреозе
и прогрессирующей мышечной дистрофии в связи со снижением скорости синтеза креатина.Слайд 48Физиологическая креатинурия наблюдается
у новорожденных, так как преобладает скорость
синтеза креатина,
у пожилых вследствие атрофии мышц,
у беременных из-за
развития мышечной массы матки,алиментарная креатинурия обусловлена принятием пищи, богатой креатином.






![Биохимия мышечной ткани Саркоплазматический ретикулумСаркоплазматический ретикулум [СР (SR)] – разветвленная подобная Саркоплазматический ретикулумСаркоплазматический ретикулум [СР (SR)] – разветвленная подобная эндоплазматическому ретикулуму органелла,](/img/thumbs/7e12597ba50afb34828d41cfdd1f15f5-800x.jpg)



![Биохимия мышечной ткани 4. Образование инозинмонофосфата [ИМФ (IMP)]. Другим источником быстрого восстановления уровня АТФ 4. Образование инозинмонофосфата [ИМФ (IMP)]. Другим источником быстрого восстановления уровня АТФ является конверсия АДФ в АТФ и](/img/thumbs/13b0855458c1da970d14ce744ae900d1-800x.jpg)