Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА Задание: 1) Запишите тему занятия
Содержание
- 1. 1 КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА Задание: 1) Запишите тему занятия
- 2. Кондуктометрия Метод основан
- 3. Кондуктометрия Основатель этого метода
- 4. Кондуктометрия Движущиеся ионы в
- 5. Кондуктометрия Удельная электропроводность (χ): электропроводность
- 6. Кондуктометрия Удельная электропроводность раствора электролита, как
- 7. Кондуктометрия Более удобной характеристикой раствора электролита
- 8. Кондуктометрия Кондуктометрический анализ основан на измерении
- 9. Кондуктометрия Зависимость электропроводности от температуры:
- 10. Кондуктометрияпрямая кондуктометрия;кондуктометрическое титрование;хронокондуктометрическое титрование – основано на
- 11. КондуктометрияПрямая кондуктометрия: метод, позволяющий непосредственно определять
- 12. КондуктометрияПрямая кондуктометрия: метод применим при малом
- 13. Кондуктометрия Кондуктометрическое титрование:метод анализа, основанный
- 14. Кондуктометрия Кондуктометрическое титрование: Графики
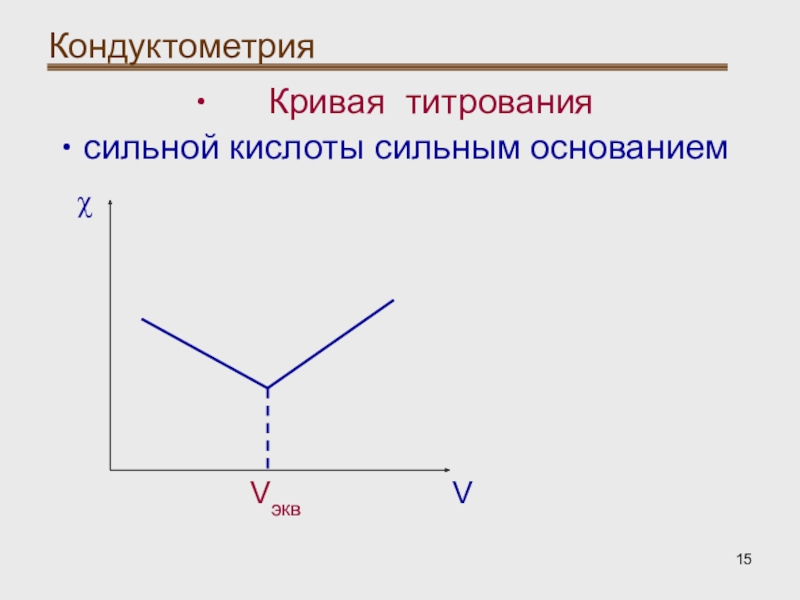
- 15. Кондуктометрия Кривая титрованиясильной кислоты сильным основаниемVVэквχ
- 16. Кондуктометрия Кондуктометрическое титрование: При
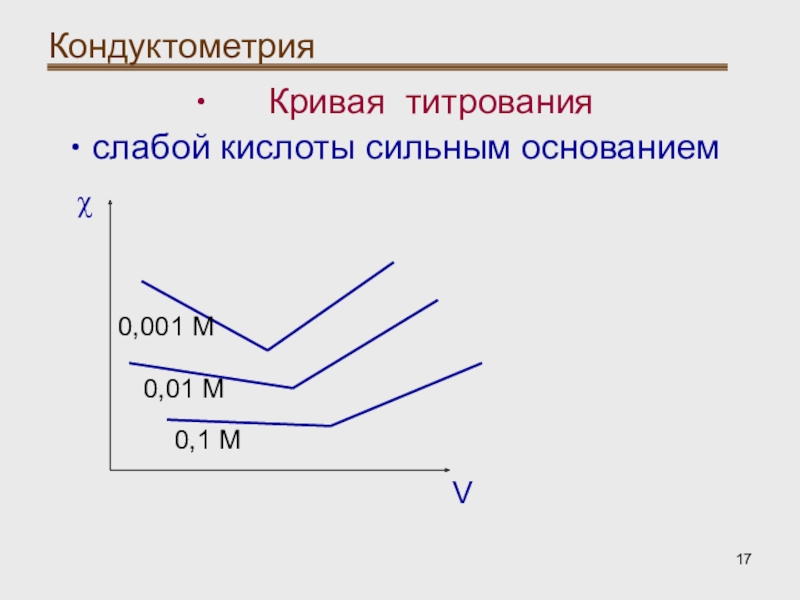
- 17. Кондуктометрия Кривая титрованияслабой кислоты сильным основаниемVχ0,001 М0,01 М0,1 М
- 18. Кондуктометрия Кондуктометрическое титрование: Для
- 19. Кондуктометрия Кондуктометрическое титрование: При
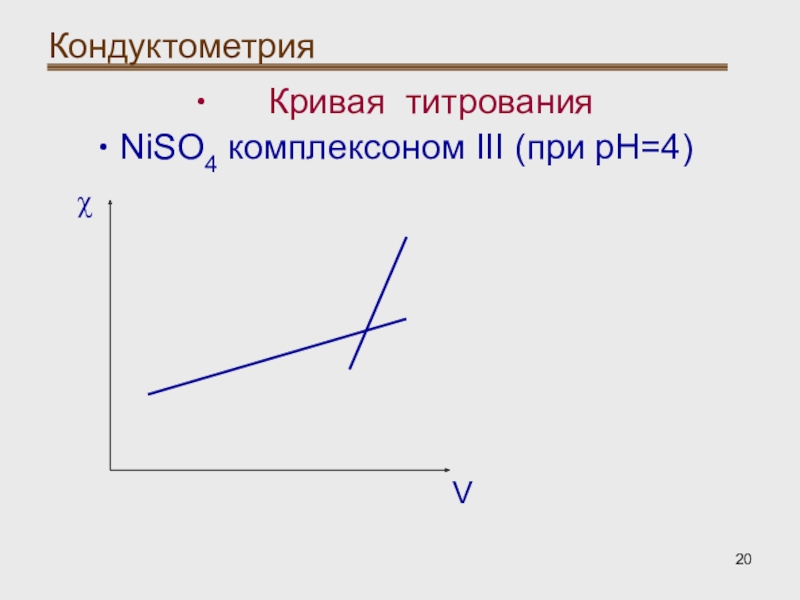
- 20. Кондуктометрия Кривая титрованияNiSO4 комплексоном III (при pH=4)Vχ
- 21. Кондуктометрия Кондуктометрическое титрование: При
- 22. Кондуктометрия Кондуктометрическое титрование: При
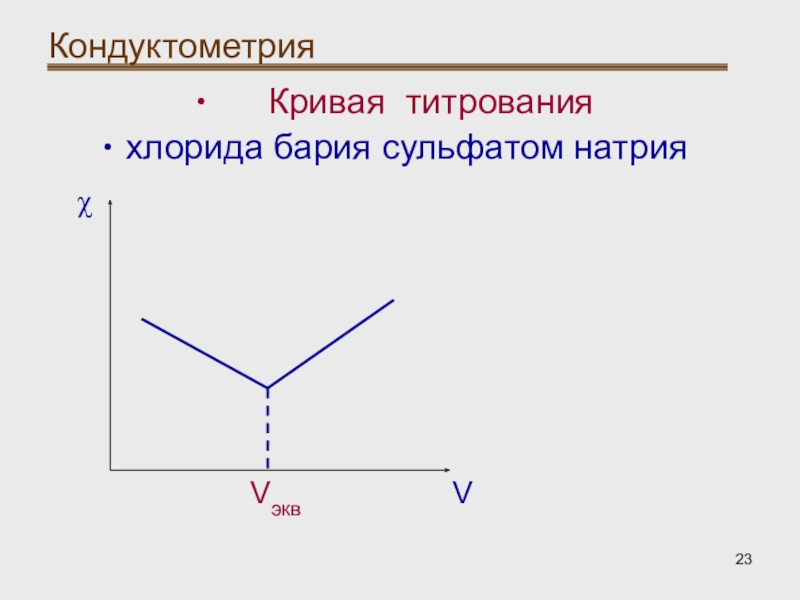
- 23. Кондуктометрия Кривая титрованияхлорида бария сульфатом натрияVVэквχ
- 24. Кондуктометрия Кондуктометрическое титрование: При
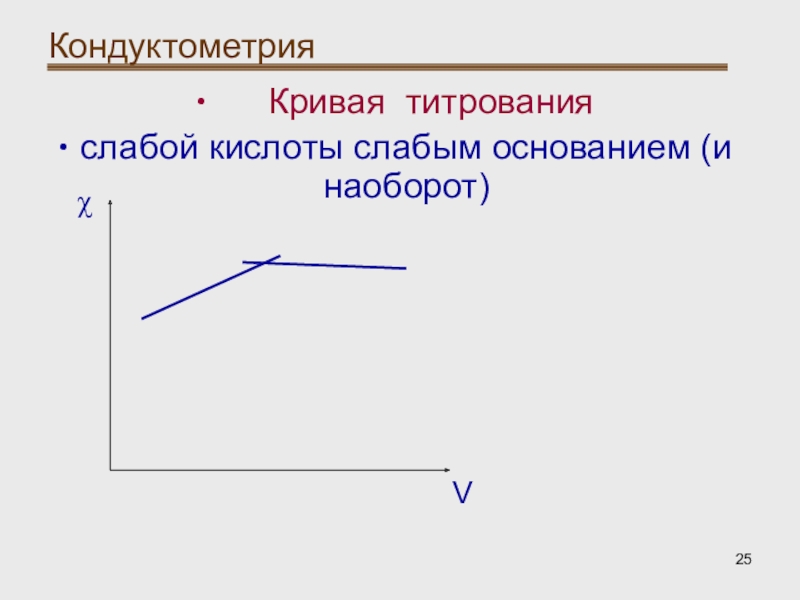
- 25. Кондуктометрия Кривая титрованияслабой кислоты слабым основанием (и наоборот)Vχ
- 26. Кондуктометрия Кондуктометрическое титрование: При
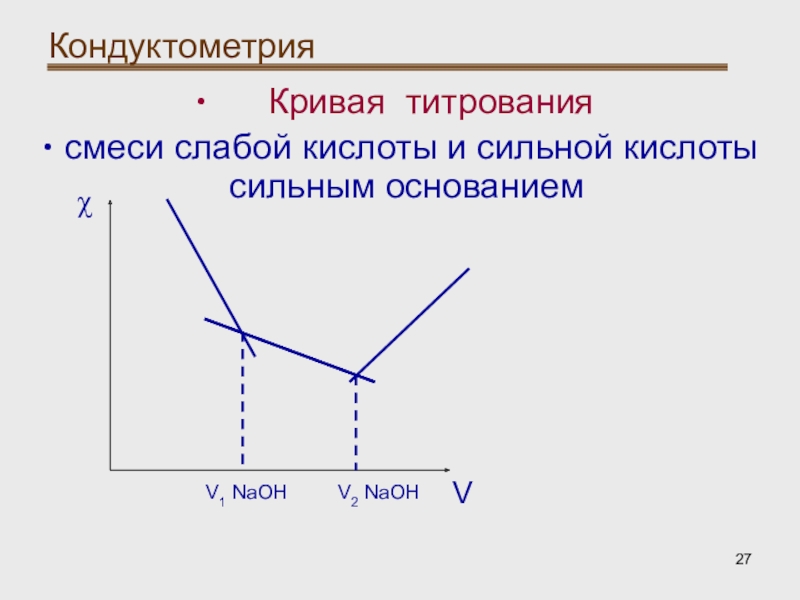
- 27. Кондуктометрия Кривая титрованиясмеси слабой кислоты и сильной кислоты сильным основанием VχV1 NaOHV2 NaOH
- 28. Кондуктометрия Особенности кондуктометрических методов анализа
- 29. Кондуктометрия Особенности кондуктометрических методов анализа
- 30. Кондуктометрия Особенности кондуктометрических методов анализа
- 31. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Задание: 1) Запишите тему занятия (слайд1).
2)
Законспектируйте презентацию (2-30слайд).
лист).Слайд 2Кондуктометрия
Метод основан на использовании зависимости
электрической проводимости растворов электролитов от их концентрации.
Основные понятия
Слайд 3Кондуктометрия
Основатель этого метода – немецкий физик
Кольрауш, который впервые в 1885 г. предложил уравнение зависимости электропроводности
растворов сильных электролитов от концентрации.Электропроводность растворов обусловлена диссоциацией растворенного вещества и миграцией образующихся ионов под действием внешнего источника напряжения.
Основные понятия
Слайд 4Кондуктометрия
Движущиеся ионы в поле электрического тока
испытывают тормозящее действие со стороны молекул растворителя – релаксационный эффект
– и со стороны противоположно заряженных ионов –электрофоретический эффект.В результате этих торможений раствор оказывает сопротивление прохождению электрического тока.
То есть электропроводность (W) – это величина обратная сопротивлению:
W =1/R , Ом-1.
Основные понятия
Слайд 5Кондуктометрия
Удельная электропроводность (χ):
электропроводность 1 см3 раствора,
находящегося между электродами площадью 1 см2 каждый, расположенными на расстоянии
1 см друг от друга.Размерность: См/м (См – сименс).
1 См=Ом-1
Основные понятия
Слайд 6Кондуктометрия
Удельная электропроводность раствора электролита, как правило, возрастает с
увеличением концентрации до известного предела, а затем снижается, то есть
проходит через максимум.Это объясняется уменьшением подвижности ионов при возрастании их концентрации вследствие существования «ионной атмосферы», которая влияет на его подвижность в электрическом поле.
Основные понятия
Слайд 7Кондуктометрия
Более удобной характеристикой раствора электролита является его эквивалентная
электропроводность (λ):
проводимость слоя электролита толщиной 1 см, помещенного
между электродами такой площади, чтобы объем электролита между ними содержал 1 моль растворенного вещества.Основные понятия
Слайд 8Кондуктометрия
Кондуктометрический анализ основан на измерении удельной или эквивалентной
электропроводности, которые связаны с концентрацией соотношением:
где С – концентрация электролита,
моль/дм3;V – объем раствора, в котором находится 1 моль вещества, см3.
Основные понятия
Слайд 9Кондуктометрия
Зависимость электропроводности от температуры:
Обычно при повышении температуры раствора происходит уменьшение его вязкости и
увеличение подвижности ионов, что приводит к росту χ и λ.Поэтому кондуктометрические измерения проводят в термостатических условиях.
Основные понятия
Слайд 10Кондуктометрия
прямая кондуктометрия;
кондуктометрическое титрование;
хронокондуктометрическое титрование – основано на определении содержания вещества
по затраченному на титрование времени, автоматически фиксируемого на диаграммной ленте
регистратора кривой титрования.Классификация
Слайд 11Кондуктометрия
Прямая кондуктометрия:
метод, позволяющий непосредственно определять концентрацию электролита путем
измерения электропроводности раствора с известным качественным составом.
Шкала приборов – солемеров откалибрована в единицах концентрации и это позволяет прямо определять солесодержание раствора.Классификация
Слайд 12Кондуктометрия
Прямая кондуктометрия:
метод применим при малом содержании ионов в
растворе, так как в этом случае его электрическая проводимость пропорциональна
концентрации.Когда испытуемый объект содержит большие количества различных солей, прямой кондуктометрический анализ невозможен.
Используют косвенный метод анализа – кондуктометрическое титрование.
Классификация
Слайд 13Кондуктометрия
Кондуктометрическое титрование:
метод анализа, основанный на определении содержания
вещества по излому кривой титрования.
При добавлении одного
электролита к другому в результате протекающей химической реакции изменяется ионный состав раствора, что приводит к изменению электрической проводимости. Классификация
Слайд 14Кондуктометрия
Кондуктометрическое титрование:
Графики кондуктометрического титро-вания строят
в координатах «объем приливаемого титранта – удельная электрическая проводимость раствора
.Кривые кондуктометрического титро-вания имеют излом, соответствующий точке эквивалентности, по которому можно установить объем титранта, израсходованного на титрование, и рассчитать концентрацию анализи-руемого раствора»
Слайд 16Кондуктометрия
Кондуктометрическое титрование:
При титровании слабых кислот
характер кривых зависит от концентрации раствора, что влияет на степень
диссоциации кислот и, соответственно, их электрическую проводимость.Слайд 18Кондуктометрия
Кондуктометрическое титрование:
Для использования реакций окисления-восстановления
применяют умеренно кислые или щелочные растворы, т.к. участие в реакции
водородных или гидроксильных ионов способствует резкому изменению электрической проводимости.Слайд 19Кондуктометрия
Кондуктометрическое титрование:
При использовании реакций комплексообразования
наиболее широко применяют комплексон III (двунатриевая соль этилендиаминтетрауксусной кислоты) .
При реакции катионов с комплексоном III в водных растворах увеличивается концентрация ионов водорода, что приводит к увеличению электрической проводимости раствора.
Слайд 21Кондуктометрия
Кондуктометрическое титрование:
При использовании реакций осаждения
кривые
титрования могут искажаться вследствие растворимости образующегося осадка.
Для
уменьшения растворимости осадка к раствору добавляют этиловый спирт.Слайд 22Кондуктометрия
Кондуктометрическое титрование:
При титровании хлорида бария
сульфатом натрия ионы бария связываются с сульфат-ионами. Характер изменения электрической
проводимости зависит от сравнительной подвижности ионов.Подвижность ионов бария выше, чем ионов натрия, поэтому до точки эквивалентности электрическая проводимость падает, а после – возрастает (избыток сульфат-ионов).
Слайд 24Кондуктометрия
Кондуктометрическое титрование:
При титровании слабой кислоты
слабым основанием (и наоборот) электрическая проводимость вначале растет вследствие образования
соли, а после прибавления избытка реагента остается постоянной, т.к. слабая кислота (или основание) мало изменяют электрическую проводимость.Слайд 26Кондуктометрия
Кондуктометрическое титрование:
При титровании смеси сильной
и слабой кислот на кривой получается две точки пересечения, что
соответствует моменту эквивалентности титрования HCl и CH3COOH.Слайд 27Кондуктометрия
Кривая титрования
смеси слабой кислоты и сильной кислоты
сильным основанием
V
χ
V1 NaOH
V2 NaOH
Слайд 28Кондуктометрия
Особенности кондуктометрических методов анализа
Возможность проводить определение
не только в прозрачных, но и в окрашенных и мутных
растворах, а также в присутствии окислителей, восстано-вителей, органических веществ;возможность определения различных неорганических и органических индивидуальных соединений;
Слайд 29Кондуктометрия
Особенности кондуктометрических методов анализа
высокая чувствительность метода,
позволяющая работать с разбавленными растворами;
анализ водных и органических растворов;
возможность автоматизации
процесса (хронокондуктометрия);использование разнообразных типов реакций;
Слайд 30Кондуктометрия
Особенности кондуктометрических методов анализа
во многих случаях
отсутствие необходимости проводить предвари-тельную пробоподготовку;
простота определения конечной точки титрования по
пересечению прямых;возможность проведения дифферен-цированного титрования смесей электролитов, что невозможно при титровании с визуальной индикацией конечной точки титрования.