Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
2018 год Ст.преподаватель Александрой В.И. ФГБОУ ВО ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ
Содержание
- 1. 2018 год Ст.преподаватель Александрой В.И. ФГБОУ ВО ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ
- 2. ТЕОРИЯ ГОРЕНИЯ и ВЗРЫВАДисциплина
- 3. Литература1. Теория горения и взрыва: практикум: учебное
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Вопросы лекцииГорение . Условия для
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Треугольник пожараОкислительИсточник зажиганияГорючее веществоСимволический треугольник горения (рисунок)
- 12. Слайд 12
- 13. Слайд 13
- 14. Органические горючие вещества – это все вещества
- 15. К горючим металлам и их производным относятся
- 16. Горючие вещества и материалыОрганическиеНеорганическиеИскопаемые и их производные:
- 17. Все индивидуальные вещества могут быть охарактеризованы коэффициентом
- 18. K = 4 × n(C) + 4
- 19. Расчет коэффициента горючести Пример 1. Рассчитать коэффициент
- 20. Пример 2. Определить горючесть этиламина (C2H5NH2). Решение.
- 21. Слайд 21
- 22. ГОРЮЧАЯ СИСТЕМАСмесь горючего и окислителя в
- 23. Слайд 23
- 24. Горючие
- 25. К внешним проявлениям горения относится пламя, которое
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. ОкислителиСоли кислород-содержащих кислот: Нитраты, хлоратыГалогены: Хлор, фтор,
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. Слайд 34
- 35. P2O5 Оксид фосфора Na2OK2O
- 36. Л
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Виды и режимы горения
- 44. ДИФФУЗИОННОЕ
- 45. ПЛАМЯопределенный объем газового пространства, в котором протекают
- 46. Структура пламениФРОНТ ПЛАМЕНИ (δпл.) – тонкий поверхностный
- 47. Процессы протекающие в пламени На подходе
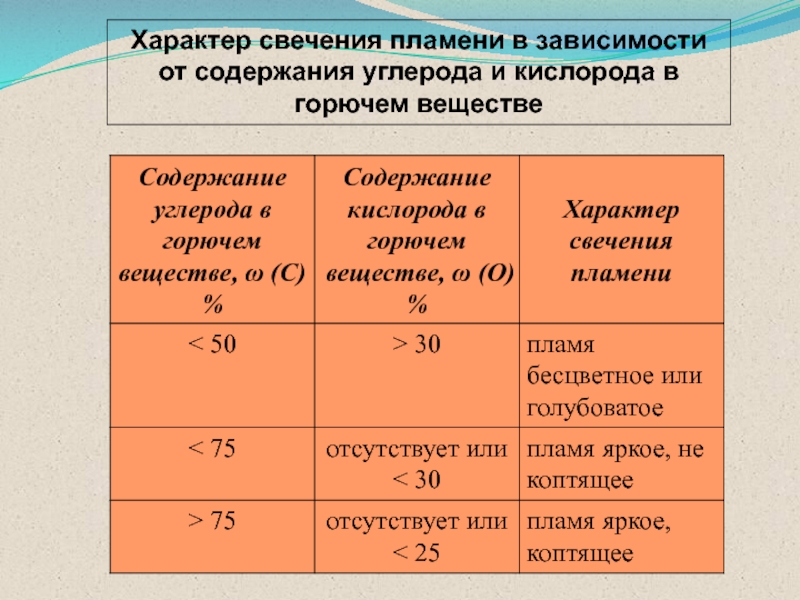
- 48. Характер свечения пламени в зависимости от содержания углерода и кислорода в горючем веществе
- 49. Рассчитать коэффициент горючести следующих веществ
- 50. метионин С5Н11NO2S, азотная кислота HNO3, глюкоза С6Н12O6,
- 51. Скачать презентанцию
Слайды и текст этой презентации
Слайд 12018 год
Ст.преподаватель
Александрой В.И.
ФГБОУ ВО
«ГОСУДАРСТВЕННЫЙ
АГРАРНЫЙ УНИВЕРСИТЕТ СЕВЕРНОГО ЗАУРАЛЬЯ»
Слайд 3Литература
1. Теория горения и взрыва: практикум: учебное пособие / В.А.
Девисилов, Т.И. Дроздова, С.С. Тимофеева / под общ. ред. В.А.
Девисилова. - М.: ФОРУМ, 2012. - 352 с. - (Высшее образование).2. Портола, В.А.. Расчет процессов горения и взрыва [Текст]: учеб. пособие для вузов / В.А. Портола, Н.Ю. Луговцова, Е.С.Торосян. – Томск: Изд-во ТПУ, 2012. – 107 с.
3. Адамян, В.Л. Теория горения и взрыва [Электронный ресурс]: учебное
пособие / В.Л. Адамян. — Электрон. дан. — Санкт-Петербург : Лань, 2018.
— 116 с. — Режим доступа: https://e.lanbook.com/book/109508. — Загл. с экрана.
Слайд 7
Вопросы лекции
Горение . Условия для возникновения горения.
Горючее вещество.
Группы горючих веществ или материалов
Полное и неполное горение.
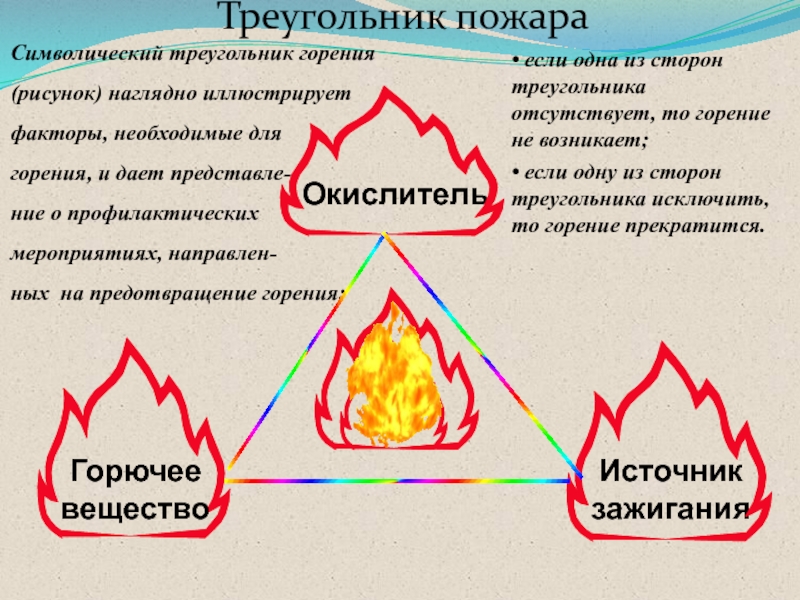
Слайд 11Треугольник пожара
Окислитель
Источник зажигания
Горючее вещество
Символический треугольник горения (рисунок) наглядно иллюстрирует факторы,
необходимые для
горения, и дает представле-
ние о профилактических мероприятиях, направлен-
ных
на предотвращение горения: • если одна из сторон треугольника отсутствует, то горение не возникает;
• если одну из сторон треугольника исключить, то горение прекратится.
Слайд 14Органические горючие вещества – это все вещества на основе углерода,
представляющие собой материалы растительного и животного происхождения, или же ископаемые
вещества, т.е. добываемые из недр земли. Все они применяются как в натуральном виде, так и после соответствующей обработки.Неорганические горючие вещества и материалы представляют собой все простые и сложные вещества неорганической природы, способные к реакциям горения. По современной химической классификации это металлы и неметаллы, их различные производные.
Слайд 15К горючим металлам и их производным относятся все щелочные и
щелочно-земельные металлы, а также металлы других групп периодической системы Д.И.
Менделеева и их производные - карбиды, сульфиды и т.п.К горючим неметаллам и их производным относятся бор, кремний, фосфор, мышьяк, сера, селен, теллур, их карбиды, гидриды, сульфиды и т.д.
По агрегатному состоянию горючие вещества и материалы подразделяются на газообразные, жидкие и твердые.
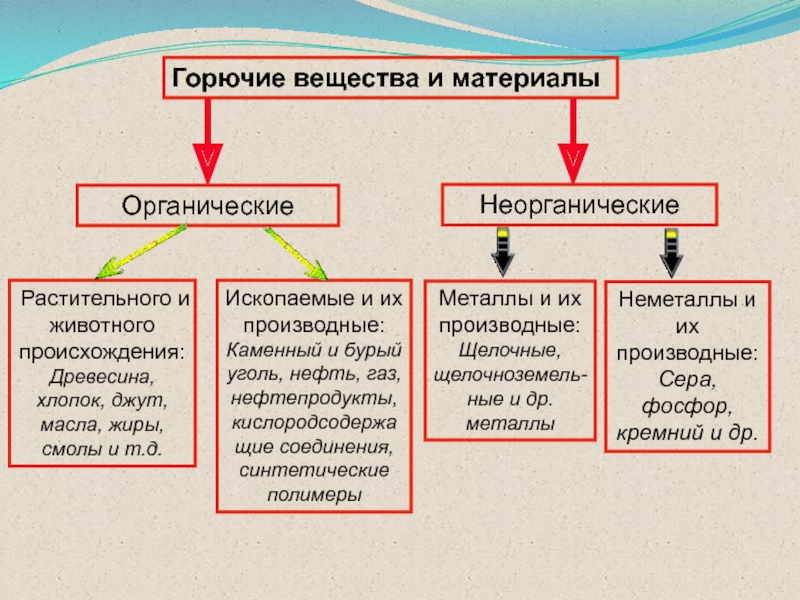
Слайд 16Горючие вещества и материалы
Органические
Неорганические
Ископаемые и их производные: Каменный и бурый
уголь, нефть, газ, нефтепродукты, кислородсодержащие соединения, синтетические полимеры
Металлы и их
производные: Щелочные, щелочноземель-ные и др. металлыНеметаллы и их производные: Сера, фосфор, кремний и др.
Растительного и животного происхождения: Древесина, хлопок, джут, масла, жиры, смолы и т.д.
Слайд 17Все индивидуальные вещества могут быть охарактеризованы коэффициентом горючести.
Коэффициент горючести
К является безразмерным коэффициентом и служит для определения горючести вещества.
Рассчитанный коэффициент горючести может быть использован для приближенного вычисления температуры вспышки вещества, а также величины нижнего концентрационного коэффициента распространения пламени.Коэффициент горючести рассчитывается по следующей формуле:
Слайд 18
K = 4 × n(C) + 4 × n(S )
+ n(H ) + n(N ) - 2 × n(O)
- 2 × n(Cl) - 3 × n(F ) - 5 × n(Br)где:
n(C), n(S), n(H), n(N), n(O), 2 n(Cl), n(F), n(Br) – число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора и брома в молекуле вещества.
Если коэффициент горючести К больше единицы (К³1), то вещество является горючим; при значении К меньше единицы (К < 1) – вещество негорючее.
Слайд 19Расчет коэффициента горючести
Пример 1.
Рассчитать коэффициент горючести анилина С6Н5NH2
и хлорной кислоты HClO4.
Решение:
В молекуле анилина n(C) = 6; n(Н)
= 7; n(N) = 1;К = 4 × 6 + 7 + 1 = 32
К > 1, следовательно, анилин – горючее вещество.
В молекуле хлорной кислоты n(Н) = 1; n(Cl) = 1; n(О) = 4;
К = 1 – 2 × 4 – 2 × 1 = - 9
К < 1, хлорная кислота – негорючее вещество.
Слайд 20Пример 2. Определить горючесть этиламина (C2H5NH2).
Решение. Рассчитываем коэффициент горючести
этиламина:
n(C) = 2; n(H = 7; п(N) = 1;
Кг = 4 ⸱ 2 + 7 + 1 = 16; Кг > 1.
Ответ. Этиламин - горючее вещество.
Пример 2. Определить горючесть закиси азота (N2О).
Решение. Рассчитываем коэффициент закиси азота: п(О) = 1; п(N) = 2;
Кг = 2 -2 · 1 = О; Кг < 1.
Ответ. Закись азота - негорючее вещество.
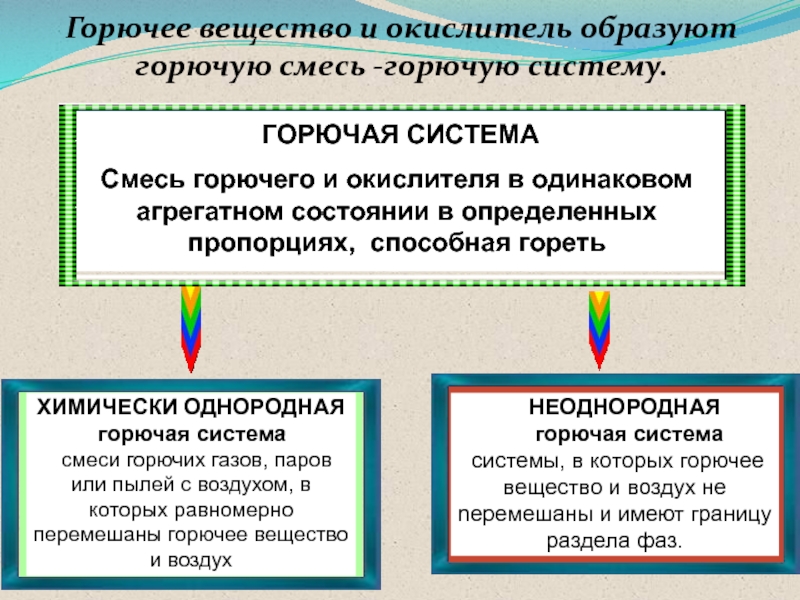
Слайд 22 ГОРЮЧАЯ СИСТЕМА
Смесь горючего и окислителя в одинаковом агрегатном состоянии
в определенных пропорциях, способная гореть
ХИМИЧЕСКИ ОДНОРОДНАЯ
горючая система смеси горючих газов, паров или пылей с воздухом, в которых равномерно перемешаны горючее вещество и воздух
НЕОДНОРОДНАЯ
горючая система
системы, в которых горючее вещество и воздух не nеремешаны и имеют границу раздела фаз.
Горючее вещество и окислитель образуют горючую смесь -горючую систему.
Слайд 24 Горючие вещества могут быть
в трех агрегатных состояниях: жидком, твердом, газообразном. Отдельные твердые вещества
при нагревании плавятся и испаряются, другие – разлагаются и выделяют газообразные продукты и твердый остаток в виде угля и шлака, третьи не разлагаются и не плавятся. Горение отличается многообразием видов и особенностей, обусловливаемых процессами теплообмена, газодинамическими эффектами, кинетикой химических превращений, а также обратной связью между внешними условиями и характером развития горения.
Слайд 25К внешним проявлениям горения относится пламя, которое характеризуется свечением и
выделением теплоты. При горении конденсированных систем (систем, состоящих только из
твердых или жидких фаз или их смесей) пламя может и не возникнуть. Такое горение называют беспламенным горением или тлением.Слайд 29Окислители
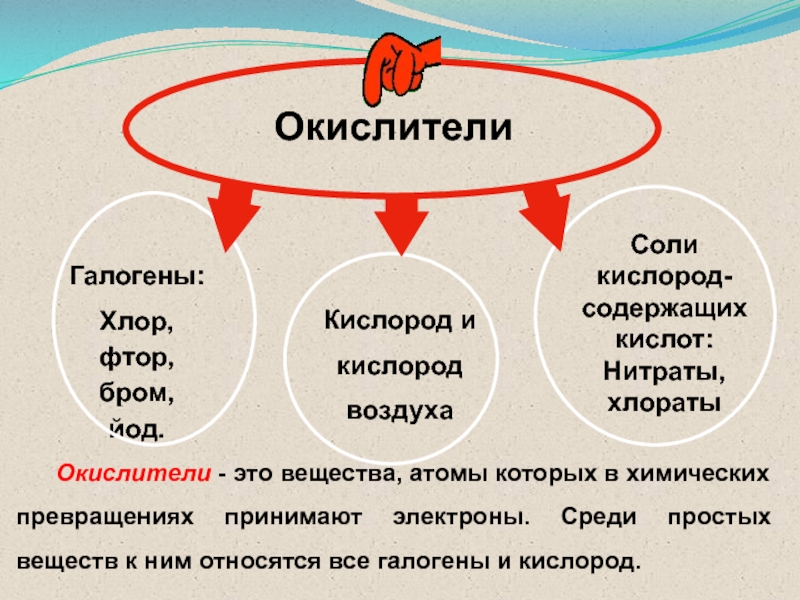
Соли кислород-содержащих кислот: Нитраты, хлораты
Галогены:
Хлор, фтор, бром, йод.
Кислород и
кислород
воздуха
Окислители - это вещества, атомы которых в химических превращениях
принимают электроны. Среди простых веществ к ним относятся все галогены и кислород.Слайд 43Виды и режимы горения
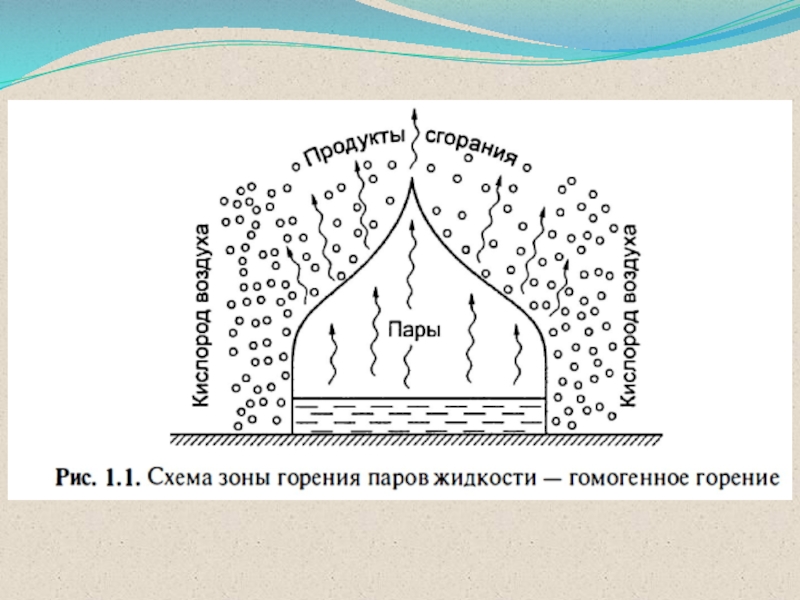
ГОМОГЕННОЕ
горение
оба компонента находятся в
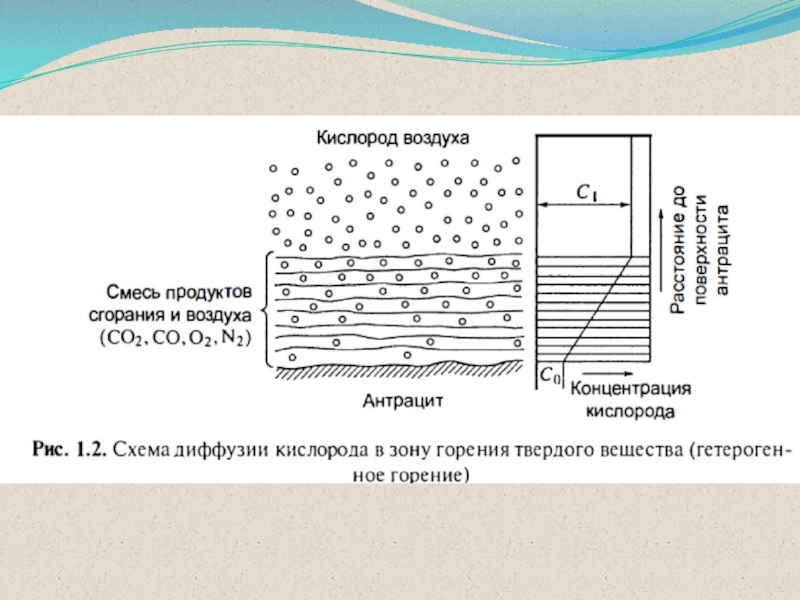
одной фазе (однородные горючие смеси) ГЕТЕРОГЕННОЕ
горение
агрегатное состояние у компонентов горючей системы различное (неоднородные горючие смеси).Пример – тление ТГМ.
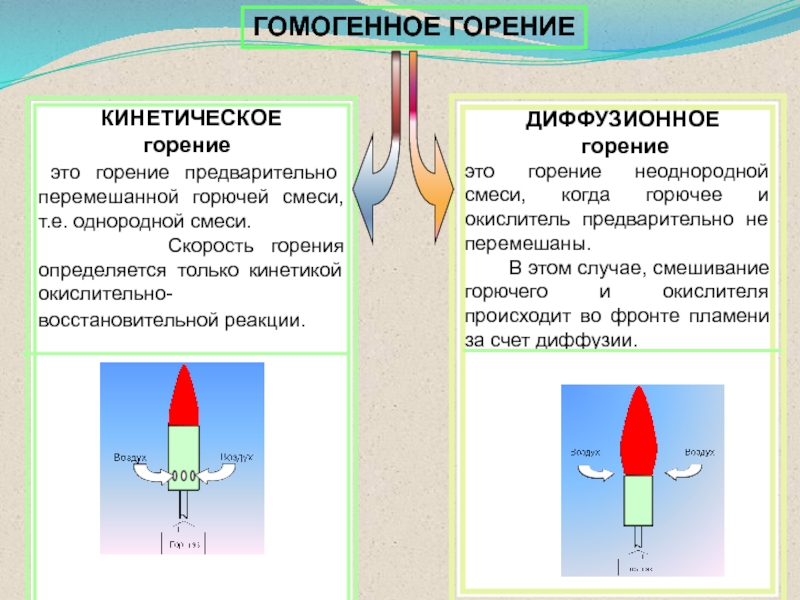
Слайд 44 ДИФФУЗИОННОЕ
горение
это горение неоднородной смеси,
когда горючее и окислитель предварительно не перемешаны.В этом случае, смешивание горючего и окислителя происходит во фронте пламени за счет диффузии.
КИНЕТИЧЕСКОЕ
горение
это горение предварительно перемешанной горючей смеси, т.е. однородной смеси.
Скорость горения определяется только кинетикой окислительно-восстановительной реакции.
ГОМОГЕННОЕ ГОРЕНИЕ
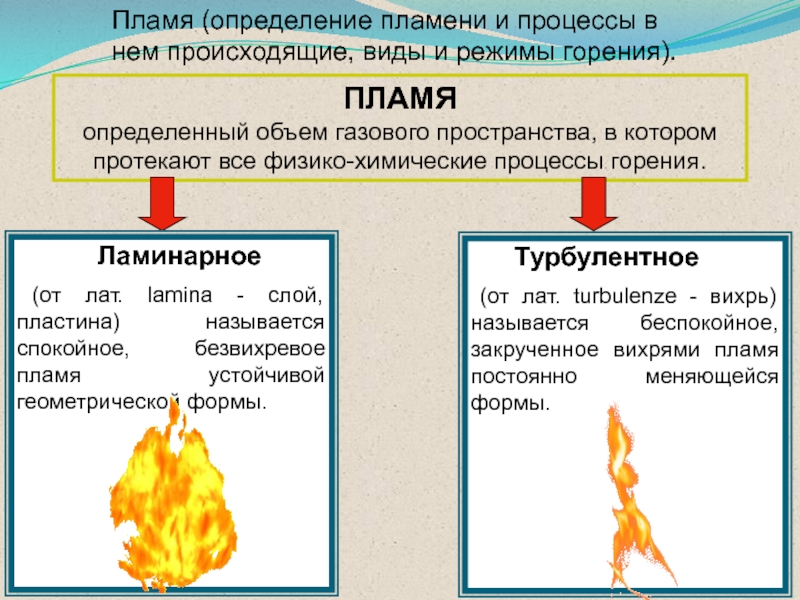
Слайд 45ПЛАМЯ
определенный объем газового пространства, в котором протекают все физико-химические процессы
горения.
Ламинарное
(от лат. lamina - слой,
пластина) называется спокойное, безвихревое пламя устойчивой геометрической формы. Турбулентное
(от лат. turbulenze - вихрь) называется беспокойное, закрученное вихрями пламя постоянно меняющейся формы.
Пламя (определение пламени и процессы в нем происходящие, виды и режимы горения).
Слайд 46Структура пламени
ФРОНТ ПЛАМЕНИ (δпл.) – тонкий поверхностный слой, ограничивающий пламя,
непосредственно в котором протекают окислительно-восстановительные реакции.
δпл.≈0,5•10-3 см.
Зона максимальных
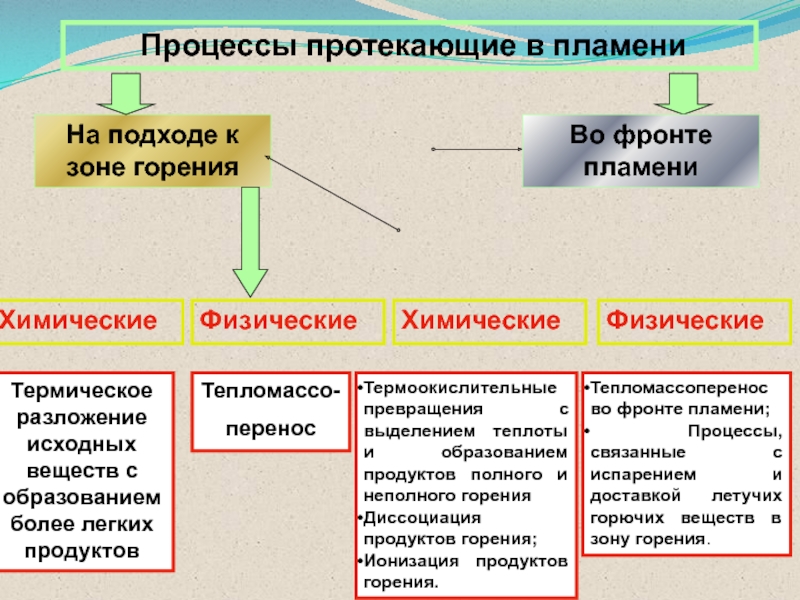
температур Слайд 47 Процессы протекающие в пламени
На подходе к зоне горения
Во
фронте пламени
Химические
Физические
Физические
Химические
Термическое разложение исходных веществ с образованием более легких продуктов
Тепломассо-
перенос
Термоокислительные превращения с выделением теплоты и образованием продуктов полного и неполного горения
Диссоциация продуктов горения;
Ионизация продуктов горения.
Тепломассоперенос во фронте пламени;
Процессы, связанные с испарением и доставкой летучих горючих веществ в зону горения.