Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкены
Содержание
- 1. Алкены
- 2. АлкеныАлкенами или олефинами, или этиленовыми углеводородами называются
- 3. Углерод четырехвалентен всегдаВ органических соединенияхНезависимо от формулы веществаИ его строения.
- 4. Основное содержание лекцииПонятие о непредельных углеводородах.Характеристика двойной связи.Изомерия и номенклатура алкенов.Получение алкенов.Свойства алкенов.
- 5. Решите задачуНайдите молекулярную формулу углеводорода, массовая доля
- 6. Проверь М(СхНY)=70 г/мольn(Н)=0,1 мольn(С)=0,05 моль x :
- 7. Понятие об алкенахАлкены – углеводороды, содержащие в
- 8. Характеристика двойной связи (С ═ С)Вид гибридизации
- 9. Схема образования sp2-гибридных орбиталейВ гибридизации участвуют орбитали одного s- и двух p-электронов:s 2psp2
- 10. Слайд 10
- 11. Гомологический ряд алкеновЭтен ПропенБутенПентенГексенГептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14Общая формула СnН2n
- 12. Изомерия алкеновДля алкенов возможны два типа изомерии: 1-ый
- 13. Примеры изомеров углеродного скелета (С5Н10) 1
- 14. Примеры изомеров положения двойной связи ( С5Н10)
- 15. Межклассовая изомерия АЛКЕНЫ ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИ
- 16. Примеры межклассовых изомеров ( С5Н10)СН2 = СН – СН2 – СН2 – СН3пентен -1циклопентан
- 17. Пространственная изомерия (С4Н8)Для алкенов возможна пространственная изомерия,
- 18. Геометрические изомеры бутенаЦис-изомерТранс-изомер
- 19. Примеры:4- этилоктен -2 СН3- СН2- СН
- 20. Физические свойства алкеновАлкены плохо растворимы в воде,
- 21. Химические свойства алкеновПо химическим свойствам алкены резко
- 22. Типы химических реакций, которые характерны для алкеновРеакции присоединения.Реакции окисления.Реакции полимеризации.Реакции -водорода
- 23. Механизм реакций присоединения алкеновπ-связь является донором электронов,
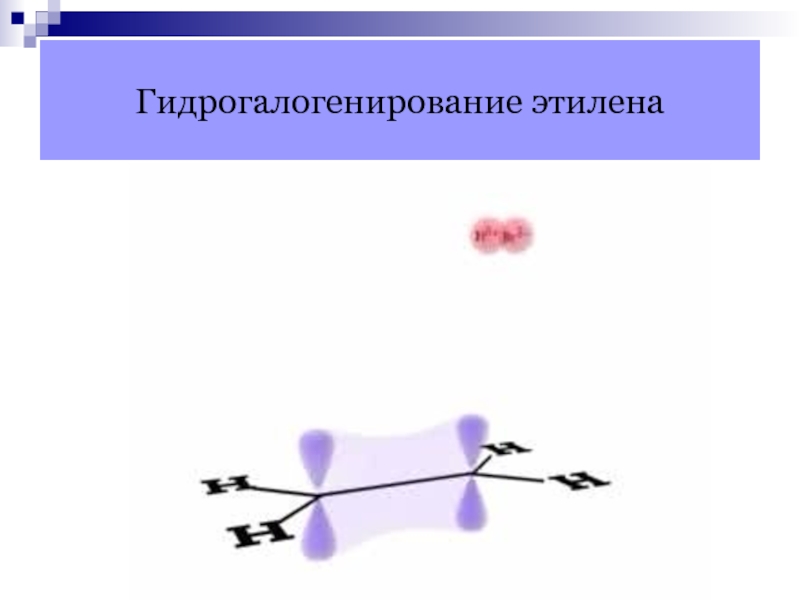
- 24. Гидрогалогенирование этилена
- 25. Реакции присоединения1. Гидрирование.CН2 = СН2 + Н2
- 26. Электрофильное присоединениеМолекула галогена не имеет собственного диполя,
- 27. Реакции присоединения3. Гидрогалогенирование. 1
- 28. Гидрогалогенирование гомологов этиленаПравило В. В. МарковниковаАтом водорода
- 29. Впервые правило было предложено русским химиком В.
- 30. Гидрогалогенирование гомологов этиленаПравило В. В. Марковникова (современное)Присоединение
- 31. Правила В. В. Марковникова и А. М.
- 32. Присоединение воды:Реакции -водородного атомаГалогенирование:
- 33. Присоединение против правила Марковникова:Механизм: а) ROOR → 2ROб)
- 34. Реакции полимеризации (свободно-радикальное присоединение)Полимеризация – это последовательное
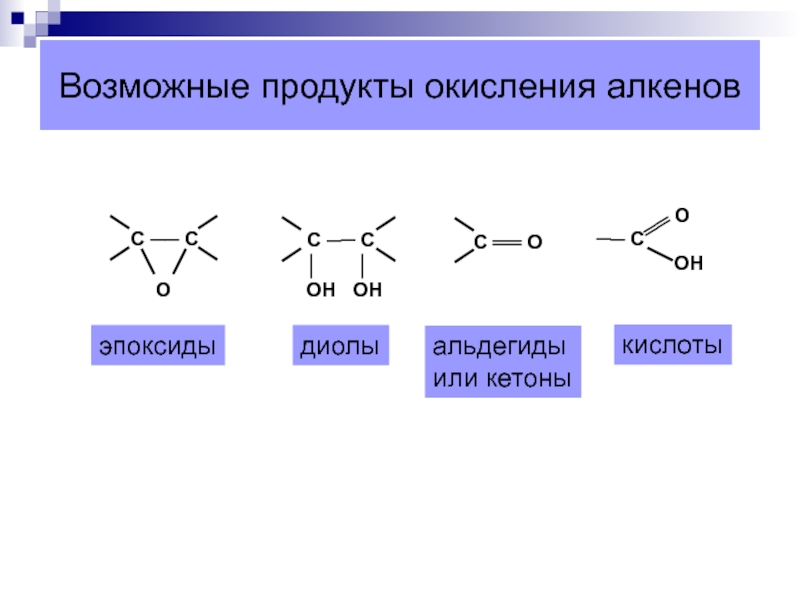
- 35. Возможные продукты окисления алкеновэпоксидыдиолыальдегидыили кетоныкислоты
- 36. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата
- 37. Реакции окисления3. Каталитическое окисление. а) 2СН2 = СН2
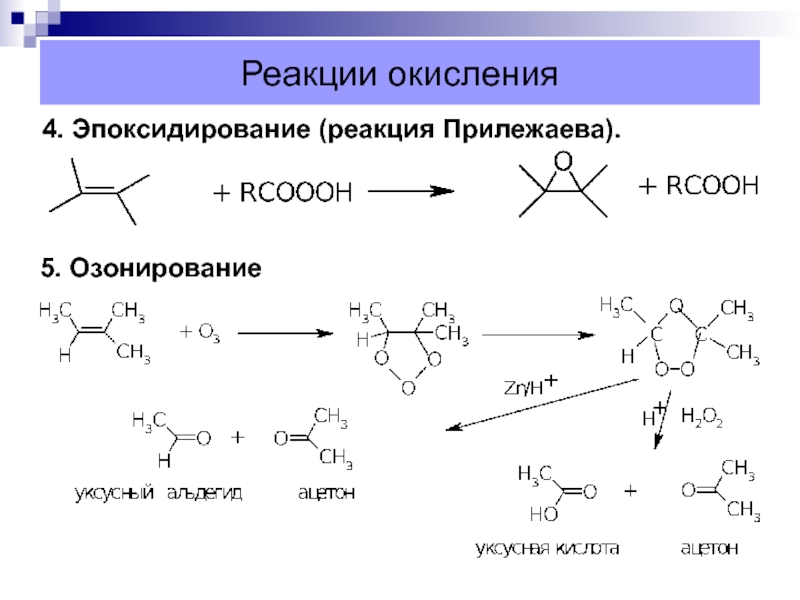
- 38. Реакции окисления4. Эпоксидирование (реакция Прилежаева).5. Озонирование
- 39. Горение алкенов Алкены горят красноватым светящимся пламенем,
- 40. Получение и горение этилена
- 41. Лабораторные способы получения алкеновПри получении алкенов необходимо
- 42. Промышленные способы получения алкеновКрекинг алканов.С10Н20
- 43. Качественные реакции на двойную углерод-углеродную связьОбесцвечивание бромной
- 44. 1
- 45. Проверьте правильность написаний уравнений реакцийСН3-(СН2)2-СН2Br + КОН
- 46. а) СН3-СН=СН2 + НСl ?б) СН2=СН-СН2-СН3
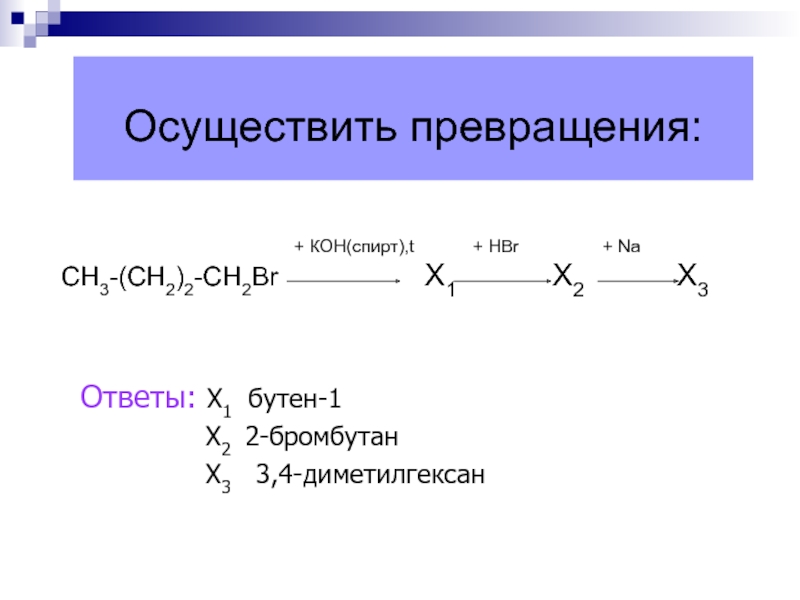
- 47. Осуществить превращения:
- 48. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Алкены
Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в
молекуле одну двойную связь и имеющие общую формулу CnH2n.
Слайд 3Углерод четырехвалентен всегда
В органических соединениях
Независимо от формулы вещества
И его строения.
Слайд 4Основное содержание лекции
Понятие о непредельных углеводородах.
Характеристика двойной связи.
Изомерия и номенклатура
алкенов.
Получение алкенов.
Свойства алкенов.
Слайд 5Решите задачу
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором
составляет
85,7 %. Относительная плотность этого углеводорода по азоту равна
2.При сжигании углеводорода массой 0,7 г образовались оксида углерода (IV) и вода количеством вещества по 0,05 моль каждое. Относительная плотность паров этого вещества по азоту равна 2,5. Найдите молекулярную формулу алкена.
При сжигании углеводорода массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность углеводорода по воздуху 1,93. Найдите молекулярную формулу вещества.
Слайд 6Проверь
М(СхНY)=70 г/моль
n(Н)=0,1 моль
n(С)=0,05 моль
x : y = 0,05
: 0,1 = 1 : 2
Простейшая формула СН2
Истинная – С5Н10
Ответ: С5Н10
М(СхНY)=56 г/моль
m(СхНY)=11,2 г
n(СО2)= 0,8 моль
n(Н2О)=0,8 моль
n(С)= 0,8 моль
n(Н)=1,6 моль
x : y = 0,8 : 1,6 = 1 : 2
Простейшая формула СН2
Истинная – С4Н8
Ответ: С4Н8
Задача 2
Задача 3
Задача 1
Слайд 7Понятие об алкенах
Алкены – углеводороды, содержащие в молекуле одну двойную
связь между атомами углерода, а качественный и количественный состав выражается
общей формулой СnН2n, где n ≥ 2. Алкены относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.
Слайд 8Характеристика двойной связи
(С ═ С)
Вид гибридизации –
Валентный угол –
Длина связи С = С –
Строение ─
Вид связи –
По типу перекрывания –
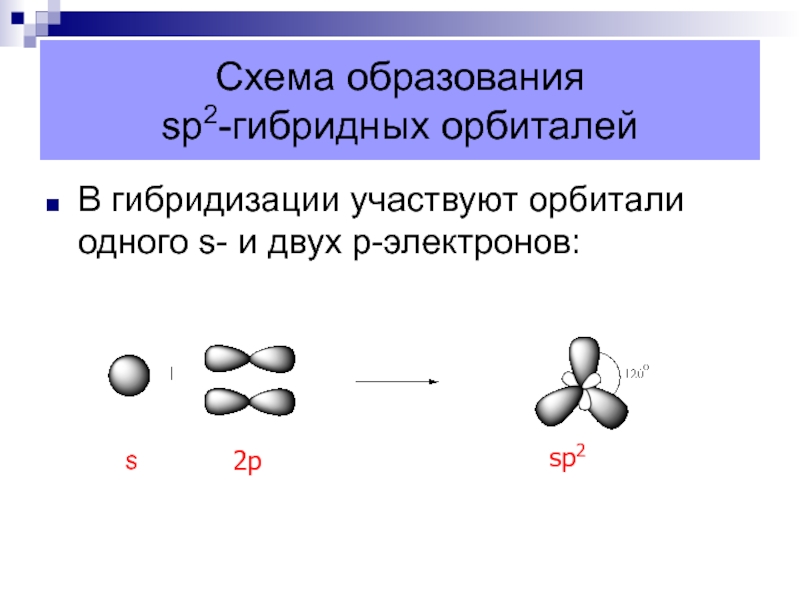
Слайд 9Схема образования
sp2-гибридных орбиталей
В гибридизации участвуют орбитали одного s- и
двух p-электронов:
s
2p
sp2
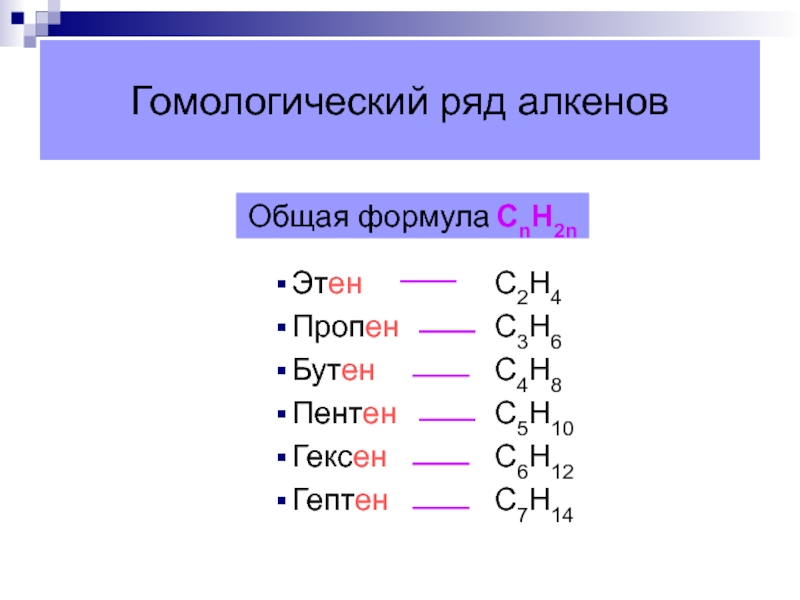
Слайд 11Гомологический ряд алкенов
Этен
Пропен
Бутен
Пентен
Гексен
Гептен
C2H4
C3H6
C4H8
C5H10
C6H12
C7H14
Общая формула СnН2n
Слайд 12Изомерия алкенов
Для алкенов возможны два типа изомерии:
1-ый тип – структурная
изомерия:
углеродного скелета
положения двойной связи
Межклассовая
2-ой тип – пространственная изомерия:
геометрическая
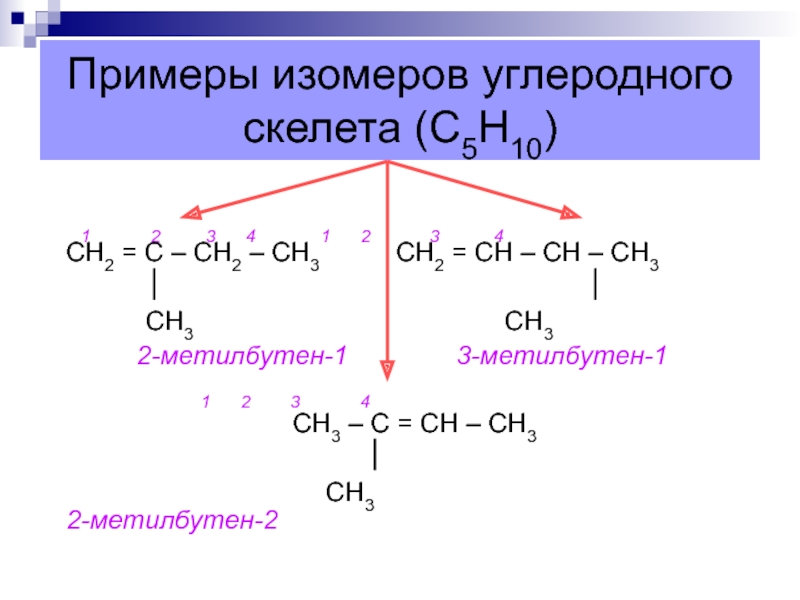
Слайд 13Примеры изомеров углеродного скелета (С5Н10)
1 2
3 4 1 2 3
4 СН2 = С – СН2 – СН3 СН2 = СН – СН – СН3СН3 СН3
2-метилбутен-1 3-метилбутен-1
1 2 3 4
СН3 – С = СН – СН3
СН3 2-метилбутен-2
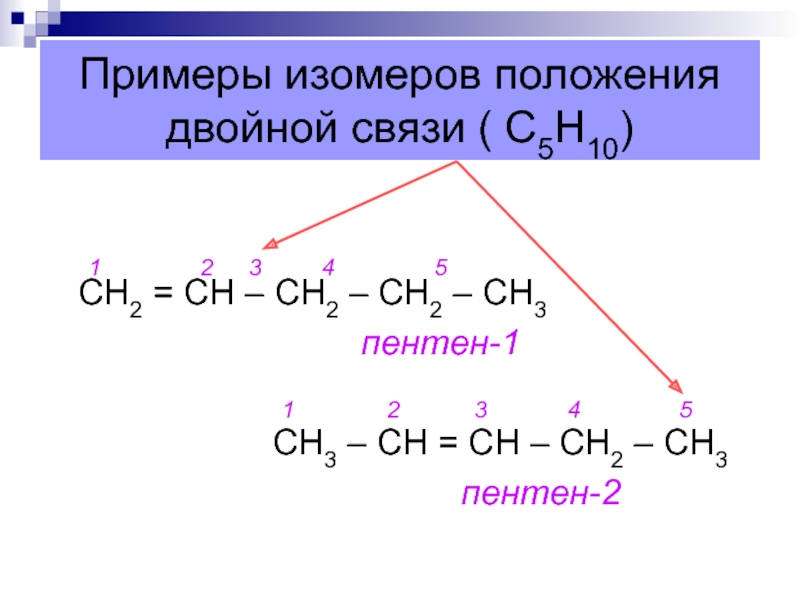
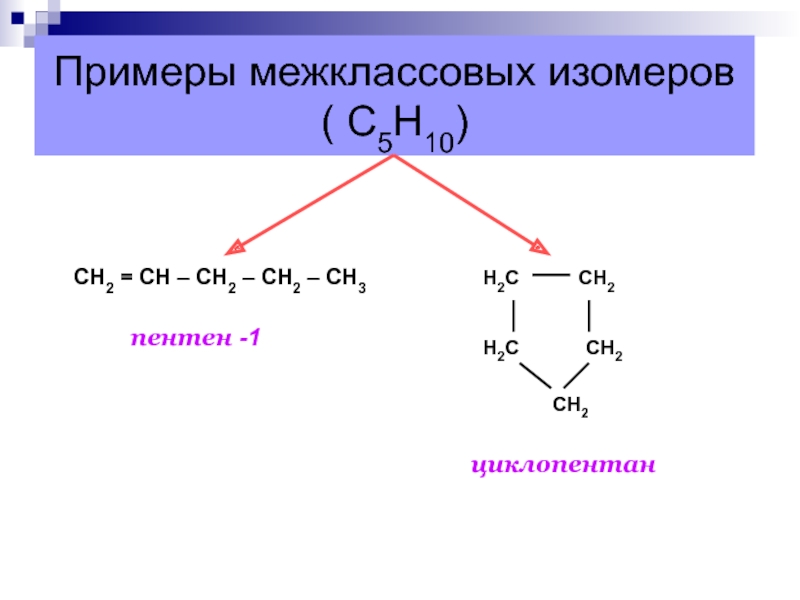
Слайд 14Примеры изомеров положения двойной связи ( С5Н10)
1
2 3
4 5 СН2 = СН – СН2 – СН2 – СН3пентен-1
1 2 3 4 5
СН3 – СН = СН – СН2 – СН3
пентен-2
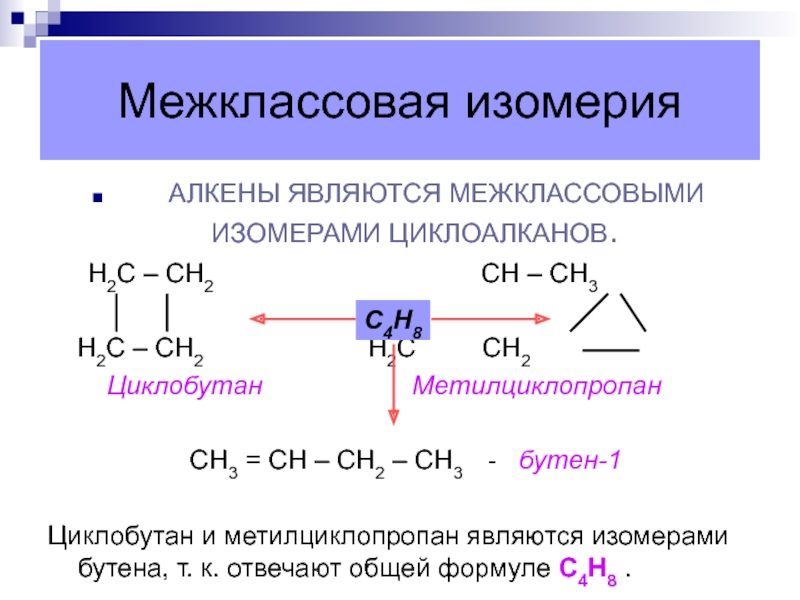
Слайд 15Межклассовая изомерия
АЛКЕНЫ ЯВЛЯЮТСЯ МЕЖКЛАССОВЫМИ
ИЗОМЕРАМИ ЦИКЛОАЛКАНОВ.
Н2С – СН2
СН – СН3Н2С – СН2 Н2С СН2
Циклобутан Метилциклопропан
СН3 = СН – СН2 – СН3 - бутен-1
Циклобутан и метилциклопропан являются изомерами бутена, т. к. отвечают общей формуле С4Н8 .
С4Н8
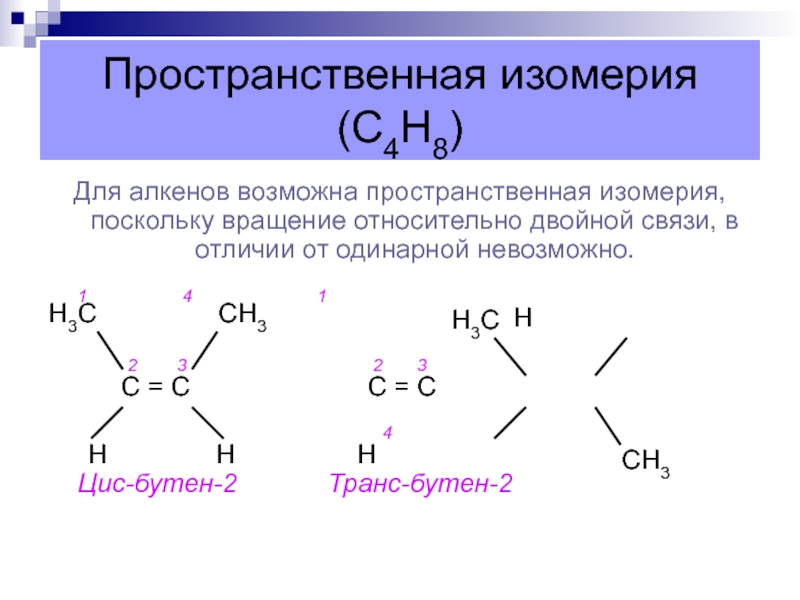
Слайд 17Пространственная изомерия (С4Н8)
Для алкенов возможна пространственная изомерия, поскольку вращение относительно
двойной связи, в отличии от одинарной невозможно.
1
4 1Н
2 3 2 3
С = С С = С
4
Н Н Н Цис-бутен-2 Транс-бутен-2
Н3С
СН3
Н3С
СН3
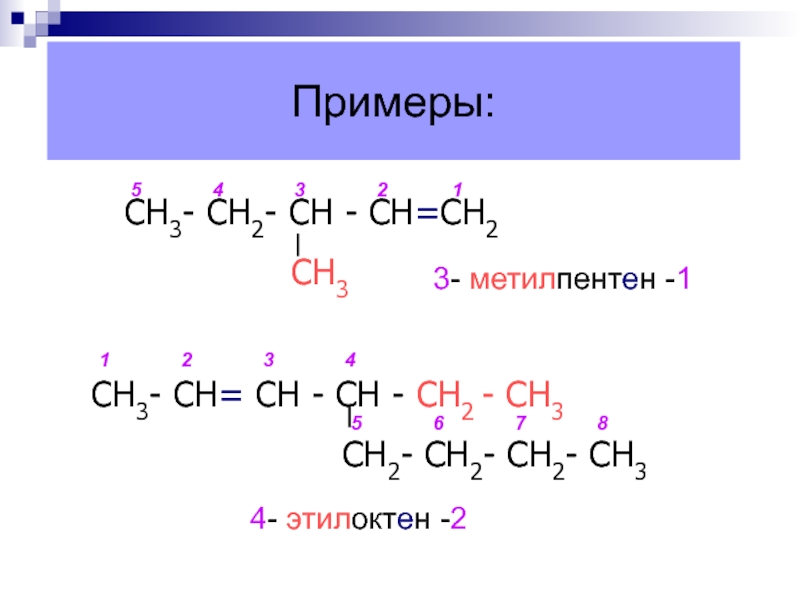
Слайд 19Примеры:
4- этилоктен -2
СН3- СН2- СН - СН=СН2
СН3
СН3- СН= СН
- СН - СН2 - СН3СН2- СН2- СН2- СН3
1
2
3
4
5
6
7
8
1
2
3
4
5
3- метилпентен -1
Слайд 20Физические свойства алкенов
Алкены плохо растворимы в воде, но хорошо растворяются
в органических растворителях.
С2– С4 - газы
С5– С16 - жидкости
С17…
- твёрдые веществаС увеличением молекулярной массы алкенов, в гомологическом ряду, повышаются температуры кипения и плавления, увеличивается плотность веществ.
Слайд 21Химические свойства алкенов
По химическим свойствам алкены резко отличаются от алканов.
Алкены химически более активные вещества, что обусловлено наличием двойной связи,
состоящей из σ- и π-связей. Алкены способны присоединять два одновалентных атома или радикала за счёт разрыва π-связи, как менее прочной.Слайд 22Типы химических реакций, которые характерны для алкенов
Реакции присоединения.
Реакции окисления.
Реакции полимеризации.
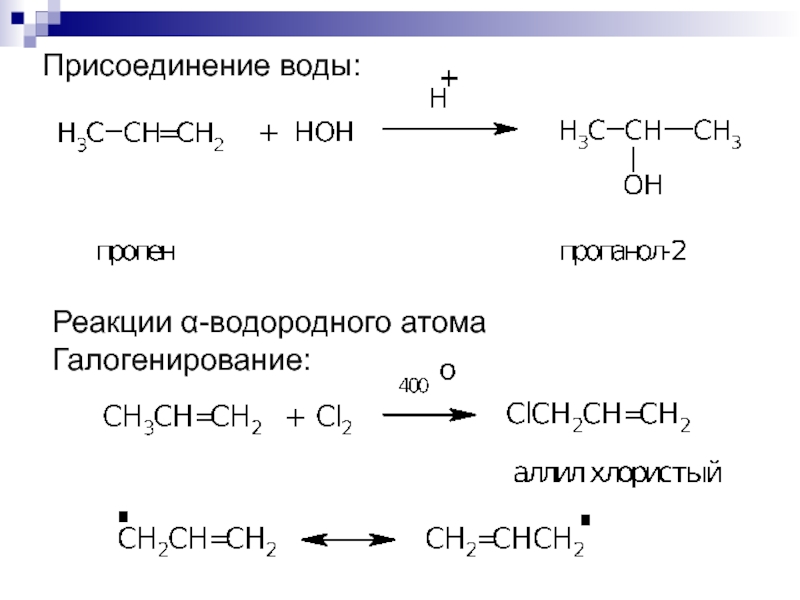
Реакции
-водорода
Слайд 23Механизм реакций присоединения алкенов
π-связь является донором электронов, поэтому она легко
реагирует с электрофильными реагентами.
Электрофильное присоединение: разрыв π-связи протекает по гетеролитическому
механизму, если атакующая частица является электрофилом.Свободно-радикальное присоединение: разрыв связи протекает по гомолитическому механизму, если атакующая частица является радикалом.
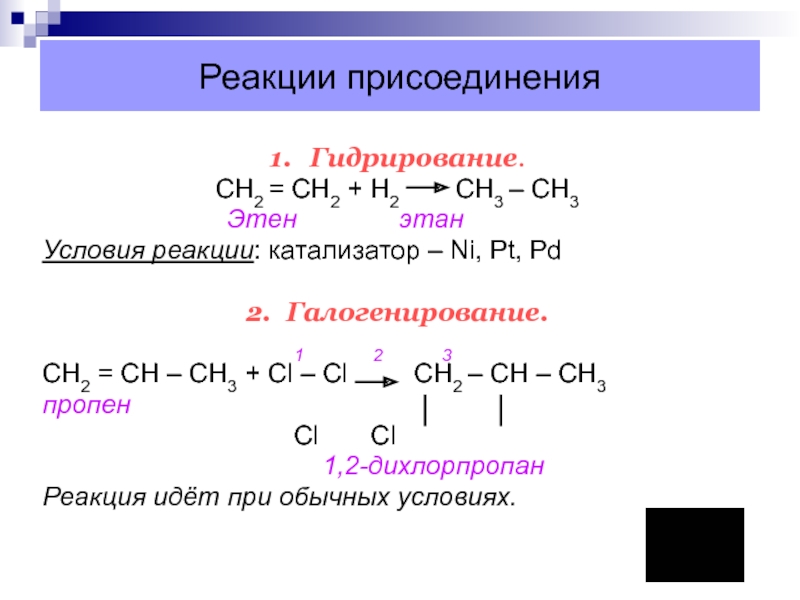
Слайд 25Реакции присоединения
1. Гидрирование.
CН2 = СН2 + Н2 СН3 – СН3
Этен этан
Условия реакции: катализатор – Ni, Pt, Pd
2. Галогенирование.
1 2 3
CН2 = СН – СН3 + Сl – Сl СН2 – СН – СН3
пропен
Cl Cl
1,2-дихлорпропан
Реакция идёт при обычных условиях.
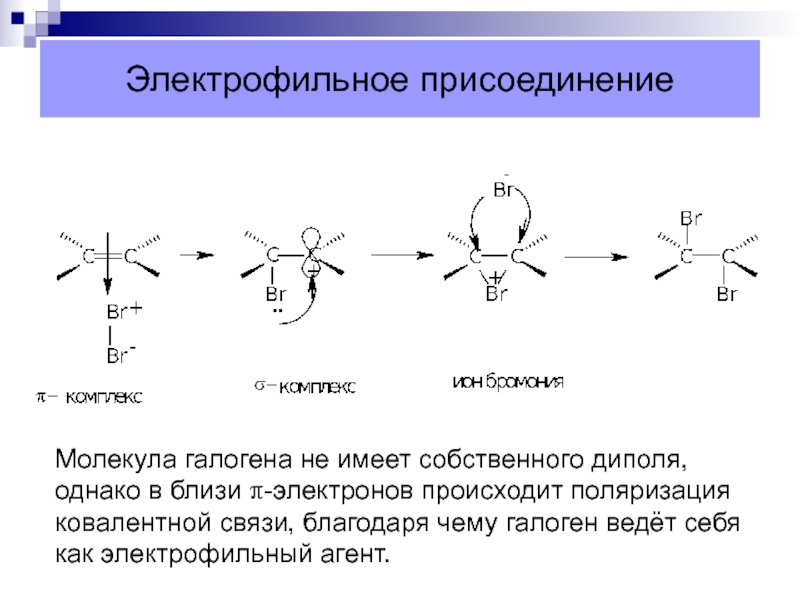
Слайд 26Электрофильное присоединение
Молекула галогена не имеет собственного диполя,
однако в близи
π-электронов происходит поляризация
ковалентной связи, благодаря чему галоген ведёт себя
как
электрофильный агент.Слайд 27Реакции присоединения
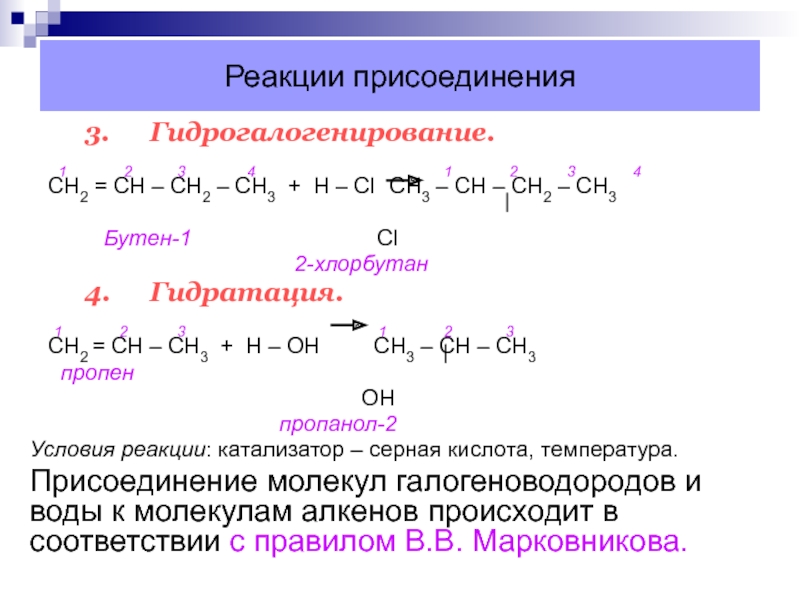
3. Гидрогалогенирование.
1
2 3
4 1 2 3 4СН2 = СН – СН2 – СН3 + Н – Сl CН3 – СН – СН2 – СН3
Бутен-1 Cl
2-хлорбутан
4. Гидратация.
1 2 3 1 2 3
CН2 = СН – СН3 + Н – ОН СН3 – СН – СН3
пропен
ОН
пропанол-2
Условия реакции: катализатор – серная кислота, температура.
Присоединение молекул галогеноводородов и воды к молекулам алкенов происходит в соответствии с правилом В.В. Марковникова.
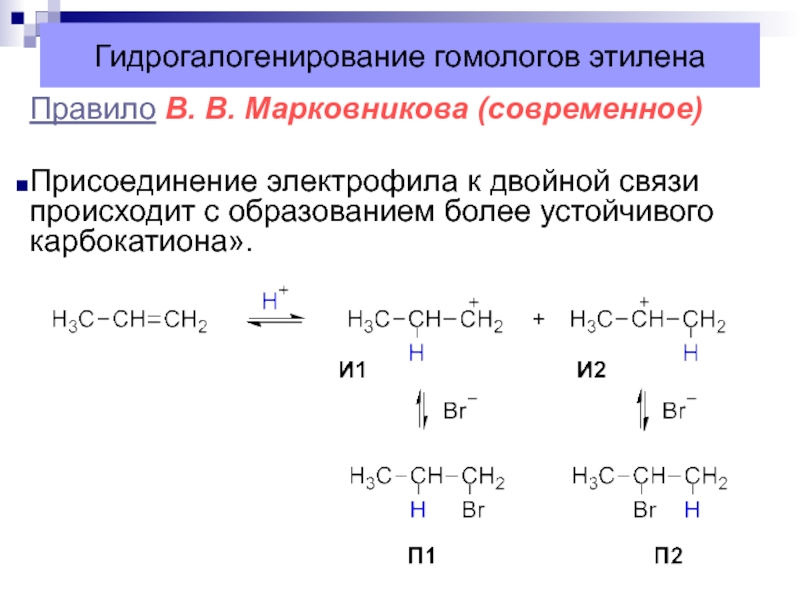
Слайд 28Гидрогалогенирование гомологов этилена
Правило В. В. Марковникова
Атом водорода присоединяется к более
гидрогенизированному атому углерода при двойной связи, а атом галогена или
гидроксогруппа – к менее гидрогенизированному.Слайд 29Впервые правило было предложено русским химиком В. В. Марковниковым в
1869 году.
Правило Марковникова как таковое установилось лишь в 1924 году
благодаря работе О. Маасса (англ. O. Maass), который растворял безводные галогеноводороды и алкены в гексане и наблюдал образование продуктов, предсказанных Марковниковым. В частности, он первым провёл классический иллюстративный эксперимент — присоединение бромоводорода к пропену, в котором достоверно образовался 2-бромпропан.Слайд 30Гидрогалогенирование гомологов этилена
Правило В. В. Марковникова (современное)
Присоединение электрофила к двойной
связи происходит с образованием более устойчивого карбокатиона».
Слайд 31Правила В. В. Марковникова и А. М. Зайцева
(мнемоническое)
Найдешь ли справедливость
тут,
Где действуют двойные связи:
Где много – так еще дадут,
Где мало
– так отнимут сразу!Правило Зайцева —эмпирическое правило, используемое в органической химии для предсказания преобладающего продукта в реакциях отщепления воды или галогеноводородов от спиртов и галогенидов соответственно.
Правило формулируется следующим образом: при дегидратации вторичных и третичных спиртов и при дегидрогалогенировании вторичных и третичных галогенидов водород отщепляется преимущественно от наименее гидрогенизированного атома углерода.
Правило предложено русским химиком А. М. Зайцевым в 1875 году.
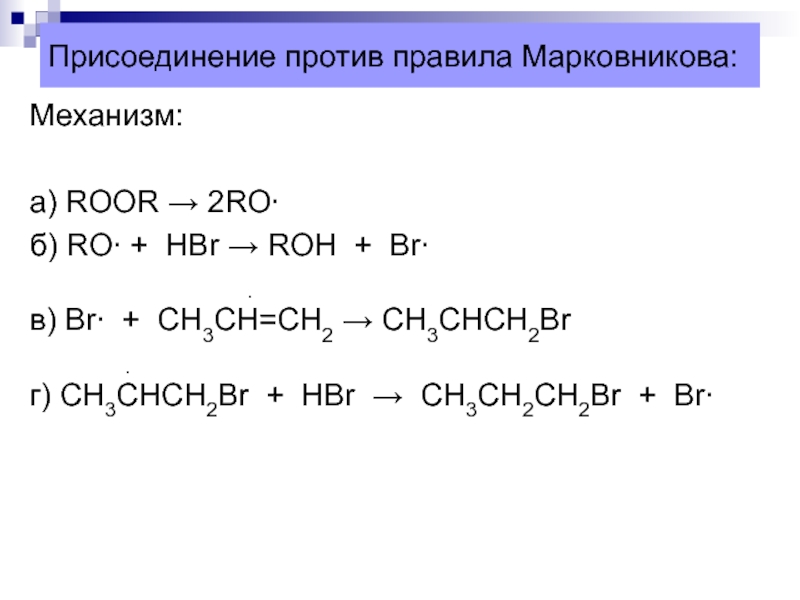
Слайд 33Присоединение против правила Марковникова:
Механизм:
а) ROOR → 2RO
б) RO + HBr
→ ROH + Br
в) Br + CH3CH=CH2 → CH3CHCH2Br
г) СH3CHCH2Br + HBr → CH3CH2CH2Br + Br
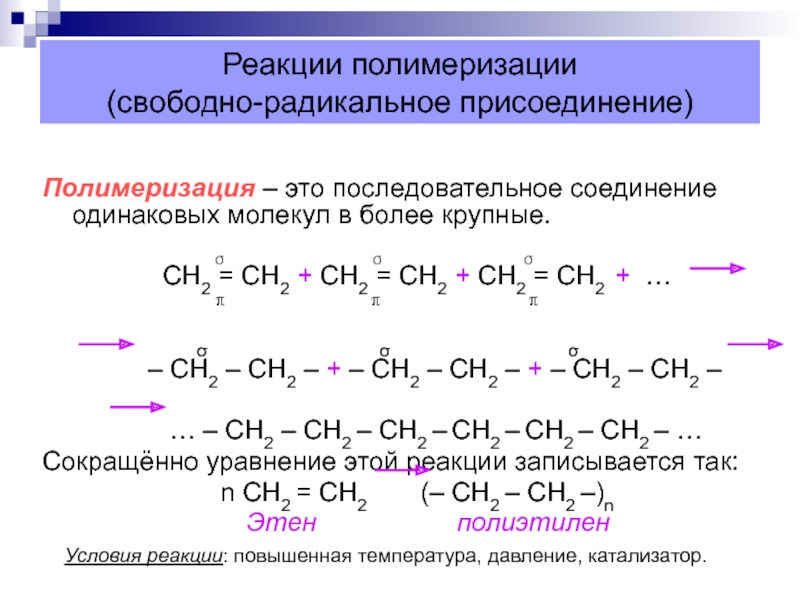
Слайд 34Реакции полимеризации
(свободно-радикальное присоединение)
Полимеризация – это последовательное соединение одинаковых молекул в
более крупные.
σ σ σСН2 = СН2 + СН2 = СН2 + СН2 = СН2 + …
π π π
σ σ σ
– СН2 – СН2 – + – СН2 – СН2 – + – СН2 – СН2 –
… – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – …
Сокращённо уравнение этой реакции записывается так:
n СН2 = СН2 (– СН2 – СН2 –)n
Этен полиэтилен
Условия реакции: повышенная температура, давление, катализатор.
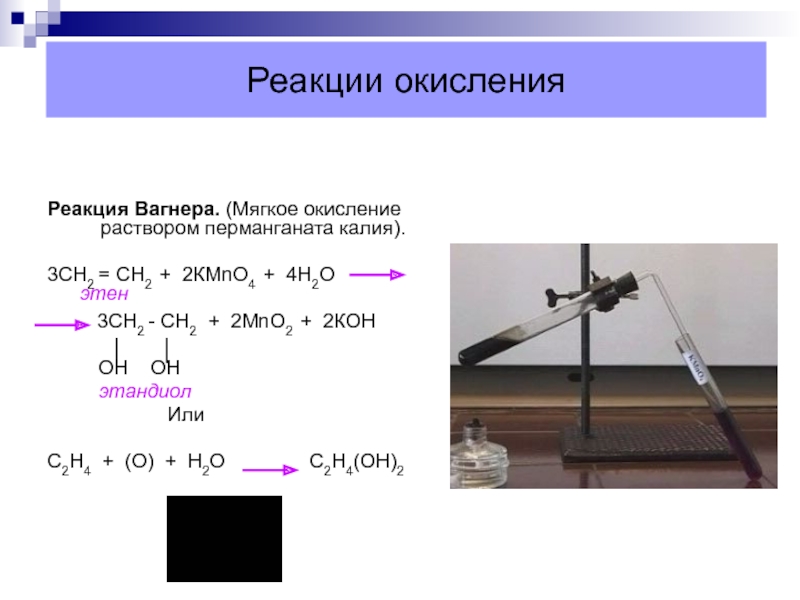
Слайд 36Реакции окисления
Реакция Вагнера. (Мягкое окисление раствором перманганата калия).
3СН2 = СН2
+ 2КМnО4 + 4Н2О
3СН2 - СН2 + 2МnО2 + 2КОНОН ОН
Или
С2Н4 + (О) + Н2О С2Н4(ОН)2
этандиол
этен
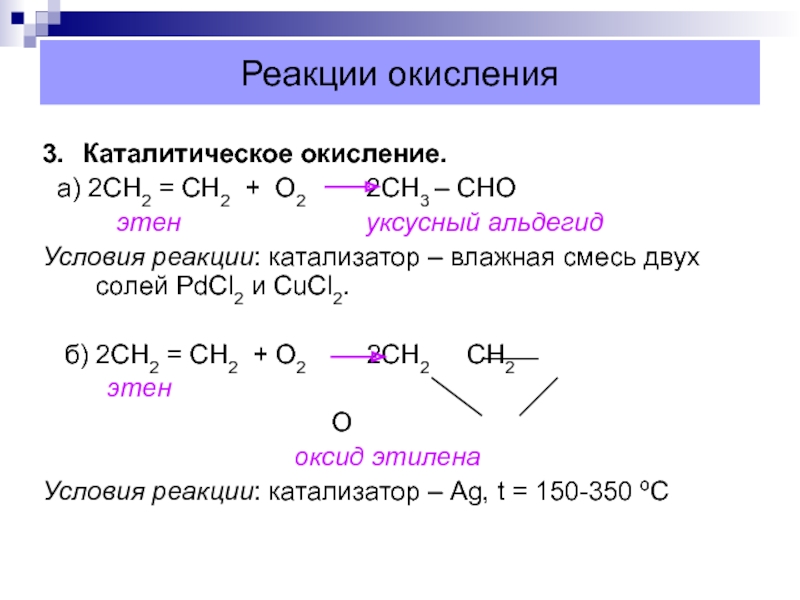
Слайд 37Реакции окисления
3. Каталитическое окисление.
а) 2СН2 = СН2 + О2
2СН3 – CHО
этен
уксусный альдегидУсловия реакции: катализатор – влажная смесь двух солей PdCl2 и CuCl2.
б) 2СН2 = СН2 + О2 2СН2 СН2
этен
О
оксид этилена
Условия реакции: катализатор – Ag, t = 150-350 ºС
Слайд 39 Горение алкенов
Алкены горят красноватым светящимся пламенем, в то время
как пламя предельных углеводородов голубое. Массовая доля углерода в алкенах
несколько выше, чем в алканах с тем же числом атомов углерода.При недостатке кислорода
Слайд 41Лабораторные способы получения алкенов
При получении алкенов необходимо учитывать правило А.М.
Зайцева: при отщеплении галогеноводорода или воды от вторичных и третичных
галогеналканов или спиртов атом водорода отщепляется от наименее гидрированного атома углерода.Дегидрогалогенирование галогеналкенов.
Н3С ─ СН2─ СНСl ─ СН3 + КОН Н3С ─ СН ═ СН ─ СН3 + КСl + Н2О
2-хлорбутан бутен-2
Условия реакции: нагревание.
Дегидратация спиртов.
Н3С ─ СН2 ─ ОН Н2С ═ СН2 + Н2О
этанол этен
Условия реакции: катализатор – Н2SO4(конц.), t = 180ºС.
Дегалогенирование дигалогеналканов.
Н3С ─ СНCl ─ СН2Сl + Мg Н3С─СН ═ СН2 + MgCl2
1,2-дихлорпрпан пропен
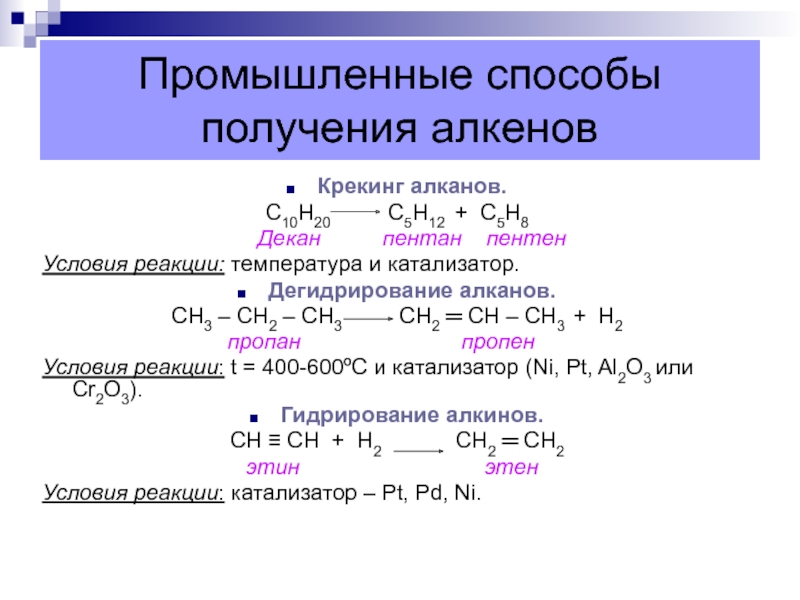
Слайд 42Промышленные способы получения алкенов
Крекинг алканов.
С10Н20
С5Н12 + С5Н8
Декан пентан пентенУсловия реакции: температура и катализатор.
Дегидрирование алканов.
СН3 – СН2 – СН3 СН2 ═ СН – СН3 + Н2
пропан пропен
Условия реакции: t = 400-600ºС и катализатор (Ni, Pt, Al2O3 или Cr2O3).
Гидрирование алкинов.
CН ≡ СН + Н2 СН2 ═ СН2
этин этен
Условия реакции: катализатор – Pt, Pd, Ni.
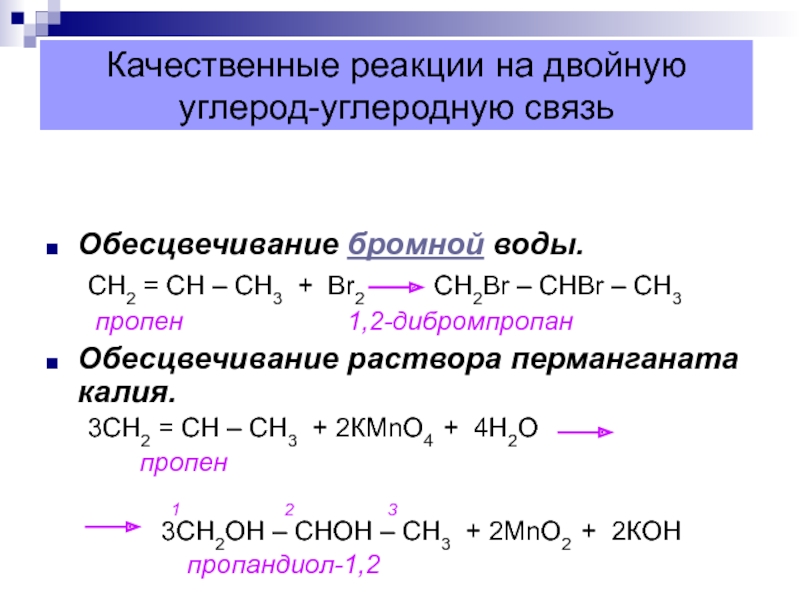
Слайд 43Качественные реакции на двойную углерод-углеродную связь
Обесцвечивание бромной воды.
СН2 = СН
– СН3 + Вr2 CH2Br –
CHBr – CH3пропен 1,2-дибромпропан
Обесцвечивание раствора перманганата калия.
3СН2 = СН – СН3 + 2КМnО4 + 4Н2О
пропен
1 2 3
3СН2ОН – СНОН – СН3 + 2МnО2 + 2КОН
пропандиол-1,2
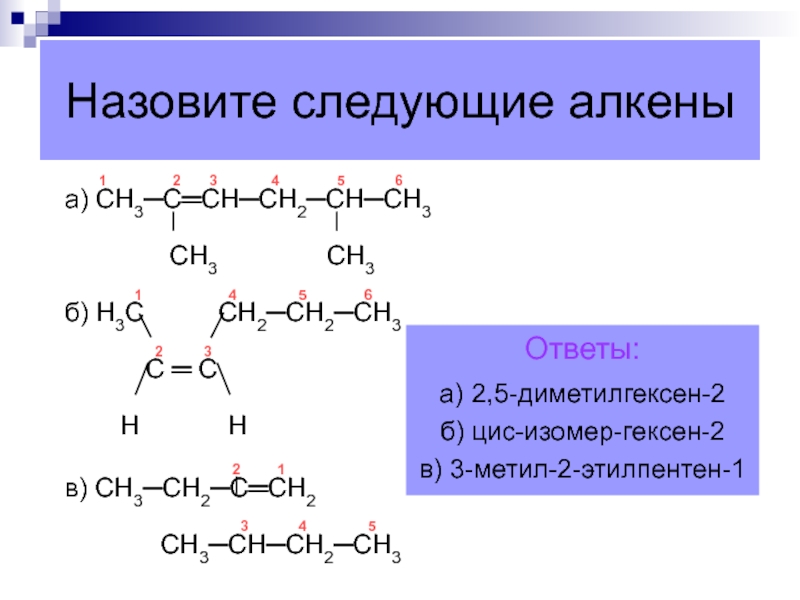
Слайд 44 1
2 3
4 5 6а) СН3─С═СН─СН2─СН─СН3
СН3 СН3
1 4 5 6
б) Н3С СН2─СН2─СН3
2 3
С ═ С
Н Н
2 1
в) СН3─СН2─С═СН2
3 4 5
СН3─СН─СН2─СН3
Ответы:
а) 2,5-диметилгексен-2
б) цис-изомер-гексен-2
в) 3-метил-2-этилпентен-1
Назовите следующие алкены
Слайд 45Проверьте правильность написаний уравнений реакций
СН3-(СН2)2-СН2Br + КОН СН3-СН2-СН=СН2 +
КBr + Н2О
СН3-СН2-СН=СН2 + НBr СН3-СН2-СН-СН3
Br
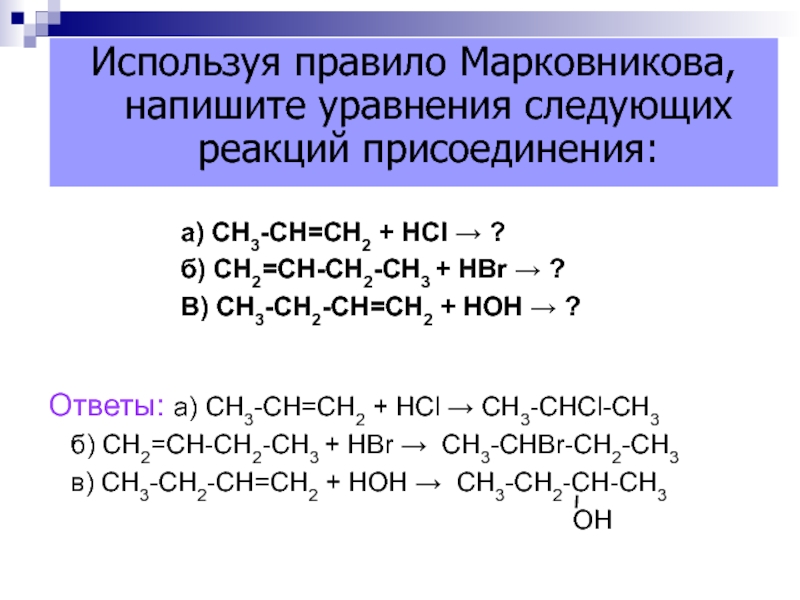
Слайд 46а) СН3-СН=СН2 + НСl ?
б) СН2=СН-СН2-СН3 + НBr
?
В) СН3-СН2-СН=СН2 + НОН ?
Ответы: а) СН3-СН=СН2 + НСl
СН3-СНCl-СН3б) СН2=СН-СН2-СН3 + НBr СН3-СНBr-СН2-СН3
в) СН3-СН2-СН=СН2 + НОН СН3-СН2-СН-СН3
ОН
Используя правило Марковникова, напишите уравнения следующих реакций присоединения:
Слайд 47
Осуществить превращения:
+ КОН(спирт),t
+ НBr + NaСН3-(СН2)2-СН2Br Х1 Х2 Х3
Ответы: Х1 бутен-1
Х2 2-бромбутан
Х3 3,4-диметилгексан