Слайд 1БИОФИЗИКА СОКРАТИТЕЛЬНЫХ ПРОЦЕССОВ
ДВИЖЕНИЕ – ЭТО ЖИЗНЬ!
Слайд 2ВИДЫ ПОДВИЖНОСТИ
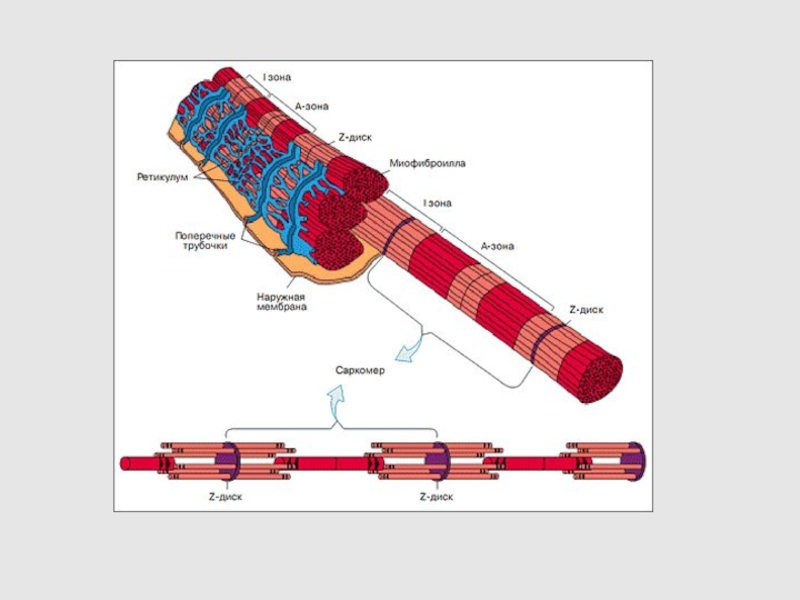
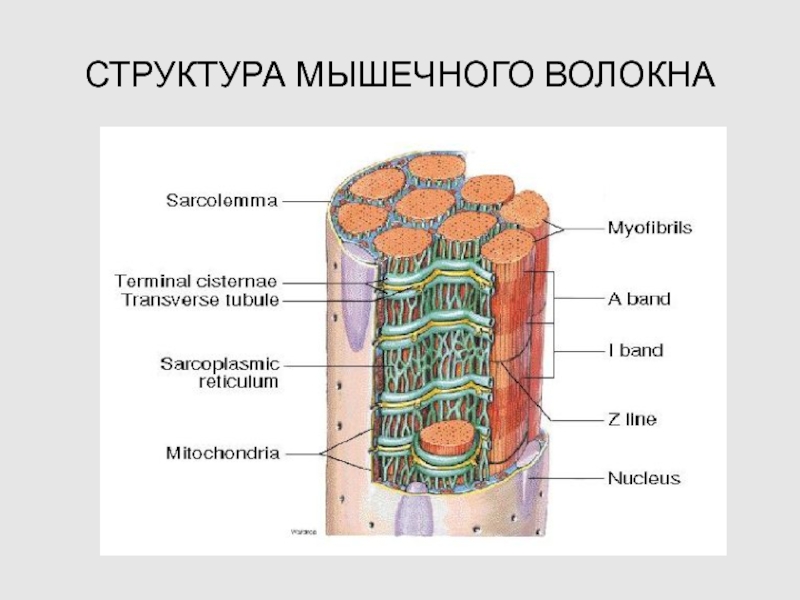
2. СТРУКТУРА МЫШЕЧНОГО ВОЛОКНА
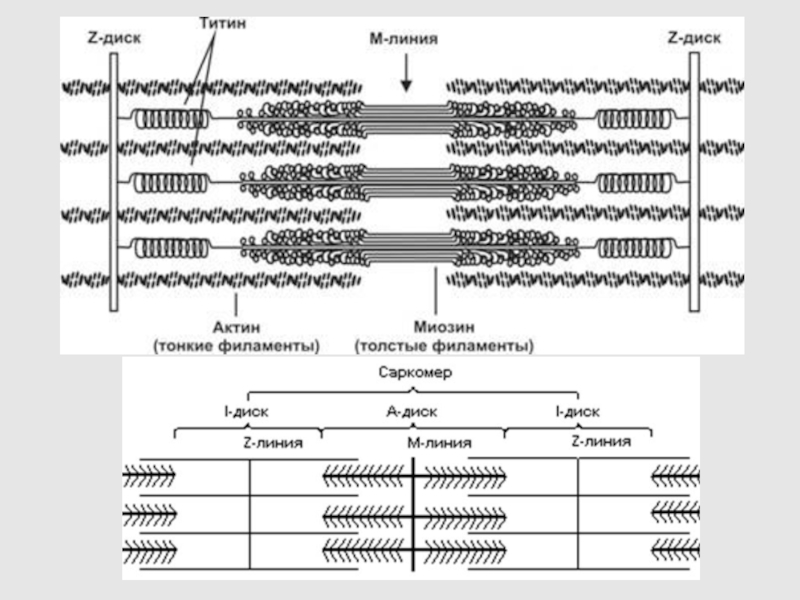
3. СТРОЕНИЕ САРКОМЕРА
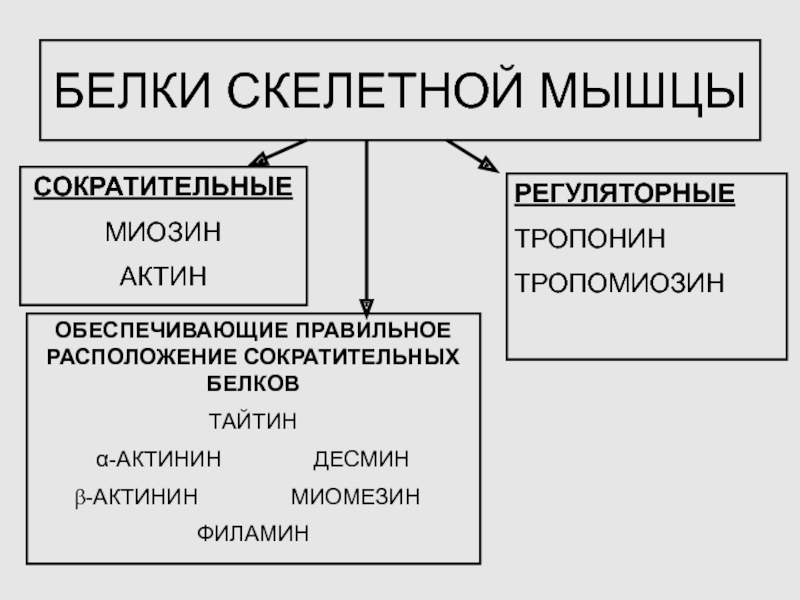
4. БЕЛКИ СКЕЛЕТНЫХ МЫШЦ:
СОКРАТИТЕЛЬНЫЕ, РЕГУЛЯТОРНЫЕ, ВСПОМОГАТЕЛЬНЫЕ
5. МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ
6. ЭЛЕКТРОМЕХАНИЧЕСКОЕ СОПРЯЖЕНИЕ В СКЕЛЕТНЫХ
МЫШЦАХ
7. БИОМЕХАНИКА СКЕЛЕТНОЙ МЫШЦЫ
Слайд 3
ВИДЫ ПОДВИЖНОСТИ
МЫШЕЧНАЯ НЕМЫШЕЧНАЯ
СОКРАЩЕНИЯ МЫШЦ РАЗНОГО ТИПА ДВИЖЕНИЕ ЖГУТИКОВ БАКТЕРИЙ
АМЕБОИДНОЕ ДВИЖЕНИЕ
ДВИЖЕНИЕ
ЦИТОПЛАЗМЫ КЛЕТОК
СОКРАЩЕНИЕ ХВОСТОВОГО ЧЕХЛА
БАКТЕРИОФАГА
Слайд 4МЫШЕЧНАЯ ТКАНЬ
ИСЧЕРЧЕННАЯ (СКЕЛЕТНАЯ, РАБОЧИЙ МИОКАРД)
НЕИСЧЕРЧЕННАЯ (ГЛАДКАЯ)
Слайд 5ФУНКЦИИ СКЕЛЕТНЫХ МЫШЦ:
ПОДДЕРЖАНИЕ ПОЗЫ
ПЕРЕМЕЩЕНИЕ ТЕЛА В ПРОСТРАНСТВЕ
ДВИЖЕНИЕ ЧАСТЕЙ ТЕЛА
ОТНОСИТЕЛЬНО ДРУГ ДРУГА
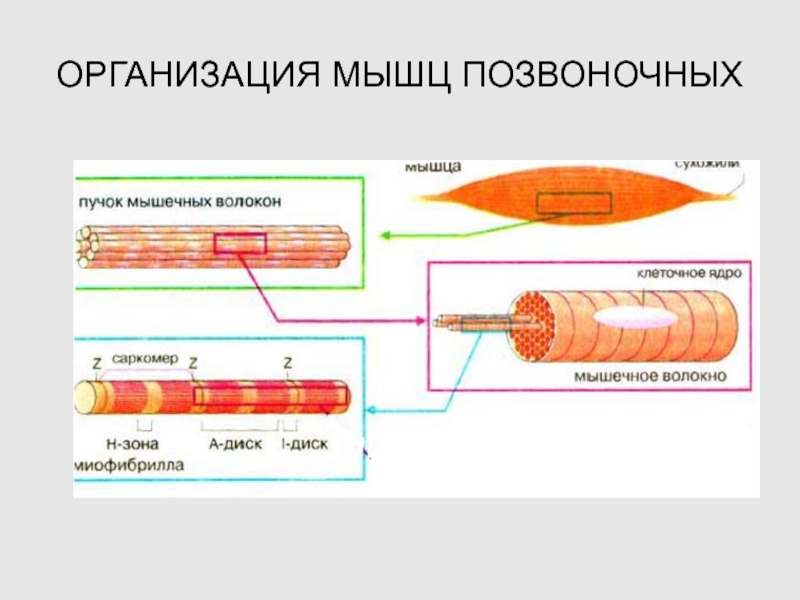
Слайд 6ОРГАНИЗАЦИЯ МЫШЦ ПОЗВОНОЧНЫХ
Слайд 9ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКАЯ ФОТОГРАФИЯ САРКОМЕРА
Слайд 11
Схематическое изображение строения саркомеров мышечного волокна:
а - продольный разрез
б - поперечный разрез в области пересечения толстых и тонких
нитей (гексагональная структура)
в - изменение длины саркомера в результате движения толстых и тонких нитей
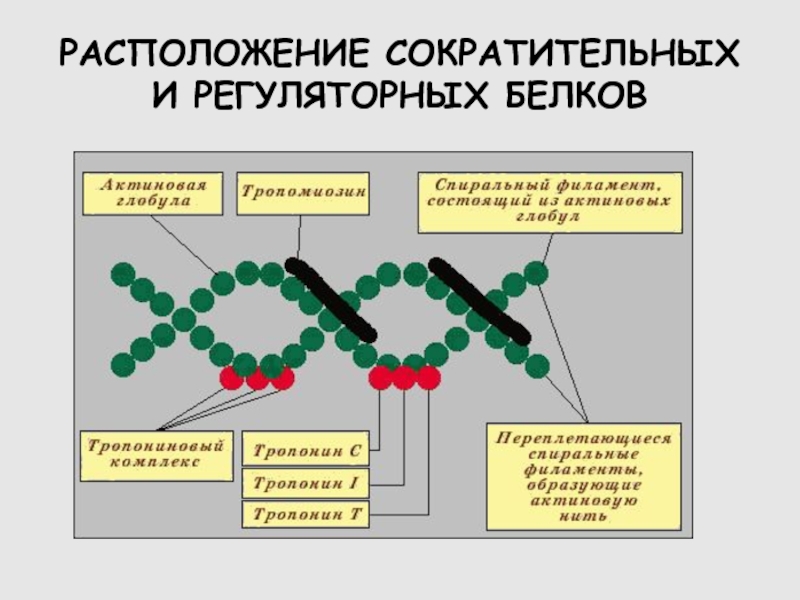
Слайд 12БЕЛКИ СКЕЛЕТНОЙ МЫШЦЫ
СОКРАТИТЕЛЬНЫЕ
МИОЗИН
АКТИН
РЕГУЛЯТОРНЫЕ
ТРОПОНИН
ТРОПОМИОЗИН
ОБЕСПЕЧИВАЮЩИЕ ПРАВИЛЬНОЕ РАСПОЛОЖЕНИЕ СОКРАТИТЕЛЬНЫХ БЕЛКОВ
ТАЙТИН
α-АКТИНИН
ДЕСМИН
-АКТИНИН
МИОМЕЗИН
ФИЛАМИН
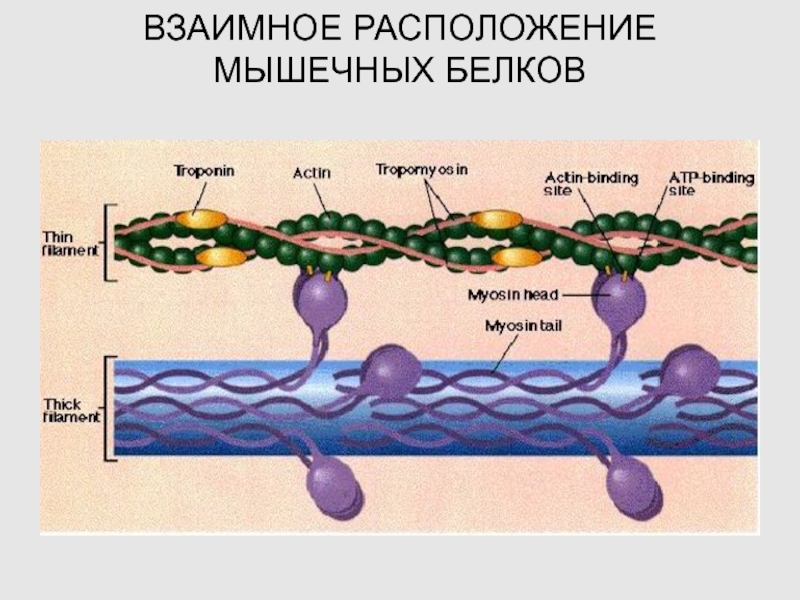
Слайд 13РАСПОЛОЖЕНИЕ СОКРАТИТЕЛЬНЫХ И РЕГУЛЯТОРНЫХ БЕЛКОВ
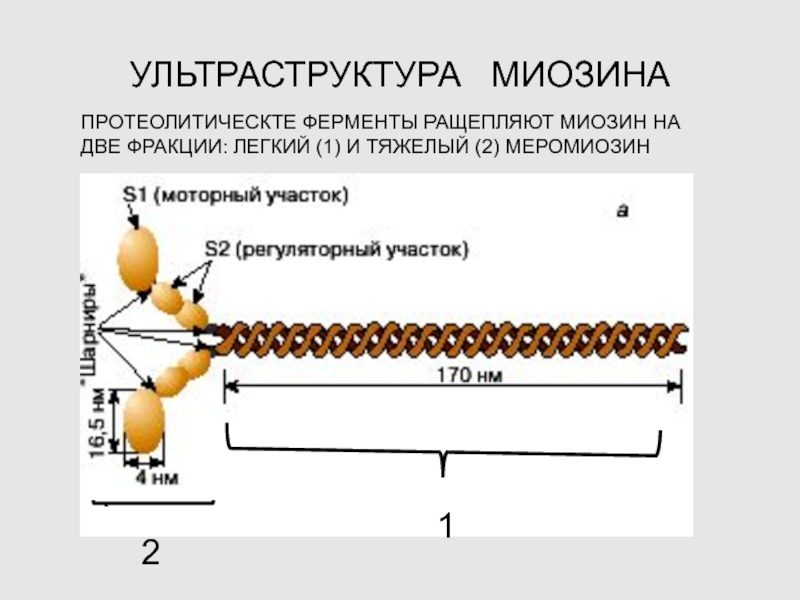
Слайд 14УЛЬТРАСТРУКТУРА МИОЗИНА
ПРОТЕОЛИТИЧЕСКТЕ ФЕРМЕНТЫ РАЩЕПЛЯЮТ МИОЗИН НА ДВЕ ФРАКЦИИ: ЛЕГКИЙ
(1) И ТЯЖЕЛЫЙ (2) МЕРОМИОЗИН
2
1
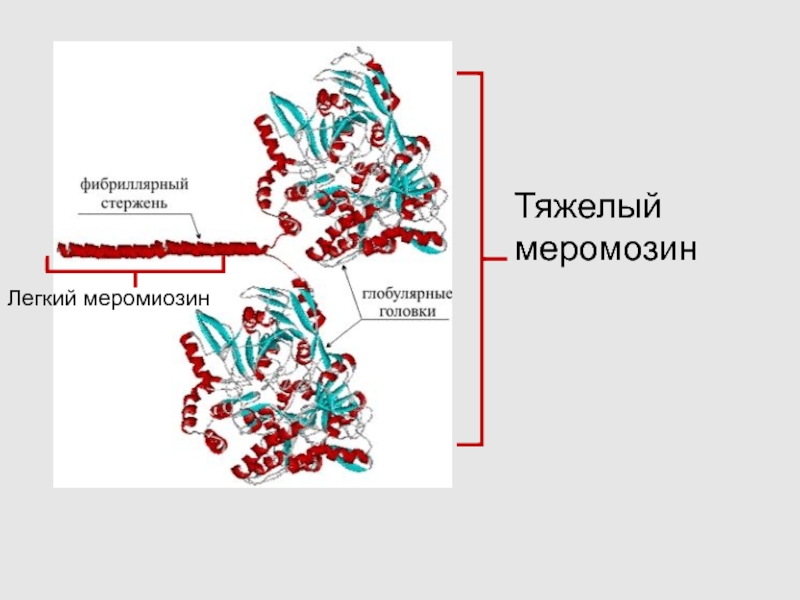
Слайд 15
Тяжелый меромозин
Легкий меромиозин
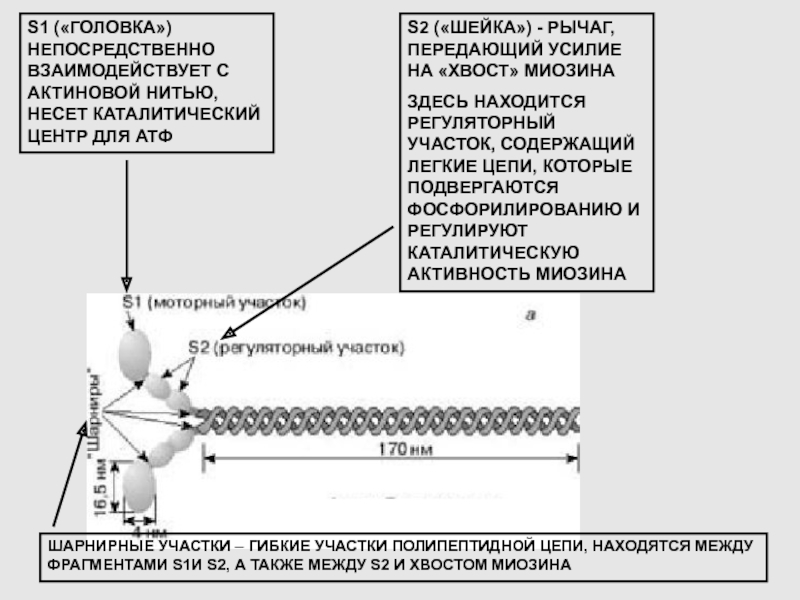
Слайд 16S1 («ГОЛОВКА») НЕПОСРЕДСТВЕННО ВЗАИМОДЕЙСТВУЕТ С АКТИНОВОЙ НИТЬЮ, НЕСЕТ КАТАЛИТИЧЕСКИЙ ЦЕНТР
ДЛЯ АТФ
S2 («ШЕЙКА») - РЫЧАГ, ПЕРЕДАЮЩИЙ УСИЛИЕ НА «ХВОСТ» МИОЗИНА
ЗДЕСЬ НАХОДИТСЯ РЕГУЛЯТОРНЫЙ УЧАСТОК, СОДЕРЖАЩИЙ ЛЕГКИЕ ЦЕПИ, КОТОРЫЕ ПОДВЕРГАЮТСЯ ФОСФОРИЛИРОВАНИЮ И РЕГУЛИРУЮТ КАТАЛИТИЧЕСКУЮ АКТИВНОСТЬ МИОЗИНА
ШАРНИРНЫЕ УЧАСТКИ – ГИБКИЕ УЧАСТКИ ПОЛИПЕПТИДНОЙ ЦЕПИ, НАХОДЯТСЯ МЕЖДУ ФРАГМЕНТАМИ S1И S2, А ТАКЖЕ МЕЖДУ S2 И ХВОСТОМ МИОЗИНА
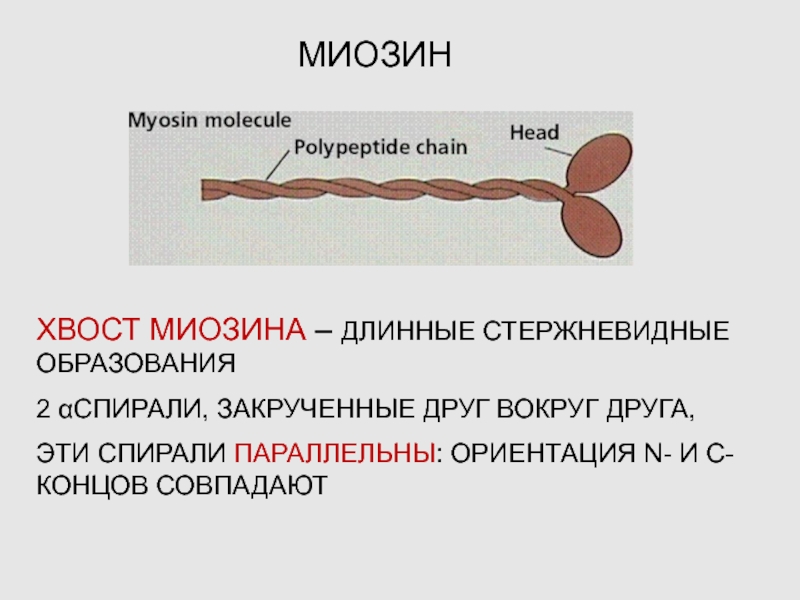
Слайд 18МИОЗИН
ХВОСТ МИОЗИНА – ДЛИННЫЕ СТЕРЖНЕВИДНЫЕ ОБРАЗОВАНИЯ
2 αСПИРАЛИ, ЗАКРУЧЕННЫЕ ДРУГ ВОКРУГ
ДРУГА,
ЭТИ СПИРАЛИ ПАРАЛЛЕЛЬНЫ: ОРИЕНТАЦИЯ N- И С-КОНЦОВ СОВПАДАЮТ
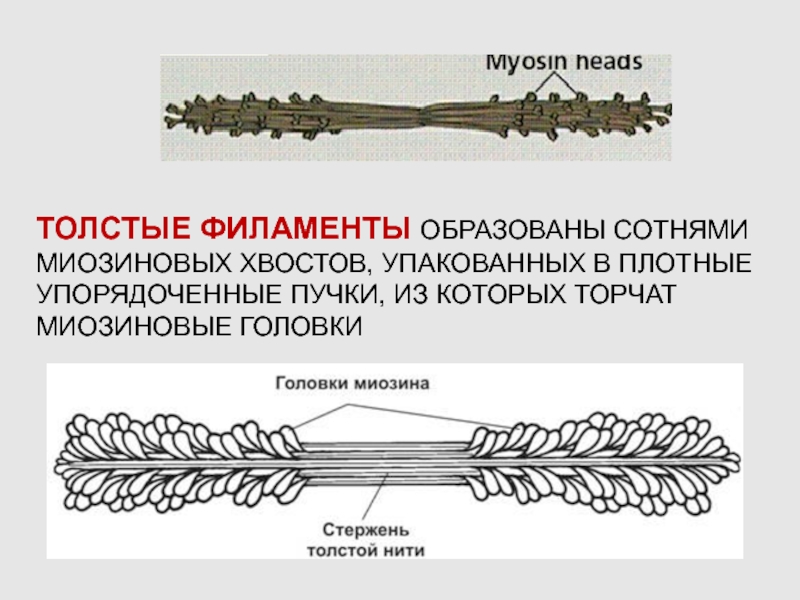
Слайд 19ТОЛСТЫЕ ФИЛАМЕНТЫ ОБРАЗОВАНЫ СОТНЯМИ МИОЗИНОВЫХ ХВОСТОВ, УПАКОВАННЫХ В ПЛОТНЫЕ УПОРЯДОЧЕННЫЕ
ПУЧКИ, ИЗ КОТОРЫХ ТОРЧАТ МИОЗИНОВЫЕ ГОЛОВКИ
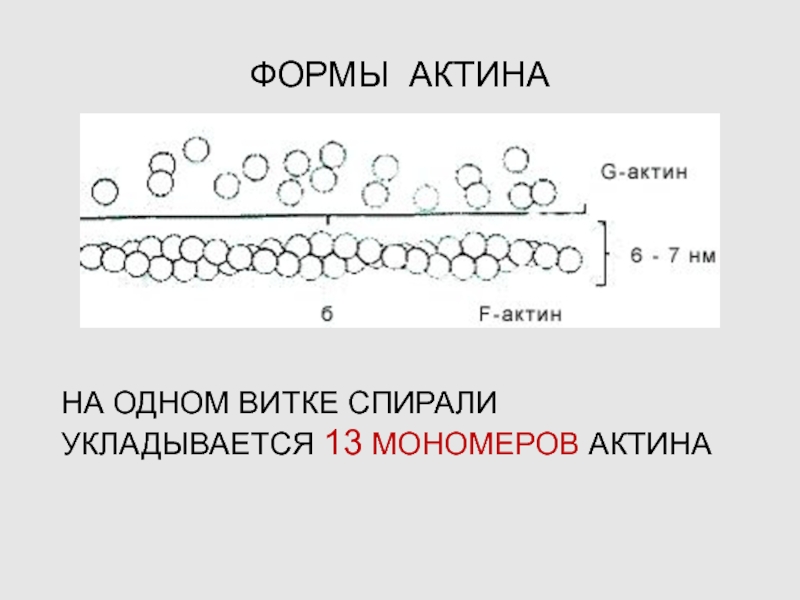
Слайд 20ФОРМЫ АКТИНА
НА ОДНОМ ВИТКЕ СПИРАЛИ УКЛАДЫВАЕТСЯ 13 МОНОМЕРОВ АКТИНА
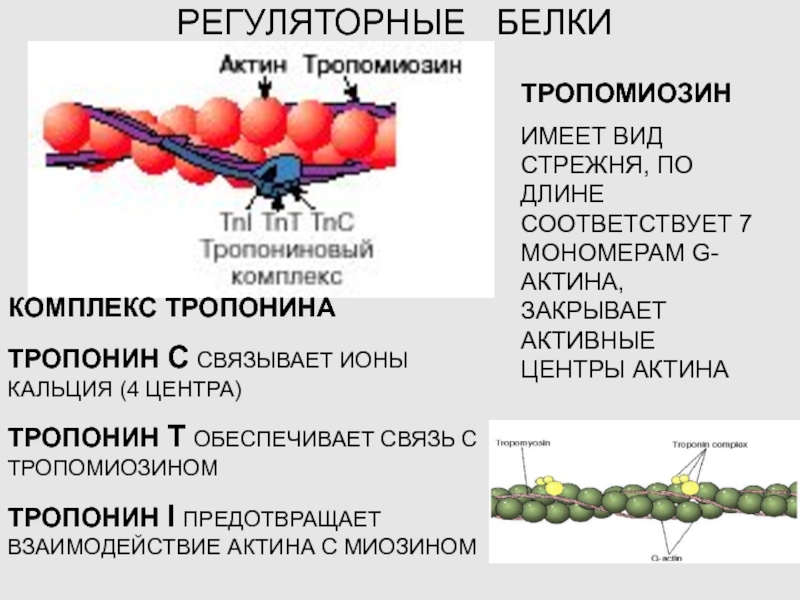
Слайд 21РЕГУЛЯТОРНЫЕ БЕЛКИ
ТРОПОМИОЗИН
ИМЕЕТ ВИД СТРЕЖНЯ, ПО ДЛИНЕ СООТВЕТСТВУЕТ 7 МОНОМЕРАМ
G-АКТИНА, ЗАКРЫВАЕТ АКТИВНЫЕ ЦЕНТРЫ АКТИНА
КОМПЛЕКС ТРОПОНИНА
ТРОПОНИН С СВЯЗЫВАЕТ ИОНЫ КАЛЬЦИЯ
(4 ЦЕНТРА)
ТРОПОНИН Т ОБЕСПЕЧИВАЕТ СВЯЗЬ С ТРОПОМИОЗИНОМ
ТРОПОНИН I ПРЕДОТВРАЩАЕТ ВЗАИМОДЕЙСТВИЕ АКТИНА С МИОЗИНОМ
Слайд 23ВСПОМОГАТЕЛЬНЫЕ БЕЛКИ МЫШЦЫ:
Белки, обеспечивающие регулярное расположение сократительных белков
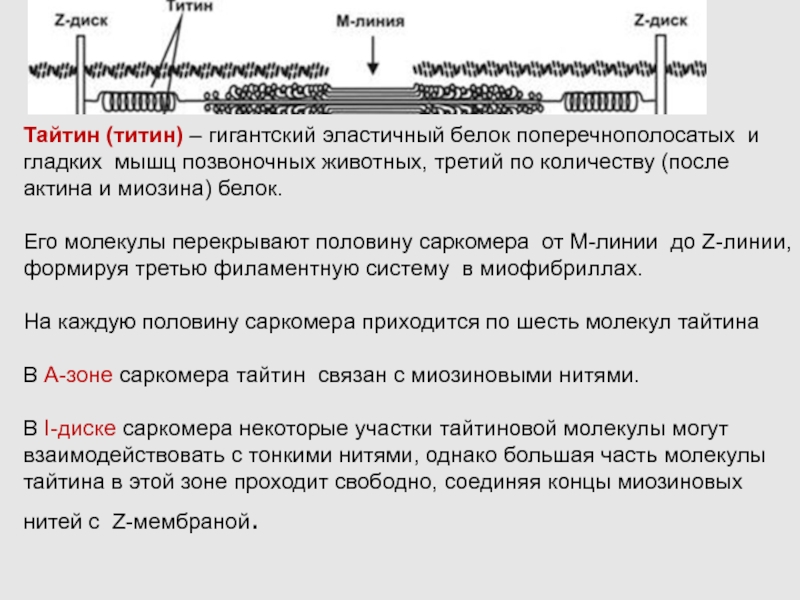
Слайд 24Тайтин (титин) – гигантский эластичный белок поперечнополосатых и гладких мышц
позвоночных животных, третий по количеству (после актина и миозина) белок.
Его молекулы перекрывают половину саркомера от М-линии до Z-линии, формируя третью филаментную систему в миофибриллах.
На каждую половину саркомера приходится по шесть молекул тайтина
В А-зоне саркомера тайтин связан с миозиновыми нитями.
В I-диске саркомера некоторые участки тайтиновой молекулы могут взаимодействовать с тонкими нитями, однако большая часть молекулы тайтина в этой зоне проходит свободно, соединяя концы миозиновых нитей с Z-мембраной.
Слайд 25Z-ПОЛОСКА СОДЕРЖИТ α-АКТИНИН, ФИЛАМИН, ДЕСМИН, КОТОРЫЕ ОБРАЗУЮТ ПОПЕРЕЧНЫЕ МОСТИКИ МЕЖДУ
АКТИНОВЫМИ НИТЯМИ, ПРИКРЕПЛЯЮТ ИХ К Z-ДИСКУ.
БЕЛКИ М-ПОЛОСЫ (МИОМЕЗИН И ДР.)
ПОДДЕРЖИВАЮТ ТОЛСТЫЕ ФИЛАМЕНТЫ
β-АКТИНИН ВЛИЯЕТ НА ПОЛИМЕРИЗАЦИЮ АКТИНА
Слайд 26ВЗАИМНОЕ РАСПОЛОЖЕНИЕ МЫШЕЧНЫХ БЕЛКОВ
Слайд 27МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ
Э.Хаксли
Слайд 28Доказательства теории скользящих нитей
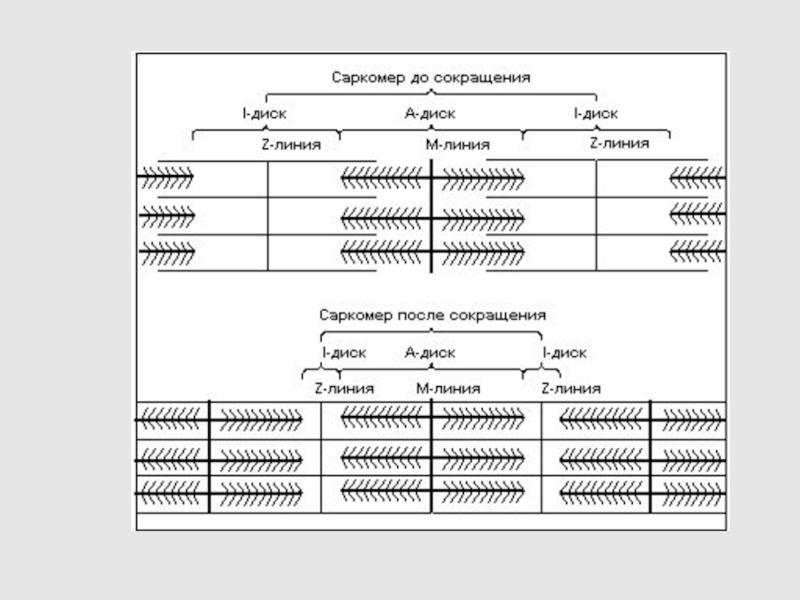
ПРИ СОКРАЩЕНИИ МЫШЦЫ ДЛИНЫ ТОЛСТЫХ И ТОНКИХ
НИТЕЙ НЕ ИЗМЕНЯЮТСЯ
САРКОМЕР УКОРАЧИВАЕТСЯ ЗА СЧЕТ ПЕРЕКРЫВАНИЯ ТОЛСТЫХ И
ТОНКИХ НИТЕЙ, КОТОРЫЕ СКОЛЬЗЯТ ДРУГ ОТНОСИТЕЛЬНО ДРУГА, ПОЛОСЫ H И I УКОРАЧИВАЮТСЯ
СИЛА, РАЗВИВАЕМАЯ МЫШЦЕЙ, СОЗДАЕТСЯ В ПРОЦЕССЕ ДВИЖЕНИЯ СОСЕДНИХ НИТЕЙ
Слайд 30Уменьшение размеров саркомеров во время сокращения
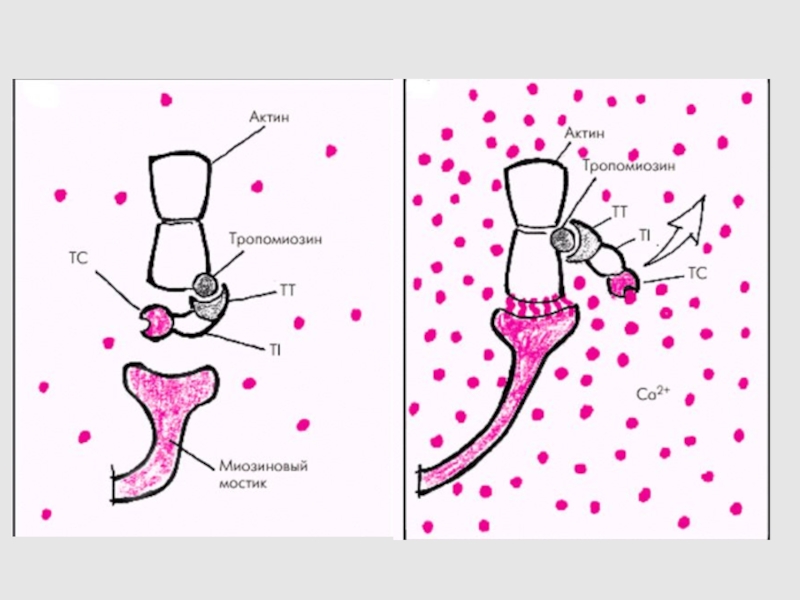
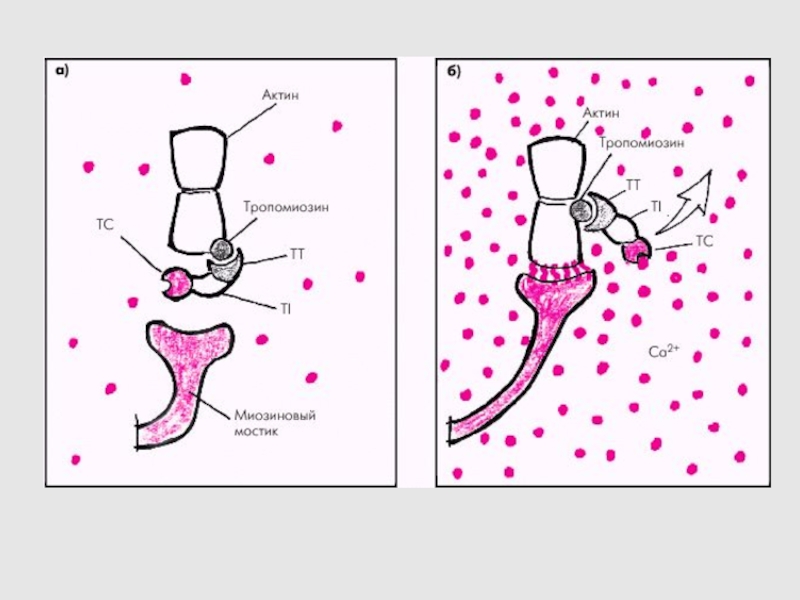
Слайд 31РОЛЬ ИОНОВ КАЛЬЦИЯ В СОКРАЩЕНИИ
ТРОПОМИОЗИН МЕНЯЕТ СВОЕ ПОЛОЖЕНИЕ В ЗАВИСИМОСТИ
ОТ КОНЦЕНТРАЦИИ ИОНОВ КАЛЬЦИЯ.
НИЗКАЯ [Ca2+] – ТРОПОМИОЗИН ОРИЕНТИРОВАН ПОД УГЛОМ
50о ПО ОТНОШЕНИЮ К ЦЕНТРУ ТОНКОЙ НИТИ
РОСТ [Ca2+] – ТРОПОМИОЗИН «СПОЛЗАЕТ» В БОРОЗДКУ АКТИНОВОЙ НИТИ, УГОЛ СТАНОВИТСЯ РАВНЫМ 70о
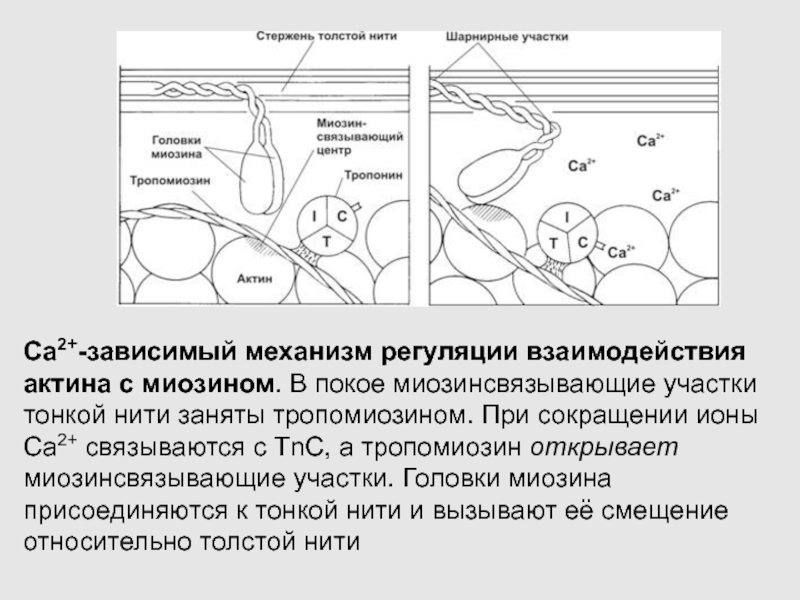
Слайд 32Ca2+-зависимый механизм регуляции взаимодействия актина с миозином. В покое миозинсвязывающие
участки тонкой нити заняты тропомиозином. При сокращении ионы Ca2+ связываются
с TnC, а тропомиозин открывает миозинсвязывающие участки. Головки миозина присоединяются к тонкой нити и вызывают её смещение относительно толстой нити
Слайд 34Скольжение толстых и тонких нитей друг относительно друга совершается за
счет энергии, выделяемой при гидролизе АТР(атф) до ADP(адф) и неорганического
фосфата (Pi).
1939 год В.А. Энгельгардт и М.Н. Любимова открыли АТРазную активность миозина,
А. Сент-Дьорди (удостоенный впоследствии Нобелевской премии): в растворе актин и миозин образуют так называемый актомиозиновый комплекс.
РОЛЬ АТФ В СОКРАЩЕНИИ
Слайд 35
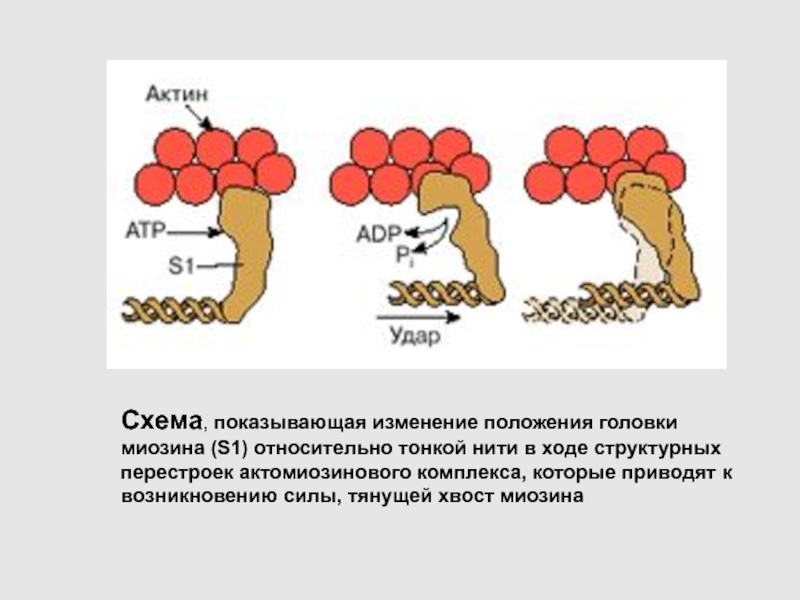
Схема, показывающая изменение положения головки миозина (S1) относительно тонкой нити
в ходе структурных перестроек актомиозинового комплекса, которые приводят к возникновению
силы, тянущей хвост миозина
Слайд 36
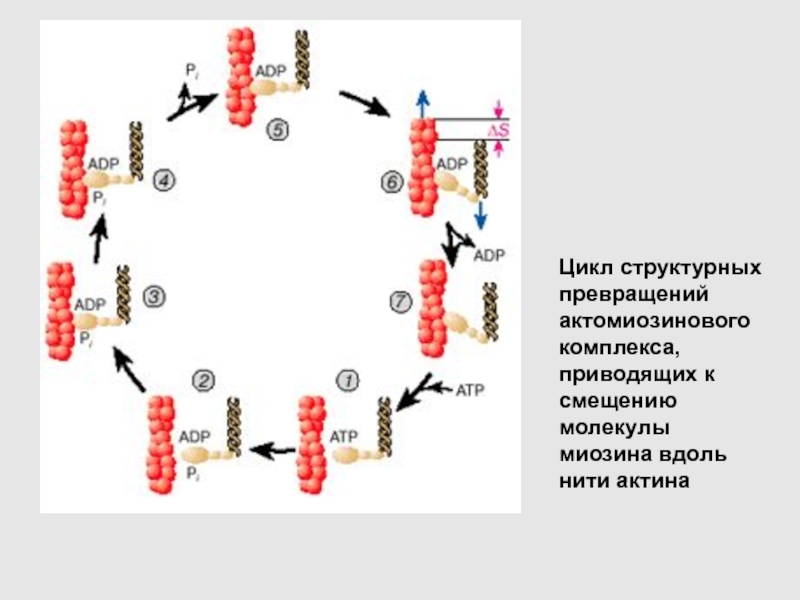
Цикл структурных превращений актомиозинового комплекса, приводящих к смещению молекулы миозина
вдоль нити актина
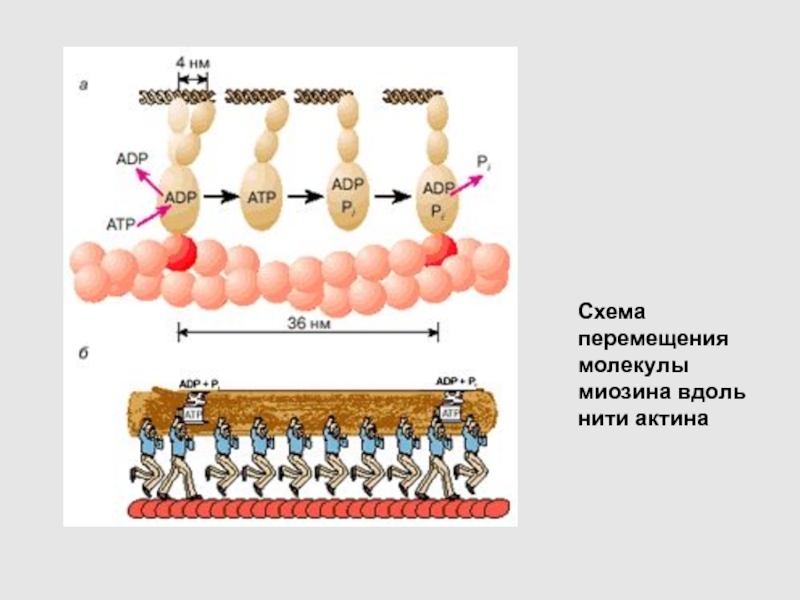
Слайд 37Рабочий цикл актомиозинового комплекса
В расслабленной мышце миозиновый мостик отделен от
актиновой цепи
Связывание молекулы АТР с активным центром миозина: его головка
остается отсоединенной от актина. В каталитическом центре миозина молекула АТР расщепляется на ADP и Pi
3. Гидролиз молекулы АТР вызывает присоединение головки миозина к актиновой нити: сначала образуется слабая связь, затем возникает более прочная связь
4. Прочное связывание головки миозина с актином инициирует освобождение фосфата Рi из активного центра В результате - поворот мостика в сторону хвоста. Вместе с поворотом мостика смещается вдоль нити актина хвост миозина, который соединен с мостиком с помощью "шарнирного" сочленения.
После смещения головки миозина, инициированного диссоциацией фосфата, молекула ADP уходит из каталитического центра, а ее место занимает новая молекула АТР. Это превращение сопровождается отсоединением головки миозина от актина, завершающим цикл структурных преобразований, происходящих в активном центре миозина.
В результате многократно повторяющихся циклов гидролиза АТР возникает направленное скольжение нитей миозина и актина друг относительно друга.

Слайд 38
Схема перемещения молекулы миозина вдоль нити актина
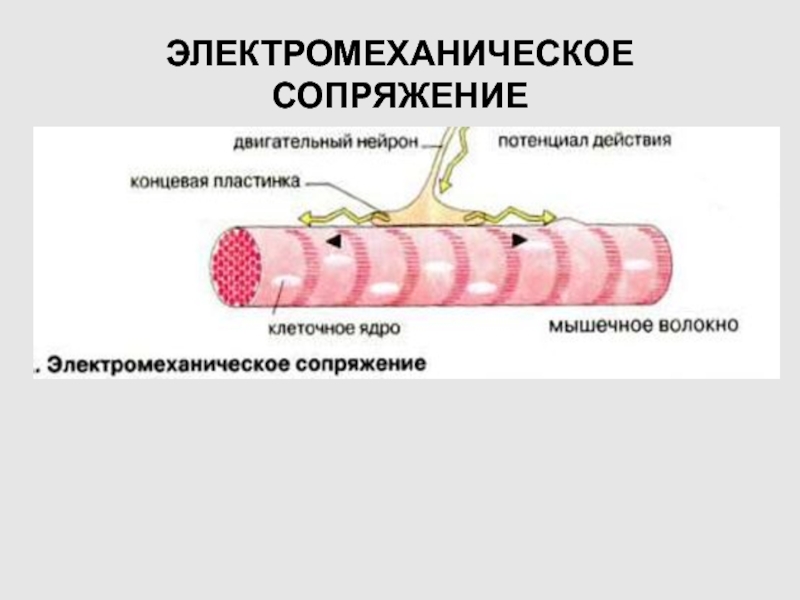
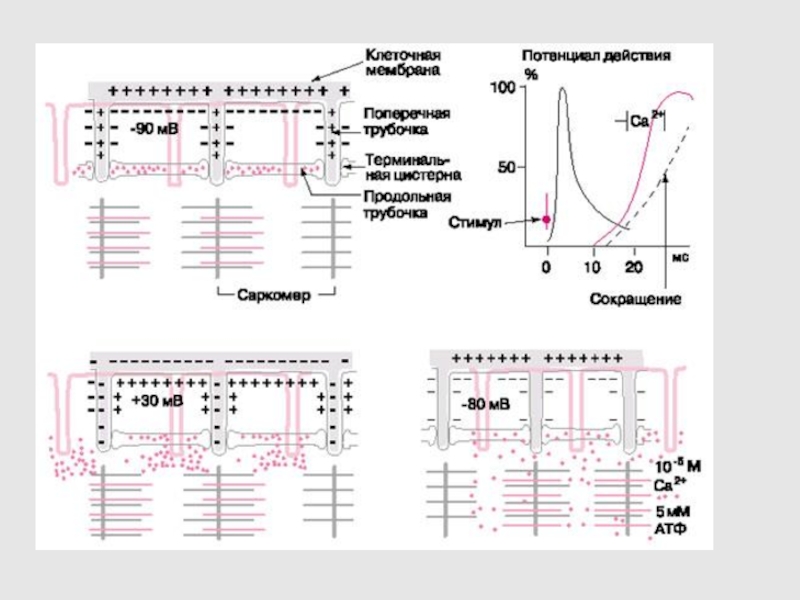
Слайд 39ЭЛЕКТРОМЕХАНИЧЕСКОЕ СОПРЯЖЕНИЕ В СКЕЛЕТНЫХ МЫШЦАХ
Слайд 40ПП МЫШЕЧНОГО ВОЛОКНА –80 –90 мВ
ПД ФАЗНОГО МЫШЕЧНОГО ВОЛОКНА: АМПЛИТУДА
120 –130 мВ, ОВЕШУТ+30 - +50мВ,
ПРОДОЛЖИТЕЛЬНОСТЬ – 3 –
5 мс
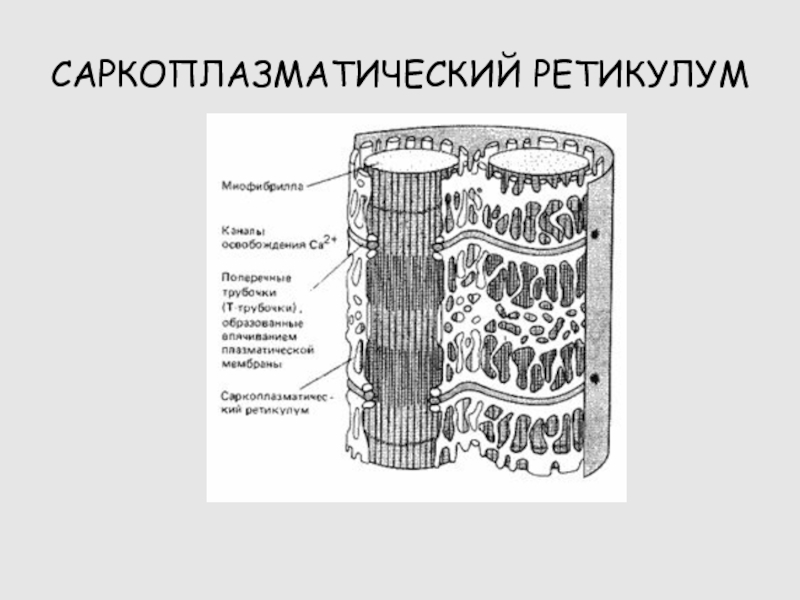
Слайд 42СИСТЕМА ЭМС
САРКОЛЕММА
Т-СИСТЕМА
SPR
РЕГУЛЯТОРНЫЕ БЕЛКИ МИОФИБРИЛЛ
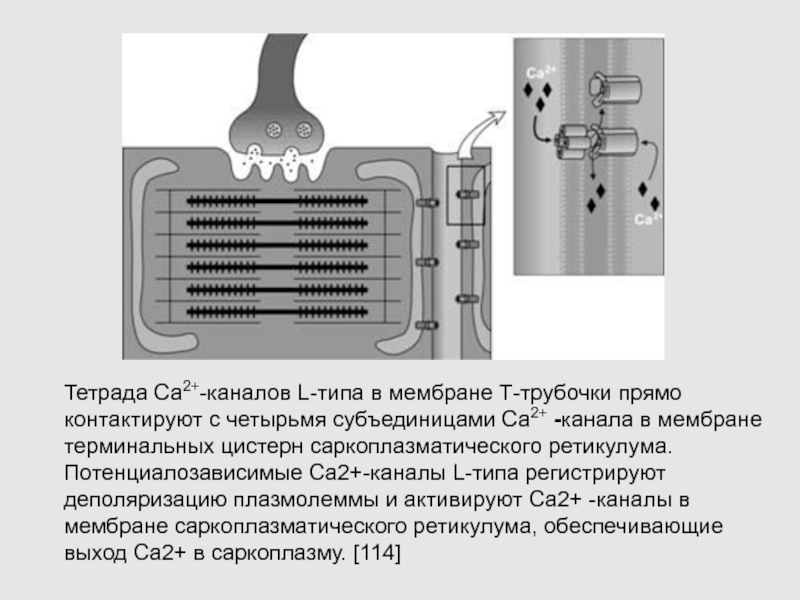
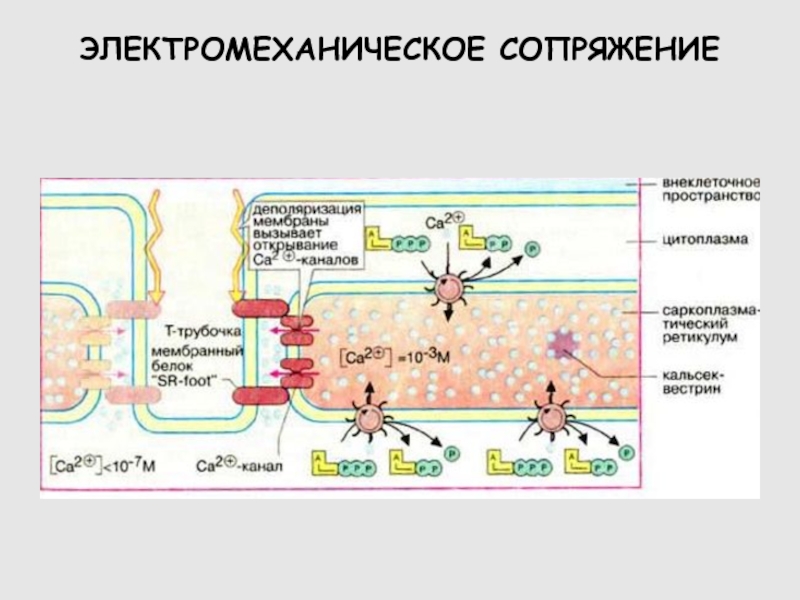
Слайд 44Тетрада Са2+-каналов L-типа в мембране Т-трубочки прямо контактируют с четырьмя
субъединицами Ca2+ -канала в мембране терминальных цистерн саркоплазматического ретикулума. Потенциалозависимые Са2+-каналы
L-типа регистрируют деполяризацию плазмолеммы и активируют Ca2+ -каналы в мембране саркоплазматического ретикулума, обеспечивающие выход Ca2+ в саркоплазму. [114]
Слайд 48раздел естественных наук, изучающий на основе моделей и методов механики
механические свойства живых тканей, отдельных органов и систем, или организма
в целом, а также происходящие в них механические явления.
БИОМЕХАНИКА –
Рисунок из книги Дж. Борелли De motu animalium
Система рычагов, схема прикрепления мышц при сгибании в суставе и при разгибании. Скелетно-мышечная схема двух человек, по-разному удерживающих различный груз
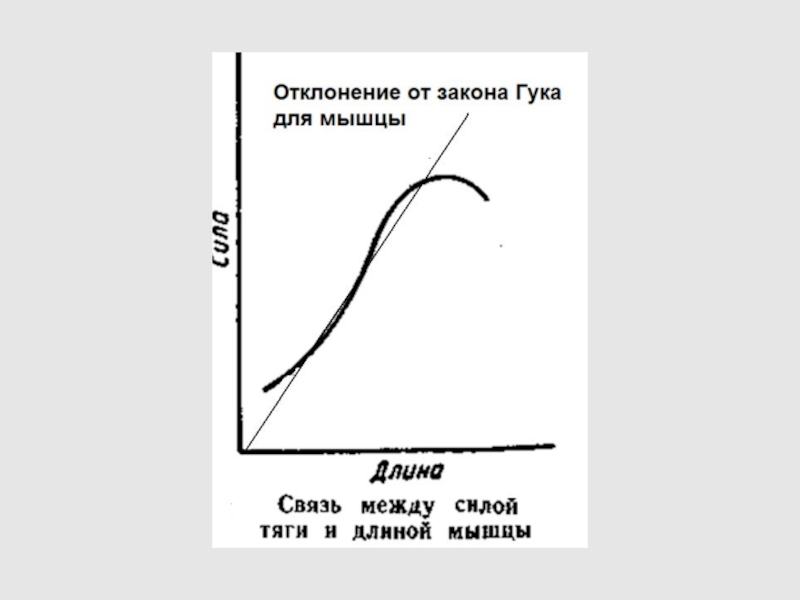
Слайд 49 Упругое тело Гука
ДЕФОРМАЦИЯ ε– ОТНОСИТЕЛЬНОЕ ИЗМЕНЕНИЕ ДЛИНЫ
Δl –
изменение длины
l - начальная длина
- МЕХАНИЧЕСКОЕ НАПРЯЖЕНИЕ
Е –
МОДУЛЬ ЮНГА
ЗАКОН ГУКА
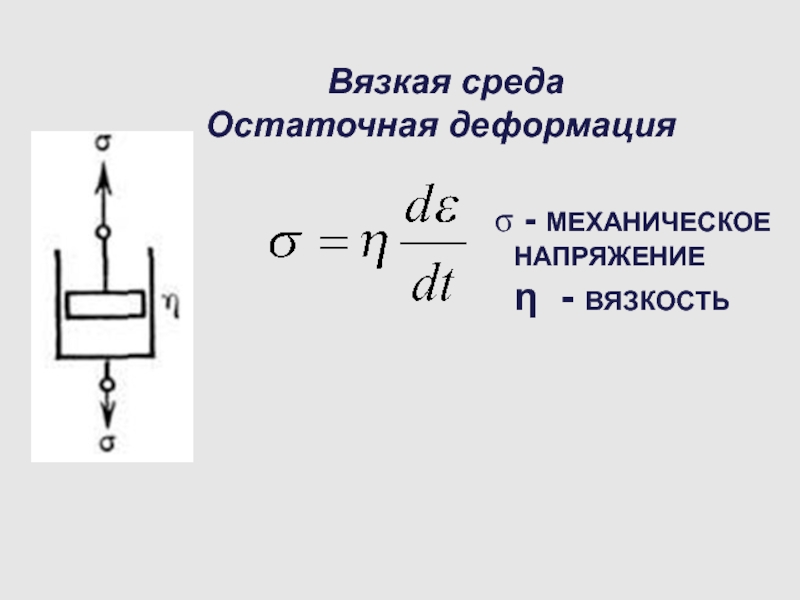
Слайд 50 Вязкая среда
Остаточная деформация
- МЕХАНИЧЕСКОЕ НАПРЯЖЕНИЕ
η - ВЯЗКОСТЬ
Слайд 52Сила, с которой мышца при ее сокращении действует на предмет,
называется мышечным напряжением.
Сила действия предмета (обычно его веса) на мышцу
- это нагрузка.
Силы мышечного напряжения и нагрузки противодействуют друг другу.
Слайд 54Интервал от начала развития напряжения до момента его максимума -
это время сокращения.
Время сокращения быстрых волокон не более 10
мс, а медленных волокон не менее 100 мс.
Длительность сокращения определяется тем, как долго цитоплазматическая концентрация Са2+ остается повышенной, обеспечивая продолжение циклической активности поперечных мостиков . Время сокращения обусловлено активностью Са2+-АТФазы саркоплазматического ретикулума , которая в быстрых волокнах выше, чем в медленных.
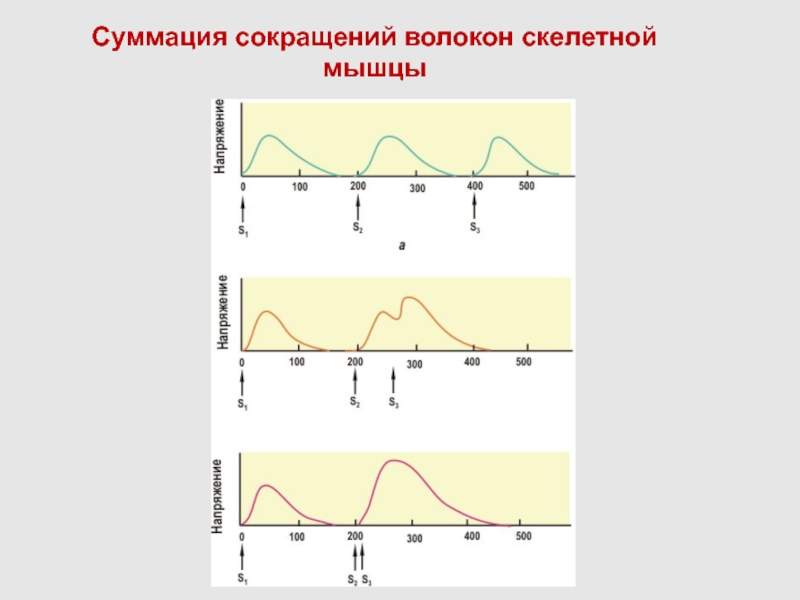
Слайд 55СУММАЦИЯ И СЛИЯНИЕ ОДИНОЧНЫХ СОКРАЩЕНИЙ
Слайд 56Суммация сокращений волокон скелетной мышцы
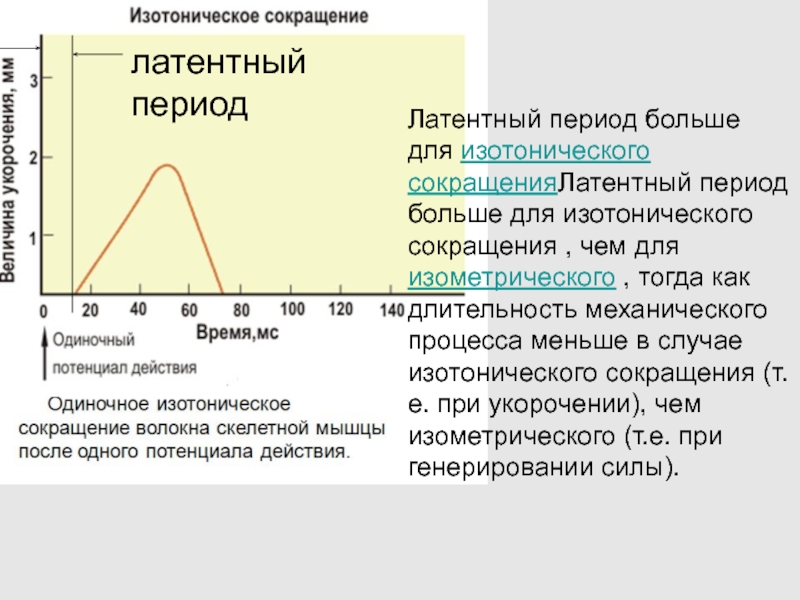
Слайд 60Латентный период больше для изотонического сокращенияЛатентный период больше для изотонического
сокращения , чем для изометрического , тогда как длительность механического
процесса меньше в случае изотонического сокращения (т.е. при укорочении), чем изометрического (т.е. при генерировании силы).
латентный период
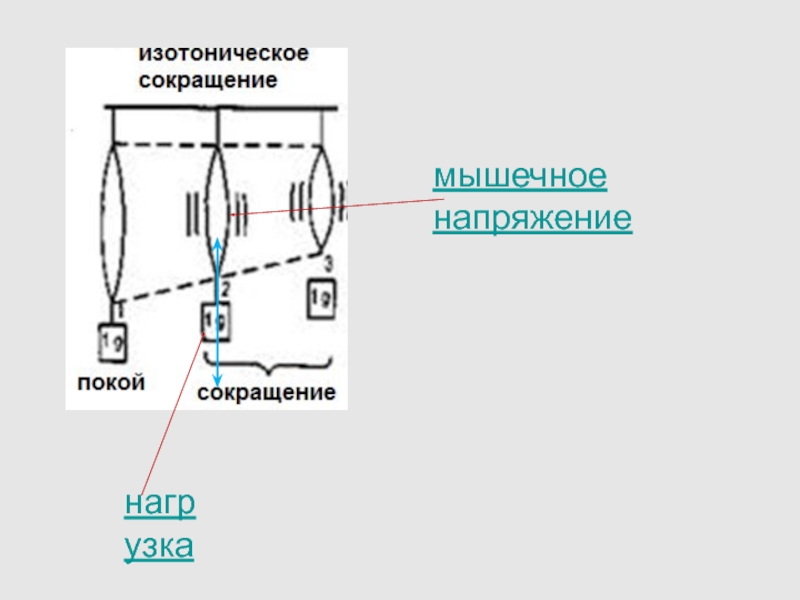
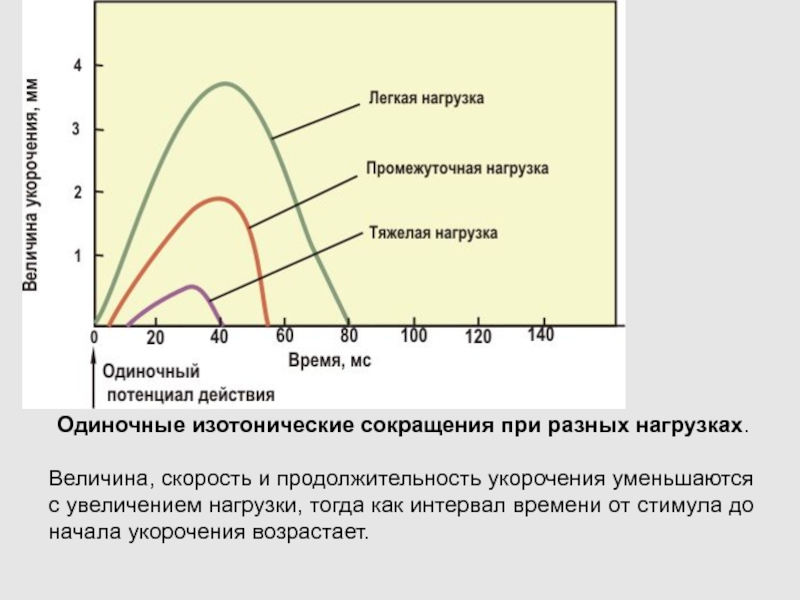
Слайд 61Одиночные изотонические сокращения при разных нагрузках.
Величина, скорость и продолжительность
укорочения уменьшаются с увеличением нагрузки, тогда как интервал времени от
стимула до начала укорочения возрастает.
Слайд 62В зависимости от нагрузки изменяются:
латентный период (чем больше нагрузка, тем
он продолжительнее)
скорость укорочения (величина укорочения мышцы в единицу времени)
длительность сокращения
величина укорочения мышцы
У
М
Е
Н
Ь
Ш
А
Ю
Т
С
Я
Слайд 63Последовательность явлений во время изотонического одиночного сокращения.
Возбуждении мышечного волокна
→ поперечные мостики начинают развивать силу. Эта сила (мышечное напряжение)
должно превысить нагрузку на волокно.
Укорочению предшествует период изометрического сокращения , в течение которого возрастает напряжение.
Чем больше нагрузка, тем больше потребуется времени, чтобы оно сравнялось с величиной напряжения и началось укорочение.
Если нагрузку повышать, то в конце концов мышечное волокно не сможет ее поднять, скорость и степень укорочения будут равны нулю и сокращение станет чисто изометрическим.
Слайд 64МЕТОДЫ ИССЛЕДОВАНИЯ ИЗОМЕТРИЧЕСКОГО И ИЗОТОНИЧЕСКОГО СОКРАЩЕНИЯ СКЕЛЕТНОЙ МЫШЦЫ
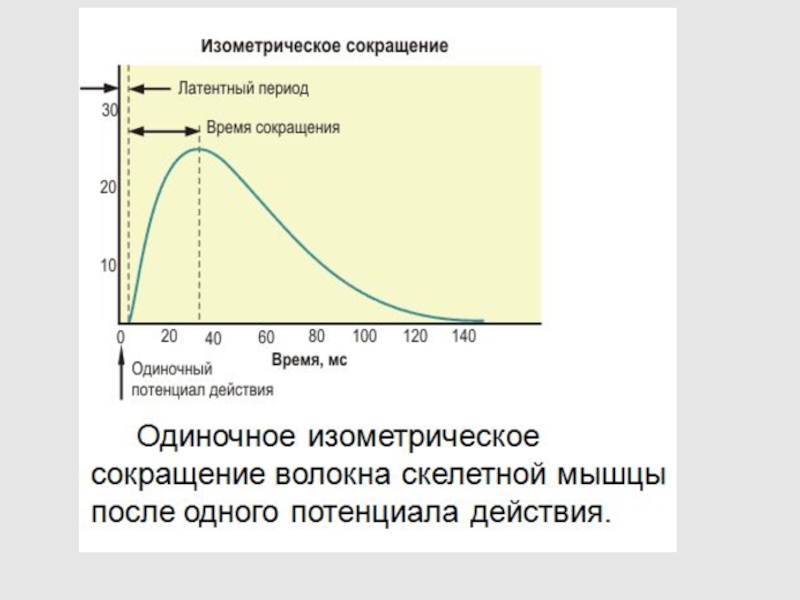
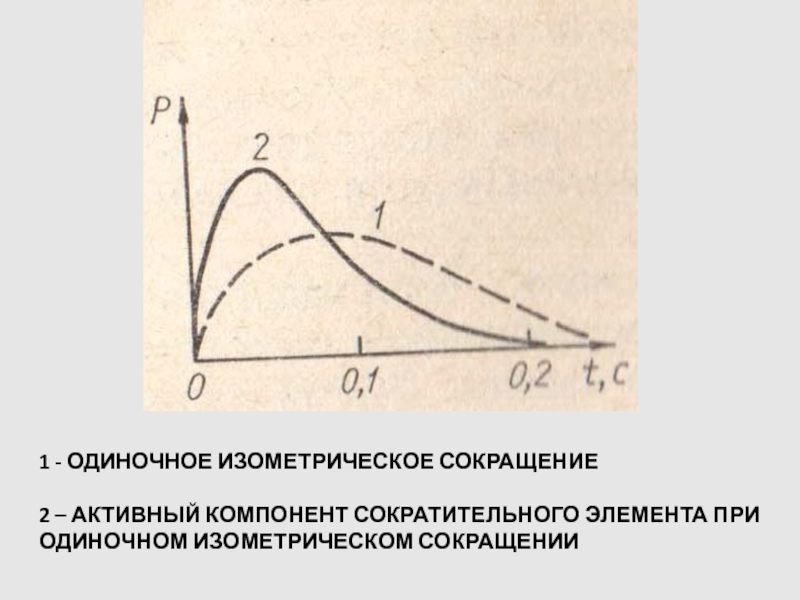
Слайд 651 - ОДИНОЧНОЕ ИЗОМЕТРИЧЕСКОЕ СОКРАЩЕНИЕ
2 – АКТИВНЫЙ КОМПОНЕНТ СОКРАТИТЕЛЬНОГО
ЭЛЕМЕНТА ПРИ ОДИНОЧНОМ ИЗОМЕТРИЧЕСКОМ СОКРАЩЕНИИ
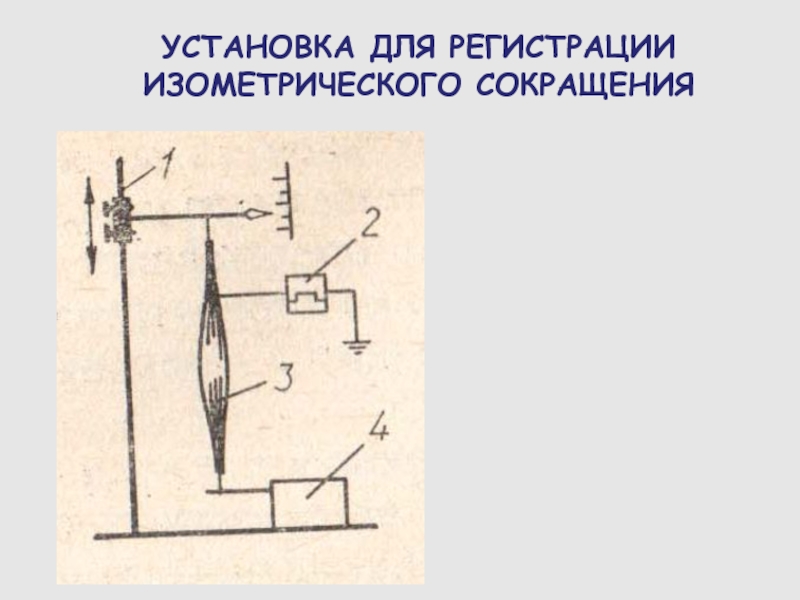
Слайд 66УСТАНОВКА ДЛЯ РЕГИСТРАЦИИ ИЗОМЕТРИЧЕСКОГО СОКРАЩЕНИЯ
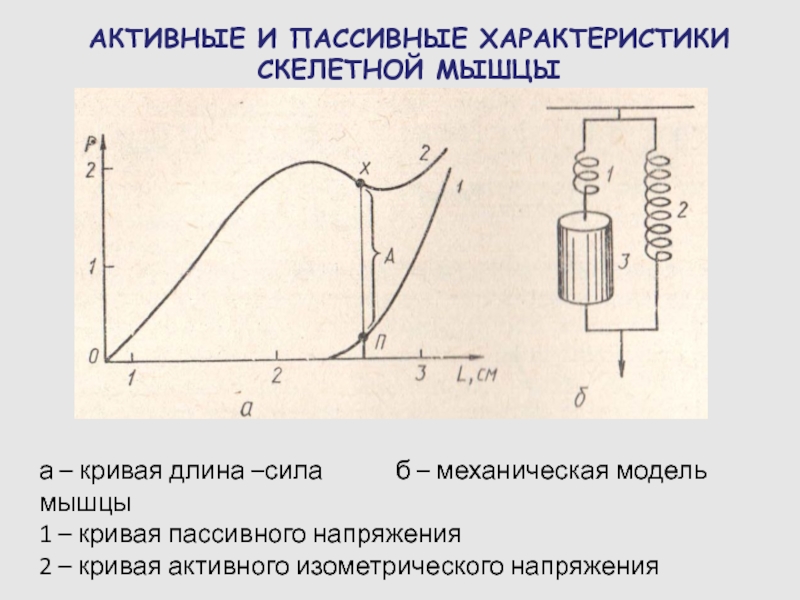
Слайд 67АКТИВНЫЕ И ПАССИВНЫЕ ХАРАКТЕРИСТИКИ СКЕЛЕТНОЙ МЫШЦЫ
а – кривая длина –сила
б – механическая модель мышцы
1
– кривая пассивного напряжения
2 – кривая активного изометрического напряжения
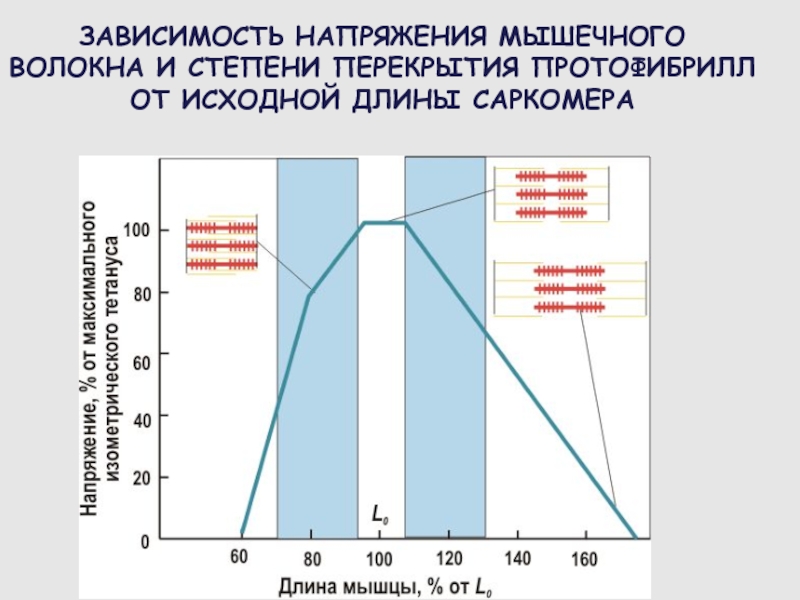
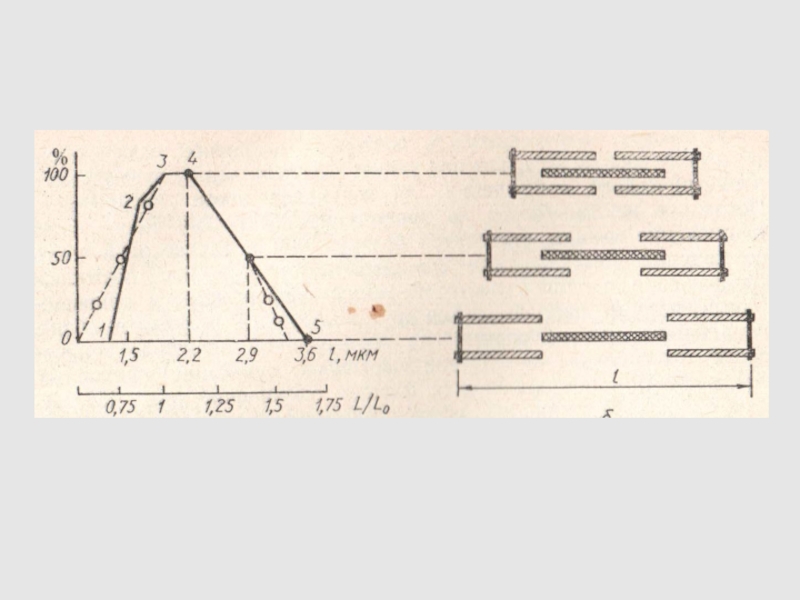
Слайд 68ЗАВИСИМОСТЬ НАПРЯЖЕНИЯ МЫШЕЧНОГО ВОЛОКНА И СТЕПЕНИ ПЕРЕКРЫТИЯ ПРОТОФИБРИЛЛ ОТ ИСХОДНОЙ
ДЛИНЫ САРКОМЕРА
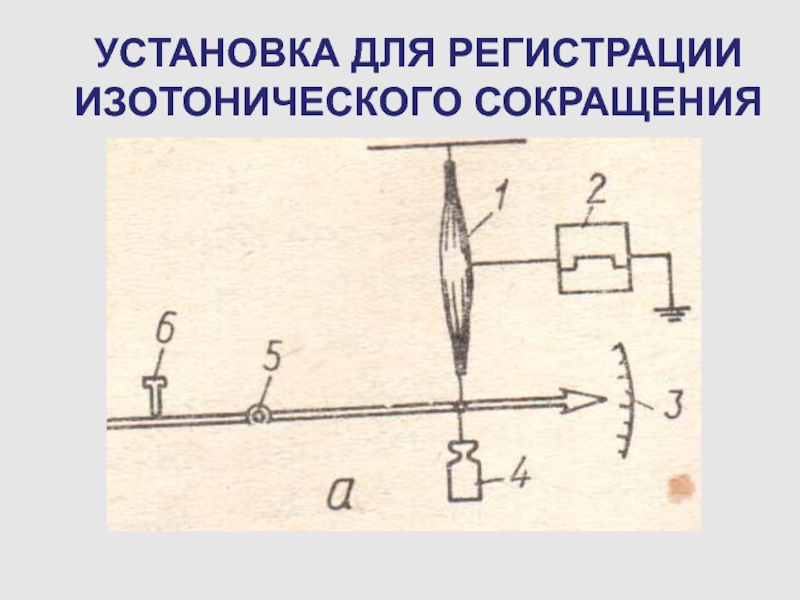
Слайд 70УСТАНОВКА ДЛЯ РЕГИСТРАЦИИ ИЗОТОНИЧЕСКОГО СОКРАЩЕНИЯ
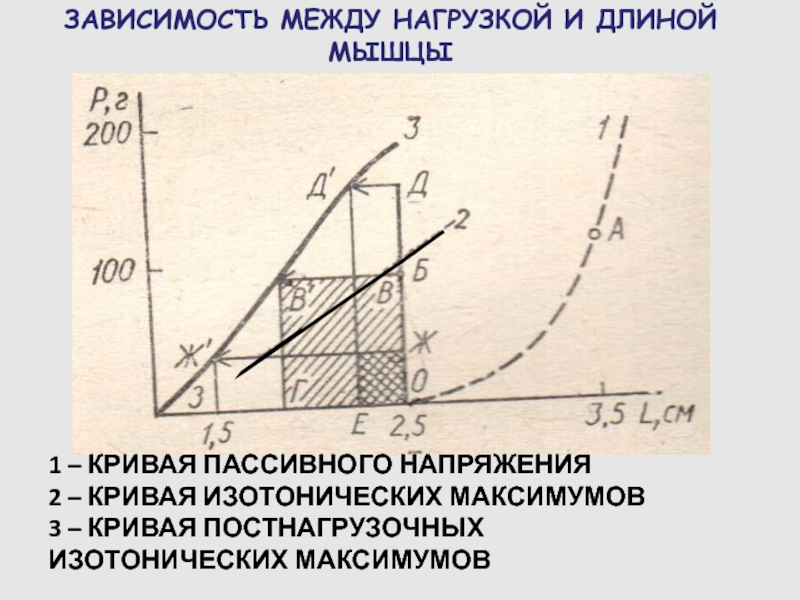
Слайд 71ЗАВИСИМОСТЬ МЕЖДУ НАГРУЗКОЙ И ДЛИНОЙ МЫШЦЫ
1 – КРИВАЯ ПАССИВНОГО НАПРЯЖЕНИЯ
2
– КРИВАЯ ИЗОТОНИЧЕСКИХ МАКСИМУМОВ
3 – КРИВАЯ ПОСТНАГРУЗОЧНЫХ ИЗОТОНИЧЕСКИХ МАКСИМУМОВ
Слайд 72Арчибалд Хилл (1886-1977) - английский физиолог. Лауреат Нобелевской премии 1922
года в области медицины и физиологии за труды в области
термодинамики мышечной деятельности.
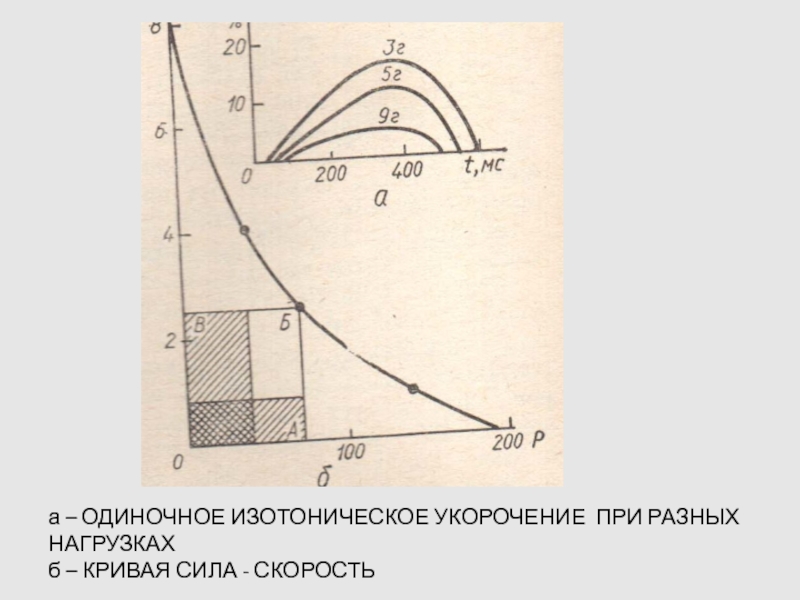
Слайд 73а – ОДИНОЧНОЕ ИЗОТОНИЧЕСКОЕ УКОРОЧЕНИЕ ПРИ РАЗНЫХ НАГРУЗКАХ
б – КРИВАЯ
СИЛА - СКОРОСТЬ
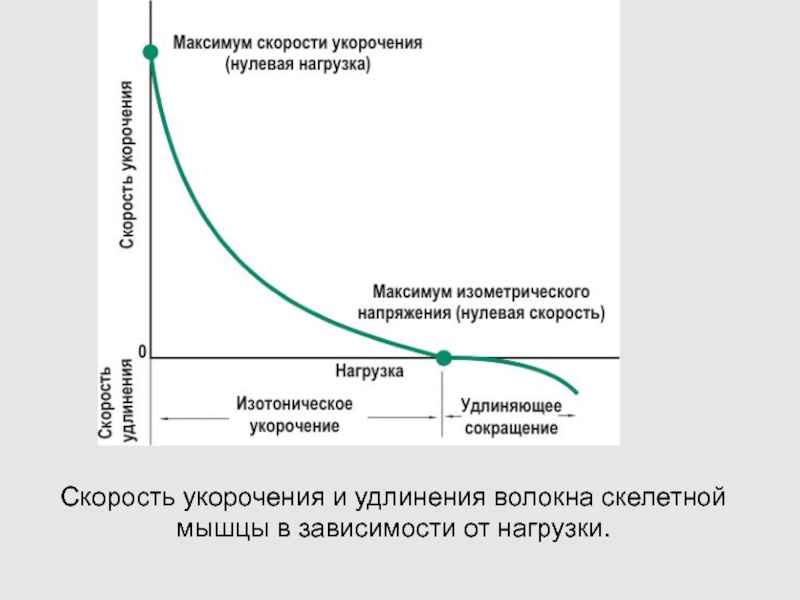
Слайд 74Скорость укорочения и удлинения волокна скелетной мышцы в зависимости от
нагрузки.
Слайд 75
УРАВНЕНИЕ ХИЛЛА
P – нагрузка
P0 – максимальная нагрузка
V – скорость сокращений
а,b
- эмпирические коэффициенты













![БИОФИЗИКА СОКРАТИТЕЛЬНЫХ ПРОЦЕССОВ РОЛЬ ИОНОВ КАЛЬЦИЯ В СОКРАЩЕНИИТРОПОМИОЗИН МЕНЯЕТ СВОЕ ПОЛОЖЕНИЕ В ЗАВИСИМОСТИ ОТ РОЛЬ ИОНОВ КАЛЬЦИЯ В СОКРАЩЕНИИТРОПОМИОЗИН МЕНЯЕТ СВОЕ ПОЛОЖЕНИЕ В ЗАВИСИМОСТИ ОТ КОНЦЕНТРАЦИИ ИОНОВ КАЛЬЦИЯ.НИЗКАЯ [Ca2+] – ТРОПОМИОЗИН](/img/thumbs/5b684a6dbd290023b276507bda2fd253-800x.jpg)