Слайд 2Ферменты
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов,
так же как неорганических катализаторов, заключается:
в активации молекул реагирующих веществ,
в
разбиении реакции на несколько стадий, энергетический барьер каждой из которых ниже такового общей реакции.
Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти в данных условиях.
Слайд 3Ферменты
Сходство ферментов и неорганических катализаторов заключается в следующем:
Катализируют только энергетически
возможные реакции.
Не изменяют направления реакции.
Ускоряют наступление равновесия реакции, но не
сдвигают его.
Не расходуются в процессе реакции.
Слайд 4Ферменты
Отличия ферментов от неорганических катализаторов позволяют им «работать» внутри живых
тел и делают их изучение очень важным направлением в химии:
Скорость
ферментативной реакции намного выше.
Высокая специфичность.
Мягкие условия работы (внутриклеточные).
Возможность регулирования скорости реакции.
Скорость ферментативной реакции пропорциональна количеству фермента.
Слайд 5Стадии ферментативного катализа
В ферментативной реакции можно выделить следующие этапы:
Присоединение субстрата (S)
к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
Преобразование фермент-субстратного комплекса
в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
Превращение переходного комплекса в комплекс фермент-продукт (E-P).
Отделение конечных продуктов от фермента.
Слайд 6Механизмы катализа
1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных
аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие
группы представляют собой мощные катализаторы многих органических реакций.
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Слайд 7Типы ферментативных реакций
В зависимости от последовательности взаимодействия между ферментом и
реактивами выделяют следующие типы ферментативных реакций:
Случайная реакция
Последовательная реакция
Тип «пинг-понг»
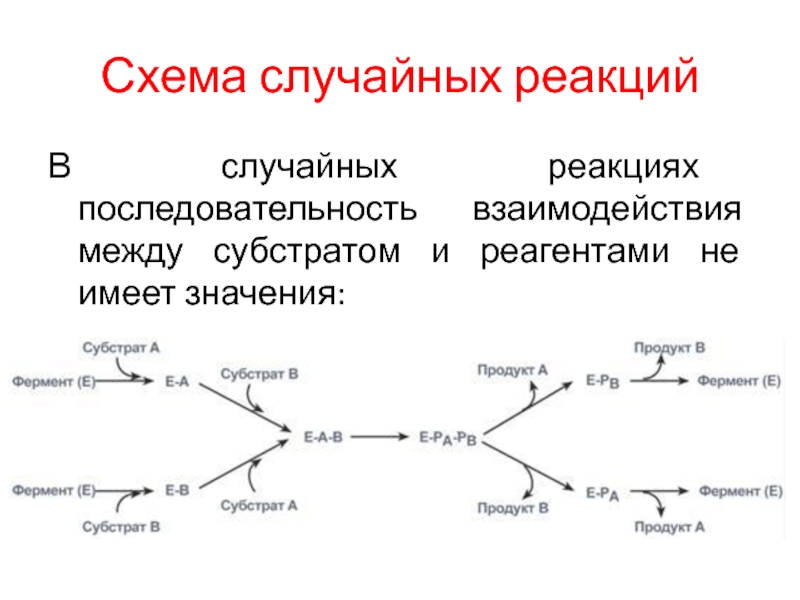
Слайд 8Схема случайных реакций
В случайных реакциях последовательность взаимодействия между субстратом и
реагентами не имеет значения:
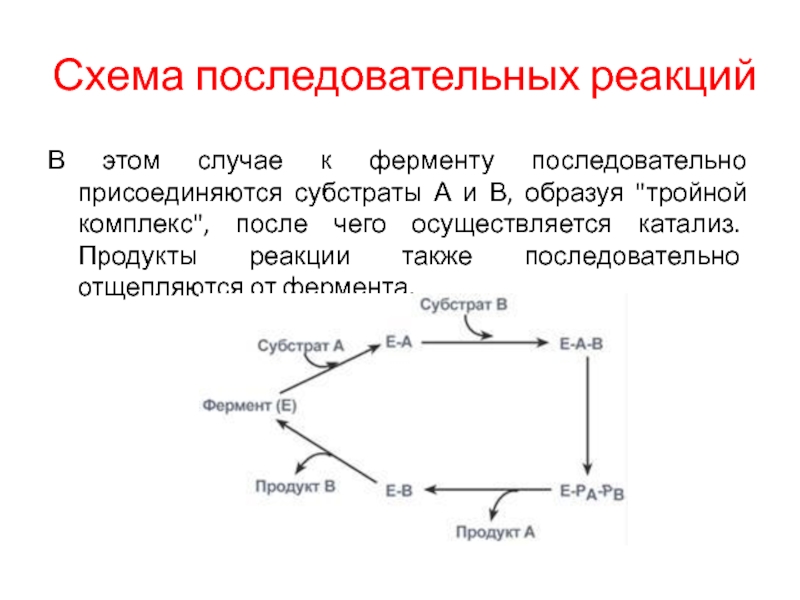
Слайд 9Схема последовательных реакций
В этом случае к ферменту последовательно присоединяются субстраты
А и В, образуя "тройной комплекс", после чего осуществляется катализ.
Продукты реакции также последовательно отщепляются от фермента.
Слайд 10Схема «пинг-понг»
В этом случае фермент сначала взаимодействует с субстратом А,
отбирая у него какие либо химические группы и превращая в
соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы.
Слайд 11Строение ферментов
Все ферменты являются белками, поэтому, они, как и остальные
белки по составу делятся на простые и сложные.
Простые ферменты состоят только
из аминокислот.
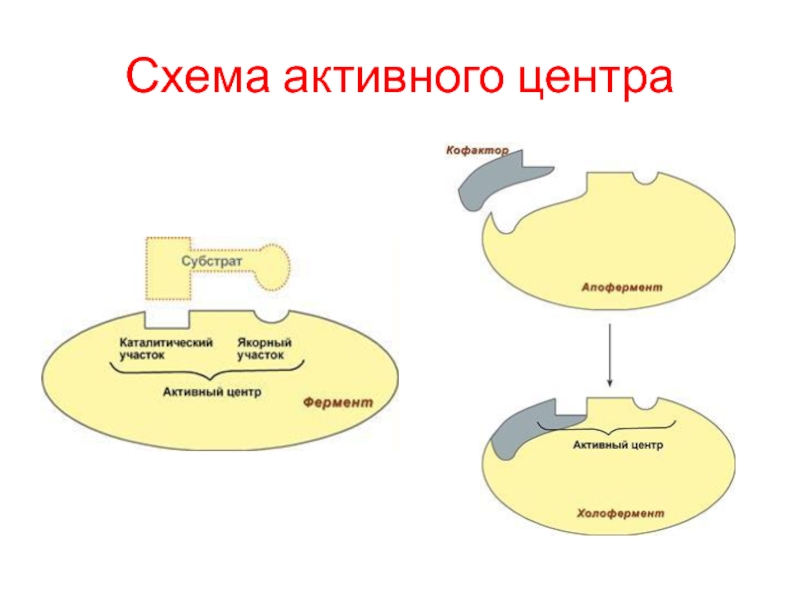
Сложные ферменты имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть - кофактор. Кофактор, в свою очередь, может называться коферментом или простетической группой.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Как многие белки, ферменты могут быть мономерами полимерами.
Слайд 12Строение ферментов
В составе фермента выделяют две области – активный центр
и аллостерический центр.
Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая
непосредственное связывание с молекулой субстрата и осуществляющая катализ. В активном центре выделяют два участка:
якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
каталитический – непосредственно отвечает за осуществление реакции.
Слайд 14Строение ферментов
Аллостерический центр – центр регуляции активности фермента, который пространственно отделен
от активного центра и имеется не у всех ферментов. Связывание
с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Слайд 15Строение ферментов
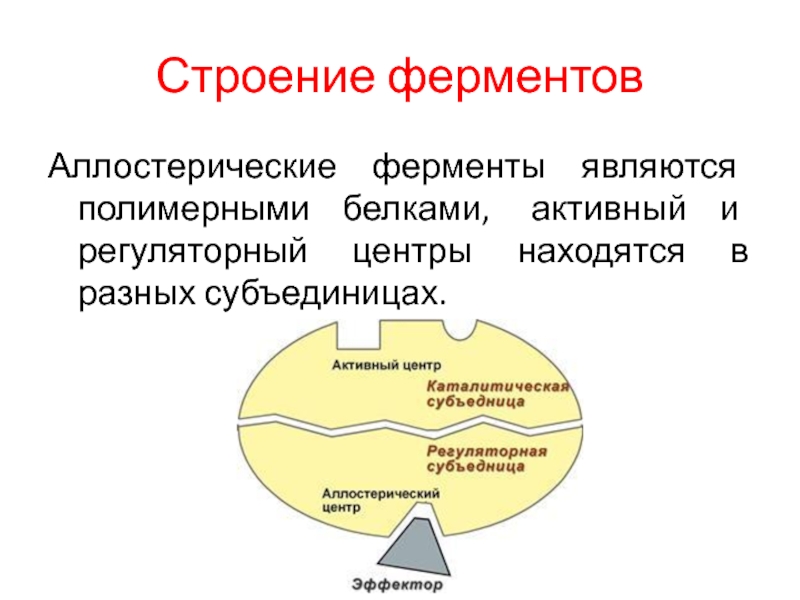
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры
находятся в разных субъединицах.
Слайд 16Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой
в единый комплекс и осуществляют ряд последовательных реакций, в которых
продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
Слайд 17Специфичность
Ферменты крайне избирательно запускают химические реакции, из всех возможных вариантов
направления фермент выбирает один нужный и катализирует реакцию только в
этом направлении – это и есть специфичность действия катализатора.
Фермент может проявлять специфичность в отношении:
Одного из стереоизомеров. Почти все ферменты человеческого организма реагируют только с L-аминокислотами. Это явление называется стереоспецифичностью.
Одного вещества. Это абсолютная специфичность. Фермент «работает» только с одним веществом.
Определенной группы веществ с общим строением. Это групповая специфичность.
Определенной группы веществ с каким-либо общим свойством. Это относительная групповая специфичность. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000
Слайд 18Механизм специфичности ферментов
В общем случае специфичность обусловлена взаимодействием определенных функциональных
групп субстрата и фермента. На данный момент существуют две теории,
объясняющие специфичность ферментов. Одна из них объясняет абсолютную специфичность, другая – групповую.
«Ключ-замок», она - же теория Фишера. Согласно этой теории конфигурация молекулы фермента соответствует только одному веществу. Они подходят друг к другу как ключ и замок. Другое вещество (другой ключ) не сможет взаимодействовать с субстратом. Эта теория легко объясняет абсолютную специфичность.
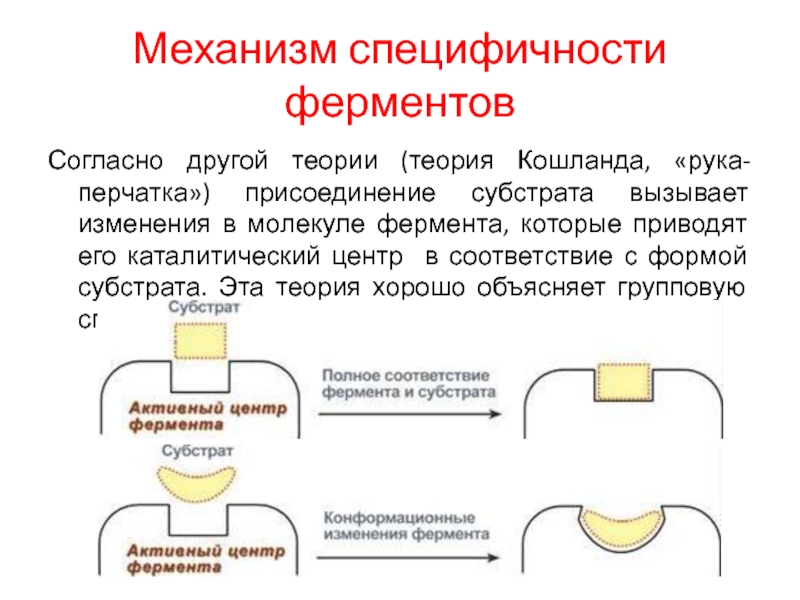
Слайд 19Механизм специфичности ферментов
Согласно другой теории (теория Кошланда, «рука-перчатка») присоединение субстрата
вызывает изменения в молекуле фермента, которые приводят его каталитический центр
в соответствие с формой субстрата. Эта теория хорошо объясняет групповую специфичность.
Слайд 20Регуляция активности фермента
В течении времени активность фермента внутри клетки непостоянна.
Ферменты реагируют на изменение внешних и внутренних условий клетки, что
необходимо для её нормального функционирования. Механизмов, которые регулируют активность фермента всего 7:
1 Доступность субстрата или кофермента
2 Компартментализация
3 Изменение количества фермента
4 Ограниченный протеолиз ферментов
5 Аллостерическая регуляция
6 Белок-белковое взаимодействие
7 Ковалентная модификация
Слайд 21Кинетические способы регуляции
По закону действующих масс скорость пропорциональна произведению концентраций.
Уменьшение концентраций приводит к уменьшению скорости реакции.
Субстрат, или кофермент может
подаваться к ферменту дозировано – это и есть ограничение их доступности.
Компартментализация – это явление, когда фермент, субстрат и кофермент концентрируются в определенных органеллах (компартментах) клетки.
При определенных условиях клетка может сокращать количество синтезируемого фермента, что сокращает его концентрацию.
Слайд 22Аллостерическая регуляция
Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы
содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными.
Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы.
В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции.
Слайд 23Белок-белковое взаимодействие
Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора
выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация
схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.
Слайд 24Ковалентная модификация
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной
группы, благодаря чему изменяется активность фермента. Чаще всего такой группой
является фосфорная кислота, реже метильные и ацетильные группы.
Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление –протеинфосфатазы.
Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии.
Слайд 25Ингибирование
В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов
с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных
веществ в организме.
В медицине разделяют общий химический термин «ингибитор»:
на вещества, которые способны уменьшать активность только одного фермента – это ингибиторы.
на вещества, которые уменьшают активность вообще всех ферментов – это инактиваторы.
Слайд 26Ингибирование
Можно выделить два основных направления ингибирования:
по прочности связывания фермента с
ингибитором ингибирование бывает обратимым (фермент можно восстановить) и необратимым (сводится к
необратимому изменению, или даже разрушению молекулы фермента).
по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное (когда ингибитор начинает конкурировать с субстратом за местно на активном центре фермента) и неконкурентное (ингибитор присоединяется не в активном центре фермента, а в другой его части).