Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фенолы
Содержание
- 1. Фенолы
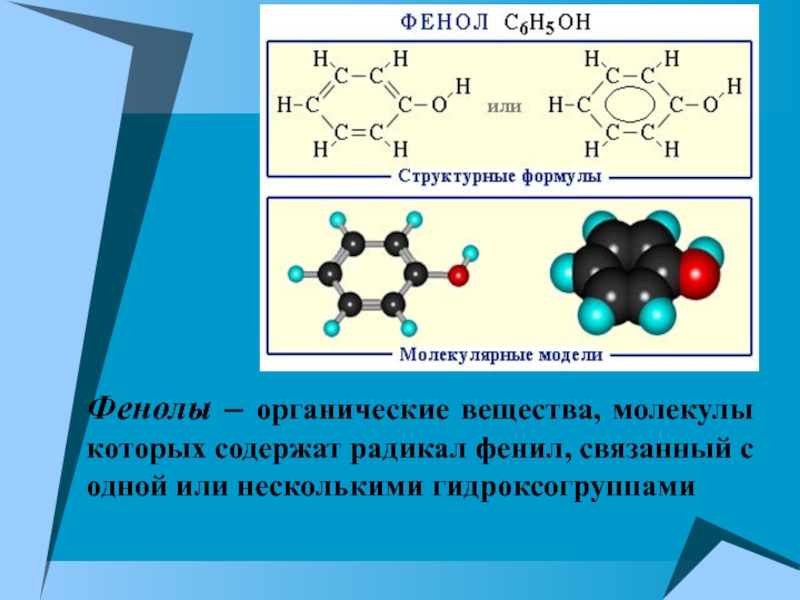
- 2. Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами
- 3. Фенолы классифицируют по атомности, т.е. по количеству
- 4. По количеству бензольных колец фенолы бывают моноядерные и многоядерные
- 5. НоменклатураПри составлении названия фенолов нумерация атомов углерода
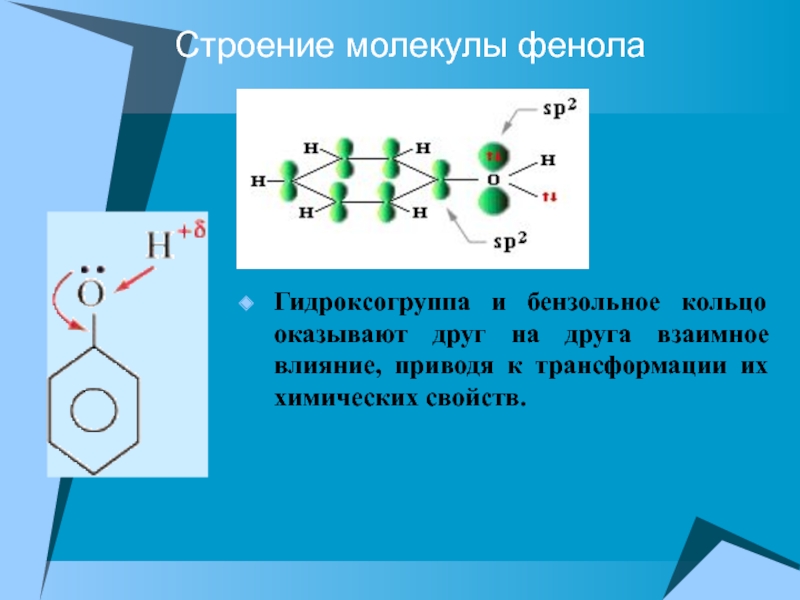
- 6. Строение молекулы фенолаГидроксогруппа и бензольное кольцо оказывают
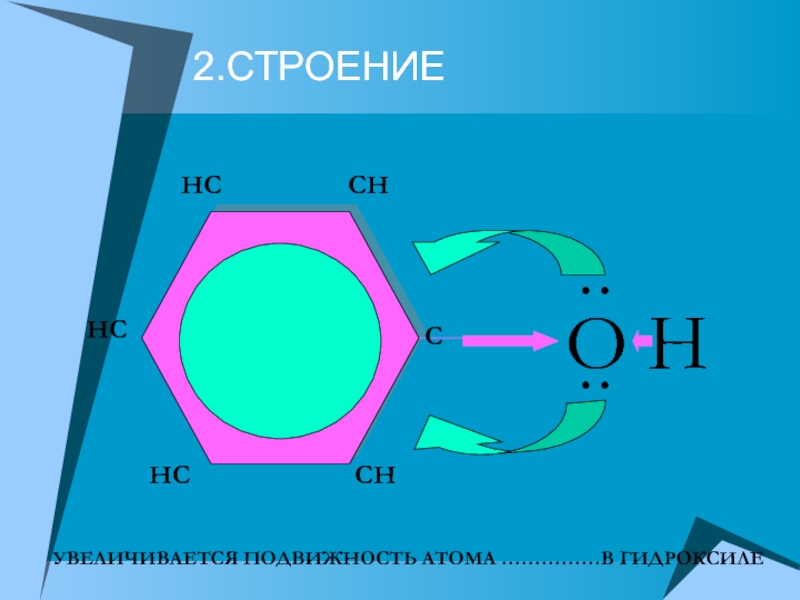
- 7. 2.СТРОЕНИЕO HHC CHHCHCCHCУВЕЛИЧИВАЕТСЯ ПОДВИЖНОСТЬ АТОМА ……………В ГИДРОКСИЛЕ
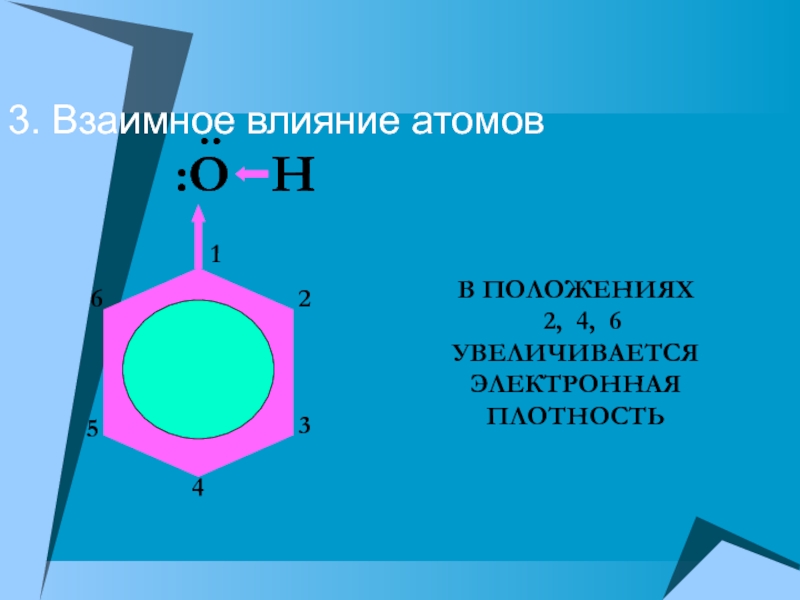
- 8. 3. Взаимное влияние атомов:O H123456..В ПОЛОЖЕНИЯХ 2, 4, 6 УВЕЛИЧИВАЕТСЯЭЛЕКТРОННАЯПЛОТНОСТЬ
- 9. Физические свойства фенолаФенол - твёрдое бесцветное кристаллическое
- 10. ФИЗИЧЕСКИЕ СВОЙСТВААгрегатное состояние –Цвет-3. Запах-4. Температура кипения-5.
- 11. Слайд 11
- 12. Химические свойства фенолаХимические свойства фенола обусловлены наличием в его молекулегидроксильной группыбензольного ядра
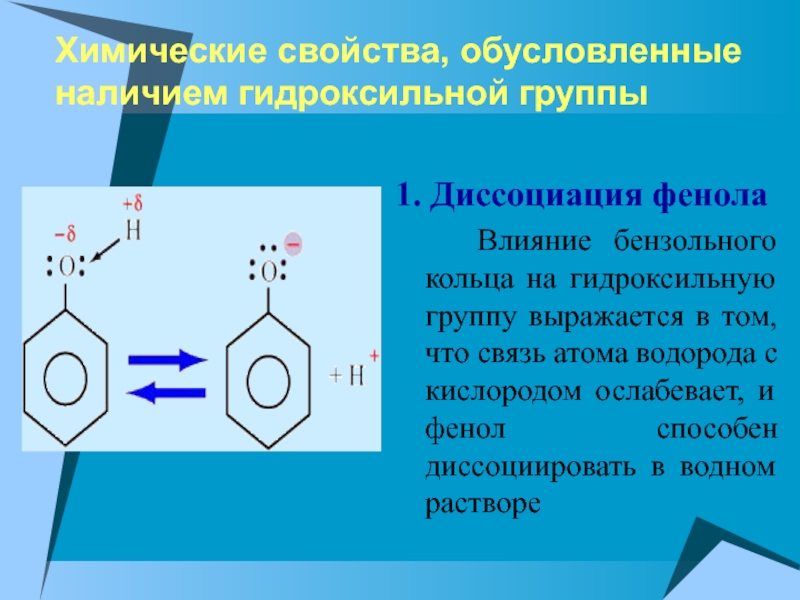
- 13. Химические свойства, обусловленные наличием гидроксильной группы1. Диссоциация
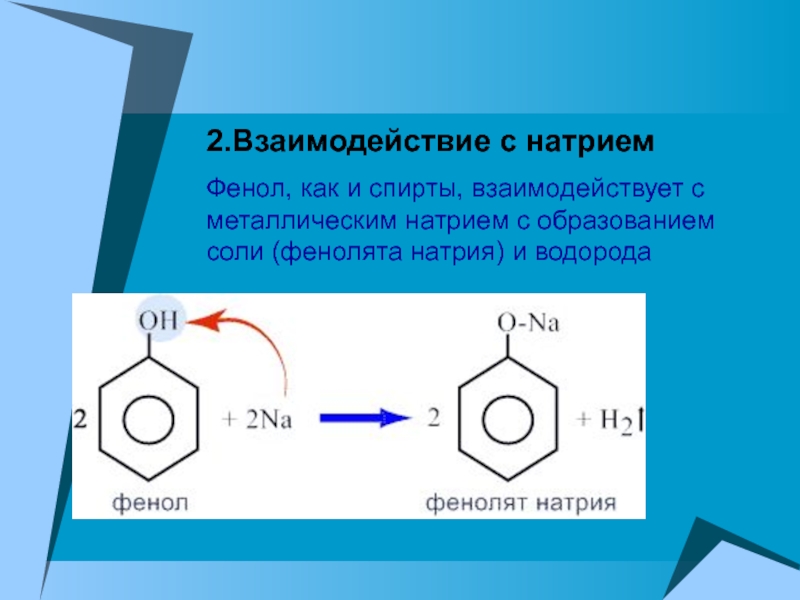
- 14. 2.Взаимодействие с натриемФенол, как и спирты, взаимодействует
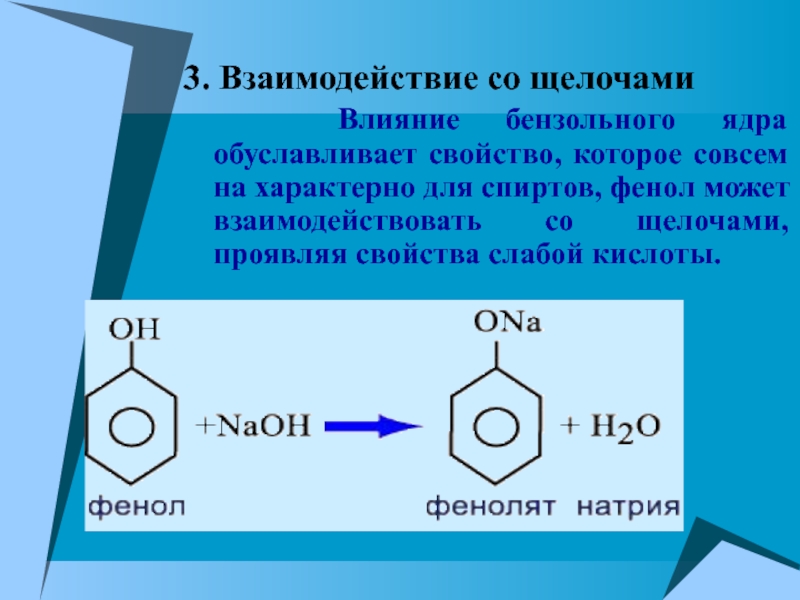
- 15. 3. Взаимодействие со щелочами Влияние
- 16. Слайд 16
- 17. Карболовая кислота в
- 18. Химические свойства, обусловленные наличием бензольного ядра
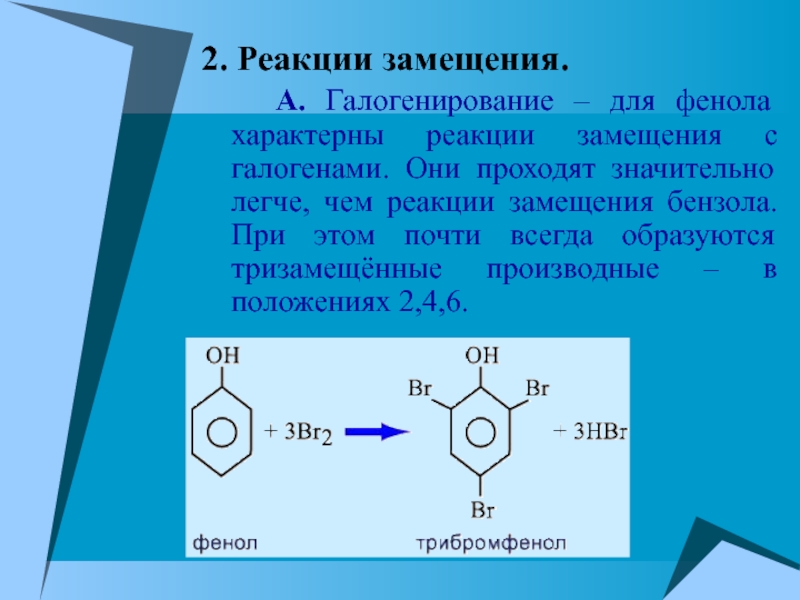
- 19. 2. Реакции замещения. А. Галогенирование –
- 20. Слайд 20
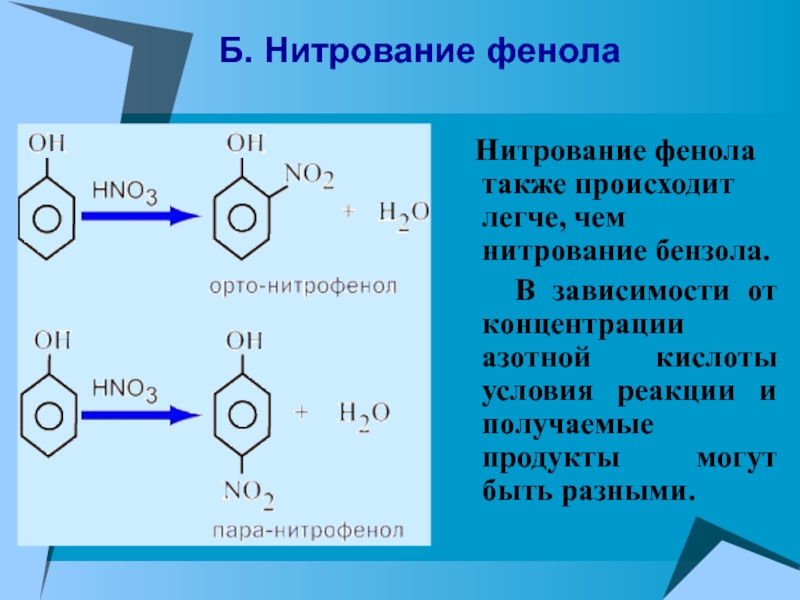
- 21. Б. Нитрование фенола Нитрование фенола
- 22. В результате полного нитрования фенола
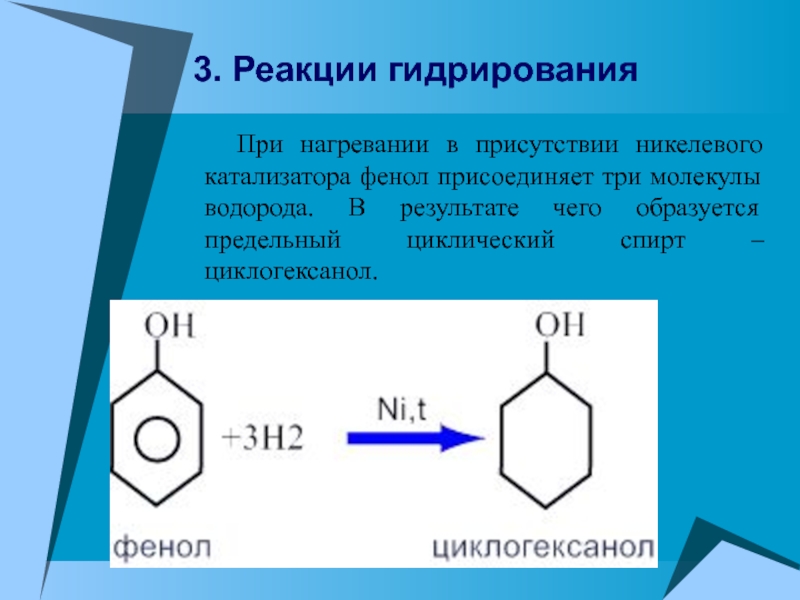
- 23. При нагревании в присутствии никелевого
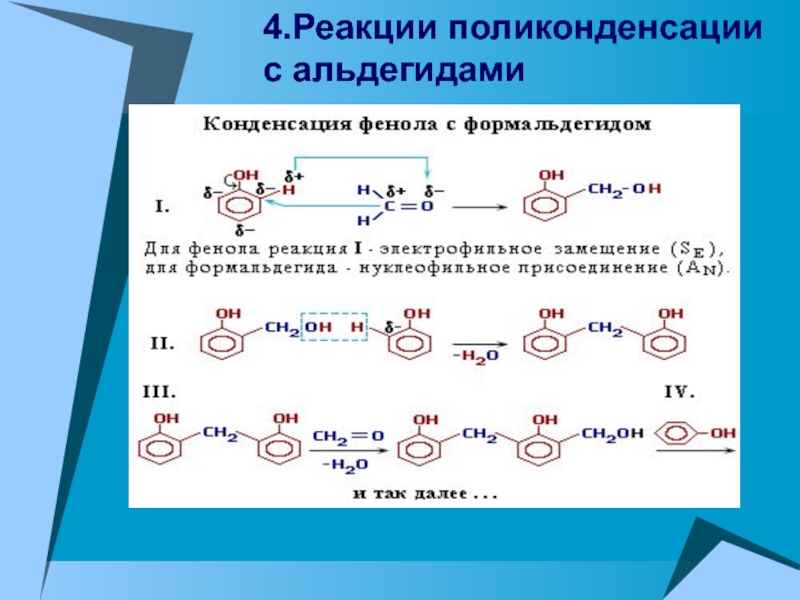
- 24. 4.Реакции поликонденсации с альдегидами
- 25. 5. Качественная реакция на фенол
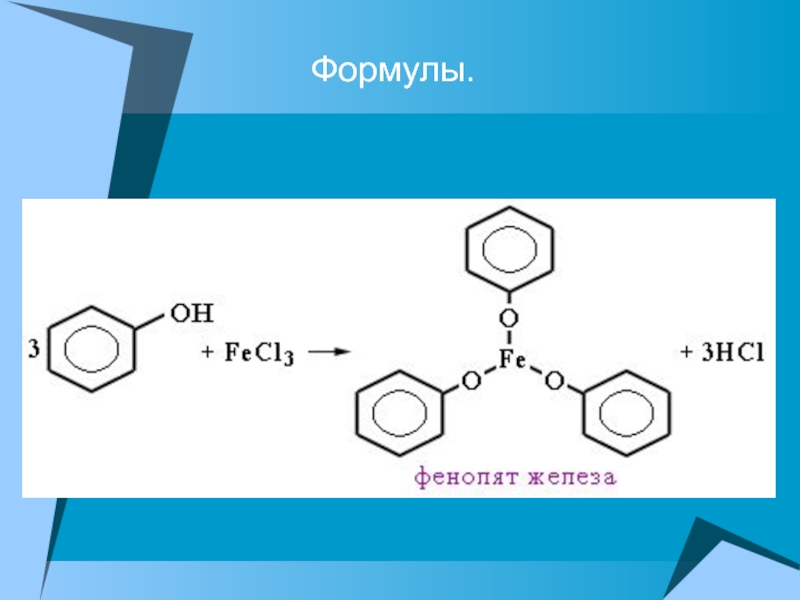
- 26. Формулы.
- 27. Получение фенола1. Фенол выделяют из каменноугольной смолы.
- 28. Применение фенола.Фенол применяют для производства фенолформальдегидных пластмасс,
- 29. 7. ПРИМЕНЕНИЕОН
- 30. Слайд 30
- 31. Сфера применения фенолов
- 32. Слайд 32
- 33. Скачать презентанцию
Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами
Слайды и текст этой презентации
Слайд 2Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный
с одной или несколькими гидроксогруппами
Слайд 3Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные
фенолы содержат в молекуле одну гидроксильную группу (фенол)
Двухатомные фенолы содержат
две гидроксильные группы (1,3-дигидроксибензол, мета-дигидроксибензол, резорцин)
Трёхатомные фенолы содержат три гидроксильные группы
Классификация фенолов
Слайд 5Номенклатура
При составлении названия фенолов нумерация атомов углерода в бензольном ядре
начинается с атома непосредственно связанного с гидроксильной группой .
Затем
называются заместители, начиная с простейшего, с указанием номера атома углерода, при котором они находятся.Слайд 6Строение молекулы фенола
Гидроксогруппа и бензольное кольцо оказывают друг на друга
взаимное влияние, приводя к трансформации их химических свойств.
Слайд 9Физические свойства фенола
Фенол - твёрдое бесцветное кристаллическое вещество. Вследствие частичного
окисления на воздухе он бывает окрашен в розовый цвет. Его
температура плавления +42ºС, температура кипения +181ºС. Фенол обладает резким характерным запахом. В холодной воде он мало растворим, но уже при 70 ºС растворяется в любых отношениях.Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с фенолом необходимо обращаться осторожно!
Слайд 10ФИЗИЧЕСКИЕ СВОЙСТВА
Агрегатное состояние –
Цвет-
3. Запах-
4. Температура кипения-
5. Температура плавления-
6. Растворимость
в воде-
7. Физиологическое воздействие-
т
Твердое в-во
БЦ, ок-сь на воздухе
– розовый
Резкий,
характерный182 С
42 С
М растворим в воде
Ядовит, сильный
антисептик
Слайд 12Химические свойства фенола
Химические свойства фенола обусловлены наличием в его молекуле
гидроксильной
группы
бензольного ядра
Слайд 13Химические свойства, обусловленные наличием гидроксильной группы
1. Диссоциация фенола
Влияние
бензольного кольца на гидроксильную группу выражается в том, что связь
атома водорода с кислородом ослабевает, и фенол способен диссоциировать в водном раствореСлайд 142.Взаимодействие с натрием
Фенол, как и спирты, взаимодействует с металлическим натрием
с образованием соли (фенолята натрия) и водорода
Слайд 153. Взаимодействие со щелочами
Влияние бензольного ядра обуславливает
свойство, которое совсем на характерно для спиртов, фенол может взаимодействовать
со щелочами, проявляя свойства слабой кислоты.Слайд 17 Карболовая кислота в 300 раз слабее
угольной. Фенол – кислота довольно слабая, более сильные кислоты вытесняют
фенол из фенолятов.Слайд 18Химические свойства, обусловленные наличием бензольного ядра
Отличия от
ароматических углеводородов:
1. Реакции окисления
Фенол окисляется кислородом воздуха, приобретая фиолетовую
окраску.Слайд 192. Реакции замещения.
А. Галогенирование – для фенола характерны
реакции замещения с галогенами. Они проходят значительно легче, чем реакции
замещения бензола. При этом почти всегда образуются тризамещённые производные – в положениях 2,4,6.Слайд 21Б. Нитрование фенола
Нитрование фенола также происходит легче, чем
нитрование бензола.
В зависимости от концентрации азотной кислоты условия
реакции и получаемые продукты могут быть разными.Слайд 22 В результате полного нитрования фенола образуется 2,4,6-тринитрофенол
(пикриновая кислота) –взрывчатое вещество.
В
XIX столетии её применяли в качестве жёлтого красителя до случая, когда в Париже (1871) одно текстильное предприятие в результате взрыва было снесено с поверхности земли.Слайд 23 При нагревании в присутствии никелевого катализатора фенол присоединяет
три молекулы водорода. В результате чего образуется предельный циклический спирт
– циклогексанол.3. Реакции гидрирования
Слайд 27Получение фенола
1. Фенол выделяют из каменноугольной смолы.
Однако
потребность в феноле настолько велика, что этого источника оказывается недостаточно.
2.
Синтез фенола из бензолаСлайд 28Применение фенола.
Фенол применяют для производства фенолформальдегидных пластмасс, синтетического волокна капролактам,
красителей, лекарств, взрывчатых веществ и других продуктов. Раствор фенола в
воде обладает дезинфицирующими свойствамиСлайд 30
Чем опасен фенол.
Практически
сразу после получения фенола ученые установили, что это химическое вещество обладает не только полезными свойствами, что позволяет его использовать в различных сферах науки и производства, но и является сильнодействующим ядом. Так, вдыхание паров фенола в течение непродолжительного времени может привести к раздражению носоглотки, ожогам дыхательных путей и последующему отеку легких с летальным исходом. При соприкосновении раствора фенола с кожей образуются химические ожоги, которые впоследствии трансформируются в язвы. Слайд 31 Сфера применения фенолов достаточно широка, но
большинство жителей нашей страны узнало о них из-за скандала,
разразившегося в конце 1990-х гг. вокруг печально известных «фенольных домов» – панельных многоэтажек серии П-49/П, построенных в конце 1970 – начале 1980-х гг. Эти дома в свое время считались экспериментальными. В бетон, использованный при их строительстве, добавляли фенолформальдегид. Это должно было ускорить его затвердевание и тем самым приблизить сроки сдачи домов. Новоселы, поначалу обрадовавшиеся просторным квартирам, вскоре поняли, что вместе с новым жильем они получили целый букет проблем со здоровьем – это и аллергия, и болезни глаз, почек, дыхательных путей, и даже злокачественные новообразования.Дело в том, что фенол и его производные без труда проникают в организм человека через кожу и желудочно-кишечный тракт, а пары фенола – через легкие. В организме фенол легко образует соединения с другими веществами, присутствующими в организме. Чем выше концентрация фенола в крови, тем сильнее его неблагоприятное влияние на здоровье человека.