Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иммунотерапия + клинический случай
Содержание
- 1. Иммунотерапия + клинический случай
- 2. Иммунная система человекаИммунная система человека включает в
- 3. Роль иммунной системы заключается в защите организма
- 4. Одна из линий защиты организма состоит из
- 5. Существует много различных типов лейкоцитов, каждый из
- 6. ИммуннотерапияИммунотерапия — это лечение, подразумевающее искусственное воздействие
- 7. Противоопухолевый иммунный ответЦикл противоопухолевого иммунного ответа состоит
- 8. Слайд 8
- 9. Опухолевые клетки используют различные механизмы уклонения от
- 10. Слайд 10
- 11. Слайд 11
- 12. Ингибирование CTLA-4
- 13. Слайд 13
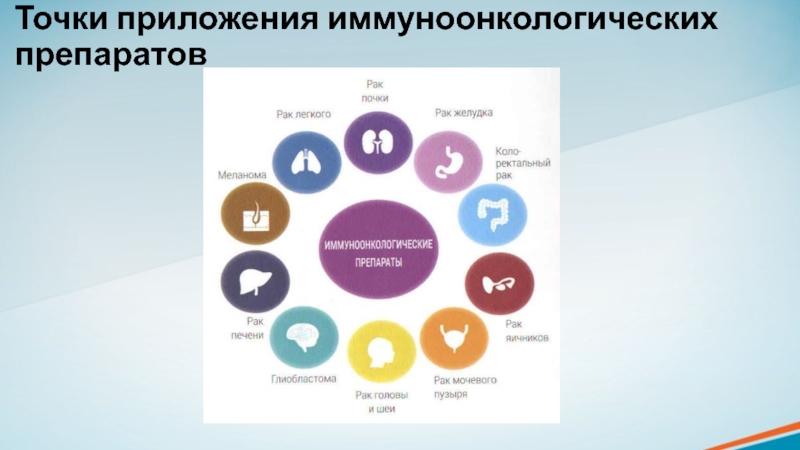
- 14. Точки приложения иммуноонкологических препаратов
- 15. Ингибиторы CTLA-4, PD-1, PD-L1 были одобрены для
- 16. Слайд 16
- 17. Слайд 17
- 18. Препараты, блокирующие контрольные точки иммунного ответа, потенциально
- 19. Наиболее часто при терапии анти-CTLA-4 поражается:кожа (сыпь,
- 20. КЛИНИЧЕСКИЙ СЛУЧАЙ Пациент Д., 21
- 21. c 09.2017 ДАКАРБАЗИН
- 22. МАРТ 2018 - ПРОГРЕССИРОВАНИЕ27.03.2018 множественные метастазы левой
- 23. ПЭТ-КТ – сентябрь 2018- выраженное уменьшение метастазов
- 24. МРТ сентябрь 2018- выраженное уменьшение метастазов
- 25. Проведено 22 курса иммунотерапии по схеме ниволумаб
- 26. Слайд 26
- 27. Клинический случай Пациент, 44 года
- 28. Клинический случай Пациент, 44 года
- 29. Клинический случай Пациент, 44 года КТ
- 30. Клинический случай Пациент, 44 года Назначен
- 31. Клинический случай Пациент, 44 года Лечение перенес
- 32. БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Иммунотерапия + клинический случай
Черепова Евгения Владимировна
Студентка 5 курса 13 группы
Сеченовский
Университет ИЗД
Слайд 2Иммунная система человека
Иммунная система человека включает в себя лимфатическую систему,
костный мозг, селезенку и вилочковую железу. Вместе они производят и
циркулируют специализированные иммунные клетки. Кожа, роговица глаза и мембраны, выстилающие дыхательные пути, ЖКТ, мочевые пути и репродуктивный тракт действуют как физические и химические барьеры против микроорганизмов, таких как бактерии и вирусы. Костный мозг и вилочковая железа являются первичными лимфоидными органами, в которых продуцируются и размножаются лейкоциты. Белые кровяные клетки представляют собой группу иммунных клеток, имеющих ключевое значение для иммунитета.Слайд 3Роль иммунной системы заключается в защите организма от чужеродных или
опасных захватчиков, включая микроорганизмы (бактерии, вирусы, грибы) и раковые клетки.
Чтобы сделать это избирательно, иммунная система должна уметь различать свои (нормальные клетки, принадлежащие человеку) и чужие (аномальные клетки или частицы, которые чужды человеку).Нормальный иммунный ответ включает в себя:
Распознавание потенциально вредных антигенов.
Они могут возникнуть вне тела, например, от вторгающихся бактерий, или изнутри тела, например нормальные клетки, которые мутировали и потенциально могли стать, или уже стали злокачественными.
2. Активация и мобилизация защиты клеток и антител.
Атака против захватчика или аномальной клетки.
Прекращение атаки после противодействия угрозе.
Слайд 4Одна из линий защиты организма состоит из лейкоцитов, которые проходят
через кровоток в ткани и органы, и атакуют аномальные клетки.
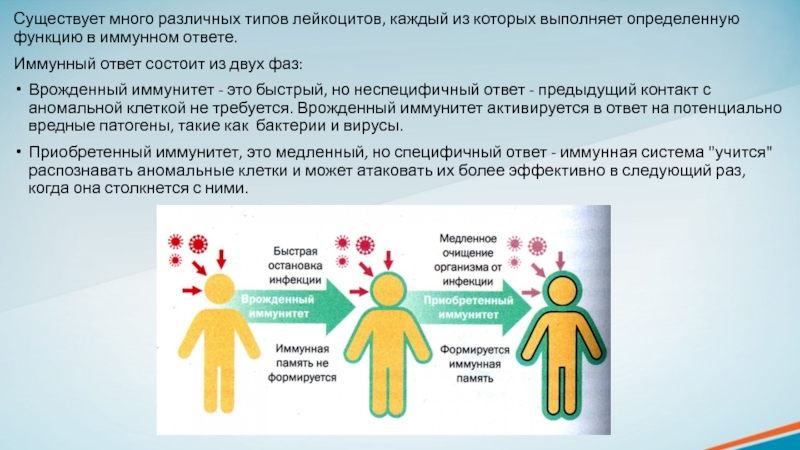
Существуют различные типы лейкоцитов, которые выполняют разные функции: от прямой атаки, до выделения специальных веществ, которые усиливают иммунный ответ других клеток.Слайд 5Существует много различных типов лейкоцитов, каждый из которых выполняет определенную
функцию в иммунном ответе.
Иммунный ответ состоит из двух фаз:
Врожденный
иммунитет - это быстрый, но неспецифичный ответ - предыдущий контакт с аномальной клеткой не требуется. Врожденный иммунитет активируется в ответ на потенциально вредные патогены, такие как бактерии и вирусы.Приобретенный иммунитет, это медленный, но специфичный ответ - иммунная система "учится" распознавать аномальные клетки и может атаковать их более эффективно в следующий раз, когда она столкнется с ними.
Слайд 6Иммуннотерапия
Иммунотерапия — это лечение, подразумевающее искусственное воздействие на иммунитет при
помощи лекарственных препаратов. Принципы метода заключаются в стимуляции защитных функций
или подавлении неспецифичных функций. При активизации естественной защиты организма применяют лекарственные средства, стимулирующие скрытые резервы для борьбы с болезнью.Действие лекарственных препаратов иммунотерапии заключается в естественном противораковом иммунном ответе организма на атаку, в то время как химиотерапия влияет непосредственно на рост и пролиферацию опухолевых клеток. Иммунные контрольные точки предназначены для отключения иммунного ответа и предотвращения повреждения здоровых клеток. Но опухолевые клетки перенимают этот механизм и деактивируют Т-клетки. Ингибиторы контрольных точек и ингибиторы пути предотвращают эту дезактивацию и увеличивают противоопухолевый иммунный ответ организма.
Слайд 7Противоопухолевый иммунный ответ
Цикл противоопухолевого иммунного ответа состоит из нескольких этапов:
Высвобождение антигенов опухоли. Наличие опухолевых антигенов является пусковым механизмом для
запуска противоопухолевого иммунного ответа. Презентация антигенов опухоли. Антигены, выделяемые опухолью, не активируют Т-лимфоциты напрямую, а захватываются антигенпрезентирующими клетками, например, дендритными клетками, макрофагами, В-лимфоцитами. Антигенпрезентирующие клетки поглощают и перерабатывают антигены (процессинг). После процессинга, антигенпрезентирующие клетки представляют фрагменты антигенов на своей поверхности с помощью главного комплекса гистосовместимости.
Активация Т-лимфоцитов. Для активации Т-лимфоцитов необходимо 2 сигнала:
Т-клеточный рецептор взаимодействует с опухолевым антигеном (с участием главного комплекса гистосовместимости)
Костимулирующий рецептор CD28 на Т-лимфоците, связывается с CD80 и CD86, на антигенпрезентирующей клетке.
Затем происходит пролиферация активированных T-лимфоцитов.
4. Миграция Т-лимфоцитов к опухоли.
5. Инфильтрация Т-лимфоцитами опухоли.
6. Распознавание опухолевых клеток. Происходит благодаря связыванию Т-клеточного рецептора с распознанным опухолевым антигеном на главном комплексе гистосовместимости.
7. Уничтожение опухолевых клеток. Т-лимфоцит уничтожает опухолевую клетку, что приводит к выбросу опухолевых антигенов и цикл противоопухолевого иммунного ответа повторяется.
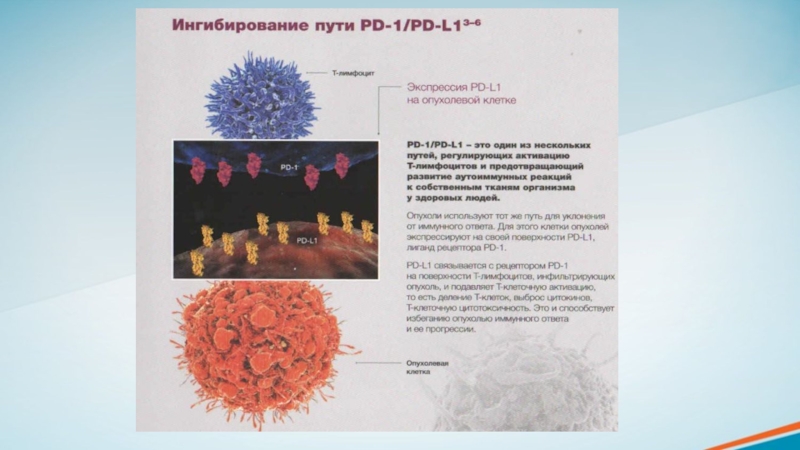
Слайд 9Опухолевые клетки используют различные механизмы уклонения от иммунного ответа. Один
из них иммунные контрольные точки.
Иммунные контрольные точки являются рецепторами на
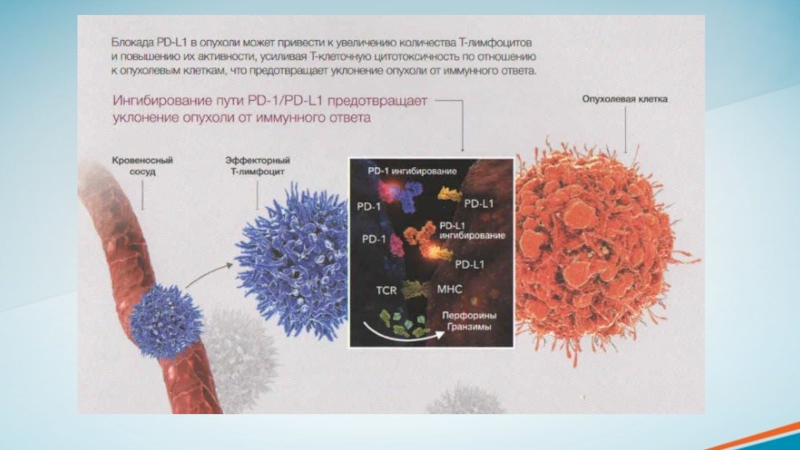
поверхности Т-лимфоцитов и других иммунокомпетентных клеток. Данные рецепторы связываются с соответствующими лигандами, которые располагаются на опухолевых и других клетках и подавляют Т-клеточный иммунный ответ. PD-1 (рецептор запрограммированной клеточной гибели 1) и СТLA-4 (ассоциированный с цитотоксическими Т-лимфоцитами антиген 4) — наиболее изученные иммунные контрольные точки, которые экспрессируются преимущественно Т-лимфоцитами.
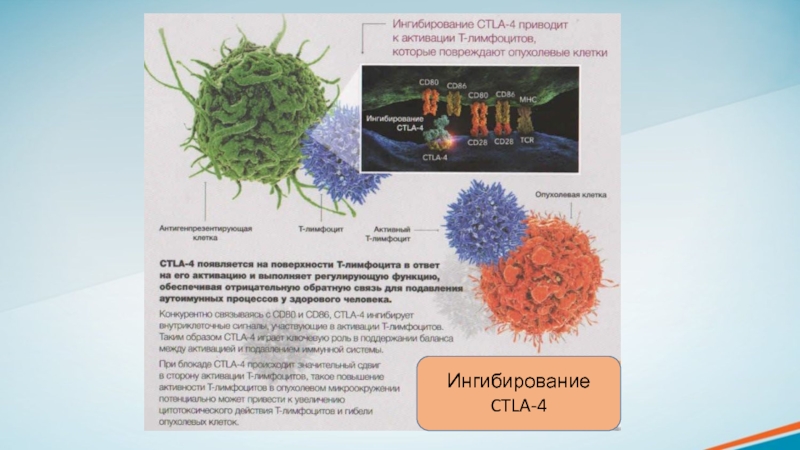
CTLA-4 блокирует активацию Т-лимфоцитов на 3 этапе противоопухолевого иммунного ответа.
Активация пути передачи сигналов от рецептора PD-1 происходит на завершающих этапах цикла, после инфильтрации Т-лимфоцитами опухоли. Данные сигналы приводят к инактивации Т-лимфоцитов.
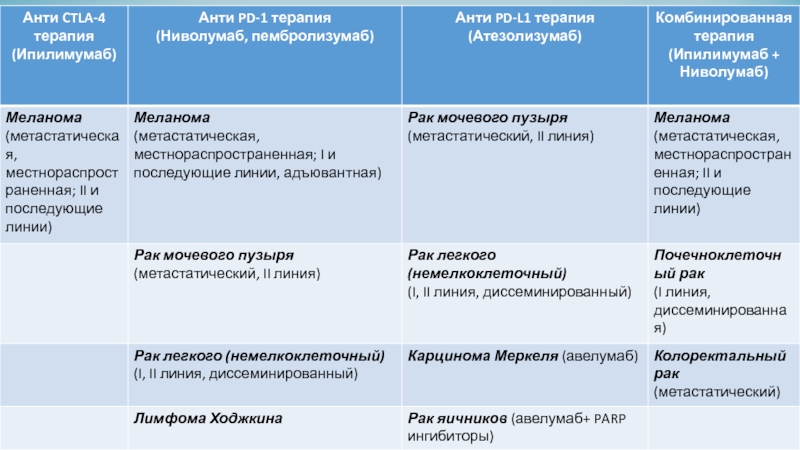
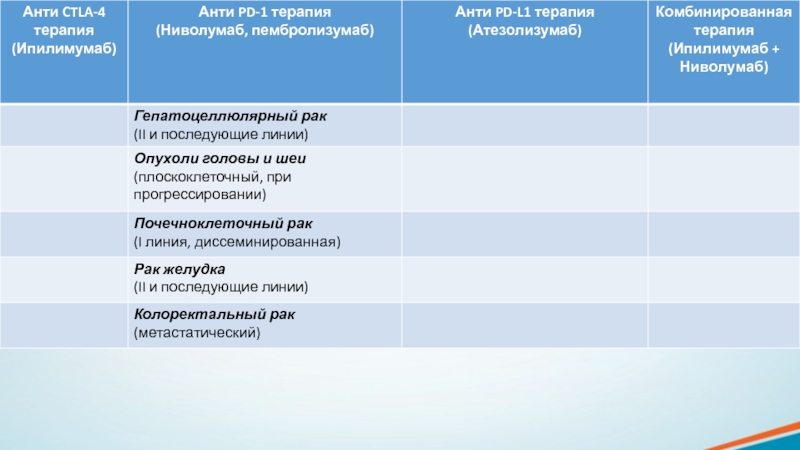
Слайд 15Ингибиторы CTLA-4, PD-1, PD-L1 были одобрены для клинического применения при
различных типах рака, они постоянно тестируются в клинических испытаниях и
показывают отличные результаты. Все имеющиеся на сегодняшний день ингибиторы представляют собой моноклональные антитела – специализированные целевые белки, каждый из которых связывается с определенной молекулой. Все они вводятся путём внутривенных инфузий. В основном, они назначаются в виде одного препарата, но иногда их можно сочетать с химиотерапией или друг с другом.Слайд 18Препараты, блокирующие контрольные точки иммунного ответа, потенциально могут вызвать иммуноопосредованные
нежелательные явления с поражением любых органов и систем.
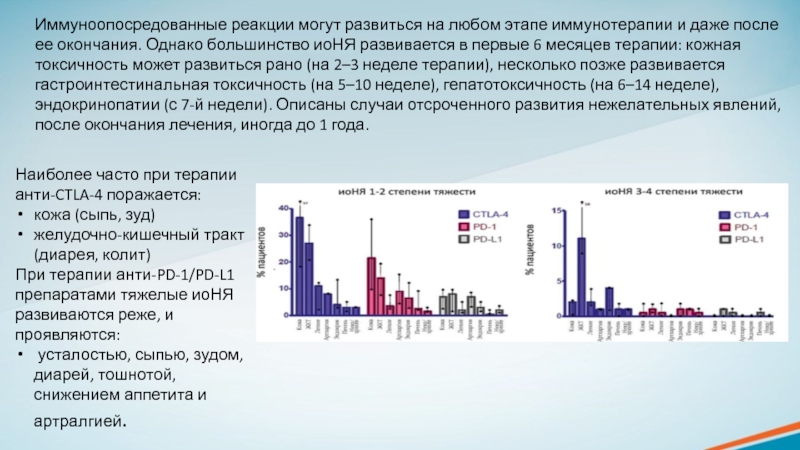
Слайд 19Наиболее часто при терапии анти-CTLA-4 поражается:
кожа (сыпь, зуд)
желудочно-кишечный тракт (диарея,
колит)
При терапии анти-PD-1/PD-L1 препаратами тяжелые иоНЯ развиваются реже, и проявляются:
усталостью, сыпью, зудом, диарей, тошнотой, снижением аппетита и артралгией.Иммуноопосредованные реакции могут развиться на любом этапе иммунотерапии и даже после ее окончания. Однако большинство иоНЯ развивается в первые 6 месяцев терапии: кожная токсичность может развиться рано (на 2–3 неделе терапии), несколько позже развивается гастроинтестинальная токсичность (на 5–10 неделе), гепатотоксичность (на 6–14 неделе), эндокринопатии (с 7-й недели). Описаны случаи отсроченного развития нежелательных явлений, после окончания лечения, иногда до 1 года.
Слайд 20 КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациент Д., 21 год.
Диагноз: Меланома кожи
pT2aN2aM0 стадия III A
Анамнез заболевания:
Узловое образование кожи спины выявлено в
июле 2017 года.15.08.2017 - иссечение опухоли и регионарных лимфатических узлов.
Гистология (Молдова)-пигментная меланома. Мутация в гене BRAF- не выявлено.
Пересмотр гистопрепаратов и иммуногистохимия в ЛРЦ – узловая пигментная эпителиойдноклеточная меланома кожи, толщина опухоли по Бреслоу 1,78 мкм, без изъязвления, метастаз меланомы pT2aN2a.
Выполнено молекулярно-генетическое исследование в ЛРЦ: не выявлена мутация в гене BRAF, KIT (пересмотр в КГБ 62)
Слайд 21
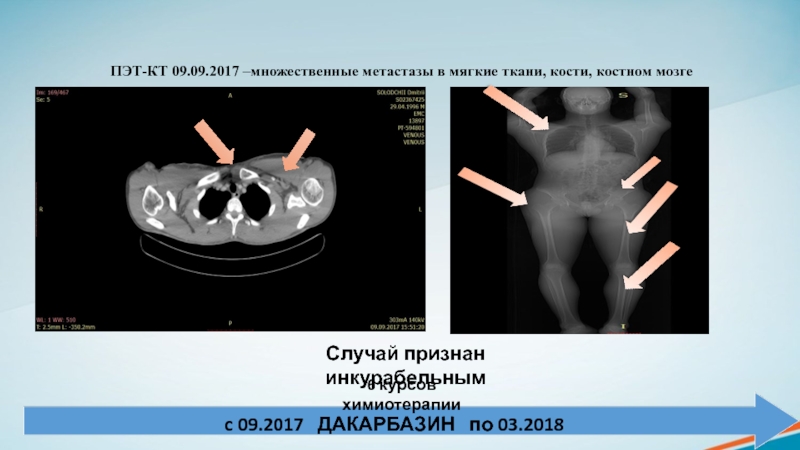
c 09.2017 ДАКАРБАЗИН по 03.2018
ПЭТ-КТ 09.09.2017 –множественные метастазы
в мягкие ткани, кости, костном мозге
Случай признан инкурабельным
6 курсов
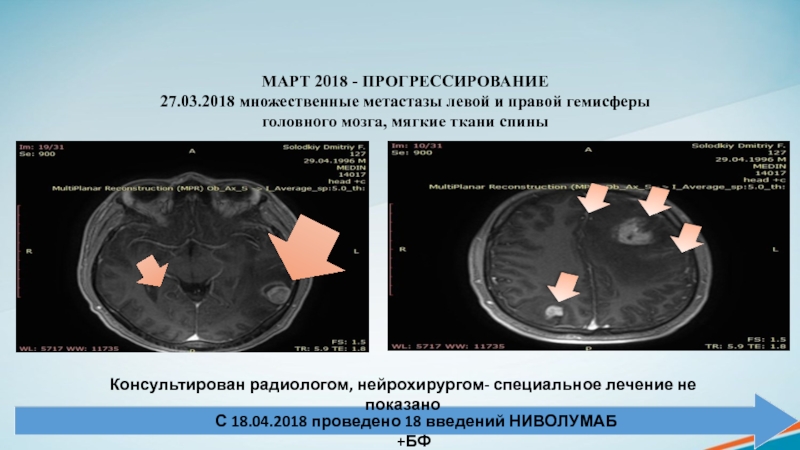
химиотерапии Слайд 22МАРТ 2018 - ПРОГРЕССИРОВАНИЕ
27.03.2018 множественные метастазы левой и правой гемисферы
головного мозга, мягкие ткани спины
С 18.04.2018 проведено 18 введений НИВОЛУМАБ
+БФКонсультирован радиологом, нейрохирургом- специальное лечение не показано
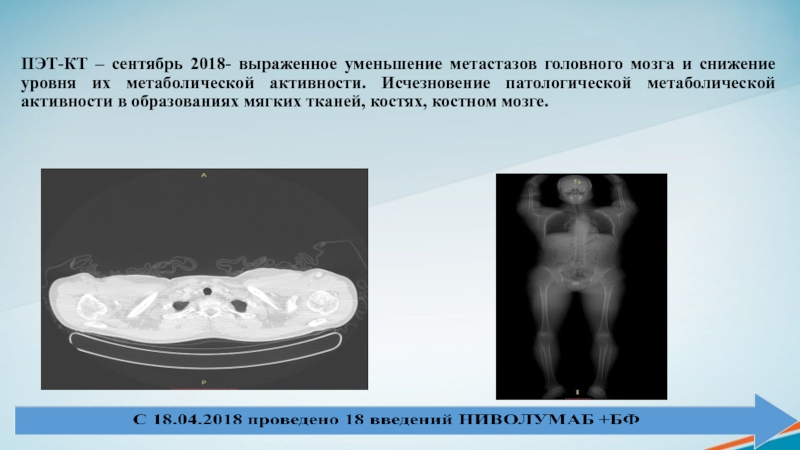
Слайд 23ПЭТ-КТ – сентябрь 2018- выраженное уменьшение метастазов головного мозга и
снижение уровня их метаболической активности. Исчезновение патологической метаболической активности в
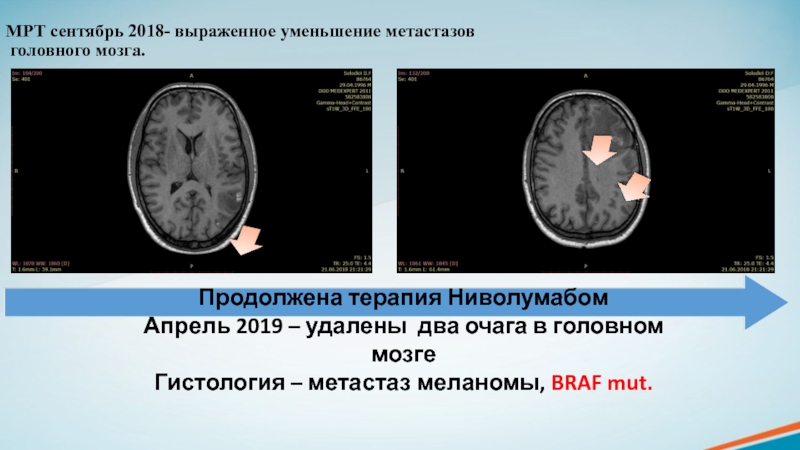
образованиях мягких тканей, костях, костном мозге.Слайд 24МРТ сентябрь 2018- выраженное уменьшение метастазов
головного мозга.
Продолжена терапия
Ниволумабом
Апрель 2019 – удалены два очага в головном мозге
Гистология
– метастаз меланомы, BRAF mut.Слайд 25Проведено 22 курса иммунотерапии по схеме ниволумаб
КТ
в июле 2019г – метастазы печени, селезенки, грудины, грудных и
поясничных позвонков, правой подвздошной костиМРТ ГМ – образования без динамики, отек правой лобной области
2 курса вемурафениб
Сентябрь 2019г – прогрессирование: рост метастазов в головном мозге, новые очаги
Проведен 1 курс химиотерапии по схеме: Темозоломид
03.10.19г – удаление метастаза головного мозга
Прогрессирование: продолженный рост метастазов гм, кровоизлияние из метастаза в левую гемисферу мозжечка, медикаментозный синдром Кушинга, тромбоцитопения 3 ст.
Симптоматическая терапия
Слайд 28Клинический случай
Пациент, 44 года
Диагноз:
рак ротоглотки T3N2bM0; IVА ст.
Гистология: плоскоклеточный неороговевающий рак
Назначено:
3 курса неоадъювантной ПХТ по схеме TPF (Доцетаксел + цисплатин + 5‑фторурацил)Курс лучевой терапии по радикальной программе на ротоглотку СОД 70Гр на фоне еженедельного введения карбоплатина 150мг
Полный регресс опухоли. Динамическое наблюдение
Данные ПЭТ/КТ: очаги в мягких тканях носоглотки слева SUV5,25, размерами около 2,2х1,2 см
Гистология: низкодифференцированный плоскоклеточный рак носоглоточного типа
Диагноз: Рак носоглотки T1N0M0; I ст.
Назначено: цисплатин 180 мг + курс лучевой терапии по радикальной программе на область носоглотки СОД 66ГР.
Полный регресс опухоли. Динамическое наблюдение.
02/2016
04/2017
Слайд 29Клинический случай
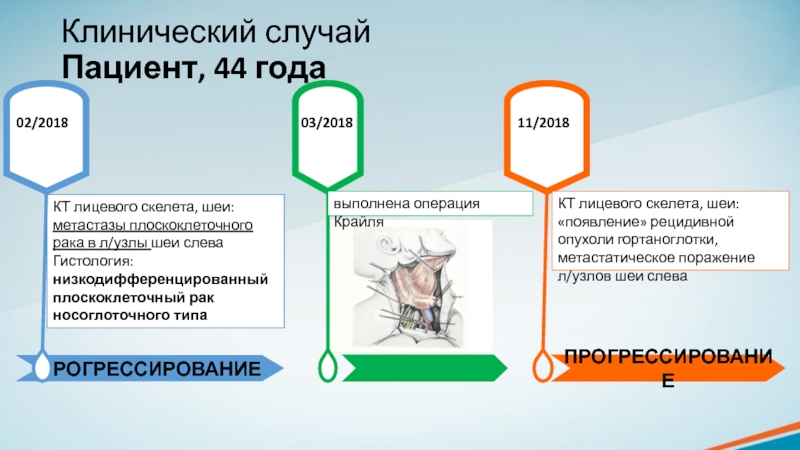
Пациент, 44 года
КТ лицевого скелета, шеи:
метастазы плоскоклеточного рака
в л/узлы шеи слева
Гистология: низкодифференцированный плоскоклеточный рак носоглоточного типа
02/2018
выполнена операция
Крайля11/2018
КТ лицевого скелета, шеи:
«появление» рецидивной опухоли гортаноглотки, метастатическое поражение л/узлов шеи слева
Слайд 30Клинический случай
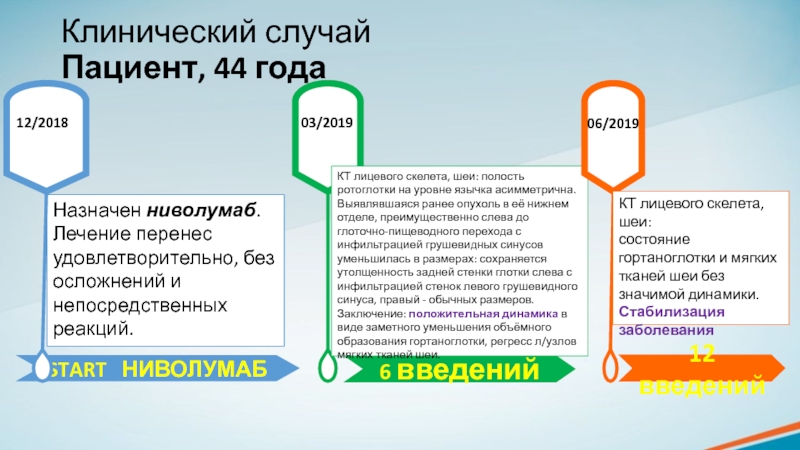
Пациент, 44 года
Назначен ниволумаб.
Лечение перенес удовлетворительно, без осложнений
и непосредственных реакций.
12/2018
03/2019
КТ лицевого скелета, шеи: полость ротоглотки на уровне
язычка асимметрична. Выявлявшаяся ранее опухоль в её нижнем отделе, преимущественно слева до глоточно-пищеводного перехода с инфильтрацией грушевидных синусов уменьшилась в размерах: сохраняется утолщенность задней стенки глотки слева с инфильтрацией стенок левого грушевидного синуса, правый - обычных размеров. Заключение: положительная динамика в виде заметного уменьшения объёмного образования гортаноглотки, регресс л/узлов мягких тканей шеи.06/2019
КТ лицевого скелета, шеи:
состояние гортаноглотки и мягких тканей шеи без значимой динамики. Стабилизация заболевания
Слайд 31Клинический случай
Пациент, 44 года
Лечение перенес удовлетворительно, без осложнений и непосредственных
реакций
КТ лицевого скелета, шеи:
! после 18 введений !
По сравнению с
11.03.19г. и 11.06.19г. – полный регресс опухоли гортаноглотки.09/2019
Продолжение иммунотерапии…