Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ионная связь
Содержание
- 1. Ионная связь
- 2. Проверим упр.4 к §8 Атом кремния содержит в
- 3. Вопрос на засыпку:Какую особенность в строении имеют
- 4. Какие разные элементы!Все остальные элементыИмеют завершенные уровни,не
- 5. Атомы элементов - металловЕсли мало электронов на
- 6. Атомы элементов - неметалловЕсли внешний уровень близок
- 7. Итак…Атомы металлов имеют тенденцию к отдаче электронов
- 8. В периодах: Металлические свойства ослабевают, а неметаллические
- 9. СамыйСильный Неметалл!В группах (главных подгруппах):Металлические свойства усиливаются,а
- 10. Если встретились металл с неметаллом: Na0 –
- 11. Ионная химическая связь это связь, образующаяся между положительно и отрицательно заряженными ионами.
- 12. Алгоритм составления схемы образования ионной связи.Разберите алгоритм
- 13. Подведем итоги:1. Какие группы элементов мы выделили
- 14. Задание №1:Сравните металлические свойства элементов, поставив вместо
- 15. Проверьте себя:Сравните металлические свойства элементов, поставив вместо
- 16. Задание №2:Расположите элементы в порядке уменьшения их
- 17. Проверьте себя:Расположите элементы в порядке уменьшения их
- 18. Поставьте себе оценку:Общее количество баллов за 2
- 19. Поставьте на карточках “+”, если вы с этим утверждением согласны: РЕФЛЕКСИЯ:
- 20. Домашнее задание:§10, составьте схемы образования ионной связи
- 21. Комплект уроков«ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ»к учебнику О.С.Габриеляна для 8 классаразработан учителем химииМАОУ Лицей№33«Физико-математический»г.Ростова-на-ДонуЛоренц Ириной Григорьевной
- 22. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Проверим упр.4 к §8
Атом кремния содержит в ядре 14 протонов
и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и
число протонов, равно поряд-ковому номеру элемента. Число энергети-ческих уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.Схема строения атома кремния: Si +14 )2)8)4
Слайд 3Вопрос на засыпку:
Какую особенность в строении имеют атомы инертных газов
(He, Ne, Ar)?
Атомы этих элементов практически не образуют соединений с
другими атомами. С чем это может быть связано? Слайд 4Какие разные элементы!
Все остальные элементы
Имеют завершенные уровни,
не взаимодействуют с
другими
атомами
Имеют незавершенные уровни, взаимодействуют с другими атомами, чтобы завершить
свои энергетические
уровниКто это?
А это кто?
Слайд 5
Атомы элементов - металлов
Если мало электронов на внешнем уровне –
атом стремится их отдать
Na +11 )2)8)1
Na+ +11 )2)8 атом натрия
ион натрия
Атомы элементов – металлов в ПС учебника обозначены
черным, а также зеленым цветом
Слайд 6
Атомы элементов - неметаллов
Если внешний уровень близок к завершению
(т.е.
содержит 7, 6, или 5 электронов), атом стремится принять недостающие
до 8 электроныCl +17 )2)8)7 Сl- +17 )2)8)8
атом хлора
ион хлора
Атомы элементов – неметаллов в ПС обозначены красным цветом
Слайд 7Итак…
Атомы металлов имеют тенденцию к отдаче электронов с внешнего уровня
Атомы
неметаллов имеют тенденцию к принятию недостающих до завершения внешнего уровня
электронов.
Слайд 8В периодах:
Металлические свойства ослабевают,
а неметаллические усиливаются, так как:
А)
увеличиваются заряды атомных ядер;
Б) увеличивается число электронов на внешнем уровне;
В)
число энергетических уровней постоянно;Г) радиус атома уменьшается;
Д) способность к отдаче электронов ослабевает, а способность к принятию недостающих электронов возрастает.
Na Mg Al Si P S Cl
Слайд 9
Самый
Сильный
Неметалл!
В группах (главных подгруппах):
Металлические свойства усиливаются,
а неметаллические ослабевают, так
как:
А) увеличиваются заряды атомных ядер;
Б) число электронов на внешнем уровне
постоянно;В) увеличивается число энергетических уровней;
Г) увеличивается радиус атома;
Д) способность к отдаче электронов возрастает, а способность к принятию недостающих электронов ослабевает.
Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
Самый
Сильный
Металл!
щелочные
металлы
г
алогены
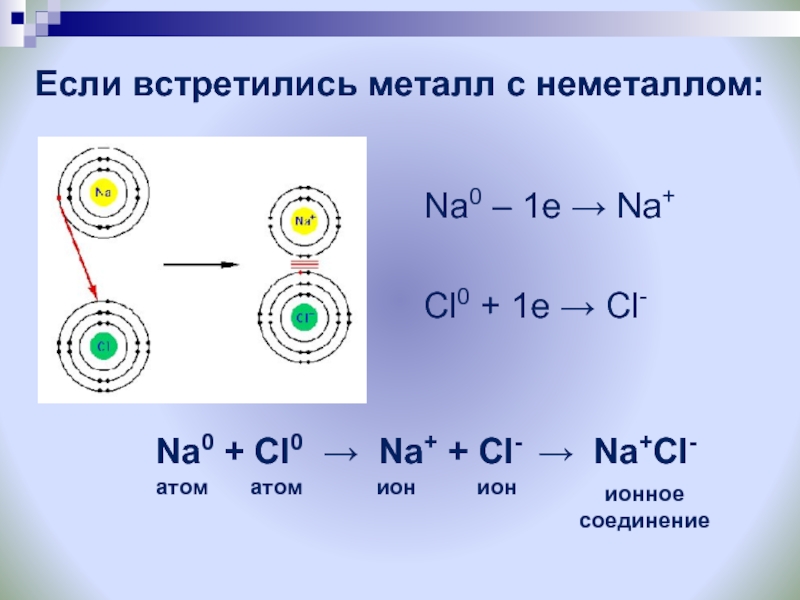
Слайд 10Если встретились металл с неметаллом:
Na0 – 1e → Na+
Cl0 + 1e → Cl-
Na0 + Cl0 → Na+ +
Cl- → Na+Cl-атом
атом
ион
ион
ионное
соединение
Слайд 11Ионная химическая связь
это связь, образующаяся между
положительно и
отрицательно
заряженными ионами.
Слайд 12Алгоритм составления схемы образования ионной связи.
Разберите алгоритм составления ионной связи
на стр.57 §9 учебника.
Пользуясь алгоритмом, составьте схемы образования ионной связи
при взаимодействии: а) калия и кислорода; б) лития и хлора; в) магния и фтора.Слайд 13Подведем итоги:
1. Какие группы элементов мы выделили с точки зрения
строения внешнего уровня их атомов?
2. Каким образом атомы металлов завершают
свои уровни? А атомы неметаллов?3. Как называются частицы, в которые превращаются атомы элементов, принимая или отдавая электроны?
4. Что такое ионная химическая связь,
в каком случае она образуется?
Слайд 14Задание №1:
Сравните металлические свойства элементов, поставив вместо ☺ знак «
или «>»:
Na ☺ K; Al ☺ Mg; Rb ☺ Sr;
Na ☺ Cs; K ☺ AlСравните неметаллические свойства элементов, поставив вместо ☺ знак «<» или «>»:
S ☺ O; F ☺ P; Si ☺ C; P ☺ S; N ☺ O
Слайд 15Проверьте себя:
Сравните металлические свойства элементов, поставив вместо ☺ знак «
или «>»:
Na < K; Al < Mg; Rb > Sr;
Na > Cs; K > AlСравните неметаллические свойства элементов, поставив вместо ☺ знак «<» или «>»:
S < O; F > P; Si < C; P < S; N < O
Каждый правильно поставленный знак – 1 балл
(всего 10 баллов!)
Слайд 16Задание №2:
Расположите элементы в порядке уменьшения их металлических свойств:
а) Al,
Na, K, B, Bа, Mg
б) Na, Rb, Mg, Ca, Cs,
AlРасположите элементы в порядке уменьшения их неметаллических свойств:
а) C, S, Si, O, P, Cl, F
б) Si, N, P, Cl, Br, As, S
Слайд 17Проверьте себя:
Расположите элементы в порядке уменьшения их металлических свойств:
а) K
> Bа > Nа > Mg > Al > B
б) Cs > Rb > Ca > Na > Mg > Al
Расположите элементы в порядке уменьшения их неметаллических свойств:
а) F > O > Cl > S > C > P > Si
б) N > Cl > Br > S > P > As > Si
2 балла за каждую полностью правильно
составленную последовательность (всего 8 баллов)
Слайд 18Поставьте себе оценку:
Общее количество баллов за 2 задания – 18;
Подсчитайте
набранное вами общее количество баллов за 2 задания.
Поставьте «5» за
15 - 18 баллов;Поставьте «4» за 11 - 14 баллов.