Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 4. Матричные биосинтезы
Содержание
- 1. Лекция 4. Матричные биосинтезы
- 2. История исследований в молекулярной биологииАпрель 1953 г.
- 3. Джеймс Уотсон (р. 1928) Френсис Крик (1916-2004)1952
- 4. "...выдающийся харизматический символ нашего времени - спиральная
- 5. Актуальность темы лекции: открытия молекулярной биологии играют
- 6. Генная и клеточная терапия – «небеса», к
- 7. Клеточная терапияТерапия с использованием стволовых клетокС помощью
- 8. Цель лекцииЗнать: строение и функции нуклеиновых кислотхимико-биологическую
- 9. План лекции1. Строение и функции ДНК и
- 10. Строение нуклеиновых кислотФункция: хранение, передача, реализация наследственной
- 11. Пентозы в структуре нуклеиновых кислот
- 12. Первичная структура НК: последовательность нуклеотидовХимические связи:1 -
- 13. Вторичная структура ДНК: двойная спиральПравозакрученная спираль
- 14. Третичная структура ДНК: нуклеопротеидные комплексы (хромосомы)Гистоновые белки:
- 15. Структура нуклеосом
- 16. Пространственная структура РНКОдноцепочечнаяШпильки – спирализованные участки (водородные
- 17. тРНКСтруктура тРНК:1 – шпильки2 - петлимолекулы-адапторы: переводят
- 18. рРНК структурный компонент рибосом80% от общего количества
- 19. РЕПЛИКАЦИЯ: синтез ДНКПротекает в ядре в S-фазу
- 20. 1 этап репликации: инициацияФормирование репликативной вилки:ДНК-топоизомераза расщепляет
- 21. Схема инициации репликации
- 22. 2 этап репликации: элонгацияСинтез новых цепей ДНКЛидирующая
- 23. 3 этап репликации: терминацияИсключение праймеровЗавершение формирования отстающей
- 24. Схема репликативной вилки
- 25. Репарация ошибок и повреждений ДНКПричина повреждений ДНК:действие
- 26. Схема работы системы репарации ДНК
- 27. Роль системы репарацииРепарация необходима для сохранения генома
- 28. ТРАНСКРИПЦИЯ: синтез РНКПротекает в ядре вне зависимости
- 29. 1 этап транскрипции: инициацияПромотор – последовательность ДНК
- 30. 2 этап транскрипции: элонгация и терминацияЭлонгация: рост
- 31. Схема транскрипции
- 32. Посттранскрипционные модификации пре-РНК «Созревание» пре-мРНК«Кэпирование»
- 33. Схема «созревания» пре-мРНК
- 34. «Созревание» пре-тРНКУдаление интроновМодификация азотистых оснований (10-15%)
- 35. «Созревание» пре-рРНК
- 36. ТРАНСЛЯЦИЯ: синтез белкаМесто синтеза: рибосомы
- 37. Свойства биологического кодаТриплетность (3 нуклеотида кодируют аминокислоту)Специфичность
- 38. Активация аминокислот
- 39. 1 этап трансляции: инициацияК мРНК присоединяется малая
- 40. 2 этап трансляции: элонгация (рост пептидной цепи)Стадии
- 41. 3 этап трансляции: терминацияВысвобождение пептида из связис
- 42. Посттрансляционные модификации белков – образование функционально активных
- 43. Регуляция матричных биосинтезовЭкспрессия генов — процесс, в
- 44. Адаптивная регуляция осуществляется при участии:регуляторных белков, взаимодействующих
- 45. Примеры адаптивной регуляции экспрессии геновКОРТИЗОЛ (как индуктор)
- 46. Примеры ингибиторов матричных биосинтезовТоксин белой поганки аманитин
- 47. Задание для самостоятельной работыИспользуя интернет-ресурсы и учебник
- 48. Противоопухолевые и антибактериальные препараты – ингибиторы матричных биосинтезов
- 49. ЗаключениеПроцессы репликации, транскрипции, трансляции (матричные биосинтезы) лежат
- 50. Литература1. Биохимия: учебник для ВУЗов / Е.
- 51. Скачать презентанцию
История исследований в молекулярной биологииАпрель 1953 г. - предложена модель пространственной структуры ДНК - двойная спираль (журнал “Nature” "Структура ДНК" Д. Уотсон и Ф. Крик)В биологии начался новый отсчет времени –
Слайды и текст этой презентации
Слайд 1Лекция 4.
Матричные биосинтезы
Репликация
Транскрипция
Трансляция
Дисциплина: Б1.Б.15. Биохимия
Специальность: 31.05.02 Педиатрия
НГМУ, кафедра медицинской химии
Д.б.н.,
доцент Суменкова Дина Валерьевна
дна и крыши, нет сторон, Все это жизни вечной трон. Все это Миг и Вдохновенье, нерукотворное круженье...Слайд 2История исследований
в молекулярной биологии
Апрель 1953 г. - предложена модель пространственной
структуры ДНК - двойная спираль (журнал “Nature” "Структура ДНК" Д.
Уотсон и Ф. Крик)В биологии начался новый отсчет времени – развитие молекулярной биологии
На этом пути сделаны серии блестящих открытий, большинство из которых отмечены Нобелевскими премиями
Слайд 3Джеймс Уотсон (р. 1928)
Френсис Крик (1916-2004)
1952 г
работа над моделированием
ДНК
Основа: правило Чаргаффа
и рентгенограммы Р. Франклин
и М. Уилкинса
1953 г –
публикация результатов1962 г – Нобелевская премия
по физиологии и медицине
Слайд 4"...выдающийся харизматический символ нашего времени - спиральная лестница, ведущая, я
надеюсь, в небеса, - была разрекламирована с поистине выдающейся интенсивностью.
Она использовалась как эмблема, ее рисовали на галстуках, она украшала фирменные бланки, ее устанавливали перед зданиями.... Она даже вторглась в высокие формы изящного искусства" .Апрель 2018 г – 65 лет с момента открытия структуры ДНК
Какова роль молекулярной биологии в развитии современной медицины?
Е. Чаргафф
Слайд 5Актуальность темы лекции: открытия молекулярной биологии играют важную роль в развитии
современной медицины
Использование ДНК-технологий
выявление мутаций генов
выявление наследственных заболеваний
определение особенностей генома
установление родства
диагностика
бактериальных и вирусных заболеванийпроизводство рекомбинантных белков, гормонов….
производство лекарственных препаратов – ингибиторов матричных биосинтезов в опухолевых и бактериальных клетках
расшифровка генома человека (международный проект под рук. Д. Уотсона, 1990-2003 г) с целью ранней диагностики и лечения заболеваний
Слайд 6Генная и клеточная терапия – «небеса», к которым привела спиральная
лестница ДНК
Генная терапия – лечение путем введения в клетки пациентов
генов, устраняющих генные дефекты или придающие им новые функцииПервый клинический опыт
1990 г, США, 4-х летняя девочка с иммунодефицитным состоянием
Причина заболевания:
мутация гена аденозиндезаминазы → нарушение обмена нуклеотидов → нарушение пролиферации и созревания лимфоцитов
Лечение: пересадка собственных лимфоцитов с предварительно введенным in vitro ретровирусом, содержащим нормальный ген фермента
Слайд 7Клеточная терапия
Терапия с использованием стволовых клеток
С помощью определенных генов можно
перепрограммировать клетку и изменить путь ее дифференцировки
Например, разработана технология получения
плюрипотентных стволовых клеток из фибробластов кожи человека с помощью генов Myc, Oct3/4, Sox2, Klf4 и их дальнейшая дифференцировка в кардиомиоциты (Шинья Яманака, Япония, Нобелевская премия 2012)
Слайд 8Цель лекции
Знать:
строение и функции нуклеиновых кислот
химико-биологическую сущность процессов репликации,
транскрипции, трансляции
Использовать знания о матричных биосинтезах для понимания химико-биологической
сущностипроцессов роста и развития организма
механизмов устойчивости организма к воздействиям внешней среды
механизмов действия противоопухолевых и антибактериальных препаратов
Использовать знания о матричных биосинтезах для формирования представлений
о принципах ДНК-технологий в диагностике и терапии
о механизме действия некоторых ядов и бактериальных токсинов
о генетических аспектах полиморфизма генов и белков, наследственных заболеваний и канцерогенеза
Слайд 9План лекции
1. Строение и функции ДНК и РНК (самостоятельное повторение
курса химии с использованием слайдов 10-18)
2. Репликация и репарация
3. Транскрипция
4.
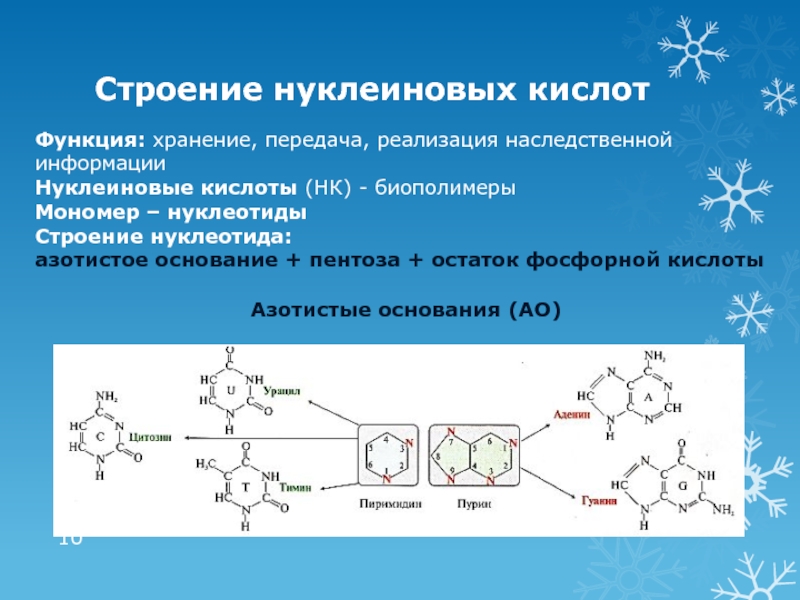
ТрансляцияСлайд 10Строение нуклеиновых кислот
Функция: хранение, передача, реализация наследственной информации
Нуклеиновые кислоты (НК)
- биополимеры
Мономер – нуклеотиды
Строение нуклеотида:
азотистое основание + пентоза + остаток
фосфорной кислотыАзотистые основания (АО)
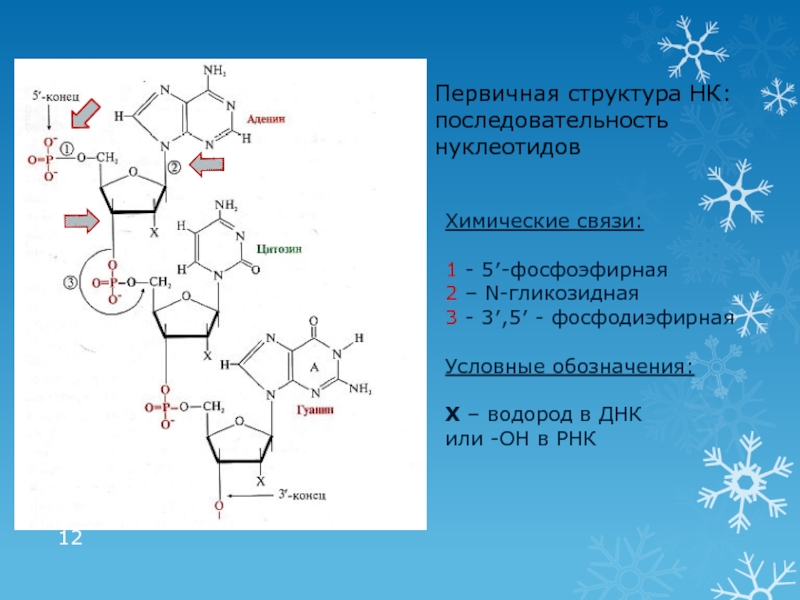
Слайд 12Первичная структура НК: последовательность нуклеотидов
Химические связи:
1 - 5′-фосфоэфирная
2 – N-гликозидная
3
- 3′,5′ - фосфодиэфирная
Условные обозначения:
Х – водород в ДНК
или -ОН
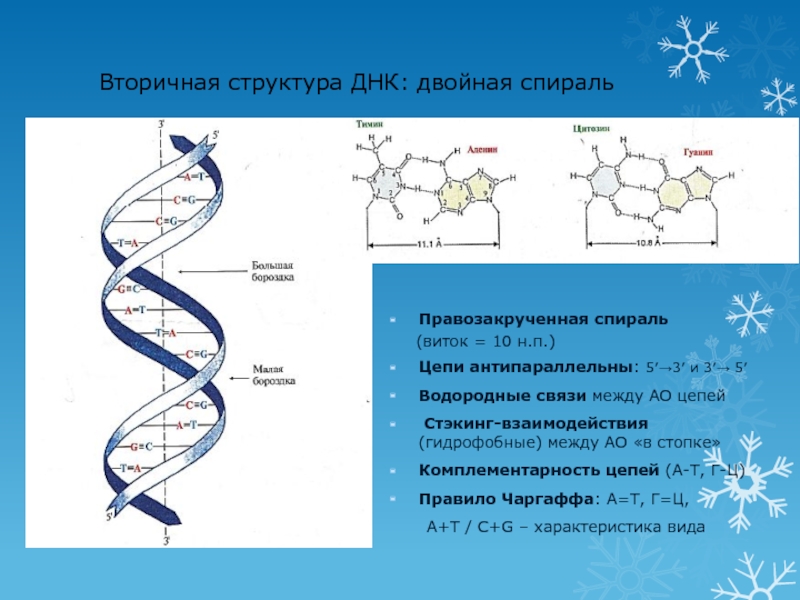
в РНКСлайд 13Вторичная структура ДНК: двойная спираль
Правозакрученная спираль
(виток =
10 н.п.)
Цепи антипараллельны: 5′→3′ и 3′→ 5′
Водородные связи между АО
цепей Стэкинг-взаимодействия (гидрофобные) между АО «в стопке»
Комплементарность цепей (А-Т, Г-Ц)
Правило Чаргаффа: А=Т, Г=Ц,
А+Т / C+G – характеристика вида
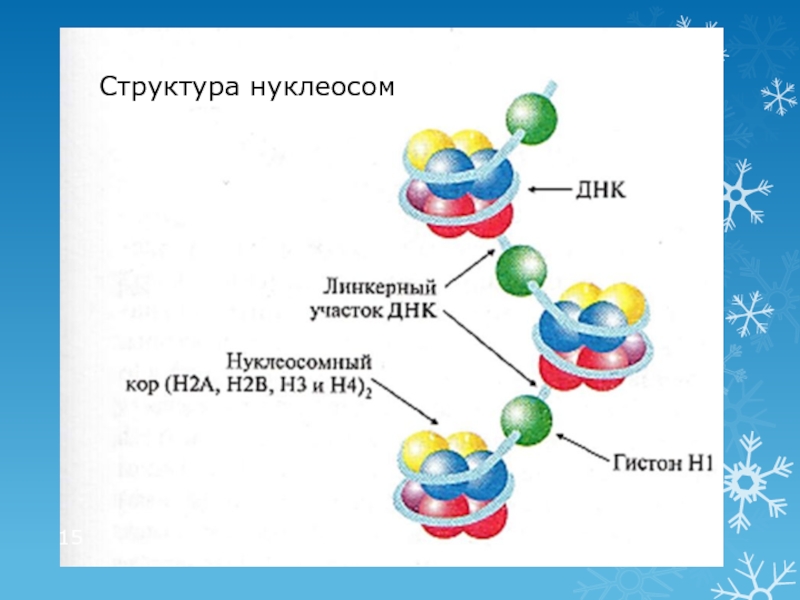
Слайд 14Третичная структура ДНК: нуклеопротеидные комплексы (хромосомы)
Гистоновые белки: белки с высоким
содержанием лиз и арг
5 типов: Н1, Н2А, Н2В, Н3, Н4
Негистоновые
белки: белки и ферменты, участвующие в матричных биосинтезахРоль белков: обеспечивают суперспирализацию и компактизацию ДНК
Нуклеосома
ДНК (≈146 н.п.) + 8 молекул гистонов (Н2А, Н2В, Н3, Н4)2
Структура удерживается ионными связями между лиз, арг и остатками фосфорной кислоты
Линкерные участки
Участок ДНК (≈30 н.п.) между нуклеосомами, с которым связаны молекулы гистона Н1
Гетерохроматин – «компактный» хроматин, транскрипционно неактивный
Эухроматин – деспирализованный хроматин с низким содержанием гистонов и высоким содержанием негистоновых белков (период транскрипции)
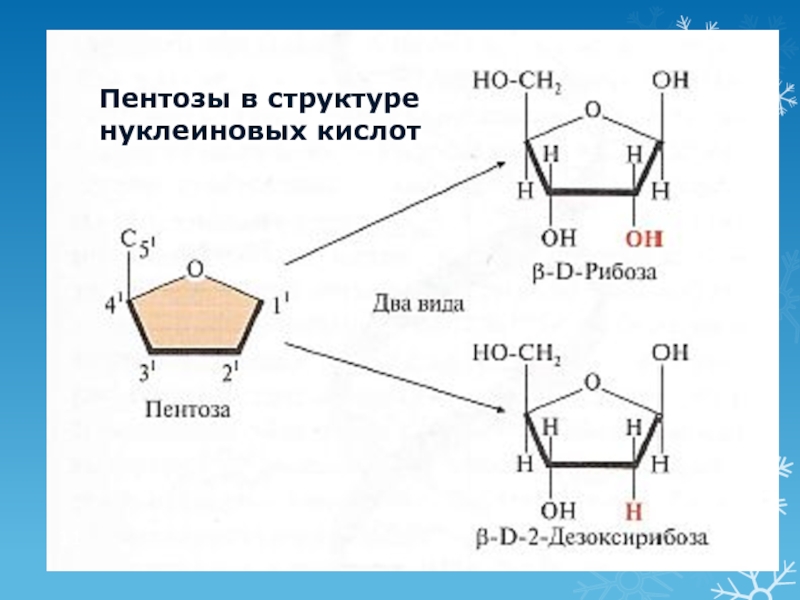
Слайд 16Пространственная структура РНК
Одноцепочечная
Шпильки – спирализованные участки (водородные связи)
Не соблюдается правило
Чаргаффа
Виды РНК:
мРНК
матрица в синтезе белка
2-4% от общего количества РНК, разнообразная
первичная структура5′ - «кэп»-конец: 7-метил ГТФ (защита от нуклеаз, участие в инициации трансляции)
3′ - поли(А)-«хвост»: 150-200 остатков АМФ (выход из ядра, защита от нуклеаз)
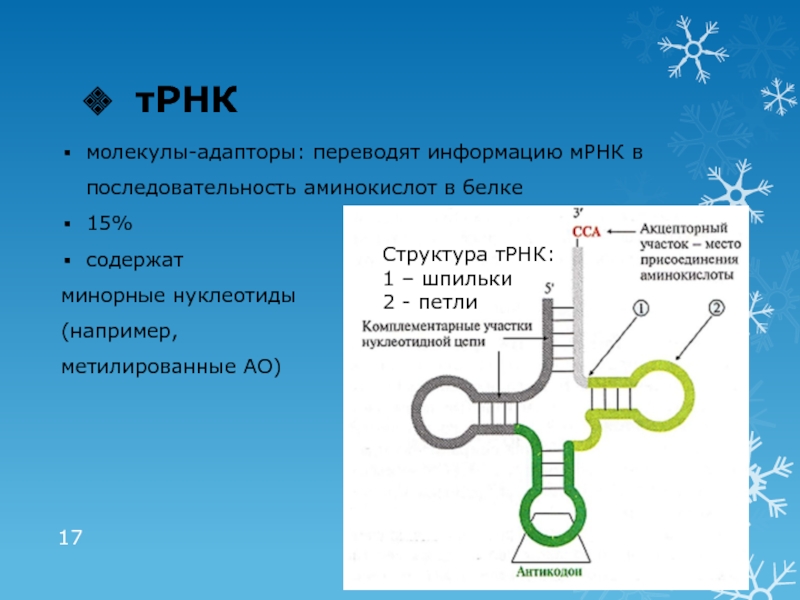
Слайд 17тРНК
Структура тРНК:
1 – шпильки
2 - петли
молекулы-адапторы: переводят информацию мРНК в
последовательность аминокислот в белке
15%
содержат
минорные нуклеотиды
(например,
метилированные АО)
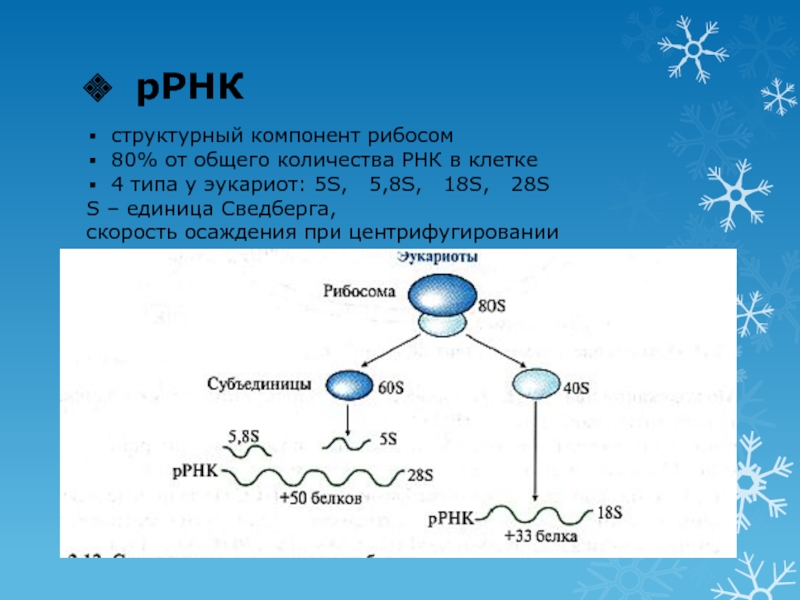
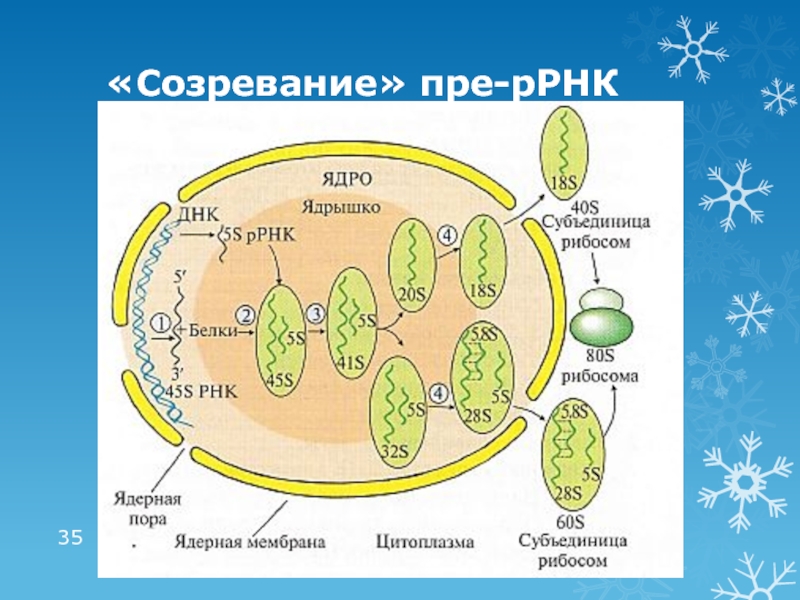
Слайд 18рРНК
структурный компонент рибосом
80% от общего количества РНК в клетке
4 типа
у эукариот: 5S, 5,8S, 18S, 28S
S –
единица Сведберга,скорость осаждения при центрифугировании
Слайд 19РЕПЛИКАЦИЯ: синтез ДНК
Протекает в ядре в S-фазу клеточного цикла перед
митозом
Стимулы: гормоны, ростовые факторы, белки-циклины
Матрица: обе нити ДНК, образуются 2
репликативные вилкиНаправление синтеза новых цепей: 5′ - 3′ по принципу комплиментарности и антипараллельности
Участки синтеза – ориджины репликации
Участок ДНК между соседними ориджинами - репликон
Этапы репликации: инициация, элонгация, терминация
Субстраты и источники энергии: дАТФ, дГТФ, дТТФ, дЦТФ
Кофактор: Mg2+
Полуконсервативный процесс синтеза: каждая дочерняя молекула ДНК содержит одну родительскую нить и одну синтезированную
Образуется идентичная молекула ДНК (клетка 4n)
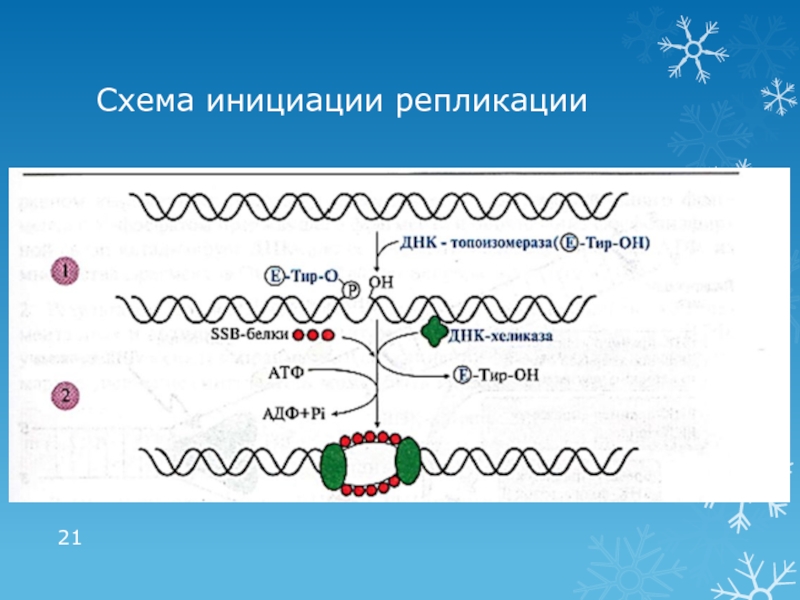
Слайд 201 этап репликации: инициация
Формирование репликативной вилки:
ДНК-топоизомераза расщепляет 3′,5′-фосфодиэфирную связь в
одной из цепей ДНК и присоединяется к 5′-концу в точке
разрыва2. ДНК-хеликаза, используя энергию АТФ, разрывает водородные связи и обеспечивает локальное разделение двойной спирали ДНК
ДНК-топоизомераза восстанавливает 3′,5′-фосфодиэфирную связь и отделяется
SSB (single strand binding)–белки связываются с одноцепочечными участками, препятствуя комплементарному скручиванию цепей
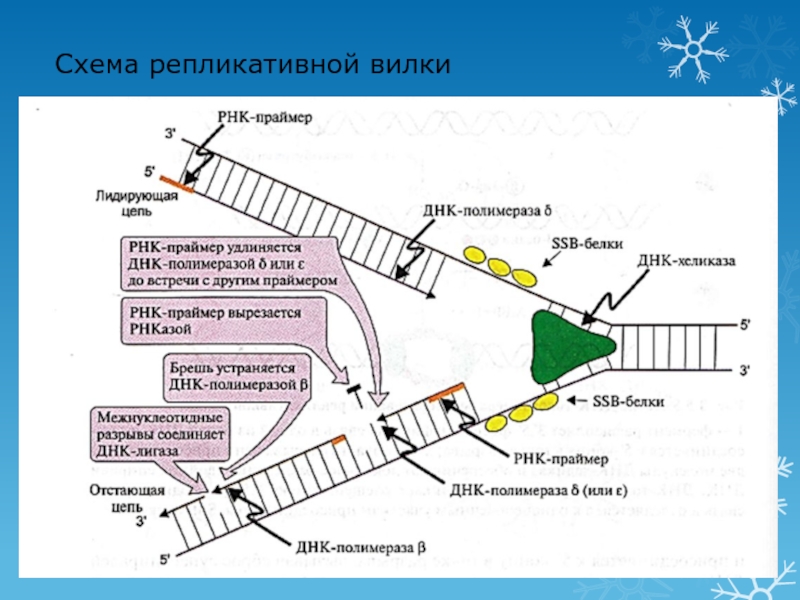
Слайд 222 этап репликации: элонгация
Синтез новых цепей ДНК
Лидирующая цепь: 3′ -
5′ (синтез непрерывный по ходу движения репликативной вилки)
Отстающая цепь: 5′
- 3′ (рост этой цепи начинается после того, как на лидирующей цепи синтезируется участок из ≈200 нуклеотидов, синтез идет против движения репликативной вилки в виде фрагментов Оказаки)Синтез цепей начинается с образования «затравки» (РНК-праймера из ≈10 нуклеотидов)
Ферменты:
ДНК-полимераза α синтезирует РНК-праймер и небольшой участок ДНК
ДНК-полимераза δ удлиняет лидирующую цепь
ДНК-полимераза δ или ε удлиняют отстающую цепь
Слайд 233 этап репликации: терминация
Исключение праймеров
Завершение формирования отстающей цепи ДНК
Эндонуклеаза (РНКаза)
удаляет РНК-праймер
ДНК-полимераза β заполняет «брешь»
ДНК-лигаза объединяет фрагменты, затрачивая энергию АТФ
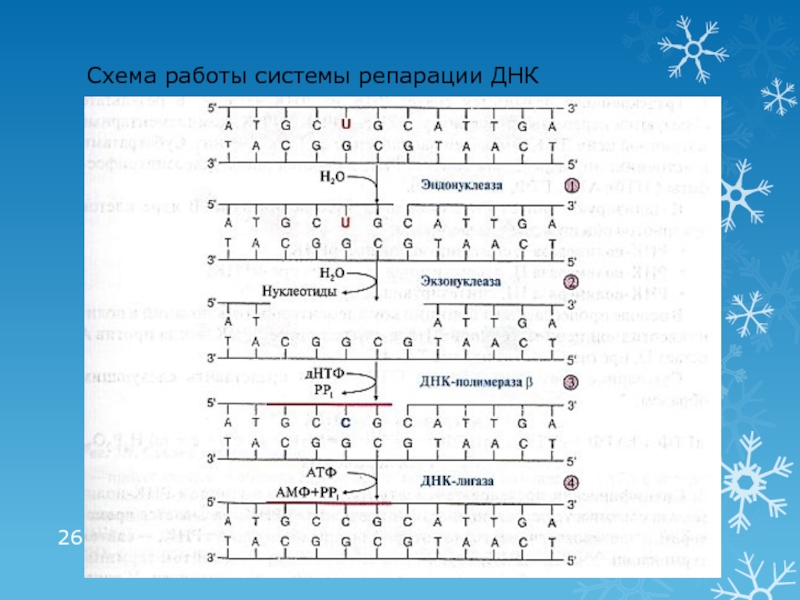
Слайд 25Репарация ошибок и повреждений ДНК
Причина повреждений ДНК:
действие факторов окружающей и
внутренней среды
Повреждение ДНК происходит с частотой от нескольких сотен до
1000 случаев в каждой клетке, каждый часВиды повреждений:
дезаминирование АО (цитозин превращается в урацил), метилирование АО
депуринизация, депиримидинизация
образование пиримидиновых димеров (действие УФО)
разрыв цепей, ковалентные сшивки между цепями
ошибки репликации
Система репарации – ферменты (нуклеазы, полимеразы, лигазы)
Слайд 27Роль системы репарации
Репарация необходима для сохранения генома и возможна благодаря
существованию 2-х цепей ДНК
Снижение активности ферментов репарации приводит к накоплению
мутацийПолагают, что от 80 % до 90 % всех раковых заболеваний связаны с нарушением репарации ДНК
ПРИМЕР: пигментная ксеродерма – наследственное заболевание, связанное с мутацией генов системы репарации ДНК; УФО таких больных приводит к накоплению мутаций в клетках кожи и развитию рака
Слайд 28ТРАНСКРИПЦИЯ: синтез РНК
Протекает в ядре вне зависимости от фаз клеточного
цикла
Матрица: нить ДНК 3′ - 5′
Субстраты и источники энергии: АТФ,
ГТФ, ЦТФ, УТФНаправление синтеза: 5′ - 3′ по принципу комплиментарности и антипараллельности
Этапы: инициация, элонгация, терминация
Участвуют факторы инициации, элонгации и терминации – белки
Образуются комплиментарные матрице продукты: мРНК, тРНК, рРНК
Ферменты:
РНК-полимераза I (синтез пре-рРНК)
РНК-полимераза II (синтез пре-мРНК)
РНК-полимераза III (синтез пре-тРНК)
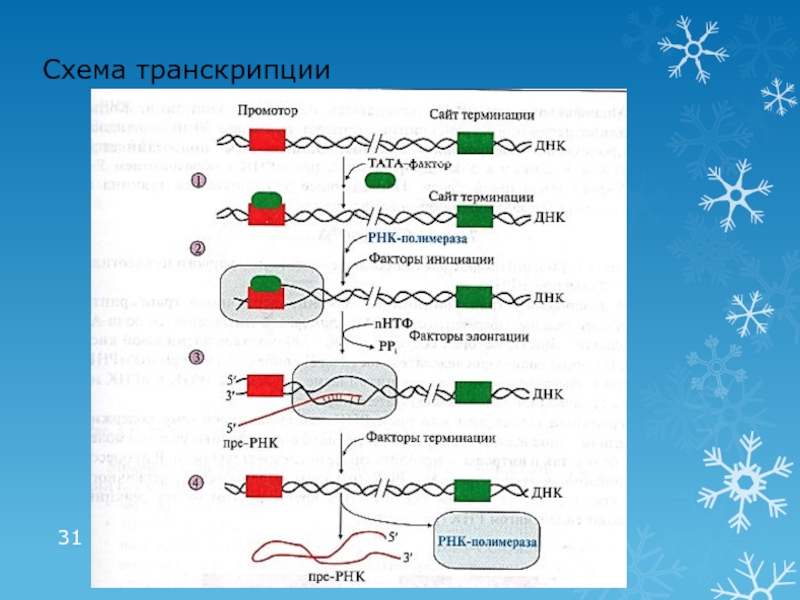
Слайд 291 этап транскрипции: инициация
Промотор – последовательность ДНК (ТАТА), с которой
связывается РНК-полимераза
Сайт терминации – участок завершения синтеза РНК
Транскриптон – участок
ДНК ограниченный промотором и сайтом терминации«Активация» промотора с помощью ТАТА-фактора
Взаимодействие промотора с РНК-полимеразой и факторами инициации
Факторы инициации обеспечивают расплетение двойной нити ДНК длиной в один виток (10 н.п.)
Слайд 302 этап транскрипции:
элонгация и терминация
Элонгация: рост нити пре-РНК
Факторы элонгации (E,
H, F) повышают активность РНК-полимеразы и облегчают расхождение цепей. Один
ген может одновременно транскрибироваться несколькими молекулами РНК-полимеразыТерминация: прекращение транскрипции
Факторы терминации облегчают отделение пре-РНК и РНК-полимеразы от матрицы ДНК
Слайд 32
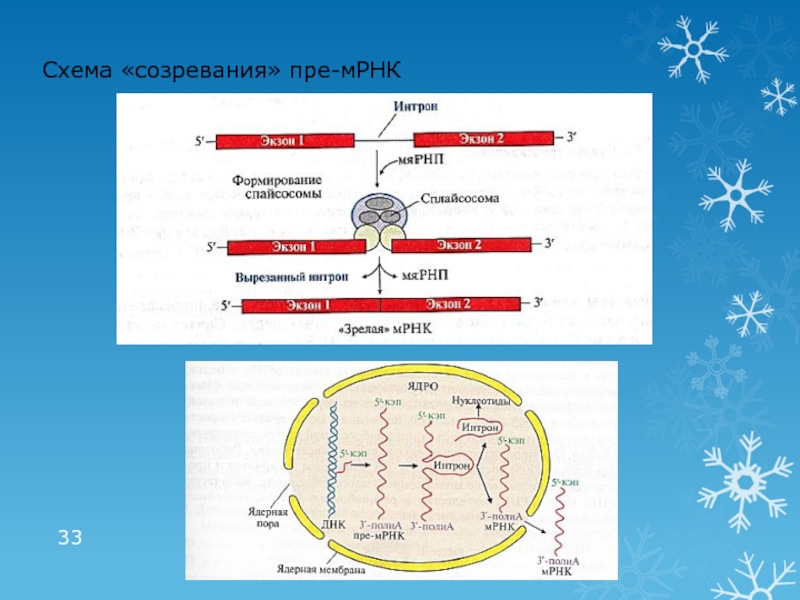
Посттранскрипционные модификации пре-РНК
«Созревание» пре-мРНК
«Кэпирование» на стадии элонгации
Образование поли(А)- «хвоста»
после транскрипции
Сплайсинг – удаление интронов (некодирующих последовательностей) и соединение экзонов
Участвуют малые ядерные рибонуклеопротеины (мяРНП), образующие комплексы – сплайсосомы
Выход «зрелой» мРНК в цитоплазму
Альтернативный сплайсинг – механизм образования различных видов «зрелой» мРНК из одной и той же молекулы пре-мРНК в разных тканях
В результате в разных тканях при считывании информации с одного и того же гена образуются различные мРНК, а соответственно и различные белки
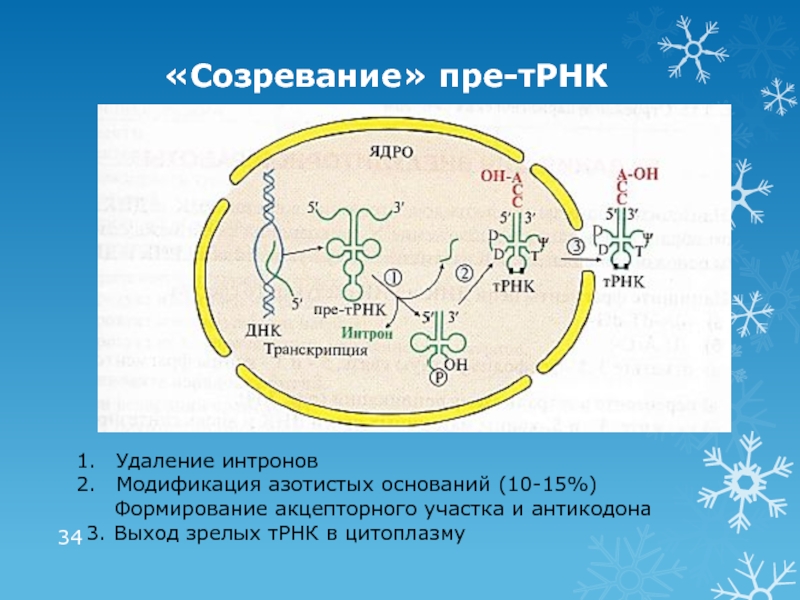
Слайд 34«Созревание» пре-тРНК
Удаление интронов
Модификация азотистых оснований (10-15%)
Формирование акцепторного участка
и антикодона
3. Выход зрелых тРНК в цитоплазму
Слайд 36ТРАНСЛЯЦИЯ: синтез белка
Место синтеза: рибосомы Матрица:
мРНК
Субстраты: аминокислоты (АК) Адапторы: тРНК
Источники энергии: АТФ, ГТФ
Кофактор: Mg
2+ (стабилизирует структуру рибосом)Факторы инициации (IF), элонгации (EF), терминации (RF)
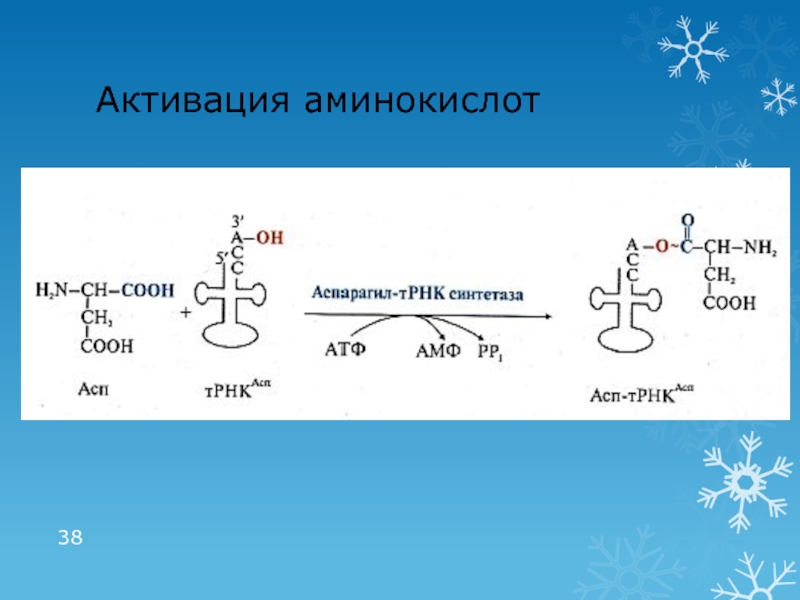
Активация АК: связывание с тРНК (аминоацил-тРНК-синтетазы)
Инициирующая аминоацил-тРНК (аа-тРНК): мет-тРНК
Инициирующий кодон мРНК: AUG
Этапы: инициации, элонгации, терминации
Образуется колинеарный матрице продукт – белок (последовательность АК соответствует последовательности кодонов мРНК)
Биологический код: запись информации о последовательности АК в белке с помощью последовательности нуклеотидов
Из школьного курса биологии вспомните и объясните свойства биологического кода!
Слайд 37Свойства биологического кода
Триплетность (3 нуклеотида кодируют аминокислоту)
Специфичность (триплет – одна
аминокислота)
Вырожденность (одна аминокислота может кодироваться несколькими разными триплетами)
Универсальность (для всех
живых организмов, независимо от уровня эволюционного развития)Наличие терминирующих стоп-кодонов: UAA, UAG, UGA
Однонаправленность (триплеты «читаются» в направлении 5′ - 3′)
Колинеарность (последовательность АК соответствует последовательности кодонов мРНК)
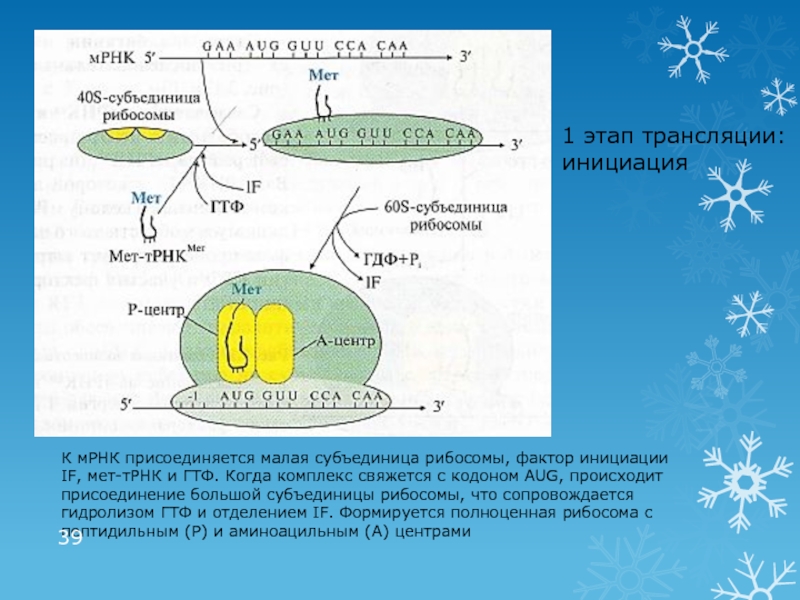
Слайд 391 этап трансляции: инициация
К мРНК присоединяется малая субъединица рибосомы, фактор
инициации IF, мет-тРНК и ГТФ. Когда комплекс свяжется с кодоном
AUG, происходит присоединение большой субъединицы рибосомы, что сопровождается гидролизом ГТФ и отделением IF. Формируется полноценная рибосома с пептидильным (Р) и аминоацильным (А) центрамиСлайд 402 этап трансляции: элонгация (рост пептидной цепи)
Стадии элонгации:
Связывание аа-тРНК в
А-центре при участии фактора элонгации EF1 и с затратой энергии
ГТФОбразование пептидной связи между АК Р-центра и АК А-центра при участии пептидилтрансферазы
Перемещение рибосомы по мРНК (транслокация) в направлении от 5′- к 3′-концу с использованием энергии ГТФ и при участии фактора элонгации EF2
Многократное повторение стадий
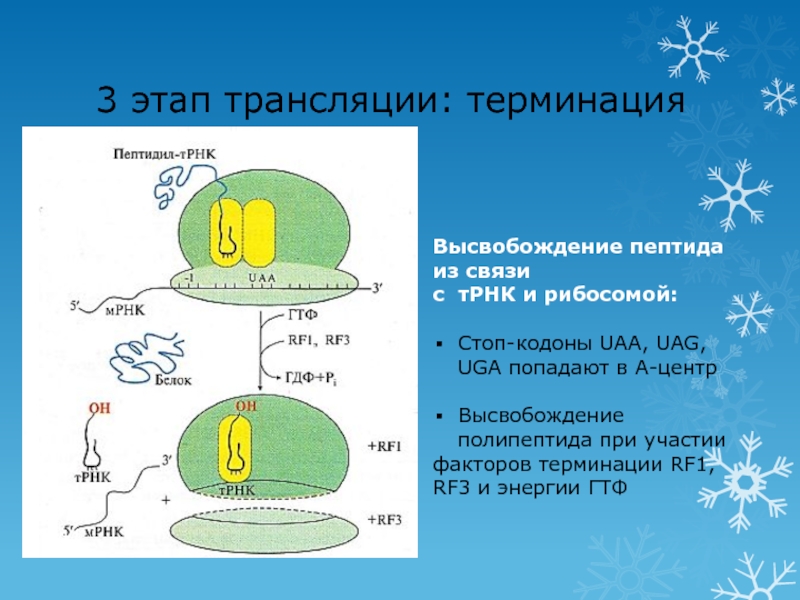
Слайд 413 этап трансляции: терминация
Высвобождение пептида из связи
с тРНК и рибосомой:
Стоп-кодоны
UAA, UAG, UGA попадают в А-центр
Высвобождение полипептида при участии
факторов терминации
RF1, RF3 и энергии ГТФСлайд 42Посттрансляционные модификации белков – образование функционально активных белков
Частичный протеолиз
Фолдинг –
формирование пространственной структуры (II, III) при участии белков-шаперонов
Модификация аминокислот (гликозилирование,
фосфорилирование, ацилирование, метилирование……)Образование дисульфидных связей (цистеин-цистеин)
Присоединение простетической группы (сложные белки)
Сборка протомеров в олигомерные белки (формирование IV структуры)
Слайд 43Регуляция матричных биосинтезов
Экспрессия генов — процесс, в ходе которого наследственная
информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт
— РНК или белок (в процессе транскрипции и трансляции)Механизмы регуляции экспрессии генов различны: компактизация ДНК, модификация ДНК и гистонов, привлечение факторов транскрипции и др.
Гены белков «домашнего хозяйства» экспрессируются с постоянной скоростью (конститутивные) и обеспечивают жизнеспособность клеток (например, гены ферментов энергетического обмена).
Стойкая репрессия транскрипции определенных генов в различных клетках обеспечивает формирование специализированных клеток, тканей и органов.
Адаптивная регуляция обеспечивает изменение скорости экспрессии генов в ответ на меняющиеся условия среды (индуцибельная экспрессия).
Слайд 44
Адаптивная регуляция осуществляется при участии:
регуляторных белков, взаимодействующих с участками ДНК
индукторов (стимулируют экспрессию)
корепрессоров (подавляют экспрессию)
Индукторы или корепрессоры стимулируют присоединение регуляторных
белков к регуляторным участкам ДНКВ качестве индукторов и корепрессоров выступают гормоны, ростовые факторы, продукты метаболических путей
Регуляторные участки ДНК:
Энхансер – «усилитель» транскрипции
Сайленсер – «тушитель» транскрипции
Слайд 45Примеры адаптивной регуляции экспрессии генов
КОРТИЗОЛ (как индуктор) стимулирует присоединение регуляторного
белка к энхансеру и вызывает экспрессию гена ФОСФОЕНОЛПИРУВАТКАРБОКСИКИНАЗЫ (ключевого фермента
синтеза глюкозы), что приводит к повышению уровня глюкозы в крови при голодании, стрессе и физической нагрузкиХОЛЕСТЕРИН (как корепрессор) стимулирует присоединение белка-регулятора к сайленсеру и вызывает подавление экспрессии гена ГМГ-КоА-РЕДУКТАЗЫ (ключевого фермента синтеза холестерина), что приводит к снижению синтеза холестерина (поэтому чем больше холестерина поступает с пищей, тем меньше его синтезируется в печени)
Слайд 46Примеры ингибиторов матричных биосинтезов
Токсин белой поганки аманитин ингибирует РНК-полимеразу II
(синтез мРНК)
Энтеротоксин возбудителя дифтерии ингибирует трансляцию, модифицируя фактор элонгации EF2
и нарушая транслокацию рибосомИнтерфероны (гликопротеины лимфоцитов и макрофагов, обладающие противовирусной активностью):
активируют РНК-азу, расщепляющую мРНК и рРНК
стимулируют синтез протеинкиназы, которая фосфорилирует и тем самым инактивирует фактор инициации трансляции IF2
прекращается синтез белков в инфицированных клетках человека, клетка погибает, но останавливается размножение вирусов
Слайд 47Задание для самостоятельной работы
Используя интернет-ресурсы и учебник выполните задания и
составьте конспект по вопросам:
1. Принцип метода полимеразной цепной реакции и
его применение в медицине.2. Роль нерепарированных изменений ДНК (мутаций) в развитии биохимической индивидуальности человека (полиморфизме генов и белков), наследственных заболеваний и канцерогенезе.
3. Заполните таблицу «Лекарственные препараты – ингибиторы матричных биосинтезов» (см. следующий слайд).
Слайд 49Заключение
Процессы репликации, транскрипции, трансляции (матричные биосинтезы) лежат в основе «производства»
белков и ферментов, функционирование которых является основой жизни
Регуляция данных процессов
лежит в основе адаптацииНарушение данных процессов приводит к развитию заболеваний
Знания о нуклеиновых кислотах и механизмах матричных биосинтезов являются основой создания лекарственных препаратов, методов диагностики и терапии
Слайд 50Литература
1. Биохимия: учебник для ВУЗов / Е. С. Северин -
М.: ГЭОТАР-Медиа, 2014. -768 с. (раздел 4)
2. Биологическая химия с упражнениями
и задачами: учебник / ред. С. Е. Северин. - М.: ГЭОТАР-Медиа, 2013. - 624 с. (С. 113 – 171, для выполнения самостоятельной работы п.1 и 2 С. 153-165) 3. Биохимия с упражнениями и задачами: учебник для студ. мед. вузов / ред. Е. С. Северин. - М. : ГЭОТАР-Медиа, 2010. - 384 с. (раздел 3, С. 54-79; для выполнения самостоятельной работы п. 1-3 С. 70, 73-77)
4. Биологическая химия: учебник для студентов медицинских вузов / А.Я. Николаев. – М.: Мед. информ. агенство, 2007. – 568 с.