Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция №21. Отбелка целлюлозы
Содержание
- 1. Лекция №21. Отбелка целлюлозы
- 2. Общая характеристика процесса отбелки Цель процесса отбелки
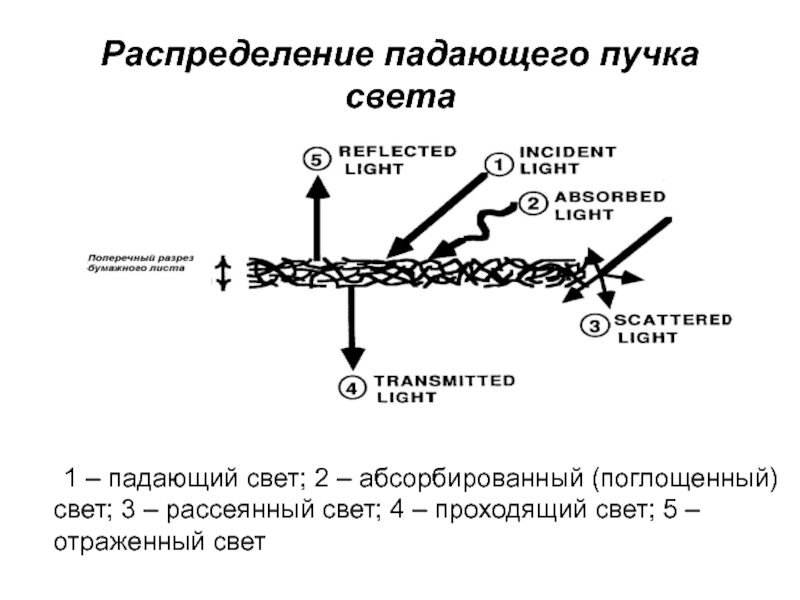
- 3. Распределение падающего пучка света 1 – падающий свет;
- 4. Зависимость отраженного света (%) от длины волны
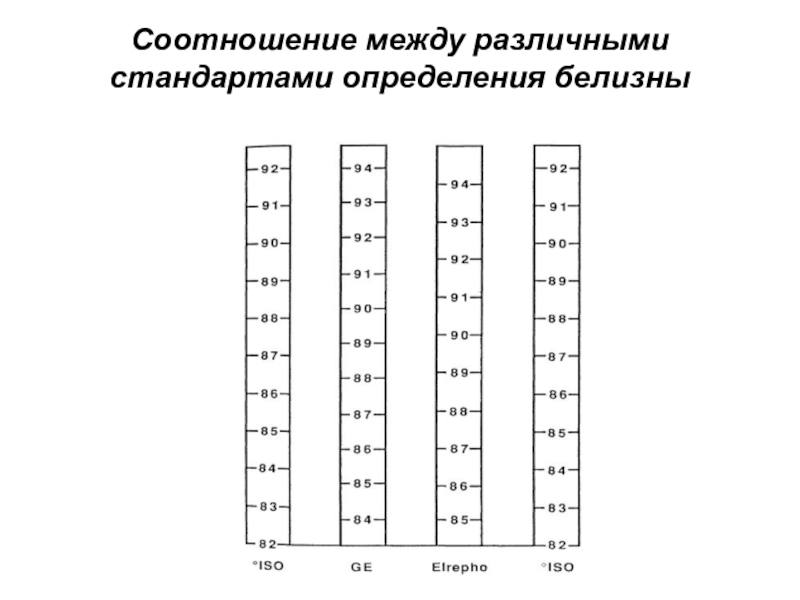
- 5. Соотношение между различными стандартами определения белизны
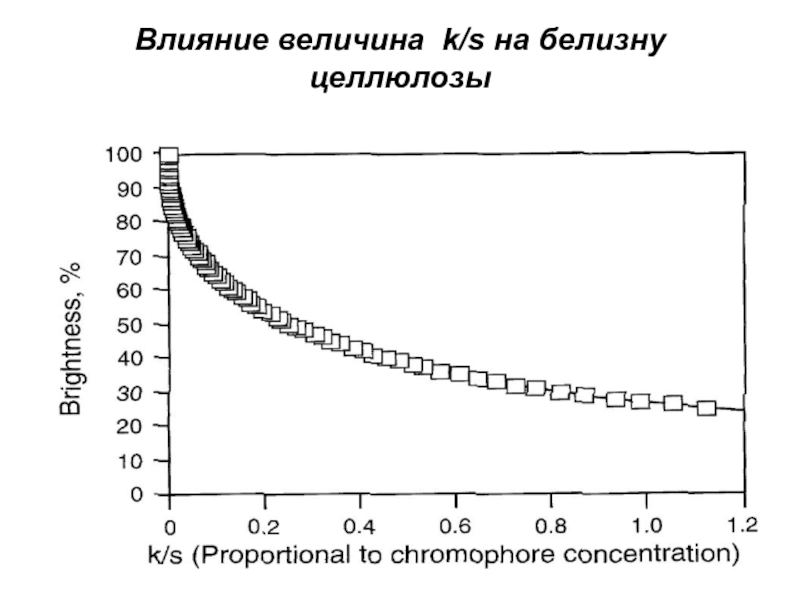
- 6. Влияние величина k/s на белизну целлюлозы
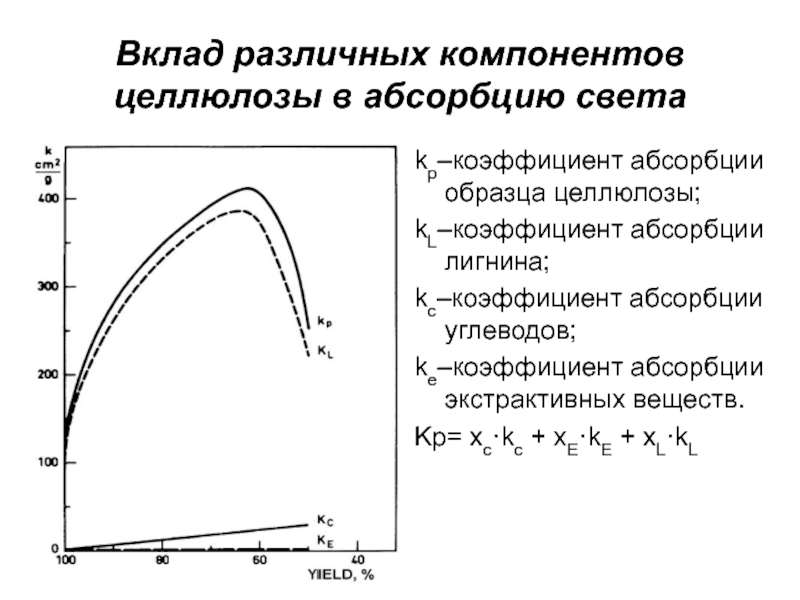
- 7. Вклад различных компонентов целлюлозы в абсорбцию светаkp–коэффициент
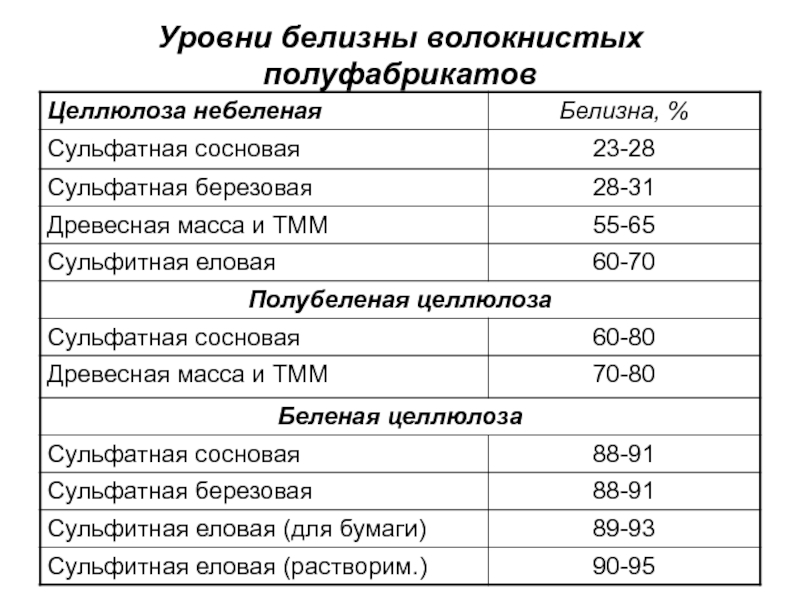
- 8. Уровни белизны волокнистых полуфабрикатов
- 9. Стабильность белизны Зависит от:температуры;освещенности;радиации;влажности;содержания химикатов;состава целлюлозы: содержания в
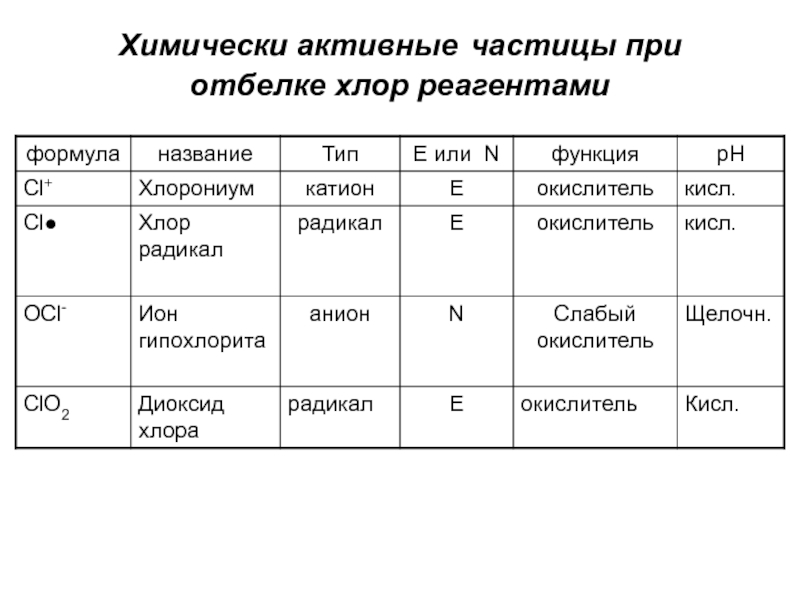
- 10. Химически активные частицы при отбелке хлор реагентами
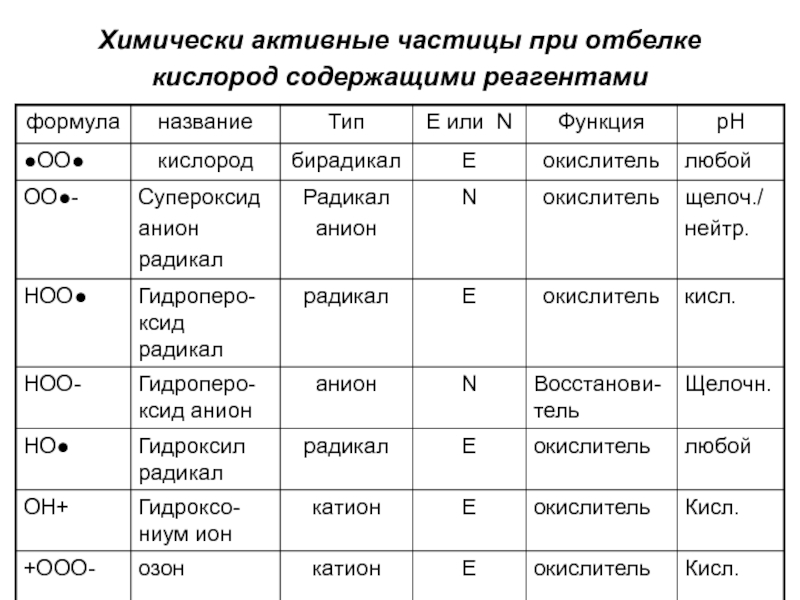
- 11. Химически активные частицы при отбелке кислород содержащими реагентами
- 12. Классификация отбеливающих реагентовКатионы или радикалы в кислой
- 13. Реакции отбеливающих реагентовМогут быть описаны в соответствии
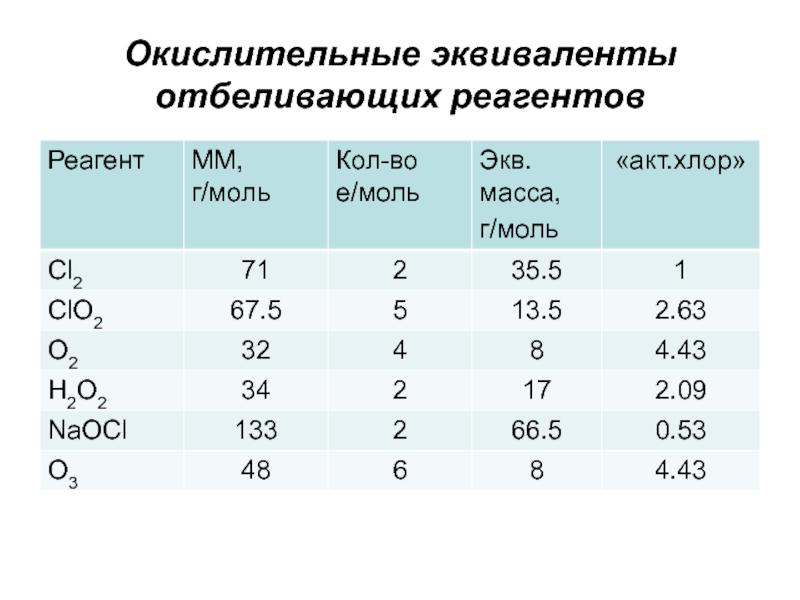
- 14. Окислительные эквиваленты отбеливающих реагентов
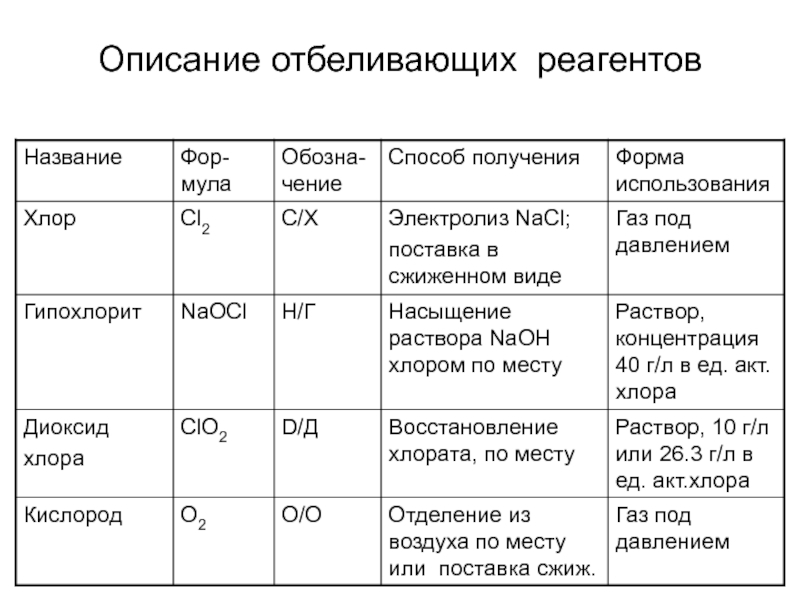
- 15. Описание отбеливающих реагентов
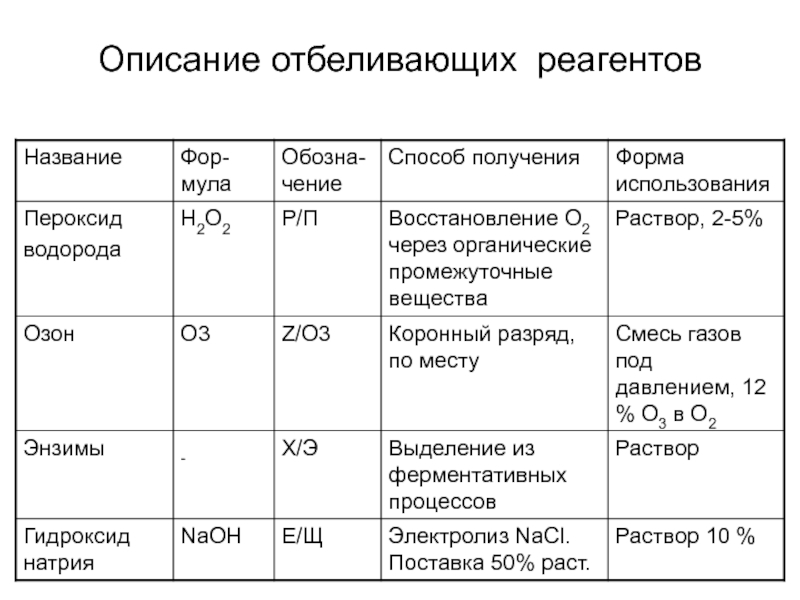
- 16. Описание отбеливающих реагентов
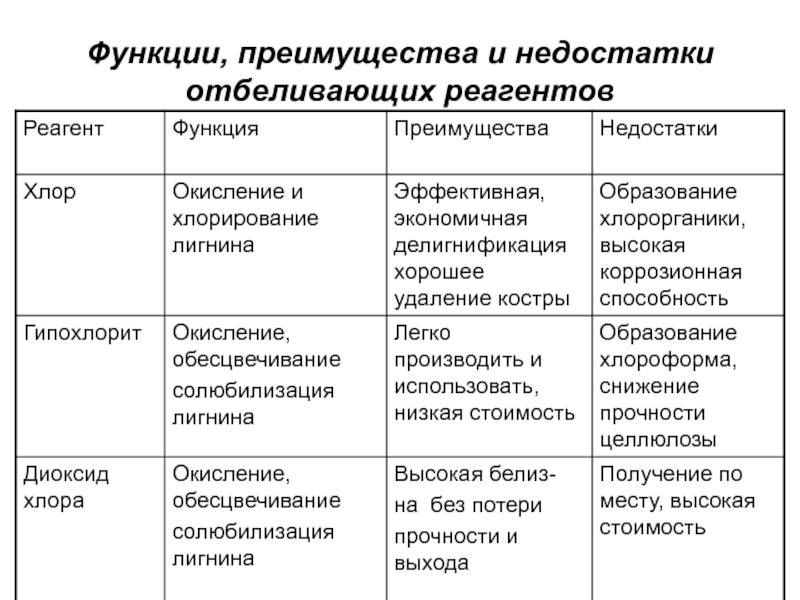
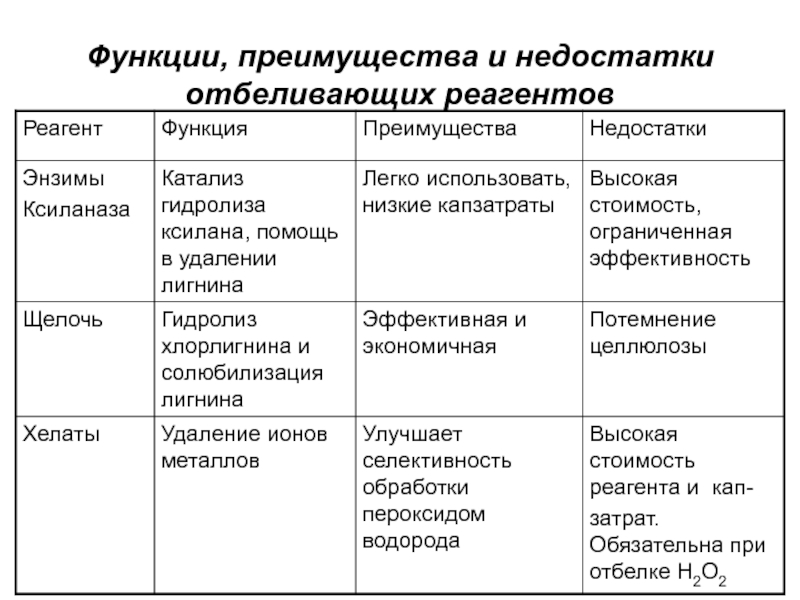
- 17. Функции, преимущества и недостатки отбеливающих реагентов
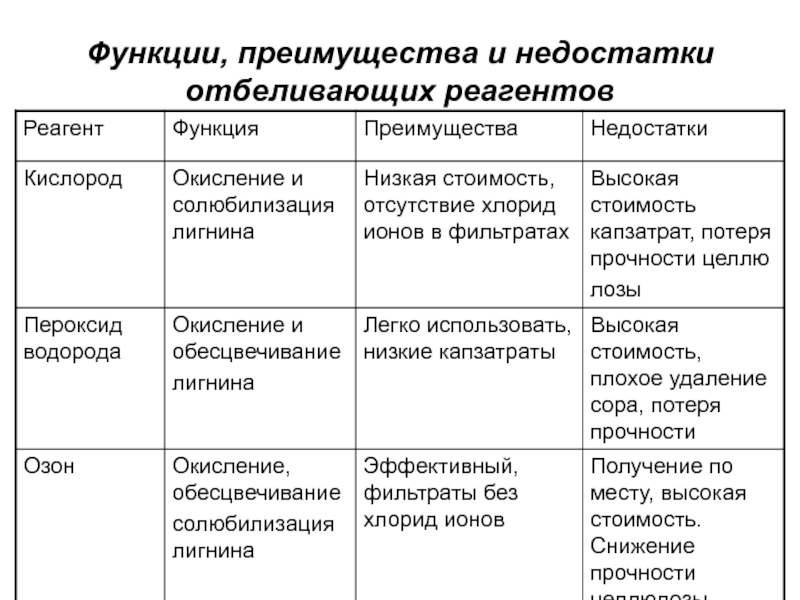
- 18. Функции, преимущества и недостатки отбеливающих реагентов
- 19. Функции, преимущества и недостатки отбеливающих реагентов
- 20. Свойства основных отбеливающих реагентов и способы их
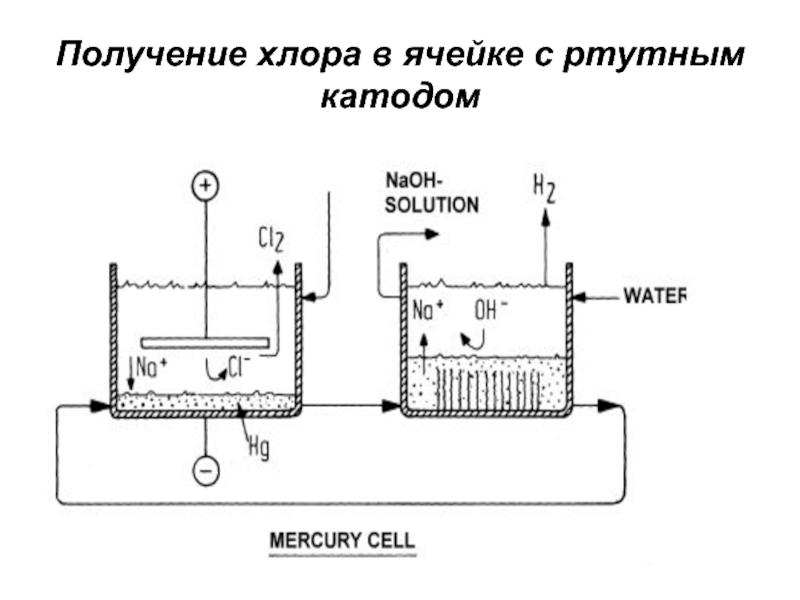
- 21. Получение хлора в ячейке с ртутным катодом
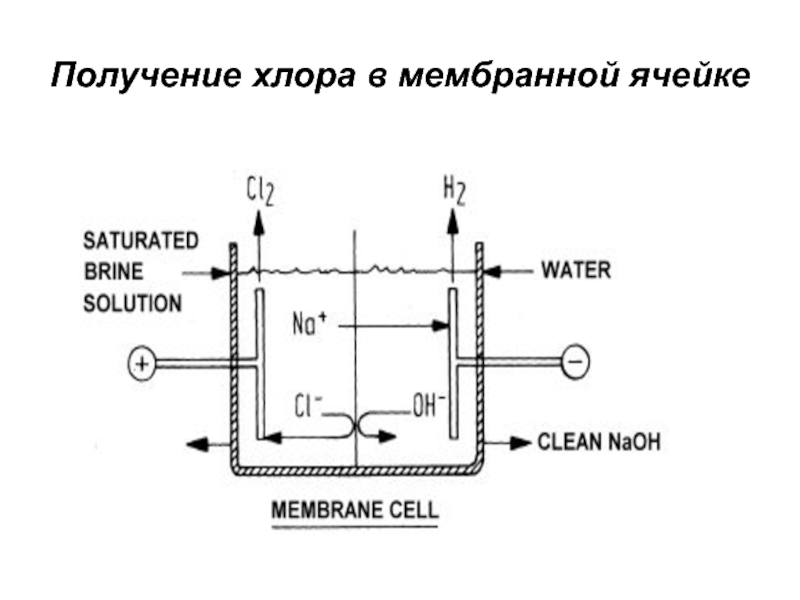
- 22. Получение хлора в мембранной ячейке
- 23. Свойства хлорапри повышении температуры и увеличении степени
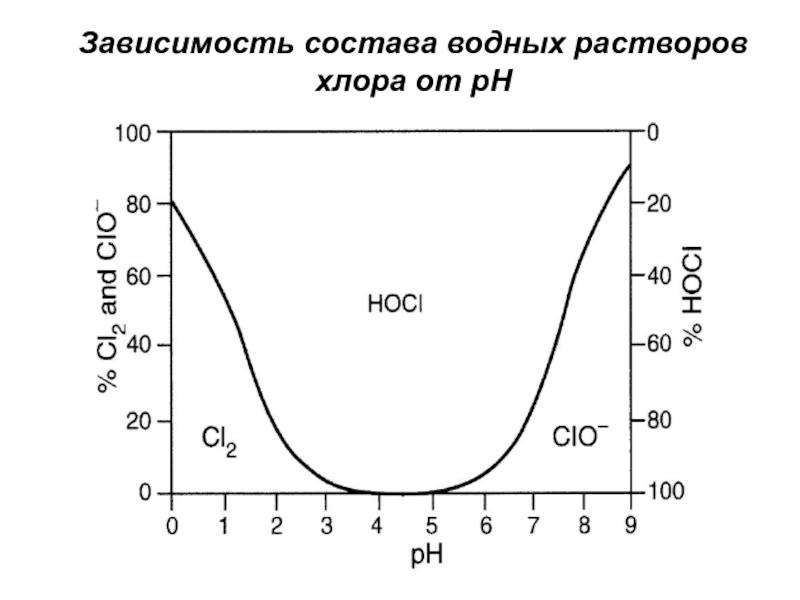
- 24. Зависимость состава водных растворов хлора от рН
- 25. Гипохлорит натрияNaOCl – соль хлорноватистой кислоты;получают насыщением
- 26. Гипохлорит натрия При рН менее 2 в
- 27. Диоксид хлораClO2– удушливый, токсичный, дурнопахнущий газ,
- 28. Способы получения диоксида хлораполучают ClO2 путем восстановления
- 29. Способы получения диоксида хлораХимические реакции восстановления хлоратов:
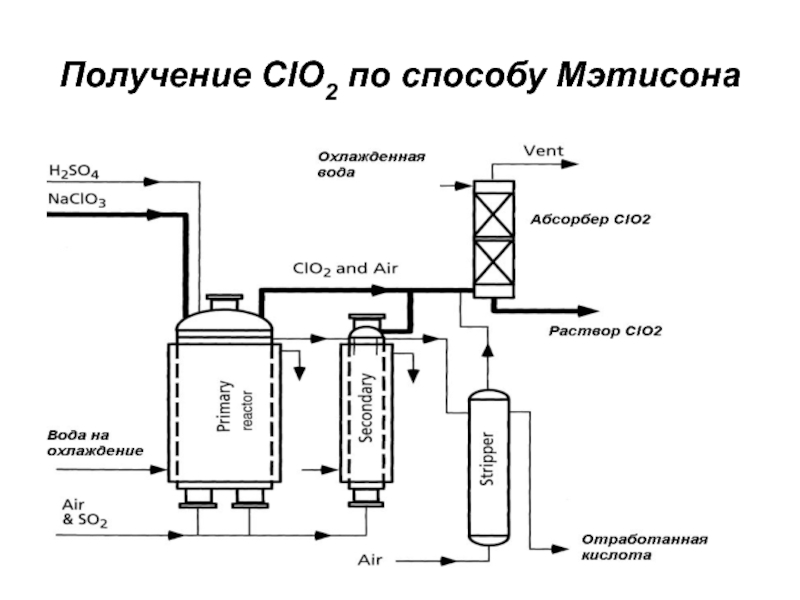
- 30. Получение ClO2 по способу Мэтисона
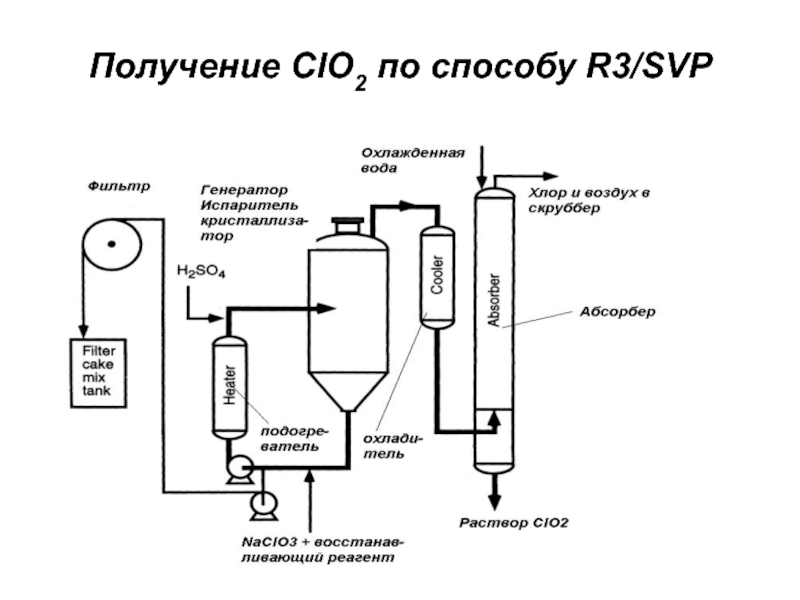
- 31. Получение ClO2 по способу R3/SVP
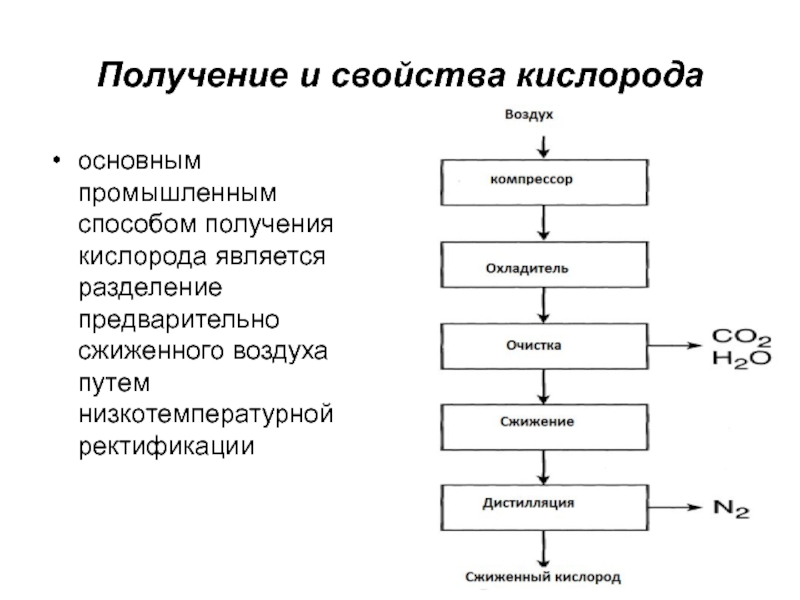
- 32. Получение и свойства кислородаосновным промышленным способом получения кислорода является разделение предварительно сжиженного воздуха путем низкотемпературной ректификации
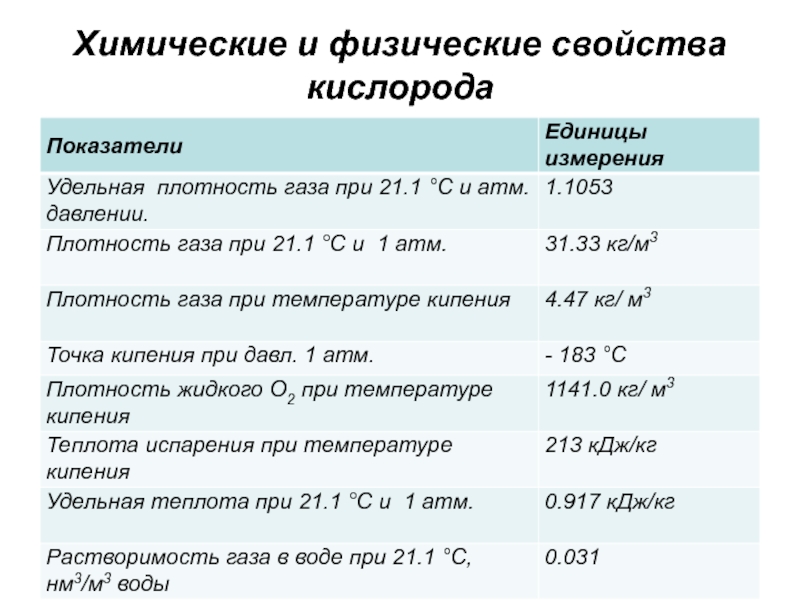
- 33. Химические и физические свойства кислорода
- 34. Получение и свойства пероксида водорода Пероксид водорода (химическая
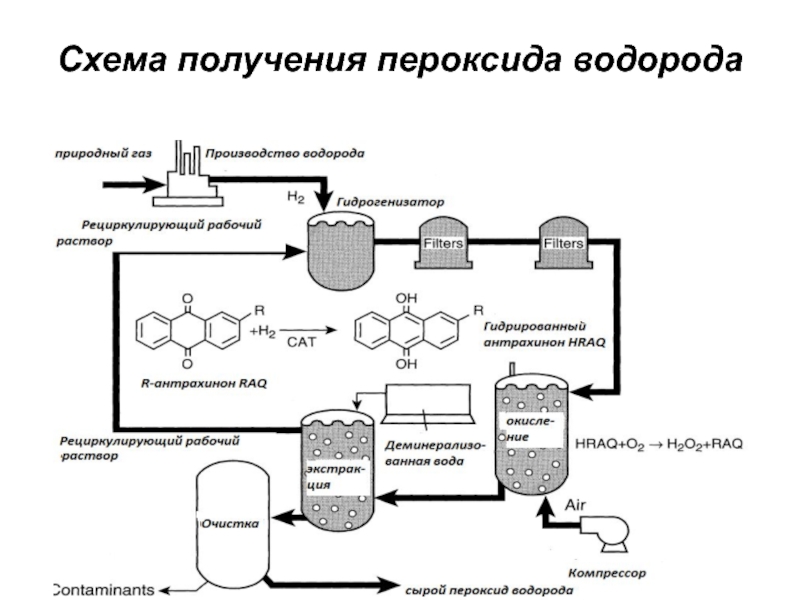
- 35. Схема получения пероксида водорода
- 36. Получение и свойства озонаОзон – сильный окислитель
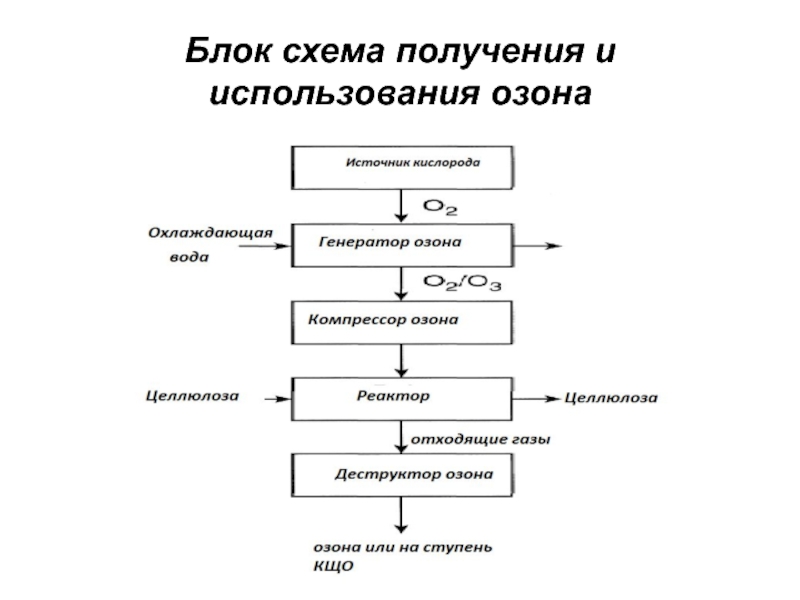
- 37. Блок схема получения и использования озона
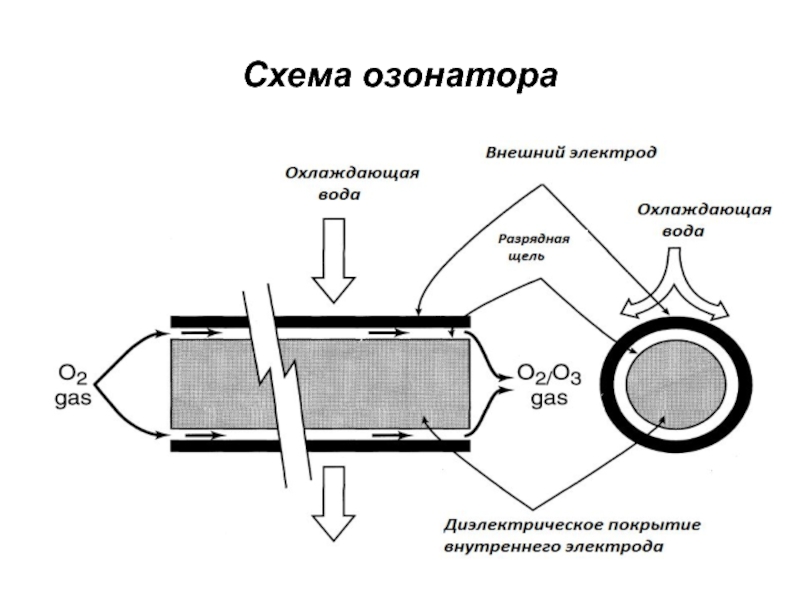
- 38. Схема озонатора
- 39. Характеристика схем отбелки Все существующие способы отбелки в
- 40. Вопросы для самопроверки1.Цель процесса отбелки.2.Что понимаем под
- 41. Вопросы для самопроверки14.Как получают диоксид хлора, и
- 42. Скачать презентанцию
Общая характеристика процесса отбелки Цель процесса отбелки - повышение белизны целлюлозы за счет удаления остаточного лигнина и придание целлюлозе определенных физико-химических свойств; Белизна целлюлозы определяется ее способностью отражать монохроматический свет по
Слайды и текст этой презентации
Слайд 1Лекция №21. Отбелка целлюлозы.
1.Общая характеристика процесса отбелки.
2.Характеристика и способы получения
отбеливающих реагентов.
Слайд 2Общая характеристика процесса отбелки
Цель процесса отбелки - повышение белизны
целлюлозы за счет удаления остаточного лигнина и придание целлюлозе определенных
физико-химических свойств;Белизна целлюлозы определяется ее способностью отражать монохроматический свет по сравнению с известным стандартом, в качестве которого используют покрытые сульфатом бария пластины;
Увеличение этой способности достигается либо путем обесцвечивания окрашивающих веществ, либо путем их удаления;
Окрашивающие вещества представляют собой остаточный лигнин, содержащий различные хромофорные группы;
Свойства хромофоров зависят от способа варки целлюлозы, вида древесины.
Слайд 3Распределение падающего пучка света
1 – падающий свет; 2 – абсорбированный
(поглощенный) свет; 3 – рассеянный свет; 4 – проходящий свет;
5 – отраженный светСлайд 4Зависимость отраженного света (%) от длины волны падающего света (нм)
для образцов целлюлозы
1 - небеленая сульфатная лиственная;
2 – полубеленая сульфатная
лиственная;3 – небеленая сульфитная хвойная;
4 – беленая сульфитная хвойная;
5 – небеленая сульфатная хвойная;
6 – беленая сульфатная хвойная
Слайд 7Вклад различных компонентов целлюлозы в абсорбцию света
kp–коэффициент абсорбции образца целлюлозы;
kL–коэффициент
абсорбции лигнина;
kc–коэффициент абсорбции углеводов;
ke–коэффициент абсорбции экстрактивных веществ.
Kp= xc·kc + xE·kE
+ xL·kLСлайд 9Стабильность белизны
Зависит от:
температуры;
освещенности;
радиации;
влажности;
содержания химикатов;
состава целлюлозы: содержания в ней остаточного лигнина,
экстрактивных, карбоксильных и карбонильных групп, гемицеллюлоз, ионов переходных металлов; остатков
отбеливающих реагентов.Слайд 12Классификация отбеливающих реагентов
Катионы или радикалы в кислой среде реагируют с
фенольными структурами лигнина;
Щелочные нуклеофилы атакуют карбонильные группы.
Группа I (Сl2, O3,
пероксикислоты) реагируют со всеми ароматическими структурами лигнина, с фенольными группами и двойными связями;Группа II (O2, ClO2) реагируют со структурами лигнина со свободными фенольными группами;
Группа III (Н2О2 в щелочной среде) реагирует с определенными функциональными группа лигнина - карбонильными
Слайд 13Реакции отбеливающих реагентов
Могут быть описаны в соответствии с окислительным потенциалом,
т.е. количеством окислительных эквивалентов которые каждый из реагентов может обеспечить
Окисление
органических веществ:RCHO + 2OH- → RCOOH + H2O + 2 e-
при этом окислитель восстанавливается:
Cl2 + 2e- → 2 Cl-
ClO2 + 2 H2O +5 e- → Cl- + 4OH-
O2 + 2H2O + 4 e- → 4OH-
NaOCl + H2O +2 e- → NaCl + 2OH-
H2O2 + 2H+ +2 e- → 2HOH
O3 + 3H+ +6 e- → 3OH-
Слайд 20Свойства основных отбеливающих реагентов и способы их получения
Хлор – газ
зеленовато-желтого цвета, в 2.5 раза тяжелее воздуха. При температуре 15…200С
и давлении 0.6 МПа легко превращается в жидкость. При атмосферном давлении жидкий хлор кипит и испаряется при температуре – 33.60С.Хлор получают путем электролиза водных растворов NaCl или KCl. Кроме хлора при электролизе образуются гидроксиды натрия или калия, водород;
При растворении в воде хлор гидролизуется с образованием соляной и хлорноватистой кислот.
Cl2 + H2O ↔ H+ Cl- + HOCl
Слайд 23Свойства хлора
при повышении температуры и увеличении степени разбавления в растворе
преобладает хлорноватистая кислота;
при подкислении раствора равновесие реакции смещается влево,
т.е. увеличивается содержание молекулярного хлора;хлор токсичен и требует при работе с ним соблюдения специальных правил безопасности;
в присутствии влаги хлор вызывает сильную коррозию металлов, поэтому хлоропроводы, отбельные башни, ванны фильтров изготавливаются из титана.
Слайд 25Гипохлорит натрия
NaOCl – соль хлорноватистой кислоты;
получают насыщением растворов соды или
гидроксида натрия хлором;
водные растворы гипохлоритов -равновесная система, в которой в
результате гидролиза присутствуют гипохлорит и хлорноватистая кислота.Na+ + ClO- + H2O → Na+ + OH- + HOCl
состав раствора гипохлорита в значительной степени зависит от рН раствора.
Слайд 26Гипохлорит натрия
При рН менее 2 в растворе преимущественно содержится
молекулярный хлор, в интервале рН 2-3 появляется также хлорноватистая кислота,
при рН 4-6 присутствует только хлорноватистая кислота;при рН более 7 увеличивается концентрация ионов гипохлорита;
при рН более 9 в растворе - только ионы гипохлорита;
растворы гипохлорита склоны к саморазложению:
факторы – повышенная температура, степень разбавления, действие солнечного света.
В результате разложения гипохлорита образуются хлораты (ClO3-) и хлориты (ClO2-).
Слайд 27Диоксид хлора
ClO2– удушливый, токсичный, дурнопахнущий газ, оранжево-желтого цвета;
при охлаждении
до температуры -11°С и атмосферном давлении превращается в жидкость красного
цвета;газообразный диоксид хлора разлагается на хлор и кислород со взрывом, поэтому применяется в виде водных растворов концентрацией не более 10 г/л;
Водные растворы ClO2 наиболее устойчивы в кислой среде.
С увеличением рН диоксид хлора гидролизуется с образованием хлорноватой, хлористой и соляной кислот:
Слайд 28Способы получения диоксида хлора
получают ClO2 путем восстановления хлоратов;
восстанавливающие реагенты:
диоксид
серы (метод Холста и Мэтисона);
метанол (способ Сольвея, R8/SVP-LITE);
соляная
кислота (способ Кестинга, R3H);хлорид натрия (R3/SVP);
пероксид водорода SVP-HP(-А),
Слайд 32Получение и свойства кислорода
основным промышленным способом получения кислорода является разделение
предварительно сжиженного воздуха путем низкотемпературной ректификации
Слайд 34Получение и свойства пероксида водорода
Пероксид водорода (химическая формула - Н2О2
,ММ 34.016) - прозрачная бесцветная жидкость;
используется только в водных растворах
и смешивается с водой в любых пропорциях;в чистом виде и при низких рН является относительно стабильным соединением;
реакция разложения пероксида водорода с образованием кислорода и воды и выделением тепла происходит в присутствии металлов переменной валентности. Ускорению этой реакции способствуют нагрев, высокое значение рН и солнечный свет;
количество кислорода, выделяющегося при разложении, зависит от концентрации пероксида водорода.
Слайд 36Получение и свойства озона
Озон – сильный окислитель и очень токсичный
газ.
Озон, используемый для отбелки, получают по месту использования из-за
его нестабильности из кислорода пропусканием коронного разрядаГенератор озона - два механических электрода, разделенных диэлектриком. Производительность современных генераторов составляет 100-1400 кг/сутки.
Установка для получения и использования озона состоит из:
- криогенной или абсорбционной установка для получения кислорода);
- генератора озона (низкочастотного 50-60 гц, средней частоты 60-1000 гц, высокочастотного – более 1000 гц);
-реактора для обработки целлюлозы озоном с узлом регулирования подачи газа;
-устройства для разрушения озона в отработанном газе.
Слайд 39Характеристика схем отбелки
Все существующие способы отбелки в зависимости от используемых
реагентов подразделяются на три группы:
с использованием хлора и его соединений;
без
использования молекулярного хлора (ECF);без использования хлора и его соединений (TCF).
cсовременные схемы отбелки – это многоступенчатые схемы, в которых используется сочетание последовательных обработок различными реагентами.
первые ступени отбелки – это делигнифицирующие ступени, на которых удаляется основная масса остаточного лигнина.
делигнифицирующий реагент прошлого века - молекулярный хлор;
в современных схемах отбелки - кислородно-щелочная делигнификация, обработка озоном, пероксидом водорода, диоксидом хлора.
для добелки целлюлозы - диоксид хлора и пероксид водорода
Слайд 40Вопросы для самопроверки
1.Цель процесса отбелки.
2.Что понимаем под термином «белизна» целлюлозы?
3.Чем
обусловлен цвет небеленой целлюлозы?
4.От чего зависит стабильность белизны?
5.Как рассчитываются окислительные
эквиваленты отбеливающих реагентов?6.Почему диоксид хлора, озон синтезируют по месту использования?
7.Почему, не смотря на очевидные преимущества, молекулярный хлор и гипохлорит не используются в современных схемах отбелки?
8.Способ получения молекулярного хлора.
9.Объясните, почему рН на ступени хлорирования не более 1.5-2?
10.Как получают гипохлорит натрия?
11.Почему обработку гипохлоритом проводят при рН не ниже 10.5?
12.Какие факторы влияют на разложение гипохлорита?
13.Почему рН на ступени делигнификации диоксидом хлора 2-3, и что происходит с увеличением рН?
Слайд 41Вопросы для самопроверки
14.Как получают диоксид хлора, и какие соединения могут
использоваться в качестве восстановителей?
15.Как можно увеличить растворимость кислорода в воде?
16.Способ
получения кислорода.17.Какие факторы влияют на разложение пероксида водорода?
18.Основной способ получения пероксида водорода.
19.Почему озон получают по месту его использования?
20.Способ получения озона и используемый питающий газ?
21.Какие отбеливающие реагенты используются в схеме отбелки ECF?
22. Какие отбеливающие реагенты используются в схеме отбелки TCF?
23.Почему используются многоступенчатые схемы?